La aldosterona, sintetizada en la zona glomerulosa de la corteza suprarrenal, es la principal hormona reguladora del metabolismo de sodio y potasio y del volumen extracelular. A través del receptor de mineralocorticoides, actúa como la señal endocrina final del sistema renina-angiotensina-aldosterona sobre el epitelio del túbulo renal y del colon distal, que estimula la reabsorción de sodio y la secreción de potasio. El agua se reabsorbe, vía ósmosis, favoreciendo la expansión del volumen circulante y, por ende, incrementando la presión arterial.
Recientemente, se ha centrado el interés en las acciones no clásicas de la aldosterona sobre el endotelio vascular, corazón y riñón. Existe evidencia de que la aldosterona está involucrada en la remodelación vascular, la función endotelial y la formación de colágena, y que contribuye a la progresión de la insuficiencia cardiaca, así como del daño renal. Se revisa la evidencia clínica y experimental que fundamenta el uso de bloqueadores de aldosterona para detener la progresión del daño renal en diferentes modelos.
Aldosterone is synthesized in the adrenal cortex and is the main regulator of sodium and potassium metabolism and the extracellular volume. Acting through the mineralocorticoid receptor, it is the final endocrine signal of the renin-angiotensin-aldosterone system with effects on the renal tubular epithelium and distal colon stimulating sodium reabsorption and potassium secretion. Water is absorbed by osmosis favoring expansion of circulating volume and increasing arterial blood pressure.
Recently there has been great interest in the non-classical actions of aldosterone on the vascular endothelium, heart and kidney. There is evidence suggesting that aldosterone participates in vascular remodeling, endothelial function and collagen deposition, contributing to heart failure progression and kidney damage. Clinical and experimental evidence supporting the use of aldosterone blocking agents in different models of kidney damage is reviewed.
1. Introducción
El sistema renina-angiotensina-aldosterona (SRAA) juega un papel fundamental en la preservación de la estabilidad hemodinámica en los seres humanos. Incluye la regulación del equilibrio hidroelectrolítico, el volumen del espacio extra-celular y la presión arterial.
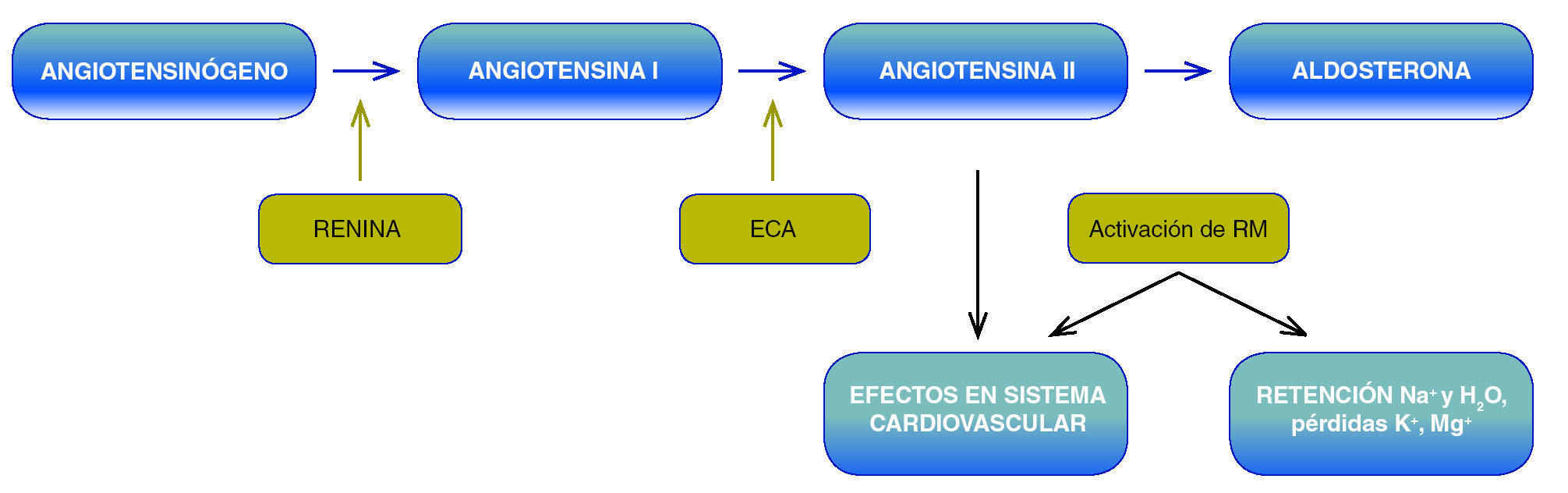
El SRAA está formado por una cascada de enzimas (fig. 1). En forma clásica, el inicio de esta cascada se describe por la liberación de renina en el riñón. Esta enzima proteolítica es producida por las células yuxtaglomerulares que se encuentran en la íntima media de las arteriolas aferentes y tienen características tanto de músculo liso como endócrinas1. El número de células yuxtaglomerulares cambia según la edad del individuo y del estado del volumen extracelular2. En un modelo de feto de rata se ha observado que la renina se expresa prácticamente en toda la vasculatura renal, incluyendo la arteriola aferente y las arterias interlobulares y arcuatas; en el recién nacido, la expresión de renina se limita a todo lo largo de las arteriolas aferentes y en el animal adulto se circunscribe al aparato yuxtaglomerular3, que se localiza en la zona de contacto entre la arteriola aferente que llega al glomérulo (polo vascular) y el túbulo contorneado distal. Estudios en humanos han demostrado que las concentraciones plasmáticas de renina y aldosterona cambian con la edad, y son menores en ancianos4.
Figura 1. Sistema renina-angiotensina-aldosterona (SRAA). ECA: enzima convertidora de angiotensina; RM: receptor de mineralocorticoides.
Las células yuxtaglomerulares contienen gránulos de renina que son secretados al plasma como respuesta a cambios en el volumen extracelular, en la osmolalidad y en la presión arterial. Una parte de esta renina es filtrada en el glomérulo y reabsorbida en el túbulo proximal. Esta enzima proteolítica actúa tanto a nivel renal como en la circulación (actividad de renina plasmática) y degrada el angiotensinógeno producido en el hígado para formar angiotensina I, un decapéptido inactivo, que a su vez es fragmentado en angiotensina II (ANG II), octapéptido, por la enzima convertidora de angiotensina (ECA). La ECA se encuentra principalmente en el pulmón, pero también se expresa en corazón, riñón y cerebro. La ANG II tiene dos tipos de receptores, AT-1 y AT-2. Al unirse al AT-1, actúa como un potente vasoconstrictor que estimula la producción de aldosterona en la zona glomerulosa de la glándula suprarrenal. La aldosterona, la señal final del SRAA, es una hormona mineralocorticoide que se une al receptor de mineralocorticoides (RM) citosólico en la nefrona distal (túbulo contorneado distal, túbulos conectores y células principales en los túbulos conectores) y en el colon. El complejo aldosterona-receptor se transloca al núcleo, donde se une a secuencias específicas de ADN (elementos de respuesta hormonal) y regula la expresión de múltiples proteínas inducidas por aldosterona. También estimula el transporte transepitelial de sodio, con la consecuente reabsorción de sodio y agua y la eliminación de potasio5, favoreciendo la expansión del volumen circulante y, por ende, incrementando la presión arterial.
El SRAA ha jugado un papel evolutivo fundamental al permitir la transición de los animales acuáticos a tierra firme durante el periodo devónico de la era paleozoica. La aldosterona inicialmente apareció en los primeros tetrápodos terrestres. Los peces no tienen esta hormona. El SRAA es el principal regulador de absorción renal de sodio, para así conservar el "mar interior" y mantener la vida en un ambiente con poca sal y agua6,7. Se ha propuesto que cuando aparecieron los primeros humanos la sal era escasa y muy preciada. Aquellos individuos que retenían más sal eran quienes tenían más posibilidades de sobrevivir. En esta era, moderna, industrializada, existe una gran disponibilidad de sal en la dieta, lo cual, aunado a un aumento en la ingesta calórica, ha ocasionado una pandemia de obesidad y un aumento en la activación del SRAA. Los individuos que, genéticamente, tienen un SRAA más activo presentan predisposición a enfermedades como hipertensión sensible a sal, enfermedad renal crónica y enfermedad cardiovascular con la dieta moderna5,8.
2. Antagonistas de aldosterona
Existe un gran interés en el desarrollo de antagonistas selectivos de la aldosterona, no solo por su efecto diurético, sino por sus potenciales efectos cardio y nefroprotectores.
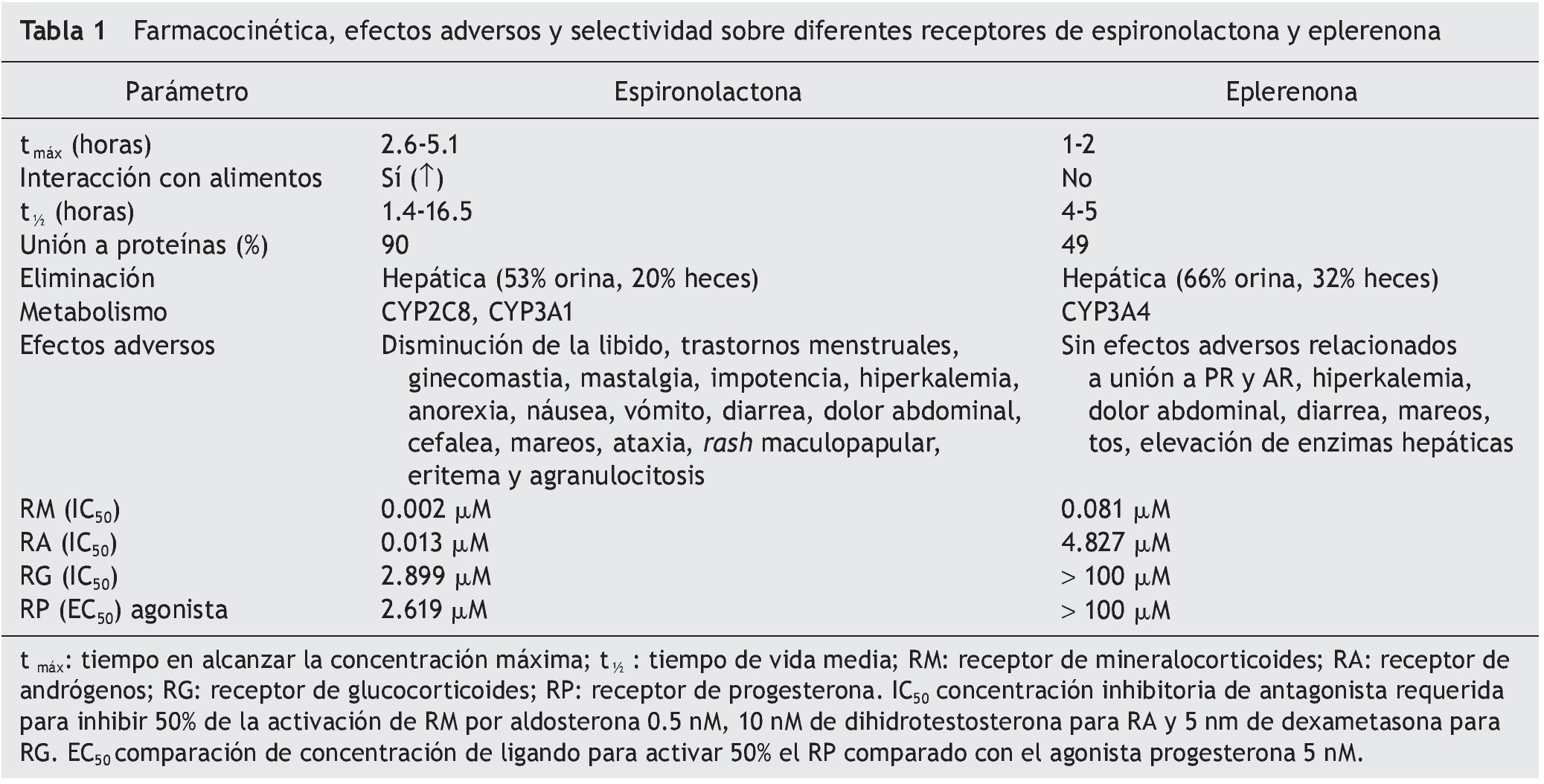
La espironolactona fue el primer antagonista mineralocorticoide, desarrollado en 1960. Ha sido utilizado ampliamente para el tratamiento de la hipertensión, hiperaldosteronismo primario, edema periférico e hipokalemia, aunque en algunos pacientes es pobremente tolerado debido a sus efectos secundarios, principalmente por una baja especificidad al RM. Adicionalmente, se une a los receptores de andrógenos y de progesterona, ocasionando trastornos menstruales en las mujeres y ginecomastia en los hombres9.
La eplerenona, un derivado de la espironolactona al cual se agregó un grupo epóxido, se desarrolló en 198710. A diferencia de la espironolactona posee una afinidad reducida para los receptores de estrógenos y progestágenos, por lo que presenta una menor incidencia de los efectos adversos sexuales11.
En la tabla 1 se describe la farmacocinética de la espironolactona y de la eplerenona, así como su selectividad sobre los receptores de mineralocorticoides, de glucocorticoides, de andrógenos y de progesterona.
Al igual que la espironolactona, el efecto secundario más importante de la eplerenona es la hiperkalemia, por lo que se requiere una estrecha vigilancia durante el tratamiento con este fármaco. En caso de presentarse hiperkalemia, se recomienda disminuir la ingesta de potasio, revisar el tratamiento concomitante que puede exacerbar esta condición —uso de bloqueadores beta adrenérgicos, analgésicos anti in flamatorios no esteroideos, heparina, entre otros— y disminuir la dosis; también se pueden administrar resinas de intercambio catiónico y los tratamientos convencionales para la hiperkalemia12,13.
La eplerenona interactúa con otros medicamentos que se metabolizan por CYP3A4 como claritromicina, eritromicina, ketoconazol, fluconazol, verapamilo y diltiazem, entre otros. Cabe mencionar que varios de los inhibidores de canales de calcio disponibles en el mercado, como el amlodipino y el diltiazem, también tienen efecto antagonista sobre los RM14.
3. Aldosterona y daño a órganos
Recientemente ha surgido un gran interés en las acciones no clásicas de la aldosterona sobre el endotelio vascular, corazón y riñón. Existe evidencia de que la aldosterona está involucrada en el remodelado vascular, en la función endotelial y en la formación de colágeno, contribuyendo a la progresión de la insuficiencia cardíaca así como del daño renal.
La aldosterona y la activación del RM promueven inflamación renal y fibrosis al favorecer la generación de especies reactivas de oxígeno15. La adición de un bloqueador de aldosterona, como eplerenona, al tratamiento de pacientes con insuficiencia cardiaca reduce el riesgo de hospitalizaciones y de muerte prematura16.
En el hiperaldosteronismo primario se ha observado que el alto consumo de sal agrava la hipertensión y el daño a órganos; este daño puede prevenirse con el uso de bloqueadores del RM17.
La señalización excesiva del RM es un mecanismo clave en el daño terminal a órganos, aún con niveles de aldosterona normales o bajos, especialmente en el contexto de alta ingesta de sal18. Se ha relacionado la GTPasa Rac1 como una vía que modula la función del RM en modelos de daño renal por hipertensión sensible a sal así como en daño cardiaco19-21.
La enfermedad renal crónica se considera un estado de hiperaldosteronismo relativo ya que, a pesar de la expansión del volumen del espacio extracelular, la secreción de aldosterona es inapropiadamente elevada, y pequeños grados de expansión del espacio extracelular magnifican los efectos prohipertensivos y proinflamatorios de la activación del RM22. La excreción urinaria de sodio en 24 horas predice la excreción urinaria de mineralocorticoides en pacientes con enfermedad renal crónica23.
En pacientes con diabetes mellitus, la combinación del bloqueo de aldosterona con espironolactona aunado a un bloqueador de receptor de angiotensina mejora la presión arterial y la proteinuria, con la ventaja de no presentar el efecto deletéreo sobre la tasa de filtración glomerular de la combinación de inhibidores de la enzima convertidora de angiotensina y el bloqueador de receptor de angiotensina, que es lo que comúnmente se emplea24.
Han surgido diversas evidencias experimentales del papel que desempeña la aldosterona en el inicio y la progresión de la nefrotoxicidad aguda y crónica mediada por inhibidores de calcineurina (uno de los principales inmunosupresores actualmente utilizados en trasplante renal y en nefropatías proteinúricas) a través de participar en la disfunción renal, la fibrosis túbulo-intersticial, la arteriolopatía y la muerte celular por apoptosis. Se ha documentado la alteración en la expresión del ARNm a nivel renocortical de diversos factores vasoactivos, tales como pro-renina, endotelina, COX-2, angiotensina, receptores AT1 y AT2, así como del TGF-β y proteínas de matriz extracelular. En estos modelos, dichas alteraciones pueden ser prevenidas o modificadas al bloquear los RM con espironolactona o eplerenona25-27. Adicionalmente, la administración de espironolactona previene la disminución en la perfusión renal y el desarrollo de insuficiencia renal aguda y la apoptosis tubular durante el daño por isquemia-reperfusión en modelo animal. Esta protección fue mediada por la reducción del estrés oxidativo, por un incremento en la expresión de enzimas antioxidantes y por la restauración en la excreción urinaria de óxido nítrico28.
La aldosterona puede jugar un papel en la regulación del inhibidor del activador de plasminógeno tipo 1 29,30 (PAI-1), y también tiene efecto directo sobre el desarrollo de la fibrosis31. En modelos animales, el bloqueo de la aldosterona con su antagonista, la espironolactona, disminuye la progresión de la fibrosis a nivel renal32. En estudios clínicos, los antagonistas de la aldosterona disminuyeron adicionalmente la proteinuria cuando se agregaban al tratamiento con inhibidores de la enzima convertidora de angiotensina y/o antagonistas de la ANG II33-35.
El incremento del PAI-1 se ha asociado con un incremento en la progresión de la fibrosis en la enfermedad cardiaca y renal36. Por otro lado, el PAI-1 puede ser disminuido al inhibir a la ANG II y/o aldosterona, y esto último se ha asociado con la prevención de la fibrosis e, incluso, regresión del daño renal37.
En el modelo animal de daño por isquemia-reperfusión la espironolactona, ya sea administrada previamente, a los 75 minutos o 3 horas después de la isquemia, previno la inflamación y la activación de vías profibróticas (TGF-β) estrés oxidativo y proteinuria38.
La administración de espironolactona antes del trasplante y tres días después del trasplante renal se comparó contra placebo en pacientes mexicanos. Se encontró disminución en el estrés oxidativo evaluado como peróxido de hidrógeno urinario, sin encontrar diferencia a 72 horas en la función renal y en marcadores de daño tubular como molécula de daño renal KIM1, proteína de choque térmico 72 e interleucina 8 39.
En un estudio realizado por nuestro grupo, la administración de eplerenona en niños mexicanos con nefropatía crónica del injerto fue bien tolerada, mejoró la tasa de filtración glomerular a 1, 3 y 6 meses y previno el deterioro progresivo de la tasa de filtración glomerular a 12 meses comparada con placebo40-42.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Apoyado por el Fondo Sectorial de Investigación en Salud y Seguridad Social SS/IMSS/ISSSTE-CONACYT Salud-2008-01-87381. Arindal Vargas recibió apoyo del programa PROBEI.
Recibido el 8 de octubre de 2013;
aceptado el 23 de enero de 2014
* Autora para correspondencia.
Correo electrónico:medeiro.mara@gmail.com (M. Medeiros).