La primera cirugía de sustitución de arco aórtico con éxito data de 1957. Durante los cerca de 60 años transcurridos desde esa fecha, avances en el diagnóstico por imagen, manejo anestésico, circulación extracorpórea, técnicas quirúrgicas y cuidados perioperatorios han culminado en el desarrollo de un amplio arsenal terapéutico que hace posible que la cirugía de arco aórtico sea en la actualidad un tratamiento eficaz y seguro en la mayoría de pacientes.
A consecuencia de este progreso, la cirugía de arco aórtico se caracteriza por su variabilidad con relación al manejo anestésico, estrategias de protección neurológica y visceral, y técnica quirúrgica. No hay una opción mejor que otra en la mayoría de los casos y, como es habitual en esta disciplina, la excelencia radica en conocer y utilizar ese arsenal terapéutico en función de las necesidades del momento.
Hipotermia profunda vs. hipotermia moderadaEn líneas generales, la cirugía de arco aórtico requiere de una parada circulatoria para realizar la anastomosis de la prótesis a la aorta torácica descendente, lo que exige la reducción de la temperatura corporal del paciente para proteger a los órganos de la anoxia. Para ello hay 2 opciones: hipotermia profunda o moderada.
La hipotermia profunda ha sido la piedra angular en este campo desde su introducción en 1975 hasta finales del siglo pasado, en lo que se llama la «edad de hielo» en la cirugía de arco aórtico. Su utilidad se sustenta en el efecto protector que tiene en los órganos al reducir su demanda metabólica; y muy especialmente en el cerebro. Una disminución de la temperatura corporal conlleva la reducción de la actividad enzimática intracelular, la necesidad de aporte de oxígeno y, por tanto, una menor demanda de flujo sanguíneo.
Hay una relación exponencial entre la temperatura y el consumo metabólico cerebral de oxígeno, de modo que a una temperatura de 14-20°C se puede realizar un arresto circulatorio del paciente durante 30min, con un bajo riesgo de provocar un daño neurológico irreversible. Pero se ha demostrado que hay una relación directa entre la duración de la parada circulatoria en hipotermia profunda y la incidencia de daño neurológico temporal, así como una disminución en la puntuación en los test de funciones cognitivas cuando la duración es superior a 25min1.
La hipotermia profunda se ha asociado a coagulopatía, disfunción endotelial microvascular cerebral, daño neurológico, respuesta inflamatoria sistémica incrementada y aumento del riesgo de disfunción multiorgánica. Por ello, el uso de esta estrategia ha ido reduciéndose y se opta en la actualidad por arrestos circulatorios a temperaturas mayores.
La hipotermia moderada tiene un rango de temperatura entre 21-28°C, pero se emplea generalmente entre los 25-28°C. Requiere de una perfusión cerebral continua para evitar un daño neurológico irreversible, pero sí permite el arresto de la circulación visceral durante un tiempo no superior a 40min. En un metaanálisis reciente2 se observa que el empleo de hipotermia moderada con perfusión cerebral selectiva reduce el riesgo de infarto cerebral postoperatorio en comparación con la hipotermia profunda aislada.
Por otro lado, hay que tener en cuenta que la parada circulatoria en hipotermia moderada puede aumentar la incidencia de fallo multiorgánico al no proteger hígado, intestinos y riñones, en función de la duración de la misma y que, pese a que hay una impresión generalizada de que la hipotermia profunda se asocia con un incremento de la morbilidad sistémica, esta creencia no ha sido validada de forma concluyente. No se ha demostrado una reducción en el fallo renal agudo, necesidad de transfusión de hemoderivados o incidencia de reintervención por sangrado entre estas 2 estrategias.
En algunos casos que permiten la perfusión distal del hemicuerpo inferior, se puede considerar el empleo de una hipotermia ligera (28-32°C); ya que no se va a realizar una parada circulatoria.
Perfusión selectiva cerebral retrógrada vs. anterógradaTanto de forma opcional en la hipotermia profunda como de modo obligatorio en el caso de hipotermia moderada, se puede instaurar una perfusión cerebral selectiva durante el arresto circulatorio para una mejor protección cerebral. Hay 2 vías principales: retrógrada y anterógrada.
La perfusión cerebral retrógrada fue descrita por primera vez en 1980 y consiste en invertir el flujo circulatorio mediante la perfusión de sangre oxigenada al cerebro a través de la vena cava superior, con un retorno de la sangre no oxigenada a través de los troncos supraaórticos. Los beneficios teóricos de esta vía son el mantenimiento de la hipotermia cerebral, la limpieza de posibles restos embólicos arteriales, tanto gaseosos como partículas, y el aporte metabólico necesario. La principal desventaja es el riesgo de edema cerebral por flujo y presión de perfusión altos, que puede exacerbar el daño cerebral.
Actualmente, pese a que hay muchos estudios que apoyan los buenos resultados de la perfusión selectiva retrógrada; ante la aparición de la vía anterógrada hay pocos datos clínicos que animen a su uso, puesto que no hay evidencia de que se obtengan mejores datos tanto en morbilidad como en mortalidad. Es por ello que actualmente está en desuso a favor de la perfusión vía anterógrada.
Para la instauración de la vía anterógrada, se pueden utilizar distintas estrategias. Desde la canulación de la arteria axilar derecha exclusivamente hasta la canulación directa a través de los ostia de los troncos supraaórticos. Cualquiera de ellas es válida, y ninguna ha demostrado ser más efectiva al resto. Lo que sí se debe tener en cuenta es que, sobre todo, en la enfermedad aneurismática, hay una alta incidencia de lesiones ateroscleróticas tanto extra como intracraneales, y que es conveniente una valoración de la anatomía vascular cerebral (sistemas carotídeo, vertebral y polígono de Willis) mediante angiotomografía computarizada o angioresonancia magnética.
La perfusión cerebral selectiva anterógrada ofrece como ventajas, frente a la retrógrada, que se puede mantener una hipotermia moderada en vez de profunda, y que es más efectiva aportando sangre oxigenada por un mecanismo más fisiológico. El principal inconveniente a tener en cuenta es el riesgo de embolismos cerebrales.
¿Qué abordaje quirúrgico es mejor?En líneas generales, aunque no siempre son factibles todas las opciones, existen 3 abordajes quirúrgicos: cirugía abierta, híbrida o endovascular.
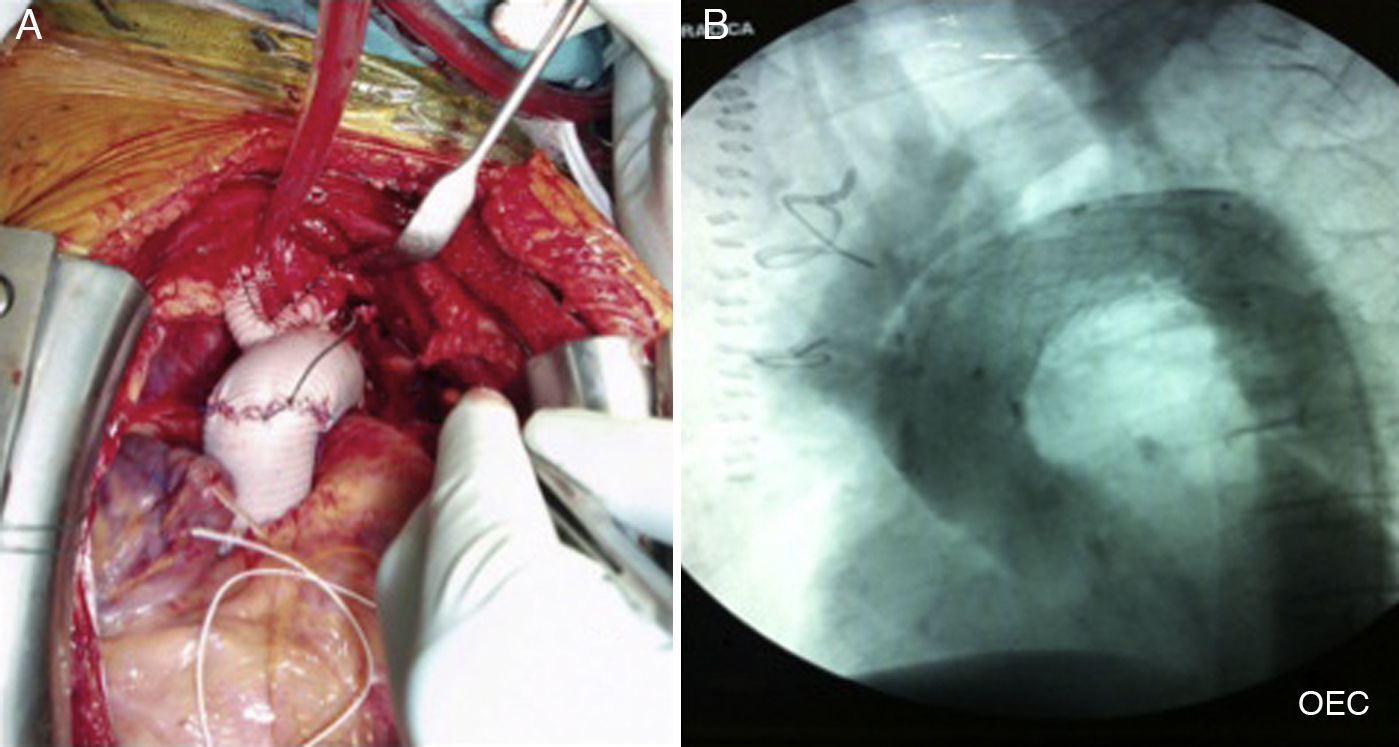
En la cirugía abierta se realiza la sustitución del arco con o sin aorta ascendente con una prótesis vascular. El acceso es por esternotomía media con instauración de circulación extracorpórea. La técnica más tradicional consistía en la resección en bloque de la salida de los troncos supraaórticos y la interposición del tubo protésico término-terminal entre aorta torácica ascendente y descendente, reinsertando al mismo la isleta de aorta con los troncos supraaórticos. Otra opción es utilizar un tubo trifurcado (fig. 1A) y reinsertar de forma independiente cada tronco supraaórtico. Pese a que cualquiera de las 2 opciones es válida, actualmente hay una mayor tendencia a utilizar la segunda alternativa por presentar en general menor dificultad técnica y menor tiempo de parada circulatoria. Existe, además, la posibilidad de dejar en aorta torácica descendente un segmento del tubo protésico, incluido dentro de la aorta nativa del paciente, cuando se prevé la necesidad de una actuación en un segundo tiempo sobre este tramo de aorta: es la clásica técnica de la trompa de elefante congelada.
El tratamiento endovascular consiste en la colocación de una endoprótesis torácica con zona de anclaje en aorta ascendente, y la inserción de chimeneas para la salida de los troncos, o bien la fabricación de una endoprótesis a medida para el arco completo.
El abordaje híbrido engloba 2 alternativas:
Por un lado se puede emplear una prótesis híbrida con una primera parte que es similar a las que se usan en la cirugía abierta, y una segunda parte adherida que es una endoprótesis, y quedaría incluida en la aorta torácica descendente (equivalente a la técnica de la trompa de elefante congelada). Esta cirugía requeriría una esternotomía completa con circulación extracorpórea, al igual que en la cirugía abierta.
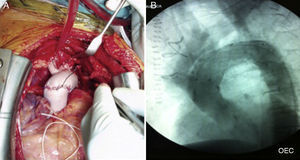
La segunda opción de tratamiento híbrido consiste en realizar una desramificación quirúrgica de los troncos supraaórticos por esternotomía (completa o miniesternotomía), sin necesidad de circulación extracorpórea y, bien en el mismo acto operatorio, o en un segundo tiempo, la colocación de una endoprótesis de aorta torácica con anclaje distal a la zona de salida del tubo protésico, cubriendo el arco completo (fig. 1B).
Aunque las técnicas híbridas y, sobre todo, el abordaje endovascular completo llevan menos tiempo en uso que la cirugía abierta, se ofrecen como alternativa, con resultados a corto y medio plazo similares al tratamiento convencional3,4. Por tanto, es recomendable tener un correcto manejo de todas ellas, e individualizar en cada caso cual puede ser la mejor opción.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.