Los pacientes afectados de una miocardiopatía pueden permanecer estables y sin problemas clínicos significativos durante muchos años. Sin embargo, la elevada incidencia proporcional de muerte súbita cardíaca (MSC) entre esta población (a menudo joven) convierte su prevención en algo prioritario.
Obviando a la omnipresente cardiopatía isquémica, las dos entidades que vamos a analizar no resultan en absoluto ajenas al clínico en su práctica habitual, y no por conocidas plantean menos incertidumbres.
Miocardiopatía dilatadaDefinimos como miocardiopatía dilatada (MCD) a la combinación de dilatación y disfunción sistólica del ventrículo izquierdo o de ambos ventrículos. En la MCD idiopática no existe una causa identificable y se llega a su diagnóstico por exclusión. Sin embargo, el término MCD continúa empleándose tanto para los casos idiopáticos como para los secundarios, al tratarse del mismo concepto fisiopatológico en ambos.
En la MCD se produce un aumento generalizado de las fibras de la matriz, que al afectar al sistema específico de conducción puede ser responsable de trastornos de conducción y sustrato de arritmogénesis.
El pronóstico de esta enfermedad es en general pobre, con el desarrollo de insuficiencia cardíaca congestiva (ICC) en los estadios finales de la enfermedad.
Se ha calculado en un 20% la mortalidad a los 5 años de la MCD, y la MSC es la causa de aproximadamente el 30% de estas muertes1. Se considera que la taquicardia ventricular (TV) y/o la fibrilación ventricular (FV) son los mecanismos más comunes de MSC, aunque en pacientes con insuficiencia cardíaca avanzada la bradicardia, la embolia pulmonar y la disociación electromecánica representan hasta el 50% de dichas muertes.
Estratificación de riesgoAspectos clínicosClase funcional (NYHA). Los signos de ICC son un poderoso marcador de muerte total y MSC, y a pesar de ser un parámetro muy subjetivo y de naturaleza imprecisa, es simple, coste-efectivo y fácil de obtener. Los pacientes con disfunción sistólica en clase funcional II-III de la NYHA tienen mayor riesgo de presentar MSC que los pacientes con clase funcional IV de la NYHA. Estos últimos tienen más probabilidad de morir por fallo de bomba.
Síncope. No se puede considerar el síncope inexplicado como un equivalente a MSC recuperada, aunque basándose en series con número limitado de pacientes se ha sentado la indicación de implante de desfibrilador automático implantado (DAI).
Mediciones no invasivasFracción de eyección del ventrículo izquierdo (FEVI) frente a otras medidas. La FEVI ha sido uno de los primeros marcadores que ha demostrado de manera consistente, en diferentes estudios, ser un predictor de mortalidad global.
El Marburg Cardiomyopathy Study2 evaluó el riesgo de arritmia ventricular en 343 pacientes con MCD con un DAI. Se analizaron como posibles predictores: la FEVI, el tamaño del ventrículo izquierdo, el ECG de señal promediada, las arritmias en el Holter, la dispersión del QTc, la variabilidad de la frecuencia cardíaca, la sensibilidad barorrefleja y la alternancia en el microvoltaje de la onda T.
En el análisis multivariado la FEVI fue el único predictor significativo de arritmia, con un riesgo relativo (RR) de 2,3 por cada 10% de descenso en la FEVI.
Como importante limitación, la determinación de la FEVI presenta una no despreciable variabilidad, debida a factores hemodinámicos del paciente y a las técnicas de medición.
Además, la adopción de puntos de corte específicos de FEVI para las indicaciones de DAI en prevención primaria conlleva una distribución dicotómica (sí/no) del riesgo de MSC. Esto refleja mal que el aumento de la mortalidad es lineal a partir de una FEVI <45%.
Mediciones invasivasEstudio electrofisiológico. Se reconoce que en la MCD no isquémica el estudio electrofisiológico tiene baja inducibilidad y reproducibilidad y bajo valor predictivo, con una utilidad incierta en la estratificación del riesgo arrítmico3.
Sin embargo, se considera útil como herramienta diagnóstica en la evaluación de palpitaciones sostenidas, taquicardia de complejo ancho, pre-síncope, e identificación y ablación de la taquicardia por reentrada rama-rama.
TratamientoEn la prevención secundaria (MSC resucitada/FV/TV sostenida) el DAI ha demostrado ser superior a la amiodarona en diferentes estudios, donde la mayoría de pacientes presentaba enfermedad coronaria.
En la prevención primaria la indicación del DAI en pacientes con MCD no isquémica ha sido menos contundente:
- -
Los ensayos clínicos iniciales de prevención primaria con DAI no incluyeron población sin cardiopatía isquémica, en la creencia de presentar un riesgo de muerte no arrítmica muy alto.
- -
La evidencia es frágil, con resultados limítrofes o negativos en los ensayos que incluyeron solo a pacientes con esta patología (CAT, AMIOVIRT, DEFINITE), aunque muchos estaban limitados por pequeños tamaños muestrales.
La indicación de prevención primaria se apoya básicamente en los resultados del ensayo Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT)4, que incluía pacientes isquémicos y no isquémicos con ICC. Incorporó 2.521 pacientes en clase funcional II-III, con FEVI <35%, y el 48% de ellos eran no isquémicos. Comparó tres ramas de tratamiento: placebo, amiodarona y DAI monocameral.
A los 5 años se observó una reducción de la mortalidad por cualquier causa del grupo de DAI del 23%. No hubo diferencias en los resultados entre cardiopatía no isquémica e isquémica. La amiodarona no aportaba beneficios en cuanto a mortalidad, comparada con el placebo.
Guías clínicasEn cuanto a las guías de manejo de arritmias ventriculares y prevención de la MSC de 2006, se criticó la adopción de puntos de corte de FEVI poco concretos (<30-35%).
Las guías de la AHA/ACC/HRS (2008)3 hacen recomendaciones específicas (tabla 1) basadas en el perfil de los principales estudios aleatorizados.
Indicaciones de desfibrilador automático implantable (DAI) en miocardiopatía dilatada no isquémica
| Clase I | - Supervivientes de paro cardíaco por FV o TV hemodinámicamente inestable tras evaluación para identificar la causa y exclusión de causa completamente reversible (nivel de evidencia A)- MCD con FEVI ≤35% y clase funcional II-III de la NYHA (nivel de evidencia B)- TV sostenida espontánea, incluso la no inestable hemodinámicamente (nivel de evidencia B) |
| Clase IIa | - Síncope inexplicado en MCD con disfunción VI significativa (nivel de evidencia C) |
FEVI: fracción de eyección del ventrículo izquierdo; FV: fibrilación ventricular; MCD: miocardiopatía dilatada; TV: taquicardia ventricular; VI: ventrículo izquierdo.
- •
En la actualidad la estratificación del riesgo de MSC en pacientes con MCD se lleva a cabo utilizando parámetros sencillos y poco sofisticados, como la historia clínica, el grado funcional de la NYHA y la FEVI, en espera de mejores predictores, que de momento parecen lejanos.
- •
No se debe soslayar que el mejor tratamiento preventivo que se puede ofrecer, el DAI, no es una terapia exenta de inconvenientes (complicaciones relacionadas con el implante, descargas inapropiadas, elevado coste), y conviene tenerlos siempre en mente.
La miocardiopatía hipertrófica (MCH) es una enfermedad hereditaria con patrón autosómico dominante causada por mutaciones detectadas en genes que codifican las proteínas sarcoméricas, pero con expresión fenotípica muy variable.
Desde el punto de vista anatomopatológico, la MCH se caracteriza por la presencia de hipertrofia miocárdica, desorganización de los miocitos y fibrosis, que pueden conducir a un amplio espectro de anomalías funcionales.
La historia natural de la enfermedad es benigna en la mayoría de pacientes, con un deterioro gradual en clase funcional con la edad. Menos del 10% de los pacientes llegan a presentar síntomas significativos de insuficiencia cardíaca.
Una de las principales características de la MCH es el riesgo de aparición de muerte súbita. Esta puede producirse a cualquier edad, con una incidencia anual del 2 al 4% en centros de referencia y de alrededor del 1% en poblaciones no seleccionadas5.
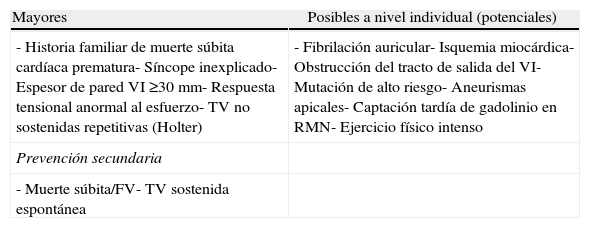
Estratificación de riesgoExiste una serie de factores clínicos clásicos de riesgo de muerte súbita aceptados de forma generalizada que pueden estudiarse fácilmente y de forma no invasiva en todos los pacientes (tabla 2) y que se conocen como factores mayores.
Factores de riesgo de muerte súbita en la miocardiopatía hipertrófica (MCH)
| Mayores | Posibles a nivel individual (potenciales) |
| - Historia familiar de muerte súbita cardíaca prematura- Síncope inexplicado- Espesor de pared VI ≥30mm- Respuesta tensional anormal al esfuerzo- TV no sostenidas repetitivas (Holter) | - Fibrilación auricular- Isquemia miocárdica- Obstrucción del tracto de salida del VI- Mutación de alto riesgo- Aneurismas apicales- Captación tardía de gadolinio en RMN- Ejercicio físico intenso |
| Prevención secundaria | |
| - Muerte súbita/FV- TV sostenida espontánea |
FV: fibrilación ventricular; RMN: resonancia magnética nuclear; TV: taquicardia ventricular; VI: ventrículo izquierdo.
Los pacientes con 2 o más de estos factores mayores constituyen un grupo de riesgo elevado que debe recibir tratamiento profiláctico5.
En los pacientes —sobre todo a partir de 30-35 años— sin ninguno de estos 5 factores, el riesgo de MSC es muy bajo.
Los pacientes con un solo factor de riesgo deben ser valorados cuidadosamente y de forma individualizada. En este sentido es muy importante tener en cuenta la edad del paciente.
Los pacientes <30 años que presentan alguno de dichos factores son posibles candidatos a recibir tratamiento profiláctico.
Algunos factores, como la presencia de TV no sostenida en Holter, el grosor extremo del ventrículo izquierdo y el síncope recurrente e inexplicado, son aspectos más estudiados y establecidos. Una historia familiar de muerte súbita prematura en múltiples familiares probablemente refleja la presencia de una mutación de alto riesgo.
Por el contrario, es infrecuente que el resultado anormal de una prueba de esfuerzo conduzca, de forma aislada, al implante de un DAI.
En los casos menos evidentes, la presencia de los denominados posibles factores o árbitros potenciales puede ayudar a decantar la estrategia de prevención.
Recientemente se conoce que la presencia y la extensión de realce tardío en la resonancia magnética con gadolinio en la MCH se asocian con una expresión más severa de la enfermedad desde un punto de vista funcional y clínico y con un mayor número de factores de riesgo de MSC. No obstante, aún no se ha podido confirmar que tengan valor pronóstico independiente.
En Estados Unidos es habitual ofrecer o recomendar la opción de implantar un DAI en prevención primaria a los pacientes con MCH y cualquiera de los 5 factores de riesgo mayores, siempre que el factor de riesgo implicado sea importante dentro del perfil clínico global del paciente. De hecho, en las muy recientes guías americanas sobre MCH, publicadas posteriormente a la elaboración del artículo, limitan los factores de riesgo mayor, al síncope inexplicado, el espesor de pared y los antecedentes familiares. La presencia de solo una de ellas podría constituir indicación de DAI.
TratamientoNo hay estudios controlados que hayan demostrado la utilidad de la implantación de DAI en la MCH, y la experiencia se basa fundamentalmente en un registro internacional6 con más de 500 pacientes. Las tasas de descargas del DAI fueron del 11% en la prevención secundaria y del 4% en la prevención primaria (muchos de ellos con un único factor de riesgo).
Está pues establecido el implante de DAI en pacientes con prevención secundaria de MSC. Existen las comentadas discrepancias en cuanto al número de factores de riesgo necesarios a la hora de indicar el DAI en prevención primaria, aunque las guías reflejan su posibilidad a partir de un factor (indicación IIa, nivel de evidencia C)3.
En un reciente registro nacional de tres centros obtenemos un reflejo más fidedigno de la práctica habitual en nuestro medio. La indicación del implante fue prevención secundaria en el 40% de los casos y primaria en el 60%; el número de factores de riesgo por paciente fue similar en los tres centros, con una media de 3 factores por paciente.
Respecto a la amiodarona, no se dispone de estudios controlados con placebo o comparados con DAI, y su papel en la prevención de la MSC no está claro.
Conclusión- -
La estratificación real de riesgo en MCH se basa de nuevo en datos clínicos y en pruebas complementarias sencillas, bien conocidas.
- -
Esto no resta ni un ápice de complejidad a la decisión de implantar un DAI a un paciente, generalmente joven y en ocasiones con poca sensación de enfermedad.
- -
El desafío no está en los pacientes con dos o más factores de riesgo (con indicación unánime), sino en los pacientes con tan solo uno de ellos.
No existe ninguna fuente de financiación.
Conflicto de interesesLos autores declaran no tener conflicto de intereses alguno.