La técnica más extendida para la ablación de FA es la ablación circunferencial de venas pulmonares (VVPP)1. Sin embargo, los resultados obtenidos no son uniformes, pues dependen de la experiencia tanto del operador como del centro. El abordaje convencional realiza las lesiones punto a punto, de manera que las líneas de ablación que se crean no son siempre continuas, facilitando tanto la aparición de taquicardias auriculares o flúteres, como la recidiva de la FA.
Por otro lado, la elevada incidencia de FA conlleva que un importante número de pacientes se beneficien de la ablación. Resulta necesario buscar abordajes alternativos que permitan acortar, simplificar y estandarizar el procedimiento. En este sentido, la crioenergía ha sido propuesta como alternativa, siendo al menos tan segura como la radiofrecuencia. Ha demostrado ser menos trombogénica2 —importante en procedimientos en el lado izquierdo del corazón—, y con el uso de catéter balón, las tasas de estenosis de venas pulmonares o de fístula atrioesofágica son mínimas. Además, los pacientes refieren menos dolor que con radiofrecuencia.
El catéter balón ofrece la ventaja de poder realizar la ablación de forma rápida y sencilla; pues se puede conseguir el aislamiento de una vena pulmonar en una sola aplicación, y a priori, las lesiones que crea son homogéneas y continuas.
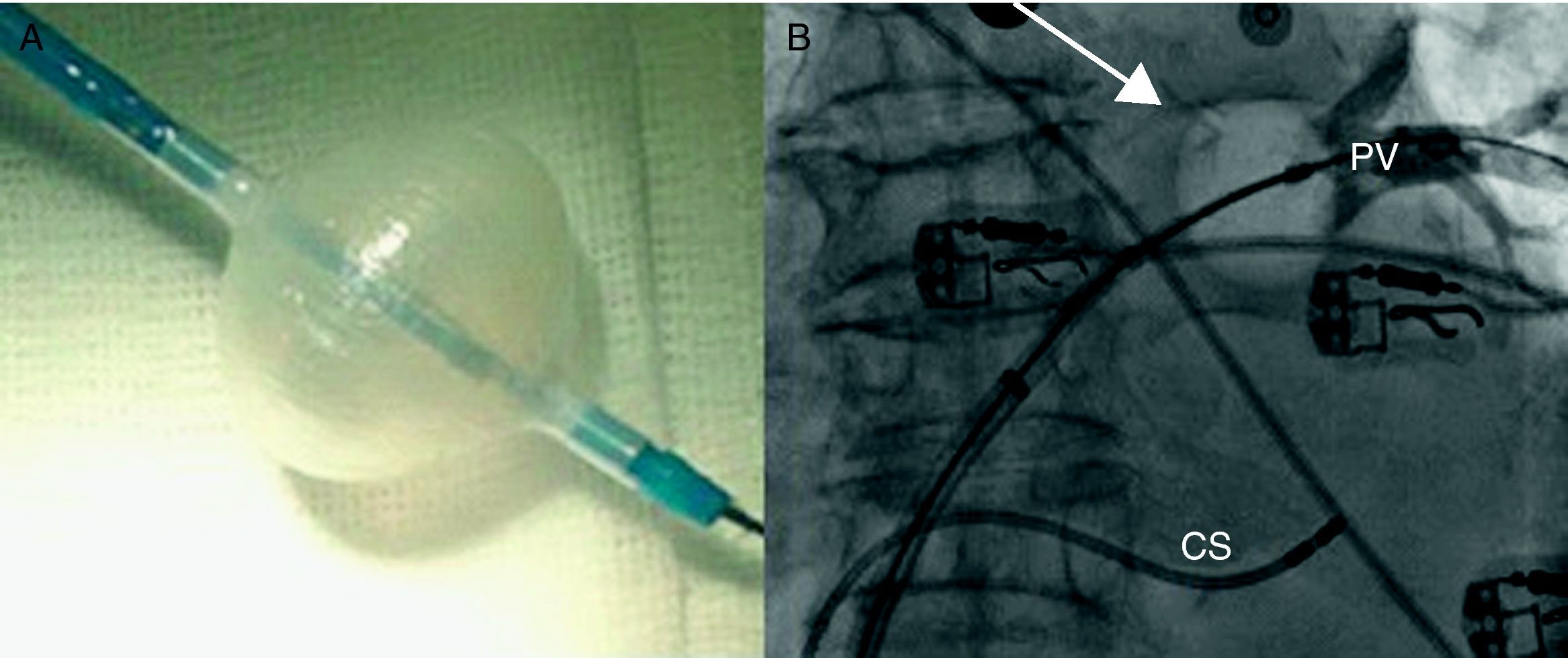
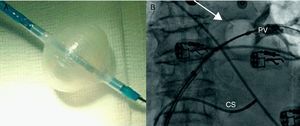
¿Qué es diferente en la crioablación con catéter balón con respecto al abordaje «convencional»?En primer lugar, el material necesario: 1) el catéter crio-balón Arctic Front®, por el que en su interior circula el líquido refrigerante (hay disponibles 2 tamaños: 23 y 28mm); 2) la vaina deflectable FlexCath® (15 F), que permite posicionar el catéter adecuadamente dentro de la aurícula izquierda (AI), y 3) la Cryoconsole®, que alberga el refrigerante y los componentes eléctricos y mecánicos que se conectan con el catéter durante el procedimiento. Tanto el catéter como la vaina son deflectables, facilitando su movilidad dentro de la AI.
Normalmente se realiza una única punción transeptal (ACT durante el procedimiento 250-300s). Se localizan las venas pulmonares con angiografía selectiva y se registra la actividad eléctrica de cada vena con el catéter de mapeo circular (Lasso, Biosense Webster, Inc, Diamond Bar Ca, USA). Se introduce una guía larga en la vena pulmonar que se pretenda aislar, sobre la cual se avanza el catéter balón. Cuando se encuentra a nivel del antro, se procede al inflado. Se considera óptima cuando la inyección de contraste muestra una retención total del mismo. Habitualmente se realizan 2 aplicaciones por vena pulmonar (VP) y el tiempo por aplicación es de 5min. El grado de oclusión de la VP (fig. 1) se mide de forma cualitativa, de manera que el grado 1 significa que no se queda retenido contraste en la VP durante el inflado y el 4, que todo el contraste se retiene en la VP que se desea aislar.
Una vez completada la ablación de las VVPP, se comprueba el aislamiento de cada vena pulmonar mediante la introducción del catéter de mapeo circular (Lasso, Biosense Webster, Inc. Diamond Bae Ca, USA). El tiempo del procedimiento, tras superar los primeros casos, en series iniciales como la de Van Belle et al3 es de 137±40min, con un tiempo de escopia de 21±7min.
¿Qué resultados ofrece?Tras la ablación, el porcentaje de venas aisladas varía entre el 70 y el 98%. En los casos en los que no se puede completar la ablación con catéter balón se finaliza el aislamiento siguiendo el tradicional abordaje punto a punto. A medio plazo, el porcentaje de éxito al año es del 70% en la mayoría de las series4. No hay disponibles resultados a largo plazo hasta el momento.
Se ha comprobado que en la mayoría de los casos las recidivas se deben a reconexiones de las VVPP inferiores. Habitualmente es en ellas en las que se alcanzan temperaturas más altas durante la ablación, por lo que la capacidad de lesión es menor. La anatomía de las venas pulmonares es un factor limitante a la hora de alcanzar el éxito de la ablación. Así, se ha reportado4 que las angulaciones agudas de las VVPP, ostium ovales o con hendiduras en la AI dificultan la posibilidad de ablación con esta técnica.
La reconexión temprana, 30-60min5 tras la ablación, es rara, por lo que intentar inducir o esperar no parece tener mucho sentido, aunque es recomendable comprobar el aislamiento de las VVPP una vez finalizada la ablación.
Las taquicardias auriculares macrorrentrantes, tras la crioablación, son menores de lo observado con radiofrecuencia4. Esto se puede explicar por el hecho de realizar lesiones más homogéneas con el balón, y por la localización relativamente más próxima al ostium de las VVPP, aunque, obviamente, esto último depende de las relaciones anatómicas entre el diámetro de la vena y el diámetro del balón.
¿Qué complicaciones nos podemos encontrar? ¿Se pueden evitar?La parálisis del nervio frénico es una complicación asociada al uso de crioenergía en la ablación de la FA. No en vano, en el estudio STOP AF (Sustained Treatment of Paroxysmal Atrial Fibrillation; resultados presentados por Packer et al en el Congreso del American College of Cardiology de 2010) la tasa de parálisis frénica fue del 11,2%. Sin embargo, la mayoría de ellas fueron transitorias y, a los 12 meses, el 98% estaban resueltas. Hasta ahora, la parálisis frénica se ha relacionado con el uso de catéteres balón de 23 mm, debido a que la relación anatómica entre el nervio frénico y la AI ocurre a nivel del ostium de la vena pulmonar superior derecha. Con el catéter balón de 28 mm, alcanzar este punto es más difícil. Sin embargo, es importante recordar que la localización de la lesión producida por el catéter balón depende del tamaño de la vena a aislar. Una maniobra que ayuda a saber si durante la aplicación de frío se está lesionando el nervio frénico y a reducir la tasa de parálisis, es la estimulación desde la vena cava superior a baja frecuencia, hasta conseguir captura diafragmática.
A priori, con el uso de introductores de 15 F y de catéteres más rígidos, se pueden esperar mayor tasa de derrames pericárdicos al manipularlos dentro de la AI. Sin embargo, en la serie descrita por Chierchia et al6 esta tasa no fue mayor que en los procedimientos con radiofrecuencia.
Si bien es cierto que técnicamente la canalización de las VVPP inferiores es un desafío, técnicas como la del palo de hockey o de gran loop descritas por Chun et al7 facilitan el abordaje de las mismas. Otras complicaciones temidas en la ablación de FA, como la fistula atrioesofágica o la estenosis de VVPP, son muy raras con esta técnica.
¿Qué puntos débiles tiene la crioablación con catéter balón?La necesidad de realizar líneas de ablación adicionales como la de techo, istmo mitral o tricuspídeo no es posible con el catéter balón, condicionando el uso de catéteres adicionales de ablación, con lo que se incrementa tanto el coste como la duración del procedimiento. Además, sería muy útil que el catéter balón de crioablación pudiera registrar señales eléctricas intracavitarias.
Por otro lado, como ya se ha comentado previamente, tanto la escasa flexibilidad de los catéteres disponibles como las variedades anatómicas de las VVPP disminuyen la posibilidad de realizar aplicaciones efectivas. Para conseguir el aislamiento en estos casos, se requieren numerosas aplicaciones, prolongándose el procedimiento.
A modo de conclusión: ¿con qué nos quedamos?Para pacientes con FA paroxísticas, la crioablación con catéter balón parece una alternativa razonable con tasas de éxito similares a las de la radiofrecuencia. Sin embargo, las variedades anatómicas y la imposibilidad de creación de líneas adicionales de ablación son las principales limitaciones hasta el momento.
La posibilidad de realizar la ablación en una sola aplicación, en vez del abordaje punto a punto, resulta muy atractiva. Nuevos catéteres de mapeo circular que permiten ablacionar suponen un paso más en este sentido, pues permiten la creación de lesiones más homogéneas y acortar y simplificar el procedimiento.
Conflictos de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Sociedad Andaluza de Cardiología por la beca para estancias en el extranjero que posibilitó que realizara una rotación externa de 3 meses en el Heart Rhythm Management Centre UZ Brussels.