Recientemente se ha demostrado que las válvulas aórticas bicúspides con diferente orientación espacial de las valvas (cúspides) son entidades etiológicas distintas. Este hallazgo induce a reconsiderar varios de los conceptos vigentes sobre la genética de estas válvulas anómalas, sobre su asociación a otras malformaciones cardíacas congénitas, sobre sus complicaciones clínicas y sobre las posibles decisiones de índole quirúrgica por tomar en función de los distintos morfotipos valvulares.
It has recently been shown that bicuspid aortic valves with different spatial orientation of the leaflets (cusps) are etiologically distinct. This finding has led to reconsidering several of the current concepts on the genetics of these anomalous valves, on their association with other hereditary cardiac malformations, their clinical complications and on the possible surgical decisions to make with regard to the different valve morphotypes.
En la especie humana, como en los demás mamíferos, la válvula aórtica presenta normalmente un diseño tricúspide o trivalvar. Está formada por tres valvas (cúspides o velos valvulares); derecha, izquierda y no coronaria, cada una anclada a su correspondiente seno aórtico, o seno de Valsalva, siguiendo una línea parabólica. Habitualmente, las dos arterias coronarias, derecha e izquierda, nacen de los senos derecho e izquierdo, respectivamente.
Ya Leonardo da Vinci demostró que el diseño tricúspide es el más eficiente para que la válvula cumpla adecuadamente su función, es decir, impedir el reflujo sanguíneo durante la diástole ventricular. Sin duda, ésta es la razón por la cual la válvula aórtica de tipo tricúspide ha estado y sigue estando sometida a una selección natural de carácter positivo. Sin embargo, en las diversas poblaciones humanas aparecen válvulas cuya morfología difiere en mayor o menor grado de la configuración tricúspide. En tal caso, se habla de anomalías o malformaciones de la válvula aórtica. Entre ellas, la más frecuente, con mucha diferencia, es la que se conoce como válvula aórtica bicúspide (VAB), caracterizada por tener solo dos valvas y dos senos de Valsalva. Su incidencia oscila entre el 1–2% en las series autópsicas. La VAB puede ser clínicamente silente durante la vida del individuo afecto, pero es un hecho bien documentado que la condición bicúspide entraña un riesgo elevado de que la válvula experimente complicaciones clínicas, como estenosis y/o insuficiencia, que suelen requerir cirugía. La VAB puede constituir una anomalía congénita aislada, pero también se encuentra asociada de forma significativa a coartación aórtica, a interrupción del arco aórtico y a defectos del septo interventricular. Además, los pacientes con VAB presentan a menudo dilatación aneurismática y disección aguda de la aorta ascendente.
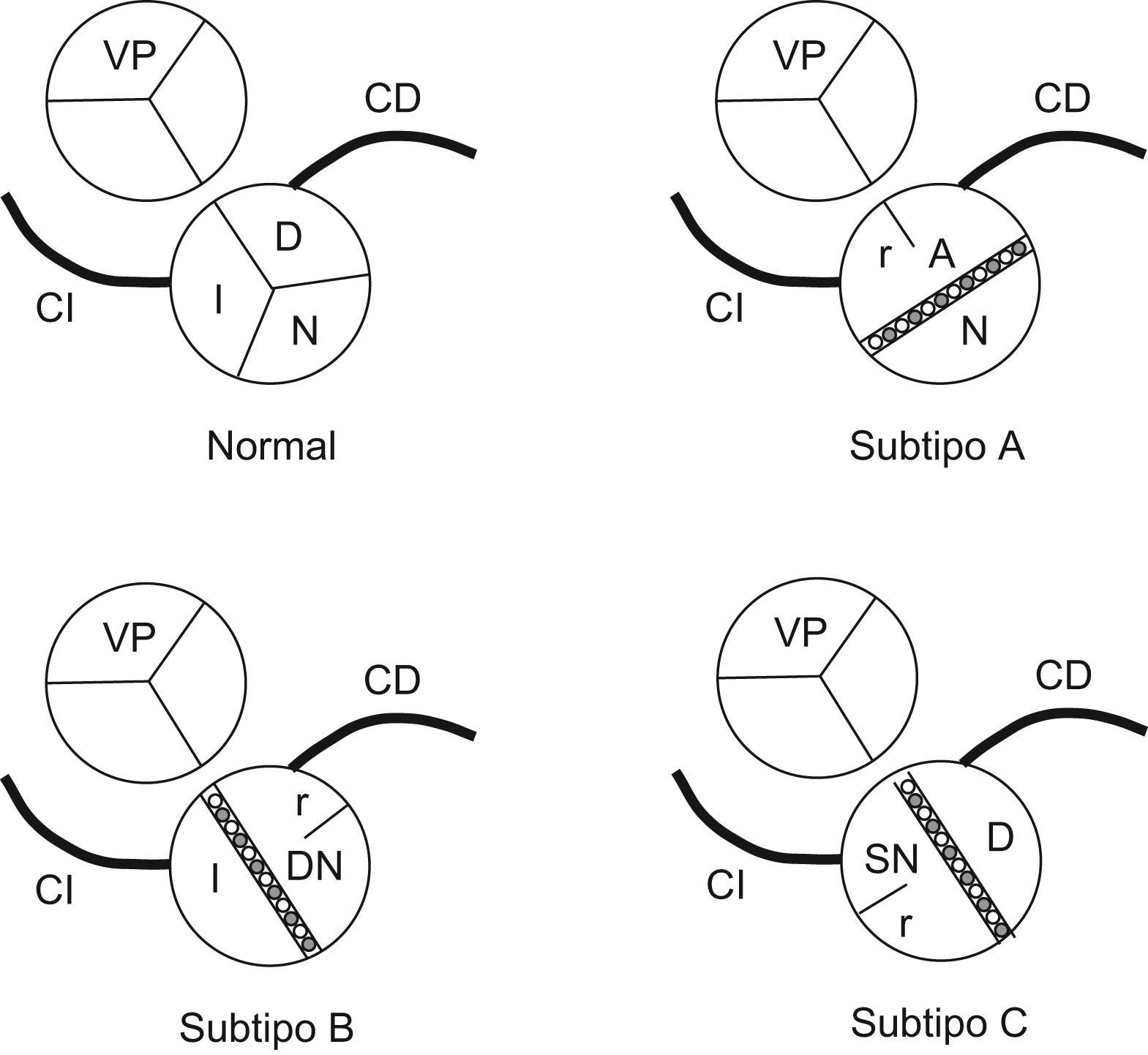
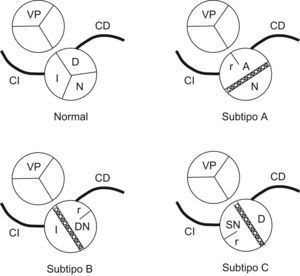
Subtipos de válvula aórtica bicúspideLa VAB está sujeta a variación morfológica (fig. 1). De forma sucinta, cabe hablar de tres subtipos principales (A, B, C) de VAB1. En el subtipo A, las valvas anteriores derecha e izquierda se presentan anatómicamente fusionadas, de manera que existe una sola valva anterior y otra posterior. En los subtipos B y C, las dos valvas están una a la derecha y la otra a la izquierda. Esta disposición es consecuencia de la unión de la valva derecha y de la no (subtipo B) o de la valva izquierda y de la no coronaria (subtipo C). Las investigaciones en las que se ha adoptado esta clasificación indican que el subtipo más frecuente es el A (50–80%) y el menos frecuente es el C (alrededor del 2%). En el subtipo A, los orificios coronarios se localizan en la pared del seno aórtico que sostiene la valva anterior. En los subtipos B y C, las arterias coronarias se originan en los senos aórticos opuestos. En muchas VAB hay septos más o menos desarrollados, denominados rafes, que se extienden desde la pared del seno de Valsalva hacia la valva. Los rafes suelen estar en las unidades valvulares (senos y valvas) fusionadas.
Representación esquemática de una válvula aórtica normal (tricúspide) y de una válvula aórtica bicúspide de los subtipos A, B y C. En las bicúspides, el seno y la válvula de morfogénesis anómala (véase el texto) suelen ser de mayores dimensiones que el seno y la valva normales. A: seno y valva anteriores o dextro-sinistros; CD: arteria coronaria derecha; CI: arteria coronaria izquierda; D: seno y valva derechos; DN: seno y valva dextro-no coronarios; I: seno y valva izquierdos; N: seno y valva no coronarios; r: posición habitual del rafe cuando existe; SN: seno y válvula sinistro-no coronarios; VP: válvula pulmonar.
Durante décadas se ha especulado sobre la etiología de la VAB, si bien los datos empíricos en los que se han fundamentado las hipótesis formuladas han sido más bien exiguos. En cualquier caso, se ha estado partiendo de la base de que todos los subtipos de VAB tienen la misma etiología. Sin embargo, los datos más recientes sobre el tema indican que esta suposición es incorrecta. La evidencia que ha revocado la idea de que todas las VAB conforman una única entidad etiológica se ha obtenido de estudios embriológicos realizados en dos modelos animales: uno con VAB del subtipo A y otro con VAB del subtipo B2. El modelo animal con VAB del subtipo A consiste en hámsteres sirios endogámicos en los que la incidencia del citado subtipo asciende al 58%. El modelo animal con VAB del subtipo B consiste en ratones mutantes deficientes en óxido nítrico sintetasa endotelial (eNOS−/−). La incidencia del subtipo B en dichos ratones se ha estimado en un 32%.
Los datos correspondientes al hámster sirio han demostrado que las VAB del subtipo A son consecuencia de una septación anómala de la porción proximal del tracto de salida cardiaco embrionario2. En concreto, se producen por una sobrefusión de las crestas septal y parietal del tracto de salida debido, aparentemente, a un comportamiento anómalo de las células de la cresta neural que intervienen en la formación del septo aorticopulmonar. Como resultado de la sobrefusión, se forma un solo cojín mesenquimático anterior en lugar de dos. Dicho cojín, anómalo, da lugar a la valva anterior. La valva posterior o no coronaria se desarrolla con normalidad.
Los hallazgos embriológicos en los ratones eNOS−/− han evidenciado que, a diferencia de las VAB del subtipo A, las del subtipo B no resultan de una septación defectuosa del tracto de salida cardiaco2. Lo que ocurre es que, antes de la septación. el margen posterior de la cresta septal y el cojín intercalado posterior se desarrollan en forma de un margen posterior de la cresta parietal normal único, que es el primordio de la valva anómala dextro-no coronaria. La valva izquierda se genera a partir del margen posterior de la cresta parietal normal. Hay indicios para pensar que el desarrollo anómalo de los cojines endocárdicos se debe a que la deficiencia de eNOS−/− altera la migración de las células endocárdicas durante la transformación epitelio-mesénquima, que tiene lugar al colonizar las células endocárdicas la gelatina cardiaca durante la morfogénesis de los cojines endocárdicos2.
Los resultados obtenidos en los hámsteres endogámicos y los ratones mutantes constituyen el primer testimonio empírico de que en el concepto de VAB se han estado incluyendo entidades etiológicas diferentes (cabe pensar que la patogénesis del subtipo C es similar a la del subtipo B, pero aún no hay pruebas experimentales de ello). Esta circunstancia abre nuevas perspectivas de estudio y lleva a reconsiderar aspectos que se han tratado desde la perspectiva de que la VAB es una entidad morfológica singular con diversas variantes anatómicas.
Implicaciones genéticas, patológicas, clínicas y quirúrgicasUno de los aspectos a reconsiderar se refiere a la genética de la VAB. En este ámbito parece que ya no hay discrepancias a la hora de aceptar que la VAB es hereditaria (su heredabilidad se ha cifrado en 0,89). Este asentimiento ha suscitado la realización de trabajos dedicados a determinar el o los genes que puedan estar implicados en la génesis de las VAB. La realidad es que, hasta ahora, tan solo se han podido identificar genes (Notch 1, Ufdil) o regiones cromosómicas (15q1.25-26) que presuntamente podrían estar involucrados en la transmisión hereditaria de la VAB, aislada o asociada a otras malformaciones y patologías cardiacas, y ello en un número reducido de grupos familiares en los que la incidencia de la VAB es significativamente mayor que la de la población general. El hecho de que varias regiones genómicas aparezcan asociadas al desarrollo de las VAB sugiere que en la expresión fenotípica del carácter subyace una considerable heterogeneidad genética y, también, que el modo de heredarse la VAB sigue pautas complejas3. A ello habrá que añadir, en el futuro, un factor que no se ha tenido en cuenta hasta ahora: la distinta etiología de los subtipos de VAB. Este factor habrá de tenerse muy en consideración en próximas investigaciones, ya que parece más que probable que los diversos subtipos de VAB se deban a genotipos diferentes.
Otro punto por revisar se refiere a la relación entre la VAB y otros defectos cardiacos congénitos. Un hecho bien conocido es que la VAB está asociada significativamente a coartación aórtica, en cuya patogénesis está involucrado un comportamiento anómalo de las células de la cresta neural cardiaca1. Pues bien, los datos más recientes sobre esta asociación indican que es el subtipo A —que también parece deberse a anomalías de las células de la cresta neural— y no el subtipo B el que realmente aparece asociado a la coartación aórtica de forma no azarosa. Este hecho invita a reflexionar sobre si existe realmente una correlación causal entre los distintos subtipos de VAB y las diversas anomalías cardiacas e incluso no cardiacas que suelen presentarse en concomitancia con la condición bicúspide de la válvula aórtica.
La constatación de que los subtipos A y B de VAB son entidades etiológicas distintas abre vías de estudio novedosas en el ámbito clínico. En 2004, Fernandes et al4 publicaron un trabajo en el que demostraron que la morfología de la VAB constituye un carácter eficiente para pronosticar el riesgo de disfunción valvular aórtica. Sus datos evidenciaron que: 1) el subtipo B tiene un riesgo dos veces mayor que el subtipo A de sufrir estenosis y/o regurgitación aórticas, y 2) la presentación clínica de ambas patologías es mucho más precoz en el subtipo B, al menos en las dos primeras décadas de la vida. El porqué de estas circunstancias está por dilucidarse pero, teniendo en cuenta la diferente etiología de los subtipos de VAB, parece razonable plantearse estudios de seguimiento de los individuos afectos que contribuyan a una mejor comprensión de la correspondencia entre tales subtipos y sus respectivas historias naturales.
Otro aspecto de interés se refiere a la noción de que la morfología de las VAB puede constituir un buen indicador de las propiedades elásticas de la aorta ascendente5. El tema atañe tanto a la comprensión de las causas que determinan la dilatación aórtica como a los problemas que se plantean en cirugía acerca de qué actitud tomar frente a dicha patología. En este contexto, es importante matizar que los datos bibliográficos resultan cada vez más concluyentes en el sentido de que la dilatación de la raíz aórtica y de la aorta ascendente se debe más a defectos congénitos de tipo estructural y no, como se suponía, a problemas de flujo generados por la propia estenosis valvular aórtica. Aun así, es cierto que cuando hay una estenosis aórtica la aorta ascendente suele dilatarse, con lo cual surge el problema de si se debe tratar dicha dilatación mediante cirugía cuando el diámetro aórtico no alcanza el valor que se considera crítico (4,5–5,0mm). En otras palabras, al tener que subsanar la estenosis aórtica a un paciente con una aorta ligeramente dilatada, es frecuente que al cirujano se le plantee el dilema de si tiene o no que proceder también a una sustitución de la aorta ascendente. En relación con ello, hay constancia de que pacientes a los que se les implantó una prótesis valvular por presentar una VAB calcificada precisan ser reintervenidos al cabo de unos años por una importante dilatación de la aorta ascendente6, con el consiguiente riesgo añadido para el paciente. En este contexto resulta altamente sugestivo formular la hipótesis de que tanto en la dilatación aórtica estructural como en la formación de VAB del subtipo A está implicado un comportamiento anómalo de las células de la cresta neural cardiaca. Ello induce a plantear futuros estudios sobre las interrelaciones entre los subtipos de VAB y la dilatación aórtica. Para ello es necesario contar con diagnósticos ecocardiográficos e informes operatorios lo más precisos posible de la morfología de las VAB que concurran con una dilatación aórtica, aunque no sea severa.