Se define insuficiencia cardiaca aguda (ICA) como la aparición de síntomas de insuficiencia cardiaca (IC) que requieren tratamiento urgente. Esta imprecisa definición refleja la enorme diversidad de situaciones que engloba la ICA. La mayoría de los casos se atienden en primer lugar por los equipos de urgencias o emergencias médicas. Esta misma urgencia del tratamiento hace difícil establecer protocolos y guías y desarrollar investigación clínica, pero en los últimos años se han editado varias guías que ofrecen bastante apoyo en la toma de decisiones1,2.
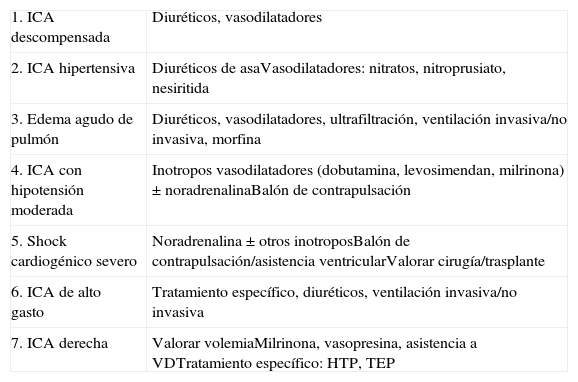
La Sociedad Europea de Cardiología tipifica 7 tipos de ICA, para los que se proponen actuaciones bien diferenciadas (tabla 1). La clasificación se complica si se incluyen características específicas de cada caso, que pueden tener relevancia: 1) ICA de novo o IC crónica descompensada, 2) con o sin enfermedad coronaria, 3) con disfunción ventricular izquierda o con función sistólica conservada. Algunas situaciones especiales requieren un abordaje específico, con protocolos independientes, como el síndrome coronario agudo que se presenta en Killip III o Killip IV, la ICA tras cirugía cardiaca, o la ICA en embarazadas. Además es importante determinar la causa de la descompensación, que puede ser: dietética, progresión de la enfermedad miocárdica, otros desencadenantes cardiovasculares (fibrilación auricular, hipertensión arterial, endocarditis), comorbilidades (infección respiratoria, anemia, insuficiencia renal, hiper o hipotiroidismo), efectos secundarios de fármacos (calcioantagonistas, antiarrítmicos I-c, corticoides, antiinflamatorios no esteroideos, inhibidores de la ciclooxigenasa 2, glitazonas, pregabalina). Esta conjunción de clasificaciones hace que elaborar un algoritmo universal sea complejo, debiendo cada centro establecer un protocolo de actuación de acuerdo con la disponibilidad de pruebas, en la que se incluya la actuación en el área de urgencias (tabla 2)1,2.
Perfiles de insuficiencia cardiaca aguda (ICA) y tratamientos propuestos.
| 1. ICA descompensada | Diuréticos, vasodilatadores |
| 2. ICA hipertensiva | Diuréticos de asaVasodilatadores: nitratos, nitroprusiato, nesiritida |
| 3. Edema agudo de pulmón | Diuréticos, vasodilatadores, ultrafiltración, ventilación invasiva/no invasiva, morfina |
| 4. ICA con hipotensión moderada | Inotropos vasodilatadores (dobutamina, levosimendan, milrinona)±noradrenalinaBalón de contrapulsación |
| 5. Shock cardiogénico severo | Noradrenalina±otros inotroposBalón de contrapulsación/asistencia ventricularValorar cirugía/trasplante |
| 6. ICA de alto gasto | Tratamiento específico, diuréticos, ventilación invasiva/no invasiva |
| 7. ICA derecha | Valorar volemiaMilrinona, vasopresina, asistencia a VDTratamiento específico: HTP, TEP |
HTP: hipertensión pulmonar; TEP: tromboembolismo pulmonar; VD: ventrículo derecho.
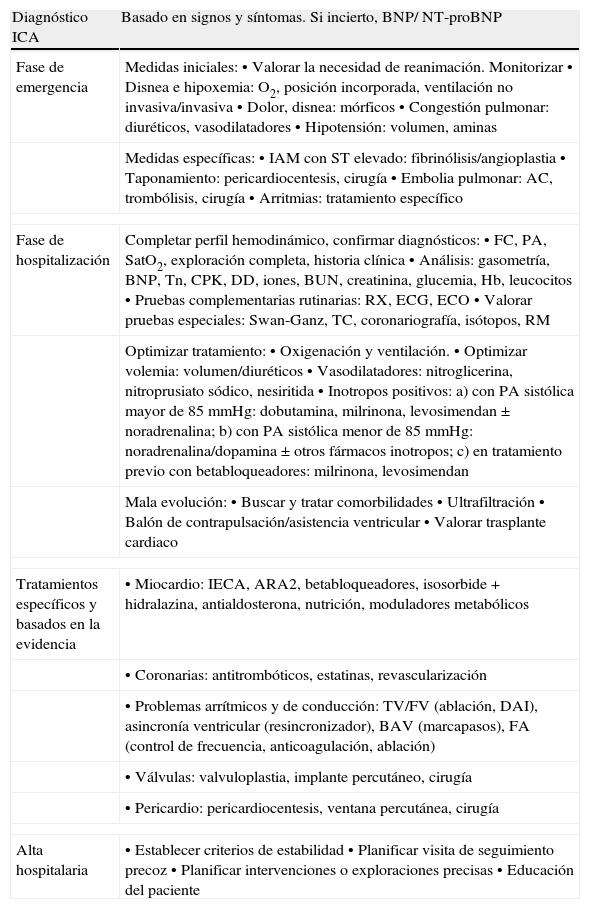
Fases en el manejo de la insuficiencia cardiaca.
| Diagnóstico ICA | Basado en signos y síntomas. Si incierto, BNP/ NT-proBNP |
| Fase de emergencia | Medidas iniciales: • Valorar la necesidad de reanimación. Monitorizar • Disnea e hipoxemia: O2, posición incorporada, ventilación no invasiva/invasiva • Dolor, disnea: mórficos • Congestión pulmonar: diuréticos, vasodilatadores • Hipotensión: volumen, aminas |
| Medidas específicas: • IAM con ST elevado: fibrinólisis/angioplastia • Taponamiento: pericardiocentesis, cirugía • Embolia pulmonar: AC, trombólisis, cirugía • Arritmias: tratamiento específico | |
| Fase de hospitalización | Completar perfil hemodinámico, confirmar diagnósticos: • FC, PA, SatO2, exploración completa, historia clínica • Análisis: gasometría, BNP, Tn, CPK, DD, iones, BUN, creatinina, glucemia, Hb, leucocitos • Pruebas complementarias rutinarias: RX, ECG, ECO • Valorar pruebas especiales: Swan-Ganz, TC, coronariografía, isótopos, RM |
| Optimizar tratamiento: • Oxigenación y ventilación. • Optimizar volemia: volumen/diuréticos • Vasodilatadores: nitroglicerina, nitroprusiato sódico, nesiritida • Inotropos positivos: a) con PA sistólica mayor de 85 mmHg: dobutamina, milrinona, levosimendan±noradrenalina; b) con PA sistólica menor de 85 mmHg: noradrenalina/dopamina±otros fármacos inotropos; c) en tratamiento previo con betabloqueadores: milrinona, levosimendan | |
| Mala evolución: • Buscar y tratar comorbilidades • Ultrafiltración • Balón de contrapulsación/asistencia ventricular • Valorar trasplante cardiaco | |
| Tratamientos específicos y basados en la evidencia | • Miocardio: IECA, ARA2, betabloqueadores, isosorbide+hidralazina, antialdosterona, nutrición, moduladores metabólicos |
| • Coronarias: antitrombóticos, estatinas, revascularización | |
| • Problemas arrítmicos y de conducción: TV/FV (ablación, DAI), asincronía ventricular (resincronizador), BAV (marcapasos), FA (control de frecuencia, anticoagulación, ablación) | |
| • Válvulas: valvuloplastia, implante percutáneo, cirugía | |
| • Pericardio: pericardiocentesis, ventana percutánea, cirugía | |
| Alta hospitalaria | • Establecer criterios de estabilidad • Planificar visita de seguimiento precoz • Planificar intervenciones o exploraciones precisas • Educación del paciente |
AC: anticoagulación; BUN: nitrógeno ureico; CPK; creatin fosfocinasa; DAI: desfibrilador implantable; DD: dímeros D; FA: fibrilación auricular; FC: frecuencia cardiaca; FV: fibrilación ventricular; Hb hemoglobina; IAM: infarto agudo de miocardio; ICA: insuficiencia cardiaca aguda; PA: tensión arterial; RX: radiografía; Tn: troponina; TV: taquicardia ventricular.
Un avance importante de los últimos años ha sido la utilización de los niveles de péptidos natriuréticos en el diagnóstico de ICA. Los síntomas típicos de IC (disnea, fatiga, edemas o ganancia rápida de peso) no son específicos, pudiendo ser difícil el diagnóstico diferencial con algunos casos de neumonía, embolismo pulmonar, enfermedad pulmonar crónica reagudizada, o insuficiencia renal crónica agudizada. Aún resulta más difícil en presencia de IC crónica que se descompensa por alguna de estas comorbilidades. En el BNP Study, que incluyó 1586 pacientes atendidos en urgencias, un valor de péptido natriurético cerebral (BNP) mayor de 100 pg/ml tuvo una precisión diagnóstica del 83%, y un valor menor de 50 tuvo un valor predictivo negativo del 96%. Resultados similares se obtuvieron en otros estudios con la porción amino terminal del péptido natriurético cerebral (NT-proBNP). La recomendación es utilizar este análisis siempre que el diagnóstico de ICA sea incierto. Aunque las variaciones en los niveles de BNP o NT-proBNP se asocian con el pronóstico, no está establecido que se deban utilizar estos cambios para guiar el tratamiento1,2.
Con los datos clínicos, parámetros bioquímicos, electrocardiográficos y radiografía de tórax se consigue caracterizar la mayoría de los pacientes con ICA. La disponibilidad del ecocardiógrafo nos aporta además una información anatómica y funcional fundamental, descartando o confirmando con rapidez la presencia de taponamiento cardiaco, enfermedades valvulares, dilatación de ventrículo derecho, disfunción ventricular izquierda o trastornos de la contractilidad, y estimando la presión de la arteria pulmonar. Esto ha relegado el uso del catéter de arteria pulmonar (Swan-Ganz). La realización de ecocardiografía en la ICA se considera clase I, evidencia C. El Swan Ganz se recomienda en casos en que el diagnóstico sea difícil y el ecocardiograma no aporte suficiente información, o que presenten una difícil estabilización, en que se combina hipoperfusión y congestión pulmonar. Se debe retirar pronto para evitar las complicaciones asociadas al catéter (infección, trombosis, arritmias). La indicación actual es clase IIb, evidencia C2.
Tratamiento farmacológicoDiuréticos, vasodilatadores e inotropos intravenosos constituyen actualmente la base del tratamiento de la ICA grave. Los episodios menos graves no precisan de inotropos. El estudio SOAP II ha rehabilitado recientemente el uso de la noradrenalina en el shock cardiogénico, encontrando una supervivencia mayor entre los casos tratados con noradrenalina frente a los tratados con dopamina. En las tabla 1 y 2 se sintetiza el manejo actual de la ICA de acuerdo con las recomendaciones de las sociedades de cardiología1-3.
Actualmente hay una pléyade de fármacos en desarrollo, algunos de los cuales ya están en fase de investigación clínica. Entre ellos están: el cinaciguat y la relaxina, con un efecto vasodilatador y perfil reno-protector y cardio-protector, o la istaroxima, y la urocortina, con un potente aumento de la función sistólica y diastólica, la aliskreina, inhibidor directo de la renina (ya aprobada para su uso en hipertensión arterial), los ácidos omega-3 (utilizados en la IC crónica: estudio GISSI-HF), el tolvaptan, inhibidor la vasopresina indicado para la hiponatremia con hipervolemia (ensayo EVEREST). Esta variedad de dianas en la investigación de la ICA es reflejo del mejor conocimiento de los mecanismos moleculares de la ICA, y nos adelanta qué habrá en los próximos esquemas frente a los actuales.
Uso de betabloqueadores en la ICAEl efecto beneficioso de los betabloqueadores en el tratamiento de la IC crónica ha sido demostrado en 4 grandes ensayos clínicos: CIBIS 2 (bisoprolol), COPERNICUS (carvedilol), MERIT-HF (metoprolol succinato de liberación retardada) y SENIOR (nevibolol en ancianos). Sin embargo, su uso en la ICA se considera contraindicado. Las evidencias actuales hacen cuestionar y replantear esta contraindicación, puesto que la gran mayoría de los pacientes con ICA pasan a tener IC crónica, pasando por consiguiente estos fármacos de estar contraindicados a tener una indicación definitiva (indicación clase IA). Este tema está abierto, con varias cuestiones pendientes de resolver, como cuál es el momento de iniciar, y qué fármacos utilizar1,2.
Los datos disponibles provienen de pequeños ensayos clínicos o de registros de diverso tamaño. El inicio estudio IMPACT-HF estudiaba la ventaja de iniciar los betabloqueadores antes del alta hospitalaria, una vez controlado el episodio de ICA. Se aleatorizaron los pacientes incluidos (n=363) a recibir betabloqueadores antes del alta, o dejarlo a criterio del cardiólogo dos semanas después. El grupo con betabloqueadores al alta tuvo más probabilidad de seguir tratamiento crónico con betabloqueadores, sin aumento de complicaciones. Más datos nos aporta el registro OPTIMIZE-HF, que incluyó en su cohorte final 17.000 pacientes ingresados por ICA. El seguimiento a un año demostró una mejor supervivencia con la administración de betabloqueadores al alta, especialmente en el subgrupo de los pacientes con disfunción sistólica, con una reducción de 35% de la mortalidad. Este registro también encontró que entre los pacientes que previamente recibían betabloqueadores, la retirada de los mismos duplicaba la probabilidad de eventos adversos con respecto a mantenerlos4.
Las recomendaciones de la ESC establecen que el uso de los betabloqueadores en pacientes con ICA activa, con crepitantes por encima de las bases, debe ser cauteloso. En el caso de que haya taquicardia y signos de isquemia, se puede usar metoprolol intravenoso (clase IIb, evidencia C), en base a la experiencia publicada procedente del estudio MIAMI, en 1985. En los pacientes que presentan IC durante un infarto de miocardio, la administración de betabloqueadores debe ser precoz, en base a subanálisis procedentes de varios ensayos (clase IIa, evidencia B). En los pacientes con IC crónica descompensada se deben administrar betabloqueadores una vez estabilizados (clase I, evidencia A). Las dosis y fármacos recomendados son las de los ensayos clínicos: bisoprolol, carvedilol, metoprolol o nevibolol, comenzando con dosis pequeñas1,2.
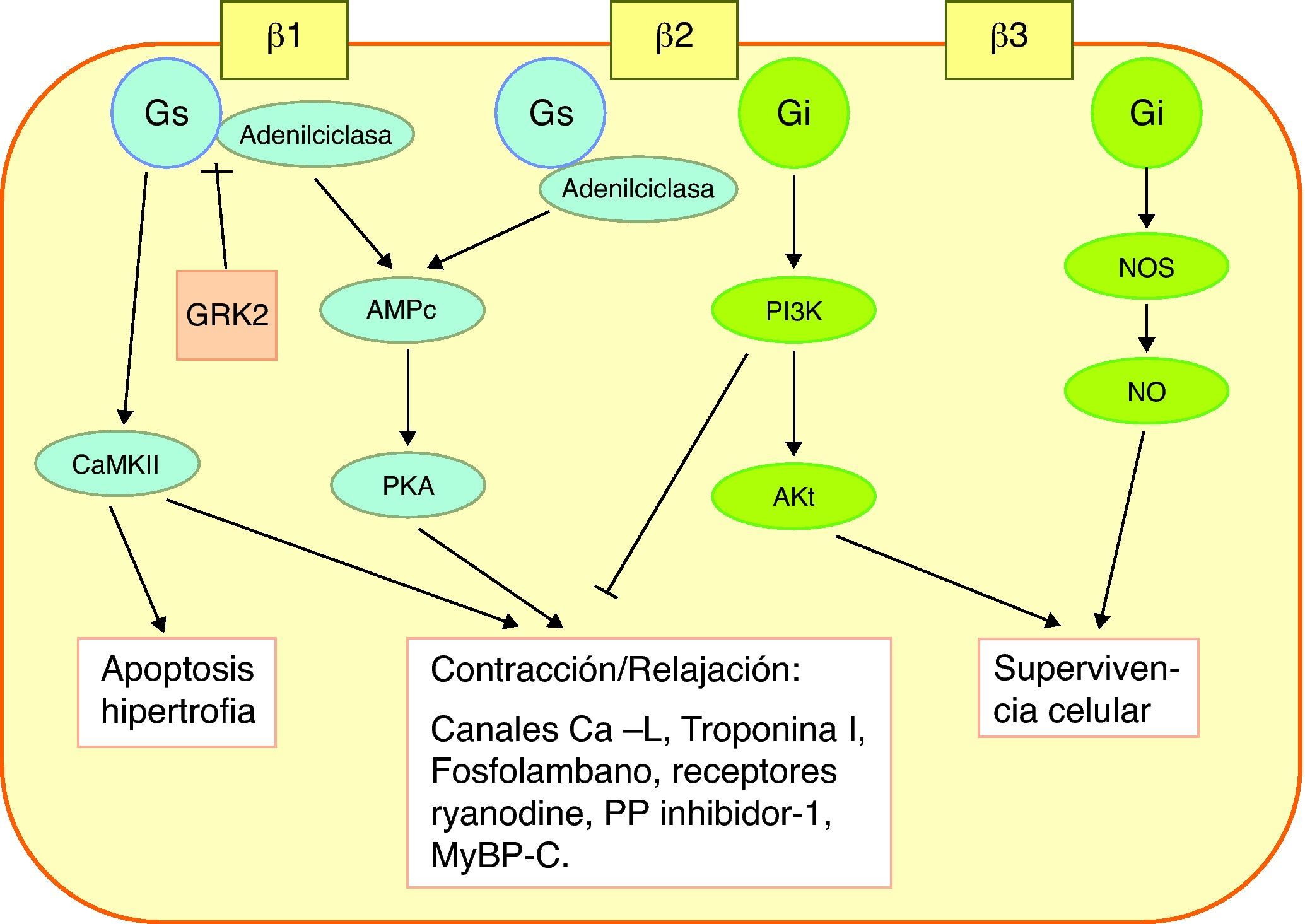
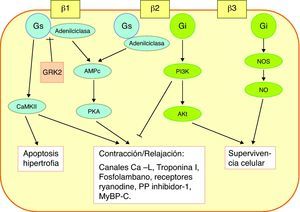
Receptores beta. Mecanismo de acción de los betabloqueadoresLos receptores beta son estructuras proteicas complejas transmembrana, con una porción extracelular, que interacciona con las catecolaminas, y una terminación intracelular, que interacciona con la proteína G. Hay al menos 3 tipos de receptores beta: β1, β2 y β3, con diferentes efectos en el miocito. La forma predominante en los miocitos ventriculares es el receptor β1, que constituye del 70 al 80%, seguido del β2, que constituye la mayor parte del 20-30% restante. Los receptores β1 se acoplan a la subforma Gs de la proteína G, activando la adenilciclasa, que produce un incremento de la proteincinasa A, y ésta a su vez activa numerosas proteínas responsables del incremento de la contractilidad: canales L de calcio, fosfolambano del retículo sarcoplásmico, troponina I, troponina C, receptores ryanodina, protein-fosfatasa inhibidor-1. Cuando hay una activación persistente de los receptores β1, se activa una vía alternativa, a través de la calciomodulina proteincinasa II (CaMKII), que también resulta en activación de las proteínas responsables de la contractilidad, pero además activa la apoptosis (fig. 1).
Mecanismo de acción de la activación de los receptores β. Los receptores β1 se acoplan a la proteína Gs, la vía de la PKA, responsable del incremento de la contractilidad. Hay una vía alternativa, a través de la CaMKII, que también activa la contractilidad, pero además activa la apoptosis. Los receptores β2 están ligados no sólo a la proteína Gs sino también a la Gi. Por medio de ésta se activa la PI3K, que inhibe la vía de la PKA y activa la molécula Akt. Los receptores β3 tienen un efecto protector celular, por medio de la producción de NO. La GRK2 inhibe la vía de la PKA. AMPc: adenosin-monofosfato cíclico; CaMKII: calciomodulina-proteincinasa; GRK2: cinasa acoplada al receptor de proteína G; MyBP-C: proteína-C de unión a la miosina; NOS: sintetasa de NO; PI3K: fosfoinositol-3-cinasa; PKA: proteincinasa A; PP: protein-fosfatasa.
Los receptores β2 están ligados no sólo a la subforma Gs de la proteína G, sino también a la Gi. Por medio de ésta se activa las fosfoinositol 3 cinasa (PI3K), que inhibe la vía inotrópica de la proteincinasa A y activa la molécula Akt, responsable de numerosas interacciones destinadas a la protección celular. Los receptores β3, que inicialmente se consideraban ubicados en los adipocitos, se sabe que existen en el miocito, y tienen un efecto protector celular, por medio de la producción de óxido nitroso.
En la IC, el estímulo constante de los receptores beta produce un efecto doble sobre los receptores β1: disminuye su número hasta un 50%, y disminuye su actividad. Uno de los mediadores más importantes de esto es la cinasa acoplada al receptor de proteína G (GRK2), que inhibe la activación de la vía de la proteincinasa A. En la IC se incrementa la expresión de GRK2 de forma paralela a la inactivación y disminución de los receptores β1. Hay varias líneas de terapia génica dirigida a GRK2 y otras dianas en estas vías de activación del inotropismo con resultados muy prometedores, pero de momento sólo en IC crónica5.
El papel del bloqueo β1 en la IC crónica sería disminuir ese estímulo constante de los receptores β1 en respuesta a las catecolaminas, interrumpiendo la sobreexpresión de GRK2, con reactivación y recuperación del número de receptores β1.
¿Cuándo comienza a ser cierto esto en la ICA? No tenemos hasta el momento respuesta. En la ICA, el estímulo inotrópico es fundamental para mantener la función miocárdica. Pero una vez que se ponen en marcha los mecanismos reguladores de los receptores β1, el estímulo de las aminas pierde eficacia. En cambio, una vez obtenida la estabilización del paciente, el inicio de pequeñas dosis de betabloqueadores disminuirá el daño miocárdico y restablecerá una respuesta fisiológica del corazón.
El efecto cardioprotector de los betabloqueadores es indudable, recomendándose su uso precoz en los pacientes que se recuperan de un episodio de ICA. Pero en el momento actual no se debe recomendar su uso antes de que el paciente se haya estabilizado, aunque sí se recomienda en general mantener los betabloqueadores en los pacientes que los recibían previamente a la ICA, individualizando en los casos de mayor inestabilidad hemodinámica. Los inotropos que no actúan a través de los receptores beta hacen más fácil mantener el betabloqueo. Hacen falta ensayos clínicos que exploren estas combinaciones o el desarrollo de nuevos protocolos de betabloqueo.