El avance en el intervencionismo en las cardiopatías congénitas ha sido tan importante en los últimos 30años que permite hoy día su sistematización. En el primer artículo tratamos de las obstrucciones a la salida de ambos ventrículos. En esta segunda parte analizaremos el cierre percutáneo de defectos cardiacos. Entre los cortocircuitos izquierda-derecha, el cierre percutáneo de comunicación interauricular, interventricular y ductus persistente suponen en la actualidad un excelente arsenal terapéutico para estas patologías. Las fístulas arteriovenosas centrales y las sistémico-pulmonares pueden también ser cerradas percutáneamente con dispositivos vasculares. Entre los cortocircuitos derecha-izquierda el cierre percutáneo de foramen oval y de fenestraciones posquirúrgicas también supone un enfoque terapéutico muy útil. Por último, la terapia celular en cardiopatías con disfunción ventricular severa en la infancia comienza a perfilarse como un tratamiento muy esperanzador.
Significant advancements in percutaneous interventions for congenital heart disease have been developed over the last 30 years. In the first article we analyzed ventricular outflow obstruction. In this second part, we will focus on heart defects and shunts. The percutaneous device closure of atrial septal and interventricular defects and the persistent ductus arteriosus in the main left-to-right shunts are safe alternatives to surgical closure. Also central and systemic-to-pulmonary fistulas may be closed percutaneously by specific devices. The right-to-left shunts, such as the patent foramen ovale or surgical fenestrations, can also be closed percutaneously. Finally, for severe left ventricular disfunction in infancy, cell therapy appears promising for the future.
En el primer artículo tratamos las obstrucciones al tracto de salida de ambos ventrículos. En esta segunda parte nos ocuparemos del cierre percutáneo de defectos septales y de cortocircuitos izquierda-derecha y derecha-izquierda por fístulas centrales o periféricas. Estos procedimientos alivian o curan cardiopatías con hiperaflujo pulmonar y también lo hacen en aquellas con cortocircuitos derecha-izquierda que ocasionan hipoxemia. En cardiopatías complejas, algunos procedimientos híbridos permiten mejorar las condiciones quirúrgicas y facilitar ciertas operaciones. Finalmente, se mencionará el futuro del tratamiento percutáneo de la disfunción ventricular severa en la edad pediátrica.
Cortocircuitos izquierda-derechaCierre de comunicación interauricularLa comunicación interauricular (CIA) es la cardiopatía con hiperaflujo que más frecuentemente se ve en el joven y en el adulto. Ello es debido a que los síntomas de hipertensión pulmonar, deterioro del grado funcional y arritmias auriculares no aparecen hasta la cuarta década de la vida, pudiendo ser confundida su auscultación con soplos banales. Por tanto, no es infrecuente que muchos pacientes lleguen a la adolescencia o a la edad adulta sin haber sido diagnosticados. El tratamiento de esta malformación ha sido clásicamente quirúrgico, pero la disponibilidad de los nuevos dispositivos de oclusión ha hecho que el tratamiento percutáneo haya ido ganando aceptación en los últimos años. Aunque las recomendaciones iniciales para el cierre percutáneo de estos defectos se limitaban a defectos pequeños, la creciente experiencia con los nuevos dispositivos ha permitido abordar defectos más complejos consistentes en comunicaciones interauriculares grandes (>30mm de diámetro), defectos múltiples, pacientes con hipertensión pulmonar o malformaciones asociadas con tratamiento percutáneo1,2.
TécnicaTodos nuestros pacientes se han tratado bajo anestesia general, que evita la ansiedad en niños o mayores y favorece la monitorización transesofágica prolongada. Además, recomendamos estudio previo de la anatomía cardiaca y del septo con TAC-64. Se realiza un cateterismo diagnóstico arterial y venoso por vía femoral. Suele ser de ayuda el empleo de ambas venas femorales. Así, vía venosa femoral izquierda se introduce un catéter de angiografía 6-7F, por la vía arterial femoral izquierda se utiliza un catéter Pigtail 5-6F y por la vía venosa femoral derecha se utiliza un catéter de orificio terminal 7F que posteriormente se sustituye por la vaina transportadora del dispositivo entre 9 y 14F. En caso de pacientes con agujeros múltiples y separados utilizamos ambos accesos venosos femorales para medición y posibles sueltas independientes1,3. Tras el registro de las presiones y toma de muestras para determinación de oximetrías a todos los niveles, se realiza una angiografía en arteria pulmonar en proyección de 4 cámaras para visualizar en recirculación el drenaje venoso pulmonar y descartar el anómalo que muchas veces se asocia a la comunicación interauricular. Esta inyección puede obviarse si existe estudio previo TAC que descarte el drenaje anómalo. Seguidamente se inyecta en la vena pulmonar superior derecha en la misma proyección. El estudio angiográfico permite la medida del septo interauricular, el diámetro del defecto y la medición de los remanentes. Tras la medición angiográfica se realiza una segunda medición de las mismas estructuras utilizando el eco transesofágico. El estudio ultrasónico permite obtener el máximo diámetro del defecto y la medición de los remanentes del septo superior, inferior, ventral y dorsal. Basado en mediciones TAC-64, el tamaño del dispositivo se selecciona ligeramente superior al diámetro máximo del orificio. Debe alertarse sobre el peligro de embolización de un posible dispositivo cuando hay ausencia de remanente septal inferior visualizado en la proyección de cavas. El dispositivo se introduce a través de la vaina correspondiente, de diámetro creciente según el tamaño del oclusor, que se implanta bajo monitorización ultrasónica y fluoroscópica. En relación con el tipo de dispositivo, el primer diseño fue el dispositivo de King y Mills4, del que no hemos tenido experiencia en nuestro país. Entre los años 1993 y 1998 estuvo disponible el dispositivo de Sideris et al.5, del que se implantaron 19 dispositivos en nuestro centro. A partir de esta fecha, el más utilizado ha sido el dispositivo de Amplatz, que es con el que se tiene mayor experiencia en el mundo. Una vez que el dispositivo es implantado, antes de la suelta definitiva efectuamos una nueva evaluación ultrasónica, asegurándonos de la adecuada posición del mismo y de la ausencia de cortocircuito residual. La estabilidad del oclusor se detecta mediante suaves movimientos de empuje y tracción antes de la suelta definitiva. Tras la misma, se repite un estudio hemodinámico y angiográfico en las mismas condiciones que basalmente. En pacientes con orificios separados que recibieron 2 oclusores independientes se utiliza una oclusión simultánea con doble balón para la medición y la selección del tamaño de los dispositivos.
ResultadosEn nuestro servicio se han tratado 348 pacientes en los que se utilizaron dispositivos de hasta 40mm de diámetro. El éxito primario (definido como cierre completo con mínimo cortocircuito residual) se alcanzó en el 99%. Se objetivó una persistencia de cortocircuito residual moderado en el 1% de los pacientes a los 6meses de seguimiento. Las complicaciones fueron raras y ocurrieron en el 3% de los pacientes, consistiendo en embolización del dispositivo en 6, taquicardia auricular en 2, derrame pericárdico en uno, bloqueo auriculoventricular completo en uno y erosión esofágica por el eco en uno. Solo 3 pacientes precisaron intervención quirúrgica. Posteriormente, muchos grupos han reportado resultados similares6.
IndicacionesActualmente se acepta que debe intentarse el cierre percutáneo de pacientes adultos con CIA tipo ostium secundum y buenos remanentes septales. No se considera indicado el cierre en pacientes con defectos muy grandes, mayores de 38mm de diámetro7. Tampoco en CIA tipo seno venoso, tipo ostium primum o asociada a drenaje venoso pulmonar anómalo. Pacientes con hipertensión pulmonar2 o defectos septales complejos como agujeros múltiples o aneurismas del septo interauricular1,3 también pueden beneficiarse de esta técnica cuando es realizada por grupos expertos.
Cierre de comunicación interventricularLa comunicación interventricular (CIV) constituye la cardiopatía congénita más frecuente. Se detecta fácilmente durante el periodo neonatal o durante la lactancia, debido a la presencia de soplo llamativo, y puede ser corregida con éxito durante este periodo. Sin embargo, algunos pacientes llegan a la adolescencia o a la edad adulta por diferentes razones y pueden ser tratados en este periodo de la vida. El cierre del defecto se ha efectuado de forma quirúrgica durante muchos años con buenos resultados. Sin embargo, la cirugía implica esternotomía, circulación extracorpórea y postoperatorio no exento de complicaciones. El cierre percutáneo de la CIV es una técnica reciente que podría representar una alternativa mecánica de menor agresividad e incomodidad para el paciente.
TécnicaDe nuevo, el dispositivo con el que más experiencia se tiene es el de Amplatz para CIV. Estos dispositivos están diseñados de forma diferente para la localización muscular o para la subaórtica. En esta última, el dispositivo es ligeramente asimétrico, de forma que el disco arterial no interfiera con la función valvular aórtica. Al igual que en otros defectos, se precisa un cateterismo diagnóstico con registro de presiones y oximetrías a todos los niveles, cálculo de cortocircuito y ventriculografía izquierda en varias proyecciones. Las de mayor utilidad serían la oblicua anterior izquierda 30° craneal 40° y oblicua anterior izquierda 70° craneal 20° (4 cámaras y axial longitudinal). De nuevo el eco transesofágico resulta de ayuda para la monitorización de todo el procedimiento, y el estudio TAC-64 previo también sirve para planificar el procedimiento. Se cruza una guía de Terumo desde el lado izquierdo por el defecto que es capturada en el lado derecho y exteriorizada por la vena femoral. De esta forma se establece un circuito arteriovenoso que permitirá el avance de la cánula hasta el ventrículo izquierdo. Sobre la misma se avanza el oclusor, que es acoplado a nivel del defecto. Una vez acoplado el dispositivo, se comprueba angiográfica y ecocardiográficamente la correcta posición del mismo antes de soltarlo. En los pacientes con CIV subaórtica también se realiza una aortografía antes y después de la suelta, para comprobar la ausencia de compromiso de sigmoideas aórticas (fig. 1). Tras el procedimiento los pacientes son dados de alta con dalteparina subcutánea durante un mes y aspirina durante 6meses, así como profilaxis antibiótica durante 2semanas para la prevención de endocarditis. El dispositivo muscular puede también utilizarse en comunicaciones subaórticas que posean un mínimo remanente superior8.
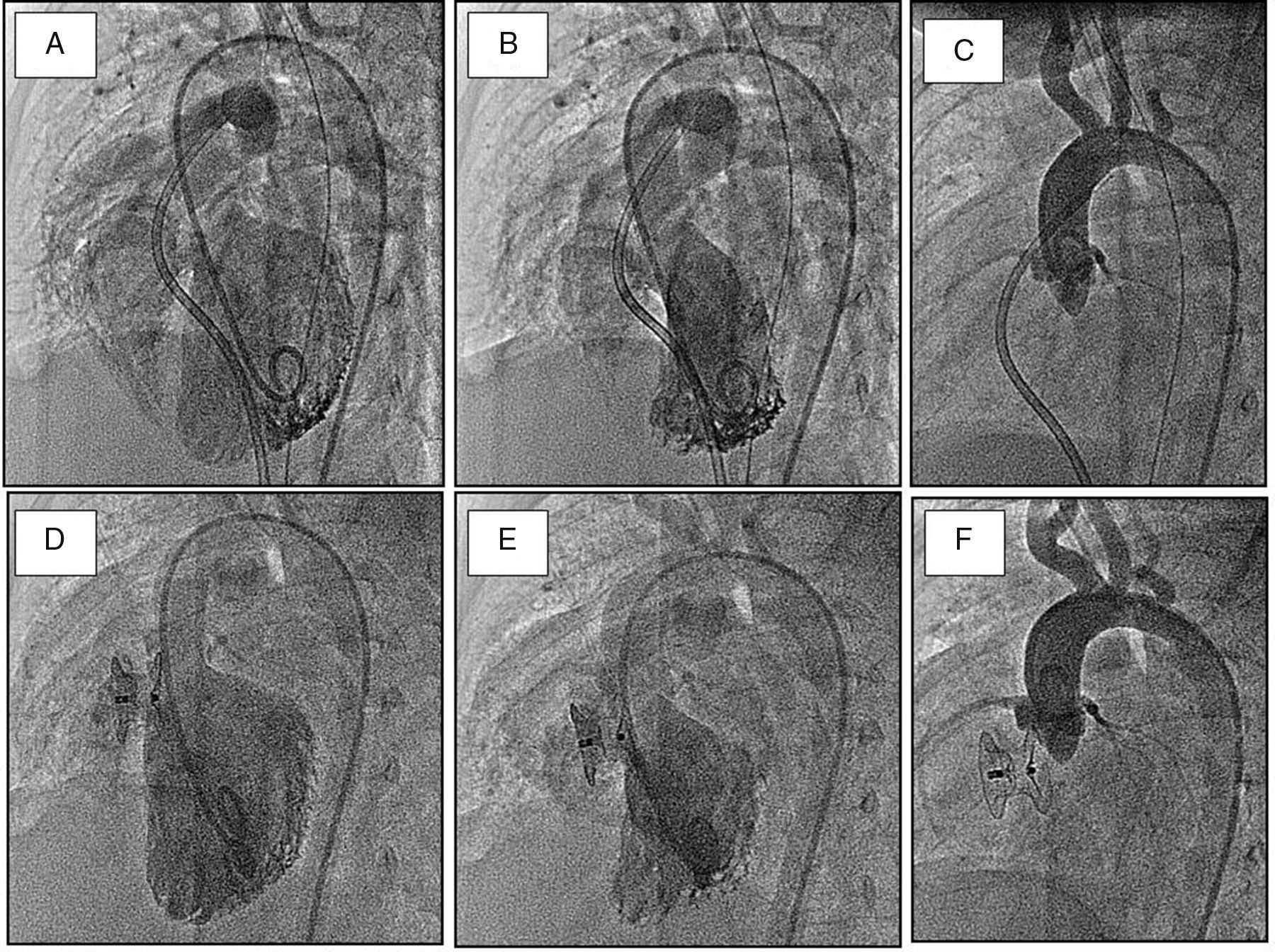
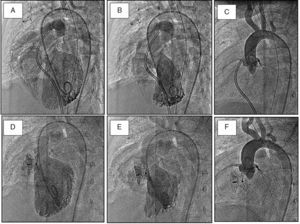
Cierre percutáneo de comunicación interventricular subaórtica grande en un lactante con insuficiencia cardiaca. Todas las angiografías están hechas en proyección oblicuo-izquierda. A,B)Imágenes basales de ventrículo izquierdo en diástole y sístole, respectivamente. C)Aortografía basal. D,E)Imágenes de ventrículo izquierdo tras el cierre con dispositivo de Amplatz muscular. F)Aortografía post, mostrando la ausencia de interferencia del dispositivo con la función valvular.
Preocupaciones con la posibilidad de bloqueo auriculoventricular secundario al implante han frenado el entusiasmo inicial. Sin embargo, en nuestra experiencia esta complicación ha sido infrecuente. Como cualquier técnica, presenta una curva de aprendizaje del operador para el perfeccionamiento de la misma. Nosotros tenemos una serie de 64 pacientes en los que se intentó la implantación del dispositivo, consiguiéndose esta de forma correcta en 50 (78%); en los 14 restantes no se pudo estabilizar el dispositivo y fue retirado sin incidencias. Estos 14 pacientes fueron derivados para cierre quirúrgico del defecto. De los 50 pacientes en los que se implantó el dispositivo, en 48 se consiguió un cierre completo y en 2 persistía un leve cortocircuito residual por ecografía al alta. Un paciente falleció con un cuadro de sepsis fulminante a las 48h del procedimiento. En 3 pacientes se produjeron trastornos de conducción auriculoventricular tras el implante, que resultaron transitorios en 2. Un niño de un año precisó marcapasos definitivo de forma tardía al implante.
En relación con el seguimiento, hasta la actualidad no hemos encontrado otras complicaciones tardías, siendo el cierre efectivo a largo plazo. La figura 1 muestra las angiografías de un lactante con insuficiencia cardiaca por CIV grande que es cerrada con un dispositivo de Amplatz muscular. El dispositivo no hacía interferencia con las sigmoideas aórticas, como muestra la aortografía postimplante.
IndicacionesTodavía no se tiene suficiente experiencia como para establecer una serie de indicaciones definitivas. Sin embargo, grupos con experiencia pueden abordar este tipo de defectos en lactantes, niños y adultos, siempre y cuando no haya hipertensión pulmonar irreversible, contraindicaciones para tratamiento antitrombótico, o el tamaño del defecto supere el del mayor dispositivo actualmente disponible (18mm). La ventaja del diseño de Amplatz consiste en que si los operadores son incapaces de estabilizar correctamente el dispositivo se puede retirar sin complicaciones, pudiendo remitirse el paciente a cirugía.
Cierre de ductus arterioso persistenteEl ductus arterioso persistente está presente en el 8% de los niños con cardiopatías congénitas. En general se detecta durante el periodo neonatal y durante la lactancia debido a la presencia del soplo que es muy característico. Sin embargo, el cardiólogo se tiene que enfrentar a pacientes adultos que no han sido corregidos durante la niñez. La ligadura quirúrgica fue descrita en 1939, y Porstmann et al.9 fueron los primeros en describir el cierre percutáneo del ductus con Ivalón. A partir de aquí el cierre percutáneo ha evolucionado rápidamente. En 1992 se introdujeron los coils de Gianturco10 que cierran efectivamente ductus pequeños pero pueden dejar un cortocircuito residual en el 32% de los casos, habiéndose descrito embolización de este material en el 8%. Más tarde, Rashkind introdujo un dispositivo de los que se implantaron muchos en nuestro país. Sin embargo, se acabó abandonándolo debido a una probabilidad de embolización de hasta el 18% y a una presencia de cortocircuito residual de hasta el 22%11. El dispositivo de Amplatz se desarrolló en 1996 para obviar los problemas anteriormente mencionados, siendo el dispositivo que más frecuentemente se usa en esta cardiopatía.
TécnicaEn pacientes adultos no se precisa, a diferencia de las anteriores malformaciones, anestesia general ni monitorización ecocardiográfica. Se realiza un cateterismo derecho-izquierdo obteniendo presiones y oximetrías a todos los niveles y se efectúa una aortografía en proyección lateral. Se realizan mediciones de longitud y diámetro mínimo de la luz a nivel del ductus para seleccionar el dispositivo. Posteriormente se cruza el ductus con un catéter de agujero terminal desde la arteria pulmonar a la aorta, y este se intercambia a través de una guía larga por la vaina transportadora del dispositivo que oscila entre 5 y 7French dependiendo del tamaño seleccionado. Se deja el extremo de la vaina en la aorta y se introduce el dispositivo; inicialmente se exterioriza solo la porción aórtica, retrayendo todo el sistema para ubicarlo correctamente a nivel del ductus y efectuar la suelta, girando en sentido contrario a las agujas de reloj el cable de liberación. Se retira la vaina y se realizan determinaciones angiográficas y hemodinámicas en las mismas condiciones que basalmente.
ResultadosEl cierre completo de ductus se consigue de forma inmediata con el dispositivo de Amplatz aproximadamente en el 85% de los casos, llegando a ser del 100% a los 6meses12-15. El procedimiento se asocia a una mínima tasa de complicaciones. La mayoría de los pacientes que presentan pequeños cortocircuitos residuales al mes presentan cierre completo a los 6meses. La posibilidad de embolización en pacientes adultos con este dispositivo es remota. En la radiografía de tórax no se detectaron migraciones o fracturas de las estructuras del dispositivo. No se han descrito recanalizaciones ni endoarteritis.
IndicacionesEl cierre de ductus es un procedimiento sencillo en manos expertas que evita la cirugía, siendo aplicable a lactantes, niños, adolescentes y adultos. El ductus arterioso persistente en los adultos suele estar calcificado. Por tanto, el tratamiento percutáneo es el método de elección en ellos. Pacientes adultos incluso por encima de los 66años han sido tratados con cierre efectivo mediante dispositivo de Amplatz sin aumento de la morbimortalidad y con una probabilidad de cierre completo a los 6meses entre el 99 y el 100%. Por tanto, creemos que el tratamiento percutáneo en los pacientes referidos está indicado en todos aquellos en los que el cortocircuito tiene significación o incluso en la profilaxis de endoarteritis. Nuestro grupo ha tratado percutáneamente un total de 192 pacientes con ductus persistente. En pacientes pediátricos también está indicado el tratamiento percutáneo, siendo su única limitación el peso del lactante. En nuestra experiencia, el límite de edad ha sido de 6meses de vida y 5kg de peso. En relación al seguimiento, el cierre es efectivo a largo plazo y no hemos encontrado complicaciones tardías.
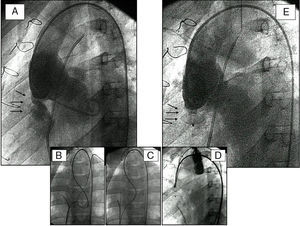
Cierre de fistulas arteriovenosasSon diversas las patologías asociadas a fístulas arteriovenosas. A veces se presentan solas y pueden ser reconocidas en un reconocimiento rutinario o encontradas tras la búsqueda de un foco embólico. Las centrales producen gran sintomatología y pueden ser consideradas para cierre percutáneo1. Las fístulas arteriovenosas pulmonares pueden comenzar con un cuadro isquémico cerebral y su cierre percutáneo puede resultar muy beneficioso. Las sistémico-pulmonares pueden ser suplencias naturales o inducidas quirúrgicamente en cardiopatías con marcada isquemia pulmonar. Su identificación y estado resultan cruciales ante cualquier indicación quirúrgica. Su cierre percutáneo puede llegar a ser un prerrequisito quirúrgico. También las fístulas quirúrgicas pueden precisar cierre percutáneo antes o después de la corrección total de la cardiopatía. Entre ellas puede haber fístulas posquirúrgicas entre la aorta y el corazón derecho tras la reparación de cardiopatías complejas. La figura 2 muestra un ejemplo de cierre de fístula entre el seno de Valsalva y el ventrículo derecho. Por tanto, son diversas las localizaciones y anatomías fistulosas que pueden cerrarse percutáneamente. También el material utilizado es diverso: desde coils hasta oclusores de ductus, llegando a oclusores vasculares específicos (de nuevo Amplatz) que parecen idóneos para este tipo de procedimientos, o bien alguna combinación de ellos. La selectividad de la oclusión (vaso aferente) evita isquemias parenquimatosas. Nuestro grupo ha cerrado un total de 14 fístulas arteriovenosas de diferentes orígenes. En todas ellas el resultado ha sido satisfactorio.
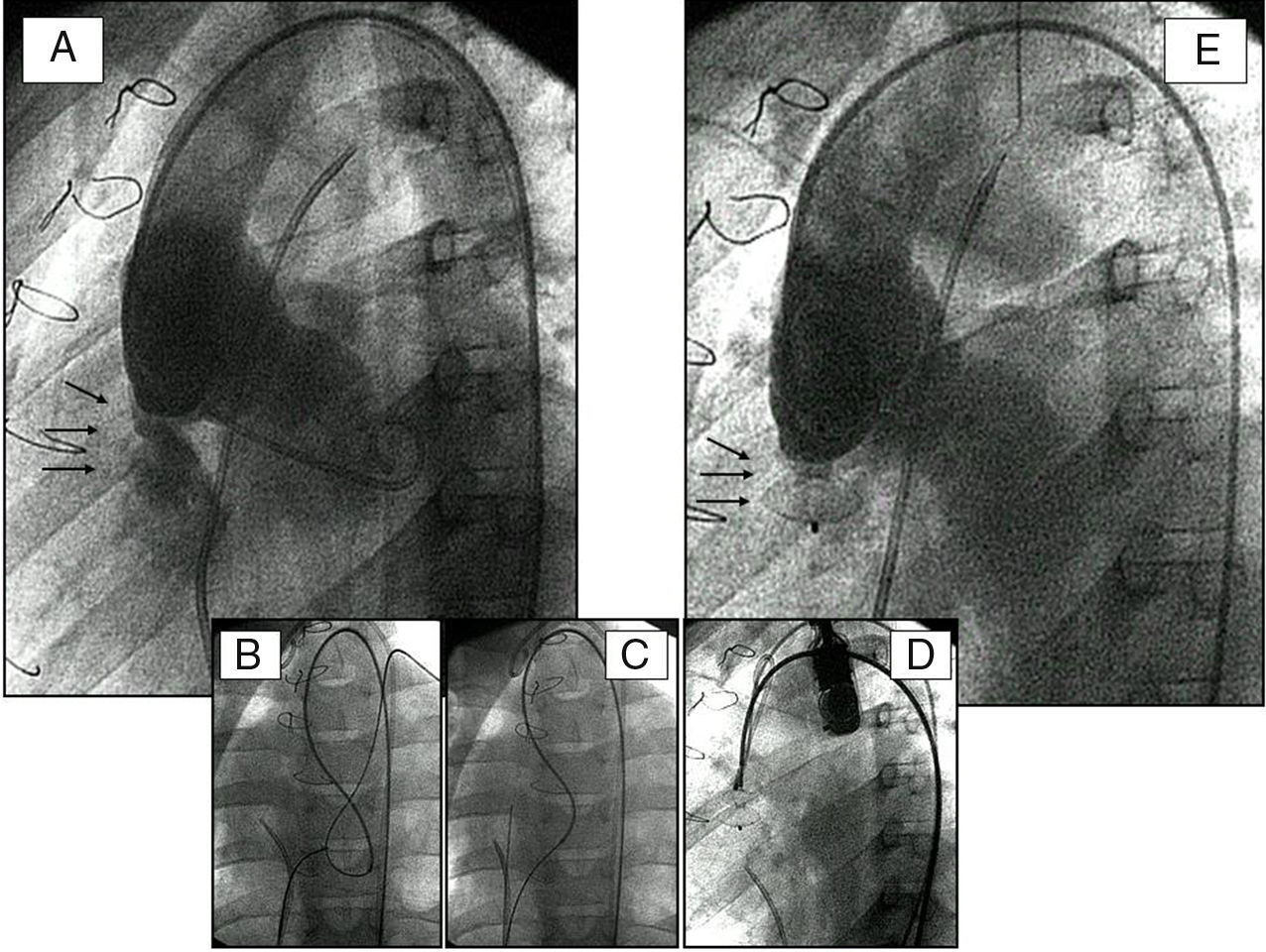
Fístula posquirúrgica entre el seno de Valsalva y el ventrículo derecho. A)Aortografía basal (proyección oblicuo-izquierda) que muestra el chorro de la fístula (flechas). B,C)Creación de un circuito veno-arterial con captura de una guía. D)Posicionamiento del dispositivo de Amplatz. E)Aortografía postimplante con cierre completo de la fístula por el dispositivo (flechas).
Un grupo especial de pacientes son aquellos con cardiopatía compleja que precisan procedimientos híbridos con la cirugía. La cirugía de derivación cavo-pulmonar es la única opción terapéutica para un conjunto de pacientes con cardiopatías complejas y corazón univentricular. Estos pacientes precisan 2-3 intervenciones quirúrgicas a lo largo de su vida, y ahorrarles alguna mediante un procedimiento percutáneo o mejorar el resultado de las mismas tiene una gran utilidad. Por otra parte, este tipo de pacientes es cada vez más infrecuente, debido al diagnóstico precoz y a la interrupción del embarazo. Por tanto, nuevas observaciones y estrategias terapéuticas combinadas son de gran valor, dadas la escasez y la complejidad de estos pacientes. Entre las opciones terapéuticas percutáneas que podemos ofrecer está la oclusión de colaterales sistémico-pulmonares mediante tapones vasculares o coils. El objetivo de esta intervención sería bajar la presión de la arteria pulmonar en pacientes que han sido intervenidos mediante derivación de cava superior a arteria pulmonar (intervención de Glenn) y van a ser reintervenidos para derivación cavo pulmonar total (intervención de Fontan).
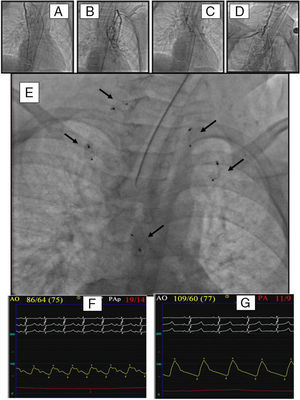
Una vez identificada la colateral mediante angiografía diagnóstica, se procede a la oclusión de la misma mediante la implantación de tapones vasculares o coils. En nuestra experiencia hemos tratado 25 pacientes con 52 colaterales mediante tapones vasculares de Amplatz. Los dispositivos fueron liberados en el vaso diana a través de un catéter guía coronario 5F (Cordis). El diámetro del dispositivo fue siempre mayor (20-40%) que el vaso embolizado. Se obtuvo una reducción de la presión pulmonar en 19 pacientes (76%). Para la reducción de la presión pulmonar, algún paciente precisó cierre de varias colaterales (fig. 3).
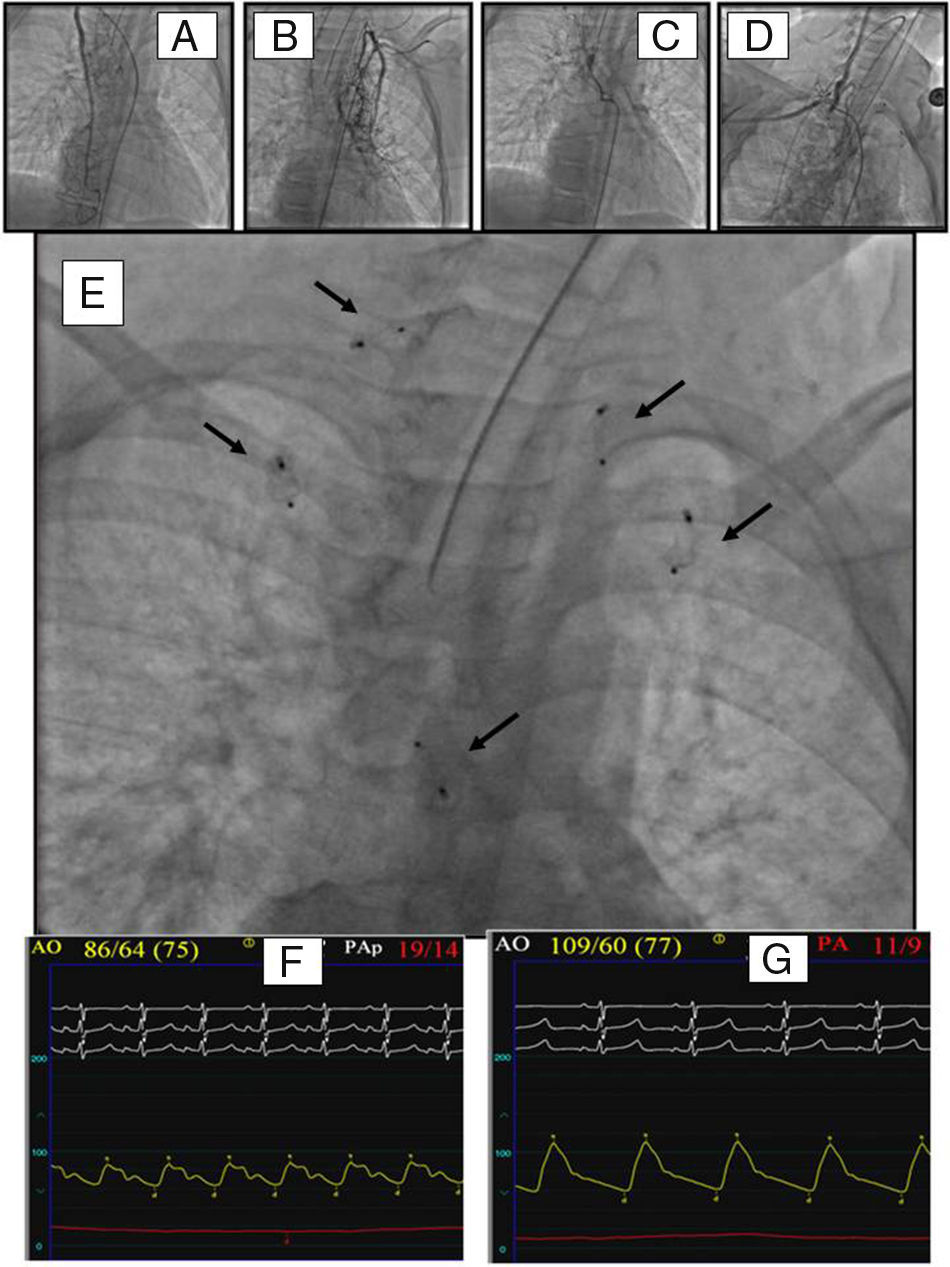
Implante de múltiples oclusores vasculares en múltiples fístulas arteriovenosas pulmonares en un paciente con intervención de Glenn que va a ser intervenido de Fontan. A-D)Inyecciones angiográficas en las fístulas. E)Imagen radiológica del tórax tras el implante de los oclusores (flechas). F,G)Se muestran los cambios observados en el registro de presiones simultáneas en la aorta y la arteria pulmonar. La caída de esta y el aumento de la presión sistémica van a permitir la intervención de Fontan.
Pacientes con derivación cavo-pulmonar parcial, con presiones pulmonares superiores a 12mmHg, en los que se planifica una derivación cavo-pulmonar completa y presentan colaterales sistémico-pulmonares en la angiografía diagnóstica.
Cortocircuitos derecha-izquierdaCierre del foramen oval permeableEl cierre percutáneo del foramen oval permeable (FOP) es una de las opciones terapéuticas propuestas para el ictus criptogénico. Distintos estudios han demostrado la asociación entre el FOP e ictus criptogénico. En la actualidad el tratamiento de estos pacientes es controvertido, aunque hay datos a favor del cierre percutáneo16 del FOP. En un estudio reciente realizado por nuestro grupo17, 52 pacientes menores de 60años diagnosticados de FOP e ictus han sido tratados con cierre percutáneo en nuestro hospital. Todos tenían diagnóstico de ictus agudo o ataque isquémico transitorio, y se realizó un estudio completo. Se descartó cardiopatía embolígena mediante ecografía. La permeabilidad del foramen se analizó con una inyección de gelafundina al 4% sonicada desde una vía venosa periférica, en condiciones basales y tras maniobra de Valsalva.
TécnicaEl implante se lleva a cabo con control angiográfico y anestesia general, por la dificultad para que los enfermos permanezcan monitorizados con ecocardiografía transesofágica durante el procedimiento. Antes del implante se efectúan angiografías en la arteria pulmonar y en la cava inferior con y sin maniobra de Valsalva. Después se realizan inyecciones de contraste ecográfico para valorar el paso de burbujas derecha-izquierda por eco, en condiciones basales y tras maniobras respiratorias de espiración forzada, que se repitieron tras el implante.
Todos los pacientes reciben tratamiento antibiótico profiláctico tras el implante, así como tratamiento antitrombótico con dalteparina (10.000UI/día durante un mes) y aspirina (150mg/día indefinidamente)3,7.
ResultadosEl cierre fue efectivo en la totalidad de los pacientes al alta. No hubo complicaciones mayores ni embolización del dispositivo. Se ha realizado seguimiento de 49 pacientes una mediana de 26 meses. El seguimiento no fue posible en 3 pacientes. No hubo episodios clínicos neurológicos ni de otro tipo atribuibles al procedimiento ni al dispositivo (endocarditis, embolización, fractura). En el estudio ecográfico tardío no se evidenció cortocircuito residual en ningún caso.
IndicacionesA falta de estudios aleatorizados que comparen el tratamiento médico con el cierre percutáneo, la alta tasa de recidiva con tratamiento médico, hasta del 13%18, y la existencia de estudios que respaldan firmemente el tratamiento con cierre percutáneo19 hacen que esta sea una opción ampliamente utilizada. La incidencia de recidiva tras el cierre descrita es variable y oscila entre el 0,6 y el 7,8%19. En nuestro estudio no hubo recidivas. Ello pudiera obedecer al régimen antitrombótico utilizado, no descrito en otros estudios, que podría favorecer un adecuado y rápido cubrimiento del dispositivo sin agregación trombótica. A pesar de la existencia de cortocircuito residual tras el alta en el 4%, en el seguimiento ecocardiográfico a los 6meses no había ningún paciente con cortocircuito, lo que concuerda con lo descrito en otros estudios20. Según nuestra experiencia, en pacientes jóvenes con ictus criptogénico y FOP el cierre percutáneo es una opción segura, sin recidivas o episodios a largo plazo.
Cierre de fenestración de FontanLa corrección de Fontan constituye el estadio final de la paliación quirúrgica en los pacientes con fisiología de ventrículo único. Los cambios hemodinámicos que se producen tras dicha cirugía pueden comprometer los resultados inmediatos, por el aumento brusco de la presión en la arteria pulmonar. Por ello, la fenestración del conducto de Fontan durante el acto quirúrgico constituye una práctica habitual en los pacientes de alto riesgo, a costa de disminuir la saturación sistémica. El desarrollo de dispositivos de implantación percutánea ha permitido el cierre de esta fenestración sin necesidad de una nueva cirugía cuando las condiciones hemodinámicas lo permitan21.
Analizamos nuestra experiencia en el cierre percutáneo de fenestraciones en conducto extracardiaco tras la intervención de Fontan, teniendo en cuenta las consideraciones técnicas de los nuevos oclusores disponibles. Además, estudiamos los cambios en la presión de la arteria pulmonar así como en la saturación de oxígeno. Se analizan 14 pacientes. La realización o no de fenestración durante la intervención se hizo en base a los criterios hemodinámicos de alto riesgo obtenidos en el cateterismo pre-Fontan22,23. Se realizan los procedimientos bajo anestesia general, se canaliza una vía arterial (4F) para monitorización y una vía venosa (femoral 6, 7 u 8F) para el abordaje terapéutico. La monitorización del procedimiento se lleva a cabo con ecocardiograma transesofágico. Tras el procedimiento, el régimen terapéutico es heparina de bajo peso molecular, ácido acetilsalicílico al menos 6meses y profilaxis de endocarditis con cefuroxima-axetilo una semana. La media de seguimiento en nuestros casos es de 45±41meses. No se registraron complicaciones mayores durante los procedimientos. En 8 de los 14 pacientes se había realizado un cateterismo terapéutico previo para cierre de colaterales sistémico-pulmonares. De los 14 pacientes, 12 presentaban ventrículo izquierdo sistémico y 2 pacientes ventrículo derecho sistémico. No se produjo ninguna muerte en el seguimiento ni reingresos por causa cardiaca.
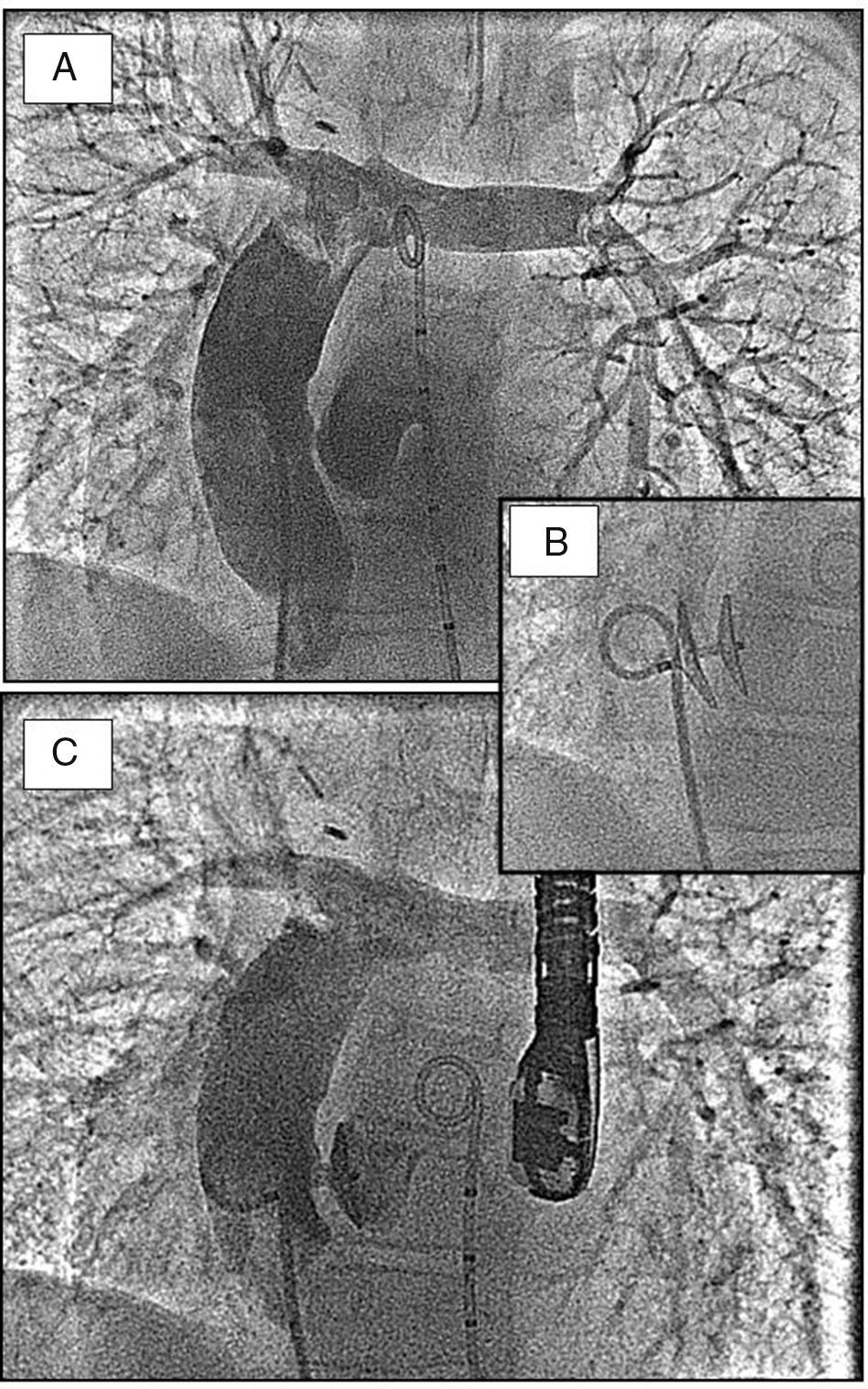
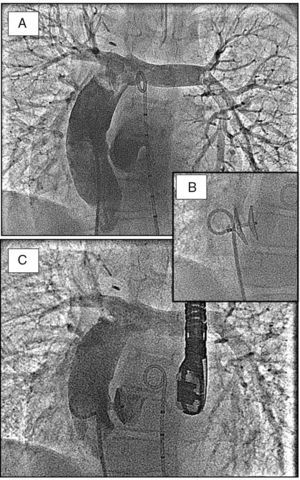
En todos los casos se utilizaron oclusores de Amplatz, eligiendo el tipo de dispositivo en base a la anatomía posquirúrgica. En 11 casos se utilizó un dispositivo de cierre de foramen oval (fig. 4); en 2 pacientes se implantó un dispositivo de cierre de CIV muscular y en un paciente se eligió un dispositivo de cierre de ductus. La saturación de oxígeno aumentó de forma significativa tras el cierre de la fenestración (89±3 vs 96±2, p=0,01) sin que se evidenciara un incremento significativo de la presión media de arteria pulmonar (17±4 vs 17±4; p=NS). Los pacientes que presentan una cardiopatía congénita por la cual se ven abocados a una circulación univentricular van a precisar de varias intervenciones quirúrgicas a lo largo de su vida. El desarrollo de dispositivos de implantación percutánea permite evitar alguno de los procedimientos quirúrgicos a estos pacientes. De la misma manera, el cierre de la fenestración resulta necesario debido a los efectos deletéreos que la hipoxemia crónica ocasiona a largo plazo. Sabemos que los pacientes sometidos a cirugía de derivación cavopulmonar que presentan un ventrículo izquierdo como sistémico experimentan mejor evolución que aquellos con ventrículo derecho sistémico. El peor pronóstico de estos pacientes se ha relacionado en estudios previos con la existencia de más alteraciones del ritmo, mayor prevalencia de incompetencia de la válvula auriculoventricular, la prolongación del índice de Tei y el menor volumen latido. En base a la experiencia existente en nuestro centro podemos decir que el abordaje multidisciplinar de estos pacientes resulta fundamental a la hora de diseñar la estrategia terapéutica, así como a la hora de establecer los tiempos. El desarrollo de dispositivos de implantación percutánea ha permitido una mayor flexibilidad en la cirugía para adaptarla a las condiciones hemodinámicas de cada paciente24. El cierre de la fenestración de Fontan mediante cateterismo se muestra como una técnica segura y eficaz en estos pacientes25.
Terapia celularComo tema en investigación y desarrollo futuro, algunas experiencias aisladas pueden arrojar luz hacia modalidades diferentes de tratamiento en situaciones excepcionales en la edad pediátrica. Aunque rara, la disfunción ventricular severa puede acontecer en edades pediátricas, sin que existan en muchos casos soluciones diferentes al trasplante cardiaco. La terapia celular en la cardiopatía isquémica del adulto se ha mostrado como un camino esperanzador, con claras mejorías en la función ventricular en pacientes con infarto de miocardio que recibieron terapia celular mediante la infusión intracoronaria de células mononucleares autólogas de la médula ósea26. La aplicación de estos conceptos de forma compasiva en un paciente lactante, con coronaria izquierda anómala saliendo de la arteria pulmonar, que fue intervenido quirúrgicamente con reimplante coronario en la aorta arrojó luz al respecto. El reimplante se ocluyó, presentando un nuevo infarto y mayor insuficiencia cardiaca, siendo remitido a nuestro centro para trasplante cardiaco. Tras estudio angiográfico, se desobstruyó el implante, cubriéndolo con un stent coronario. Tras ello se aplicó terapia celular, consiguiéndose una evolución favorable27. Su mejoría clínica y funcional resultó espectacular y perdura desde entonces. Por otro lado, la temprana edad parece jugar un papel en respuestas favorables, ya que la médula ósea es más rica y sus potencialidades mayores. Posteriormente, otro lactante con enfermedad de Kawasaki que presentó un infarto agudo de miocardio por oclusión coronaria fue tratado con terapia celular. La evolución fue también favorable, recuperando función ventricular. Finalmente, un tercer lactante con insuficiencia cardiaca por miocardiopatía dilatada fue tratado en nuestro centro con terapia celular, siguiendo el protocolo empleado en los adultos con miocardiopatía dilatada28. Hasta el momento, también la evolución de este paciente es favorable.
Se trata solo de llamar la atención sobre la posible evolución de esta terapia por vía intracoronaria para el tratamiento de disfunciones ventriculares severas en la edad pediátrica. La condición biológica de la corta edad resulta favorable.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.