Desde que en 2002 Cribier realizara en humanos el primer implante valvular aórtico transcatéter (TAVI por sus siglas en inglés) hasta la actualidad se han llevado a cabo más de 150.000 procedimientos en todo el mundo.
Datos de ensayos clínicos realizados con las prótesis percutáneas de primera generación como el PARTNER1,2 para la prótesis Edwards SAPIEN® (en el que se comparó el implante percutáneo como alternativa a tratamiento médico en caso de pacientes inoperables o a cirugía en caso de pacientes de alto riesgo quirúrgico) demostró el beneficio claro para el primer grupo con reducción de la mortalidad, así como la equivalencia con la cirugía en el segundo. Por otro lado, el estudio US Core Valve3 en el que se utilizó la prótesis autoexpandible Medtronic Core Valve® demostró superioridad con respecto a la cirugía, con mayor tasa de supervivencia al año en pacientes con alto riesgo quirúrgico.
Existen además junto a estos estudios numerosos registros que avalan esta nueva tecnología como una alternativa eficaz y segura para pacientes con estenosis aórtica grave y alto riesgo quirúrgico o inoperables, como así se recoge en las guías de práctica clínica.
Sin embargo, como toda técnica que comienza, presenta ciertas limitaciones y complicaciones que impiden su aplicación a todos los pacientes. En los últimos años están surgiendo prótesis de segunda generación, algunas ya comercializadas, cuyo objetivo es minimizar algunos de estos problemas.
Analizaremos las principales limitaciones y complicaciones del procedimiento, así como los nuevos dispositivos que están surgiendo para intentar solventarlas.
Complicaciones vasculares y del punto de accesoActualmente la vía de acceso más utilizada es la transfemoral debido a su menor tasa de complicaciones y estancia hospitalaria. La mayor experiencia y la mejora en el diseño de los dispositivos que han pasado de requerir 22–24 Fr de diámetro a los actuales 14 Fr (Sapien 3® y Medtronic Evolut R®) han contribuido a disminuir las complicaciones vasculares, que han pasado de un 15% de complicaciones mayores en los registros iniciales hasta el 3-4% de los últimos años.
No obstante, las complicaciones vasculares mayores se asocian con una mayor mortalidad a corto plazo, por lo que una adecuada selección de los pacientes que valore la anatomía iliofemoral mediante angio-TAC y use vías de acceso alternativas (subclavia, transaórtica o transapical) en caso de que no sea posible el acceso femoral, así como una adecuada técnica de punción y hemostasia ayudan a minimizar estas complicaciones.
En nuestra experiencia, la mayoría de las complicaciones vasculares se puede solucionar de forma percutánea ya sea con hemostasia prolongada ya sea a través de la vía de acceso contralateral mediante inflado prolongado con balón o el implante de un stent cubierto.
Accidente cerebrovascularEl accidente cerebrovascular (ACV) es una complicación que, aunque no muy frecuente (en torno al 3% a los 30 días), se asocia con un incremento de la mortalidad y con deterioro de la calidad de vida. En estudios por resonancia magnética se aprecian embolismos cerebrales silentes hasta en el 80% de los pacientes tras TAVI, aunque las implicaciones clínicas de estos hallazgos a largo plazo permanecen desconocidas.
La mayoría de los ACV se producen en las primeras 24 h tras el procedimiento, aunque el riesgo permanece elevado durante los 2 primeros meses. Los factores que se relacionan con un incremento del riesgo de ACV son los relacionados con la manipulación durante el procedimiento (predilatación de válvula nativa, posdilatación, reposicionamiento), la ateromatosis aortocarotídea o el inicio de fibrilación auricular tras el implante.
La mejora en los dispositivos y nuevas prótesis que permiten procedimientos menos agresivos ayudará sin duda a prevenir esta complicación, así mismo existen dispositivos de protección embólica (Claret Montage Dual Filter System®, TriGuard® y Embrella Embolic Deflector System®) que se pueden colocar en el tronco braquiocefálico o en la carótida izquierda y cuya eficacia clínica está aún por demostrar.
Disfunción protésicaLas prótesis percutáneas son susceptibles de presentar fallos estructurales y complicaciones a largo plazo, al igual que las bioprótesis quirúrgicas. Existen casos aislados descritos de endocarditis, degeneración, compresión, embolización protésica tardía y trombosis. Sin embargo, dado lo reciente de la técnica, se requiere aún un seguimiento a largo plazo riguroso de este tipo de complicaciones para conocer su incidencia real, así como la mejora en el tratamiento anticalcificación de las válvulas de segunda generación de cara a poder aplicar la técnica a pacientes más jóvenes y de un riesgo quirúrgico menor.
Insuficiencia aórtica periprotésicaLa insuficiencia aórtica periprotésica es frecuente tras el implante percutáneo con cifras del 10–20% para grado ≥ 2. En numerosos estudios se ha demostrado que la insuficiencia periprotésica, especialmente cuando es moderada o grave, se asocia con un aumento de la mortalidad a largo plazo.
Existen varios factores asociados con la aparición de esta complicación entre los que se encuentran una mala selección del tamaño protésico, una implantación demasiado alta o baja o la excesiva y asimétrica calcificación del anillo. Así mismo, parece ser más frecuente con la prótesis Core Valve® que con la prótesis Edwards®4.
Por tanto, es fundamental una adecuada valoración del anillo aórtico especialmente por angio-TAC para seleccionar un tamaño adecuado de la prótesis, así como una técnica de implante cuidadosa para evitar la aparición de esta complicación.
Para solucionar la insuficiencia tras el implante puede ser necesario, en caso de mala aposición o infraexpansión de la prótesis por la excesiva calcificación, una posdilatación con balón, mientras que si el implante es demasiado alto o bajo muchas veces es necesario implantar una segunda válvula «valve-in-valve».
Esta complicación, tanto por su frecuencia como por las implicaciones pronósticas, hace que, junto con los trastornos de conducción sea, desde nuestro punto de vista, el principal talón de Aquiles de esta técnica, por lo que los dispositivos de nueva generación se han centrado en solventar este problema, siendo la mayoría de ellos reposicionables y recapturables, lo que permite mayor control y una técnica de implante más precisa.
La prótesis Edwards SAPIEN® 3 es el nuevo modelo de la prótesis Edwards, expandible con balón, que presenta como novedad en la porción ventricular del stent un recubrimiento para disminuir la insuficiencia periprotésica, con buenos resultados en estudios preliminares.
La prótesis Medtronic CoreValve Evolut® es la nueva generación de la prótesis Core Valve®, totalmente recapturable y reposicionable, con un sistema de liberación muy preciso, lo que permite un adecuado implante con respecto al anillo nativo, evitando las insuficiencias y trastornos de conducción asociados con un implante demasiado bajo, además el recubrimiento interno de pericardio se extiende unos milímetros en la base de la prótesis para mejorar el sellado y reducir la insuficiencia.
La válvula Lotus® (Boston Scientific) es una nueva prótesis con un stent autoexpandible de nitinol, totalmente reposicionable y recapturable, que presenta una membrana externa en la parte ventricular para reducir las fugas periprotésicas, con muy buenos resultados iniciales en el registro REPRISE II, con tan solo 1% de insuficiencia moderada a los 6 meses.
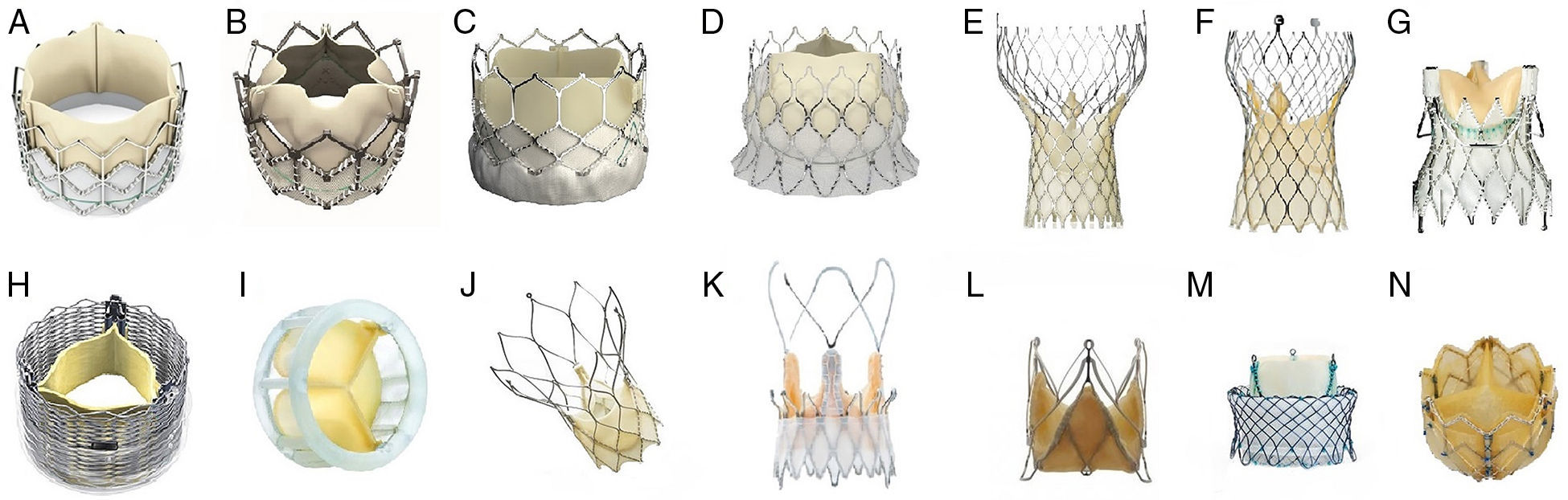
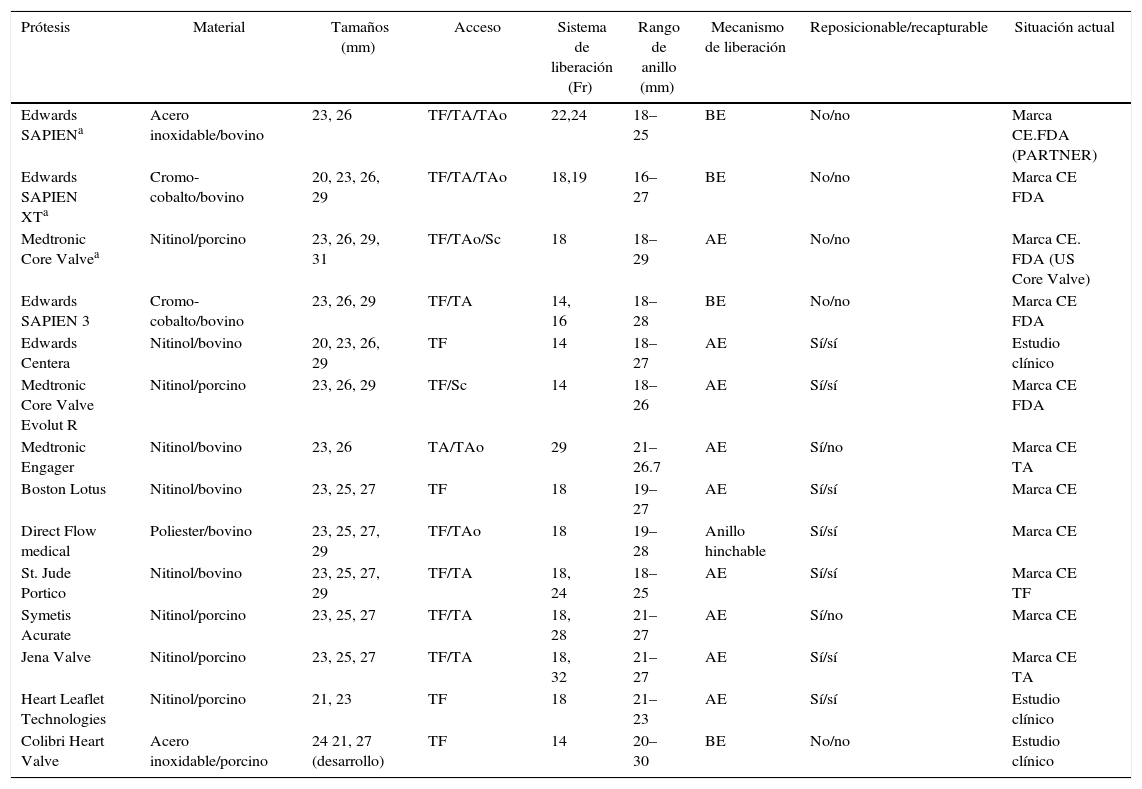
Existen múltiples modelos (tabla 1, fig. 1) de prótesis percutáneas, algunas ya comercializadas y otras en fase de investigación, dirigidas a resolver los problemas de las prótesis iniciales y cuyo impacto a medio y largo plazo sobre esta y otras complicaciones deberán ser evaluados en futuros estudios.
Modelos de prótesis percutáneas y principales características
| Prótesis | Material | Tamaños (mm) | Acceso | Sistema de liberación (Fr) | Rango de anillo (mm) | Mecanismo de liberación | Reposicionable/recapturable | Situación actual |
|---|---|---|---|---|---|---|---|---|
| Edwards SAPIENa | Acero inoxidable/bovino | 23, 26 | TF/TA/TAo | 22,24 | 18–25 | BE | No/no | Marca CE.FDA (PARTNER) |
| Edwards SAPIEN XTa | Cromo-cobalto/bovino | 20, 23, 26, 29 | TF/TA/TAo | 18,19 | 16–27 | BE | No/no | Marca CE FDA |
| Medtronic Core Valvea | Nitinol/porcino | 23, 26, 29, 31 | TF/TAo/Sc | 18 | 18–29 | AE | No/no | Marca CE. FDA (US Core Valve) |
| Edwards SAPIEN 3 | Cromo-cobalto/bovino | 23, 26, 29 | TF/TA | 14, 16 | 18–28 | BE | No/no | Marca CE FDA |
| Edwards Centera | Nitinol/bovino | 20, 23, 26, 29 | TF | 14 | 18–27 | AE | Sí/sí | Estudio clínico |
| Medtronic Core Valve Evolut R | Nitinol/porcino | 23, 26, 29 | TF/Sc | 14 | 18–26 | AE | Sí/sí | Marca CE FDA |
| Medtronic Engager | Nitinol/bovino | 23, 26 | TA/TAo | 29 | 21–26.7 | AE | Sí/no | Marca CE TA |
| Boston Lotus | Nitinol/bovino | 23, 25, 27 | TF | 18 | 19–27 | AE | Sí/sí | Marca CE |
| Direct Flow medical | Poliester/bovino | 23, 25, 27, 29 | TF/TAo | 18 | 19–28 | Anillo hinchable | Sí/sí | Marca CE |
| St. Jude Portico | Nitinol/bovino | 23, 25, 27, 29 | TF/TA | 18, 24 | 18–25 | AE | Sí/sí | Marca CE TF |
| Symetis Acurate | Nitinol/porcino | 23, 25, 27 | TF/TA | 18, 28 | 21–27 | AE | Sí/no | Marca CE |
| Jena Valve | Nitinol/porcino | 23, 25, 27 | TF/TA | 18, 32 | 21–27 | AE | Sí/sí | Marca CE TA |
| Heart Leaflet Technologies | Nitinol/porcino | 21, 23 | TF | 18 | 21–23 | AE | Sí/sí | Estudio clínico |
| Colibri Heart Valve | Acero inoxidable/porcino | 24 21, 27 (desarrollo) | TF | 14 | 20–30 | BE | No/no | Estudio clínico |
AE: autoexpandible; BE: balón expandible; CE: conformidad europea; FDA: Food and Drug Administration; Sc: subclavia; TA: transapical; TF: transfemoral; TAo: transaórtico.
Modelos de prótesis percutáneas.
A) Edwards SAPIEN; B) Edwards SAPIEN XT; C) Edwards SAPIEN 3; D) Edwards Centera; E) Medtronic Core Valve; F) Medtronic Core Valve Evolut R; G) Medtronic Engager; H) Boston Lotus; I) Direct Flow medical; J) St. Jude Portico; K) Symetis Acurate; L) Jena Valve; M) Heart Leaflet Technologies; N) Colibri Heart Valve.
La aparición de bloqueo de rama izquierda (BRI) y bloqueo AV son frecuentes tras el TAVI, con una necesidad de implante de marcapasos que es mayor para la prótesis Core Valve que para la prótesis de Edwards (28 vs. 6% según un metaanálisis reciente) como quedó demostrado en el estudio CHOISE en el que se comparaban ambas prótesis4. Igualmente el BRI es mayor para la prótesis Core Valve® (38–57% según las series).
Esto se explica por la íntima relación anatómica existente entre la válvula aórtica, el nodo AV y la rama izquierda del haz de His, que pueden resultar lesionados durante el implante. Las características de la prótesis Core Valve®, con mayor superficie protésica en contacto con el tracto de salida del ventrículo izquierdo y la autoexpansión continua del nitinol en esta zona, podrían explicar las diferencias en el porcentaje de implante de marcapasos entre una y otra válvula percutánea.
No está claro si la aparición de BRI y el implante de marcapasos se asocian con mayores complicaciones y mortalidad a largo plazo, existiendo resultados contradictorios en diferentes estudios; además, muchas veces estos trastornos de conducción son reversibles. No obstante, sí se ha relacionado el BRI con un empeoramiento en la fracción de eyección y una mayor necesidad de marcapasos en el seguimiento.
Existen una serie de predictores para el implante de marcapasos como son el bloqueo de rama derecha o bloqueo AV de primer grado previos, la profundidad de la prótesis en el tracto de salida del ventrículo izquierdo, el grado de hipertrofia ventricular izquierda, el sobredimensionamiento de la prótesis y la pre- o posdilatación agresivas.
La nueva generación de prótesis que permiten un implante más controlado y menos agresivo nos ayudarán a disminuir esta complicación al realizar un correcto posicionamiento de la válvula con respecto al anillo nativo, evitando implantes demasiado bajos.
Coste-efectividadUn aspecto importante que puede limitar el uso de esta tecnología es su elevado coste. Sin embargo, se ha demostrado como una buena alternativa, también desde el punto de vista económico, en pacientes inoperables por la mayor supervivencia y la mejoría en la calidad de vida respecto al tratamiento médico, siempre teniendo en cuenta una adecuada selección de pacientes, evitando tratar a aquellos con mal pronóstico por otras patologías, independientemente de su enfermedad valvular5.
En cuanto a pacientes con alto riesgo quirúrgico, no está tan claro, aunque parece que la TAVI es coste-efectiva con respecto a la cirugía, especialmente por vía transfemoral como se demuestra en el análisis económico del estudio PARTNER.
Así mismo, con la aparición de nuevas prótesis, el menor número de complicaciones y el incremento exponencial de la demanda es esperable que los costes de este procedimiento disminuyan.
Perspectivas futurasEl desarrollo de nuevas prótesis completamente reposicionables y recapturables con un menor perfil y con menor número de complicaciones hará posible expandir las indicaciones actuales de este procedimiento6, algunas de las cuales, ya en parte, se están realizando como la insuficiencia aórtica, la válvula aórtica bicúspide y las válvulas biológicas quirúrgicas degeneradas.
Los resultados del seguimiento riguroso a largo plazo de la durabilidad de estas prótesis y de ensayos clínicos ya en marcha como el PARNERT 2 y SURTAVI en los que se compara TAVI frente a cirugía en pacientes de riesgo intermedio determinarán si es posible aplicar esta técnica a pacientes con un perfil de riesgo más bajo.
ConclusionesEl implante percutáneo de prótesis aórticas ha supuesto un avance sustancial en el manejo de pacientes previamente no tratados por considerarse inoperables o de alto riesgo quirúrgico, con una mejoría clara en la supervivencia y en la calidad de vida. Sin embargo, existen complicaciones y retos aún por resolver inherentes a una tecnología que se encuentra en sus comienzos.
La aparición de nuevos dispositivos que intentan solventar estas limitaciones, así como su evaluación en estudios clínicos aún pendientes, nos permitirá ampliar las indicaciones actuales de este procedimiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesNo existen potenciales conflictos de interés de los autores.