Las restricciones a la prescripción de los anticoagulantes orales directos (ACOD) para la fibrilación auricular no valvular (FANV) impuestas en España por el Informe de Posicionamiento Terapéutico (IPT) de 2013 pueden limitar el acceso a estos. Con el fin de valorar su efecto, se analizaron los motivos para la prescripción del ACOD rivaroxaban, el perfil de pacientes tratados y el tiempo hasta recibirlo en hospitales de Sistema Nacional de Salud (SNS), de forma global y por comunidades autónomas (CC.AA.).
MétodosEstudio observacional, transversal, multicéntrico en consultas de especialistas del SNS entre pacientes con FANV tratados con rivaroxaban. Las CC.AA. se agruparon según condiciones de prescripción más frecuentes: ficha técnica (FT), IPT o IPT más restrictivo/modificado (IPTm).
ResultadosParticiparon 73 investigadores/1.727 pacientes. El 90,6% de los pacientes presentaba un riesgo tromboembólico alto (CHA2DS2-Vasc ≥2) y el 46,2% un riesgo hemorrágico alto (HAS-BLED ≥3). Tardaron una mediana de 21,1meses desde el diagnóstico de la FANV hasta recibir rivaroxaban. El 57,0% había recibido antagonistas de la vitaminaK (AVK). Los pacientes de CC.AA. IPT/IPTm tenían un riesgo tromboembólico y hemorrágico superior, recibieron más frecuentemente AVK y tardaron una mediana de ∼20 meses más en recibir rivaroxaban vs. CC.AA. FT.
ConclusionesLos pacientes tratados con rivaroxaban en España presentan un riesgo tromboembólico y hemorrágico alto y tardan una mediana de 21,1meses en recibirlo. La diferente adherencia al IPT genera desigualdades entre CC.AA. Los pacientes de CC.AA. IPT/IPTm tardan ∼20meses más en recibir rivaroxaban y presentan mayor riesgo tromboembólico/hemorrágico.
Restrictions on the prescription of direct oral anticoagulants (DOACs) for non-valvular atrial fibrillation (NVAF) treatment imposed in Spain by the 2013 Therapeutic Positioning Report (TPR) may limit access to this medication. With the aim of assessing the impact of the TPR, we analysed the reasons to prescribe the DOAC rivaroxaban, the profile of patients with NVAF treated and how long it takes accessing to the treatment in hospitals belonging to the National Health System, both overall and by autonomous regions.
MethodsAn observational, cross-sectional, multicenter study of patients with NVAF treated with rivaroxaban in specialist practice. The autonomous regions were grouped according to the most common prescribing practices: per Summary of Product Characteristics (SmPC), TPR or a more restrictive or modified TPR (mTPR).
Results73 researchers providing data on 1,727 patients participated. 93.7% of patients were at high thromboembolic risk (CHA2DS2-Vasc ≥3) and 46.2% were at high risk for bleeding (HAS-BLED ≥3). Median time since diagnosis of NVAF for receiving rivaroxaban was 21.1months. 57.0% patients had received vitaminK antagonists (VKA). With respect to autonomous regions where prescribing practices are guided by SmPC, patients where TPR/mTPR restrictions were followed were at higher thromboembolic and bleeding risk, had received VKA more frequently and waited a median of ∼20months longer before receiving rivaroxaban.
ConclusionsPatients treated with rivaroxaban in Spain show high thromboembolic and bleeding risks. Median time for rivaroxaban prescription is 21.1months. The differences in the adhesion to the TPR create inequalities between autonomous regions. Patients from autonomous regions following the TPR/mTPR receive rivaroxaban up to 20months later and show higher thromboembolic and bleeding risks.
Los antagonistas de la vitamina K (AVK) son el tratamiento estándar en la anticoagulación a largo plazo para prevenir el ictus en pacientes con fibrilación auricular no valvular (FANV). Sus numerosas limitaciones dificultan su uso, lo que conlleva un mal control de la coagulación1. Los anticoagulantes orales directos (ACOD) han demostrado ser al menos tan eficaces como la warfarina, con mejor seguridad2, y presentan varias ventajas para su administración2,3. Los ACOD están recomendados como tratamiento de primera línea para la prevención de ictus en pacientes con FANV3. Sin embargo, su uso en nuestro país es reducido (23,9% vs. 76,1% de AVK, datos de 2016)4, lo que puede deberse a las restricciones impuestas por el informe de posicionamiento terapéutico (IPT) de diciembre de 2013 de la Agencia Española de Medicamentos y Productos Sanitarios1,5.
El presente estudio tiene como objetivo analizar el impacto del IPT en el tratamiento de pacientes con FANV con un ACOD (rivaroxaban) en España y cómo las diferencias en la adhesión al IPT entre las distintas comunidades autónomas (CC.AA.) podría afectar a la generación de desigualdades en el acceso a este tratamiento.
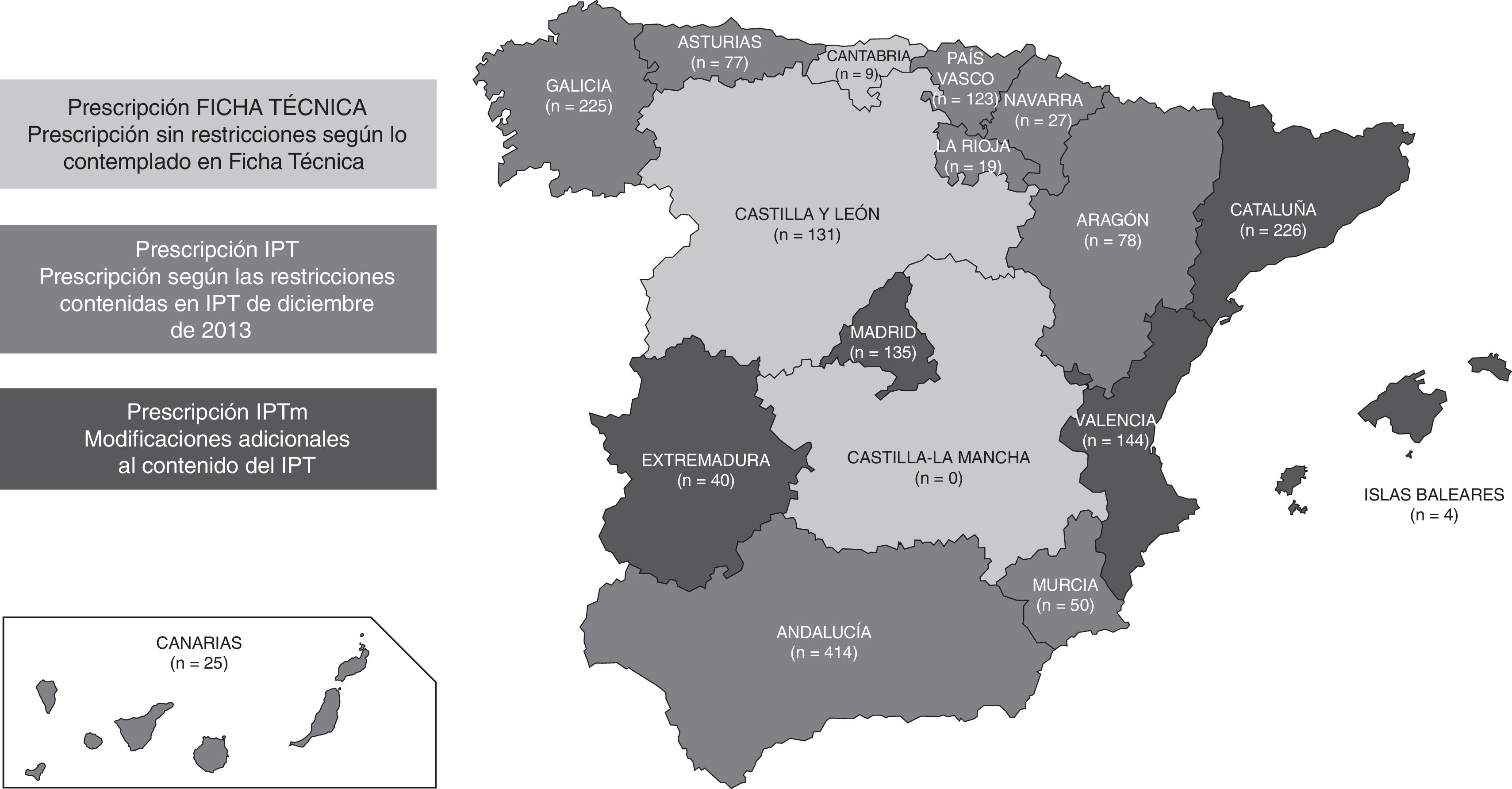
MétodosDiseño y pacientes participantesEstudio observacional, transversal, multicéntrico realizado entre octubre de 2014 y enero de 2015 en consultas del Sistema Nacional de Salud (SNS) de medicina interna, cardiología y hematología de todo el territorio nacional en pacientes con FANV ≥18años tratados con rivaroxaban con posterioridad a la entrada en vigor del IPT5 durante un mínimo de 3meses y que hubiesen firmado un consentimiento informado. Los criterios de exclusión fueron recibir otro anticoagulante o no ser adecuado para la participación en el estudio. El número de pacientes participante en cada CC.AA. se muestra en la figura 1. Se siguieron los principios de la Declaración de Helsinki y lo establecido por las regulaciones locales pertinentes. El protocolo fue aprobado por el Comité Ético de Investigación Clínica del Hospital Clínic i Provincial de Barcelona.
Recogida de datosSe recogieron en un formulario los motivos de prescripción de rivaroxaban y el tiempo hasta prescribirlo desde el diagnóstico de la FANV, las características sociodemográficas y clínicas de los pacientes y los tratamientos previos recibidos. Se valoró el riesgo tromboembólico (escalas CHADS2 y CHADS2DS2-Vasc)6,7 y de sangrado (escala HAS-BLED)8. Se solicitó el visado de la prescripción a cada centro participante. En función de las condiciones de prescripción seguidas con más frecuencia, las CC.AA. se agruparon en: CC.AA. con visado poco restrictivo, con condiciones similares a las de la FT (CC.AA.FT)9, CC.AA. con visado con condiciones impuestas por el IPT (CC.AA.IPT)5 o con visado con condiciones más restrictivas que las impuestas por el IPT o IPT modificado (CC.AA.IPTm) (fig. 1).
Cálculo de la muestraEl cálculo se realizó de forma que la muestra fuese representativa de los pacientes adultos españoles con FANV10-12 y de aquellos tratados con rivaroxaban (8%) y que permitiera detectar variables con una prevalencia de hasta un 50% (valor de máxima indeterminación). Así, 2.800 pacientes permitirían obtener una precisión a nivel nacional del 2%, garantizando también una precisión mínima del 5% para las regiones definidas en función de las restricciones de prescripción de las CC.AA. (300 pacientes en CC.AA.FT, 1.400 pacientes en CC.AA.IPT y 1.100 pacientes en CC.AA.IPTm). Considerando una tasa de pérdidas de aproximadamente el 10%, el tamaño de la muestra se precisó en 3.200 pacientes.
Análisis estadísticoEl análisis es descriptivo, expresándose mediante frecuencias y porcentajes las variables categóricas y mediante la media y la desviación estándar (distribución normal) o la mediana, rango y cuartiles Q1 y Q3 (distribución no normal) las variables continuas. Las variables categóricas se compararon mediante el test exacto de Fisher, las continuas mediante el T-test o el test de U de Mann-Whitney. El programa usado fue SAS v.9.3. La significación estadística se estableció en p<0,05.
ResultadosParticiparon 73 investigadores: 51 (70,8%) cardiólogos, 18 (25,0%) hematólogos y 3 (4,2%) internistas. El 78,9% (n=56) ejercía su actividad profesional en el ámbito público y el 21,1% (n=15) en el privado. Se aportaron datos de 2.251 pacientes, de los que 135 fueron considerados no elegibles (fig. 2). De los pacientes válidos (n=2.116), 1.727 (81,6%) estaban tratados en centros del SNS y constituyeron la población de análisis.
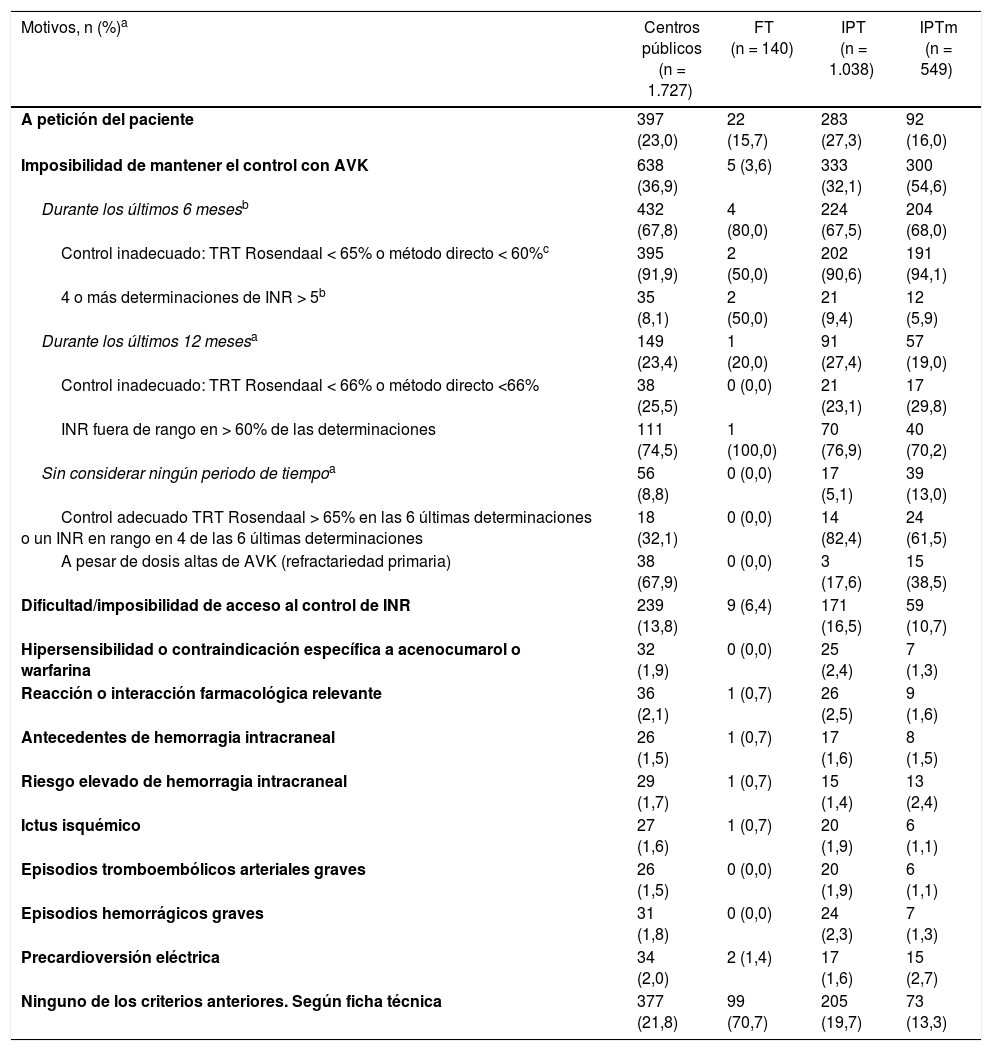
La tabla 1 muestra los motivos para iniciar el tratamiento con rivaroxaban. En CC.AA.IPT o IPTm, la «imposibilidad de mantener el control con AVK» fue el motivo de prescripción de rivaroxaban más frecuente, especialmente en las segundas (32,1% vs. 54,6%). «Por petición del paciente» fue el segundo motivo en importancia en estos dos tipos de CC.AA., sobre todo en las CC.AA.IPT. Ambos fueron los motivos más frecuentes en la población global.
Motivos para la prescripción de rivaroxaban en la población global tratada en centros públicos y en función de la tipología de CC.AA
| Motivos, n (%)a | Centros públicos (n = 1.727) | FT (n = 140) | IPT (n = 1.038) | IPTm (n = 549) |
|---|---|---|---|---|
| A petición del paciente | 397 (23,0) | 22 (15,7) | 283 (27,3) | 92 (16,0) |
| Imposibilidad de mantener el control con AVK | 638 (36,9) | 5 (3,6) | 333 (32,1) | 300 (54,6) |
| Durante los últimos 6 mesesb | 432 (67,8) | 4 (80,0) | 224 (67,5) | 204 (68,0) |
| Control inadecuado: TRT Rosendaal < 65% o método directo < 60%c | 395 (91,9) | 2 (50,0) | 202 (90,6) | 191 (94,1) |
| 4 o más determinaciones de INR > 5b | 35 (8,1) | 2 (50,0) | 21 (9,4) | 12 (5,9) |
| Durante los últimos 12 mesesa | 149 (23,4) | 1 (20,0) | 91 (27,4) | 57 (19,0) |
| Control inadecuado: TRT Rosendaal < 66% o método directo <66% | 38 (25,5) | 0 (0,0) | 21 (23,1) | 17 (29,8) |
| INR fuera de rango en > 60% de las determinaciones | 111 (74,5) | 1 (100,0) | 70 (76,9) | 40 (70,2) |
| Sin considerar ningún periodo de tiempoa | 56 (8,8) | 0 (0,0) | 17 (5,1) | 39 (13,0) |
| Control adecuado TRT Rosendaal > 65% en las 6 últimas determinaciones o un INR en rango en 4 de las 6 últimas determinaciones | 18 (32,1) | 0 (0,0) | 14 (82,4) | 24 (61,5) |
| A pesar de dosis altas de AVK (refractariedad primaria) | 38 (67,9) | 0 (0,0) | 3 (17,6) | 15 (38,5) |
| Dificultad/imposibilidad de acceso al control de INR | 239 (13,8) | 9 (6,4) | 171 (16,5) | 59 (10,7) |
| Hipersensibilidad o contraindicación específica a acenocumarol o warfarina | 32 (1,9) | 0 (0,0) | 25 (2,4) | 7 (1,3) |
| Reacción o interacción farmacológica relevante | 36 (2,1) | 1 (0,7) | 26 (2,5) | 9 (1,6) |
| Antecedentes de hemorragia intracraneal | 26 (1,5) | 1 (0,7) | 17 (1,6) | 8 (1,5) |
| Riesgo elevado de hemorragia intracraneal | 29 (1,7) | 1 (0,7) | 15 (1,4) | 13 (2,4) |
| Ictus isquémico | 27 (1,6) | 1 (0,7) | 20 (1,9) | 6 (1,1) |
| Episodios tromboembólicos arteriales graves | 26 (1,5) | 0 (0,0) | 20 (1,9) | 6 (1,1) |
| Episodios hemorrágicos graves | 31 (1,8) | 0 (0,0) | 24 (2,3) | 7 (1,3) |
| Precardioversión eléctrica | 34 (2,0) | 2 (1,4) | 17 (1,6) | 15 (2,7) |
| Ninguno de los criterios anteriores. Según ficha técnica | 377 (21,8) | 99 (70,7) | 205 (19,7) | 73 (13,3) |
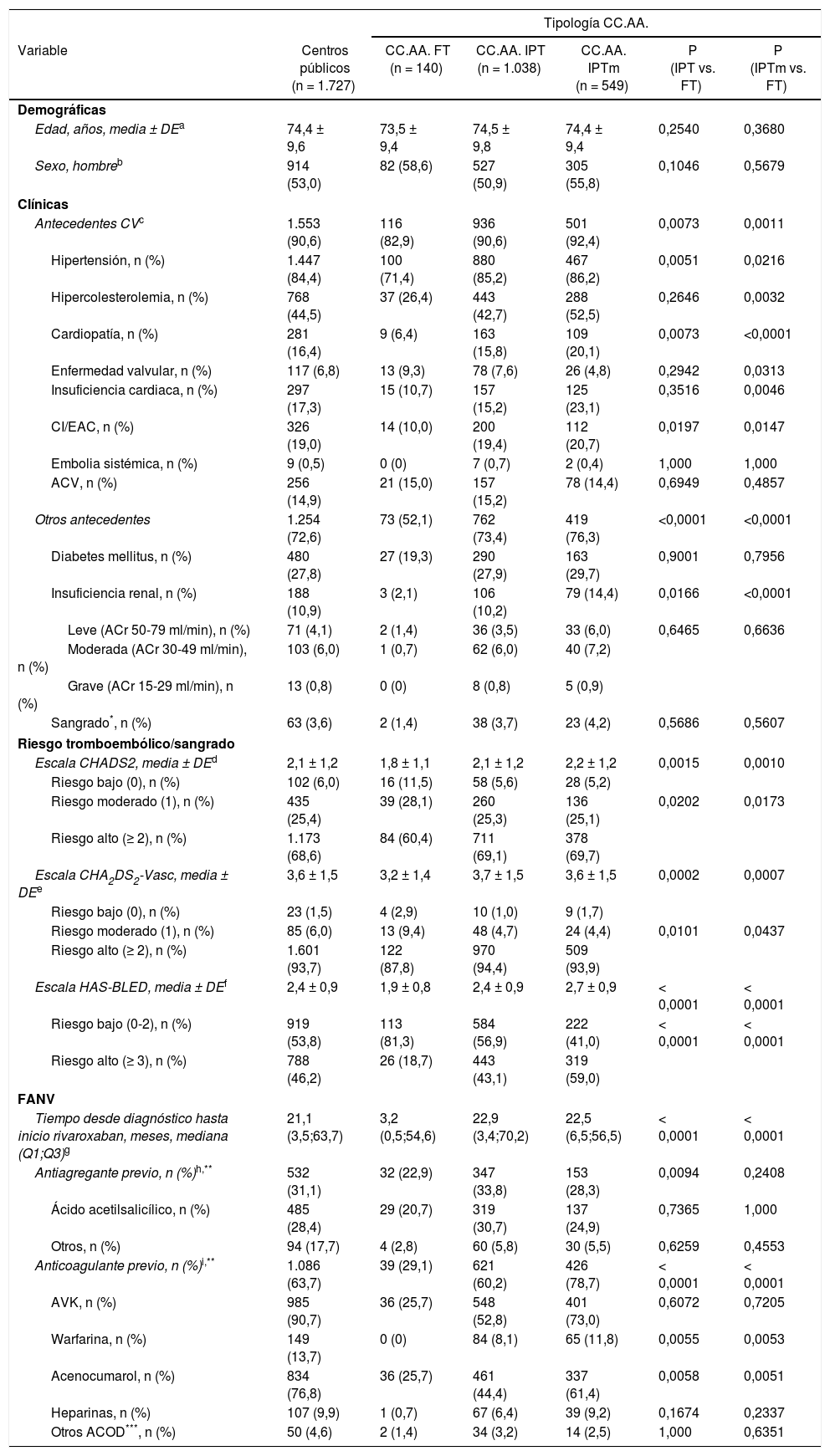
La mediana (Q1;Q3) de tiempo desde el diagnóstico de la FANV hasta recibir rivaroxaban fue de 21,1 (3,5;63,7) meses. El 31,1% de los pacientes (n=532) habían recibido previamente tratamiento antiagregante y el 63,7% tratamiento anticoagulante (n=1.086), de los que 985 (90,7%) fue AVK (tabla 2).
Características demográficas, clínicas y de la FANV de la población global tratada en centros públicos y en función de la tipología de CC.AA
| Tipología CC.AA. | ||||||
|---|---|---|---|---|---|---|
| Variable | Centros públicos (n = 1.727) | CC.AA. FT (n = 140) | CC.AA. IPT (n = 1.038) | CC.AA. IPTm (n = 549) | P (IPT vs. FT) | P (IPTm vs. FT) |
| Demográficas | ||||||
| Edad, años, media ± DEa | 74,4 ± 9,6 | 73,5 ± 9,4 | 74,5 ± 9,8 | 74,4 ± 9,4 | 0,2540 | 0,3680 |
| Sexo, hombreb | 914 (53,0) | 82 (58,6) | 527 (50,9) | 305 (55,8) | 0,1046 | 0,5679 |
| Clínicas | ||||||
| Antecedentes CVc | 1.553 (90,6) | 116 (82,9) | 936 (90,6) | 501 (92,4) | 0,0073 | 0,0011 |
| Hipertensión, n (%) | 1.447 (84,4) | 100 (71,4) | 880 (85,2) | 467 (86,2) | 0,0051 | 0,0216 |
| Hipercolesterolemia, n (%) | 768 (44,5) | 37 (26,4) | 443 (42,7) | 288 (52,5) | 0,2646 | 0,0032 |
| Cardiopatía, n (%) | 281 (16,4) | 9 (6,4) | 163 (15,8) | 109 (20,1) | 0,0073 | <0,0001 |
| Enfermedad valvular, n (%) | 117 (6,8) | 13 (9,3) | 78 (7,6) | 26 (4,8) | 0,2942 | 0,0313 |
| Insuficiencia cardiaca, n (%) | 297 (17,3) | 15 (10,7) | 157 (15,2) | 125 (23,1) | 0,3516 | 0,0046 |
| CI/EAC, n (%) | 326 (19,0) | 14 (10,0) | 200 (19,4) | 112 (20,7) | 0,0197 | 0,0147 |
| Embolia sistémica, n (%) | 9 (0,5) | 0 (0) | 7 (0,7) | 2 (0,4) | 1,000 | 1,000 |
| ACV, n (%) | 256 (14,9) | 21 (15,0) | 157 (15,2) | 78 (14,4) | 0,6949 | 0,4857 |
| Otros antecedentes | 1.254 (72,6) | 73 (52,1) | 762 (73,4) | 419 (76,3) | <0,0001 | <0,0001 |
| Diabetes mellitus, n (%) | 480 (27,8) | 27 (19,3) | 290 (27,9) | 163 (29,7) | 0,9001 | 0,7956 |
| Insuficiencia renal, n (%) | 188 (10,9) | 3 (2,1) | 106 (10,2) | 79 (14,4) | 0,0166 | <0,0001 |
| Leve (ACr 50-79 ml/min), n (%) | 71 (4,1) | 2 (1,4) | 36 (3,5) | 33 (6,0) | 0,6465 | 0,6636 |
| Moderada (ACr 30-49 ml/min), n (%) | 103 (6,0) | 1 (0,7) | 62 (6,0) | 40 (7,2) | ||
| Grave (ACr 15-29 ml/min), n (%) | 13 (0,8) | 0 (0) | 8 (0,8) | 5 (0,9) | ||
| Sangrado*, n (%) | 63 (3,6) | 2 (1,4) | 38 (3,7) | 23 (4,2) | 0,5686 | 0,5607 |
| Riesgo tromboembólico/sangrado | ||||||
| Escala CHADS2, media ± DEd | 2,1 ± 1,2 | 1,8 ± 1,1 | 2,1 ± 1,2 | 2,2 ± 1,2 | 0,0015 | 0,0010 |
| Riesgo bajo (0), n (%) | 102 (6,0) | 16 (11,5) | 58 (5,6) | 28 (5,2) | ||
| Riesgo moderado (1), n (%) | 435 (25,4) | 39 (28,1) | 260 (25,3) | 136 (25,1) | 0,0202 | 0,0173 |
| Riesgo alto (≥ 2), n (%) | 1.173 (68,6) | 84 (60,4) | 711 (69,1) | 378 (69,7) | ||
| Escala CHA2DS2-Vasc, media ± DEe | 3,6 ± 1,5 | 3,2 ± 1,4 | 3,7 ± 1,5 | 3,6 ± 1,5 | 0,0002 | 0,0007 |
| Riesgo bajo (0), n (%) | 23 (1,5) | 4 (2,9) | 10 (1,0) | 9 (1,7) | ||
| Riesgo moderado (1), n (%) | 85 (6,0) | 13 (9,4) | 48 (4,7) | 24 (4,4) | 0,0101 | 0,0437 |
| Riesgo alto (≥ 2), n (%) | 1.601 (93,7) | 122 (87,8) | 970 (94,4) | 509 (93,9) | ||
| Escala HAS-BLED, media ± DEf | 2,4 ± 0,9 | 1,9 ± 0,8 | 2,4 ± 0,9 | 2,7 ± 0,9 | < 0,0001 | < 0,0001 |
| Riesgo bajo (0-2), n (%) | 919 (53,8) | 113 (81,3) | 584 (56,9) | 222 (41,0) | < 0,0001 | < 0,0001 |
| Riesgo alto (≥ 3), n (%) | 788 (46,2) | 26 (18,7) | 443 (43,1) | 319 (59,0) | ||
| FANV | ||||||
| Tiempo desde diagnóstico hasta inicio rivaroxaban, meses, mediana (Q1;Q3)g | 21,1 (3,5;63,7) | 3,2 (0,5;54,6) | 22,9 (3,4;70,2) | 22,5 (6,5;56,5) | < 0,0001 | < 0,0001 |
| Antiagregante previo, n (%)h,** | 532 (31,1) | 32 (22,9) | 347 (33,8) | 153 (28,3) | 0,0094 | 0,2408 |
| Ácido acetilsalicílico, n (%) | 485 (28,4) | 29 (20,7) | 319 (30,7) | 137 (24,9) | 0,7365 | 1,000 |
| Otros, n (%) | 94 (17,7) | 4 (2,8) | 60 (5,8) | 30 (5,5) | 0,6259 | 0,4553 |
| Anticoagulante previo, n (%)i,** | 1.086 (63,7) | 39 (29,1) | 621 (60,2) | 426 (78,7) | < 0,0001 | < 0,0001 |
| AVK, n (%) | 985 (90,7) | 36 (25,7) | 548 (52,8) | 401 (73,0) | 0,6072 | 0,7205 |
| Warfarina, n (%) | 149 (13,7) | 0 (0) | 84 (8,1) | 65 (11,8) | 0,0055 | 0,0053 |
| Acenocumarol, n (%) | 834 (76,8) | 36 (25,7) | 461 (44,4) | 337 (61,4) | 0,0058 | 0,0051 |
| Heparinas, n (%) | 107 (9,9) | 1 (0,7) | 67 (6,4) | 39 (9,2) | 0,1674 | 0,2337 |
| Otros ACOD***, n (%) | 50 (4,6) | 2 (1,4) | 34 (3,2) | 14 (2,5) | 1,000 | 0,6351 |
Pacientes perdidos:
Dabigatran o apixaban.
ACOD: anticoagulante oral directo; ACr: aclaramiento de creatinina; ACV: accidente cerebrovascular; CI/EAC: cardiopatía isquémica/enfermedad arterial coronaria; CV: cardiovascular; FT: ficha técnica de producto; IPT: informe de posicionamiento terapéutico de 2013; IPTm: informe de posicionamiento terapéutico de 2013 modificado.
Los pacientes de CC.AA. IPT o IPTm presentaron con más frecuencia comorbilidades y un riesgo tromboembólico y hemorrágico más alto, tardaron más tiempo en recibir rivaroxaban y recibieron con más frecuencia tratamiento antiagregante y anticoagulante previos vs. aquellos de CC.AA.FT (tabla 2).
DiscusiónEl presente estudio muestra que los pacientes tratados con un ACOD (rivaroxaban) en España bajo el marco de prescripción del IPT de 20135 presentan un riesgo tromboembólico y hemorrágico elevado (el 92,5% y el 42,4% presentan, respectivamente, un CHAD2DS2-Vasc ≥2 y un HAS-BLED ≥3) y una elevada carga de comorbilidades. La mediana hasta recibir este tratamiento es de 21,1meses, tiempo durante el cual reciben AVK en un alto porcentaje. Este aspecto es importante, ya que hasta un 40% de los pacientes con FANV tratados con AVK no tiene un control adecuado de la coagulación1, lo que parece deberse a la dificultad inherente de mantener al paciente dentro del rango terapéutico3. El principal motivo para iniciar el tratamiento con un ACOD en los hospitales del SNS participantes en el estudio (33%) —fundamentalmente por el alto porcentaje relativo de pacientes de hospitales de CC.AA.IPT o IPTm en la población analizada— fue precisamente la imposibilidad de control de la coagulación con un AVK en los últimos 6 o 12meses. En pacientes con FANV, la espera de 6-12meses para valorar la posibilidad de control con un AVK puede tener consecuencias nefastas cuando no se consigue. La heterogeneidad de la adherencia al IPT queda puesta de manifiesto en el porcentaje de médicos que expresan prescribir rivaroxaban por petición del paciente (un 27,3% en CC.AA.IPT y un 16% en CC.AA.IPTm) y sin tener en cuenta ninguno de sus condicionantes (19,7% y 13,3%, respectivamente).
Las diferencias en el perfil de pacientes tratados con rivaroxaban en función de la adherencia al IPT observadas en nuestro estudio ponen de manifiesto el efecto del mismo sobre el acceso a los ACOD. Así, los pacientes tratados con rivaroxaban en las CC.AA.IPT o IPTm han mostrado tener un mayor riesgo tromboembólico y de sangrado con respecto a los pacientes de CC.AA.FT. El retraso en acceder al tratamiento con rivaroxaban fue muy superior con respecto a estas (∼20meses adicionales). Este retraso es superior al que imponen los visados y el IPT, por lo que debemos suponer otros condicionantes, tales como la dificultad de los facultativos para acceder a los registros de controles de razón normalizada internacional (INR) y al propio papel disuasorio del visado para la prescripción. Todo esto pone de manifiesto la desigualdad en el acceso a los ACOD en las distintas CC.AA. en función de diferencias en la adhesión al IPT.
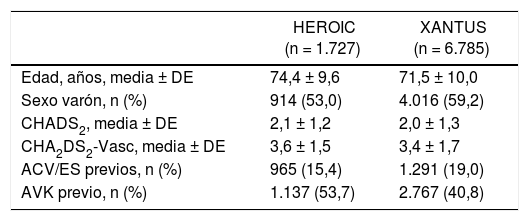
El perfil de los pacientes tratados con rivaroxaban en España difiere en algunos aspectos del de los del único estudio en práctica clínica real existente exclusivamente con rivaroxaban: el estudio XANTUS, un estudio observacional, prospectivo, no intervencionista llevado a cabo en 6.784 pacientes de Europa, Canadá e Israel13. Pese a la imposibilidad de comparar directamente ambos estudios, se observa que el paciente con FANV tratado con rivaroxaban en España presenta una edad más avanzada, así como una mayor frecuencia de tratamiento previo con AVK (tabla 3). Estas aparentes diferencias, que reflejarían el retraso en recibir un ACOD con respecto a estos países de forma global, podrían ser un reflejo del impacto de las restricciones a la prescripción impuestas por el IPT1.
Características basales de los pacientes participantes en los estudios HEROIC y XANTUS13
| HEROIC (n = 1.727) | XANTUS (n = 6.785) | |
|---|---|---|
| Edad, años, media ± DE | 74,4 ± 9,6 | 71,5 ± 10,0 |
| Sexo varón, n (%) | 914 (53,0) | 4.016 (59,2) |
| CHADS2, media ± DE | 2,1 ± 1,2 | 2,0 ± 1,3 |
| CHA2DS2-Vasc, media ± DE | 3,6 ± 1,5 | 3,4 ± 1,7 |
| ACV/ES previos, n (%) | 965 (15,4) | 1.291 (19,0) |
| AVK previo, n (%) | 1.137 (53,7) | 2.767 (40,8) |
ACr: aclaramiento de creatinina; ACV: accidente cerebrovascular (ictus, accidente isquémico transitorio); AVK: antagonista de la vitamina K; DE: desviación estándar; ES: embolia sistémica; IQR: rango intercuartílico.
En 2015, la Sociedad Española de Cardiología destacó el impacto del IPT sobre el acceso a los ACOD mediante la elaboración de un documento de consenso cuyas peticiones incluían, entre otras, suprimir la necesidad de visado para la prescripción de los ACOD14. La revisión de 2016 mantuvo prácticamente los mismos criterios, salvo la recomendación del uso de la escala de riesgo tromboembólico CHAD2DS2-Vasc15. Este documento solicitó también la inclusión del alto riesgo hemorrágico como criterio de uso de ACOD. Este perfil de paciente fue frecuente en nuestro estudio (42,4%), aunque en menor proporción que en el estudio XANTUS (72,7%) (tabla 3), quizá por el temor arraigado ante la posibilidad de hemorragias con estos tratamientos por la ausencia de antídoto.
En resumen, nuestro estudio muestra que los pacientes tratados con un ACOD (rivaroxaban) en España bajo el marco de prescripción del IPT presentan un riesgo tromboembólico y hemorrágico elevado y tardan una mediana de 21,1meses desde el diagnóstico de la FANV en recibirlo. Los pacientes de CC.AA. adheridas al IPT tardan ∼20meses más en recibirlo frente a las no adheridas y presentan un riesgo tromboembólico y hemorrágico superior, lo que genera desigualdades entre CC.AA. Estos resultados enfatizan la necesidad de revisar las condiciones de prescripción impuestas por el IPT reclamadas desde la puesta en marcha del mismo.
Nuestro estudio tiene varias limitaciones que pueden afectar a la interpretación de sus resultados. La clasificación de las CC.AA. en 3 grupos según las condiciones de prescripción más frecuentes hace que los resultados no representen fielmente la situación si se siguiera un único condicionante de prescripción. Pese a las limitaciones de esta aproximación, esta clasificación permite un acercamiento a las limitaciones en el acceso a los ACOD y al análisis de las diferencias generadas por la adherencia al IPT. Existen otros condicionantes a la prescripción de ACOD cuya consideración mejoraría la comprensión de la situación real. Pese a que el número de investigadores participantes fue elevado, no se llegó a reclutar el total de pacientes previstos en el tiempo definido. Un cálculo a posteriori mostró que la precisión a nivel nacional se mantuvo en ∼2% y en el 3-6% en las regiones establecidas. No se recogieron de forma prospectiva datos de efectividad o seguridad que, sin duda, hubieran sido de gran valor en el contexto actual.
FinanciaciónEste estudio fue financiado por Bayer Hispania.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a todos los coordinadores e investigadores su participación en este estudio, a Beatriz Viejo, PhD, por su asistencia en la redacción del presente manuscrito, y a la CRO Bioclever por su dedicación y apoyo.