Revisar nuestros resultados a corto y medio plazo en la reparación valvular mitral (RVM), utilizando neocuerdas de politetrafluoroetileno expandido (ePTFE).
MétodosDesde marzo de 2006 a febrero de 2009, en 40 pacientes la RVM por insuficiencia mitral se realizó mediante el implante de neocuerdas de ePTFE. Había 24 hombres (60%) y 16 mujeres (40%), con una edad media de 62,3±13,8 años. Hubo 32 reparaciones de velo posterior (80%), 4 de velo anterior (10%) y 4 de ambos velos (10%).
ResultadosNo hubo muertes intraoperatorias, con una mortalidad intrahospitalaria a 30 días de 1 caso (2,5%).
No hubo eventos tromboembólicos. Hubo una reintervención precoz por sangrado (2,5%). El uso de ecocardiografía transesofágica postoperatoria inmediata reveló ausencia de regurgitación mayor que leve en todos los casos.
El seguimiento se completó en el 100% de los pacientes, con un rango de 6-36 meses (media 28±6,8). La supervivencia general a 6, 12 y 24 meses es del 97,5%. La ausencia de insuficiencia mitral mayor o igual que leve es del 95% (38 casos).
La clase funcional New York Heart Association, el diámetro telediastólico y el diámetro telesistólico del ventrículo izquierdo mejoraron en todos los pacientes, con una diferencia estadísticamente significativa (p<0,05).
ConclusionesNuestros datos confirman que la técnica de neocuerdas es segura, perdurable y reproducible, permitiendo la conservación del tejido valvular mitral. Creemos que su uso irá incrementándose con el tiempo, ampliándose sus indicaciones. La técnica expuesta debe ser tenida siempre en cuenta, ya que creemos que se convertirá en la técnica de elección para la RVM.
To review our short and mid-term results of mitral valve repair with expanded polytetrafluoroethylene (ePTFE) neochordae.
MethodsMitral valve repair due to mitral regurgitation was performed using chordal replacement with ePTFE in 40 patients from March 2006 to September 2009. There were 24 men (60%) and 16 women (40%) whose mean age was 62.3±13.8. There were 32 posterior leaflet repairs (80%), 4 anterior (10%) and 4 bileaflet (10%).
ResultsNo operative death or morbidity was observed. There was a 30-day mortality rate of 1 case (2.5%). There was one early reintervention due to haemorrhage (2.5%). No thromboembolic events were reported. The intraoperative transoesophageal echocardiography revealed no grade greater than mild mitral regurgitation.
The follow up period was 100% completed with a range of 6-36 months (mean 28±6.8 months). Freedom from grade greater than mild MR was 95% (38 patients) and overall actuarial survival at 6, 12 and 24 months was 97.5%.
The New York Heart Association functional class, the left ventricular end-systolic dimension, and left ventricular end-diastolic dimension in all patients, were improved, with a statistical significant P value (P<.05).
ConclusionsOur results demonstrated safety, reproducibility and good durability of ePTFE chordal replacement, allowing the preservation of the mitral valve tissue. We believe that its use will increase over time, expanding its indications and could be considered the gold standard in the near future.
En los últimos años observamos un incremento en el número de publicaciones concernientes a la reparación valvular mitral (RVM) mediante la reconstrucción de las cuerdas tendinosas con suturas de politetrafluoroetileno expandido (ePTFE, Gore-Tex, W.L. Gore & Assoc., Flagstaff, AZ, USA), existiendo actualmente una gran variedad de técnicas para reparar el prolapso tanto del velo anterior como del velo posterior, sobre todo si son de etiología degenerativa.
La finalidad del estudio es analizar la experiencia de nuestro Hospital en la RVM mediante el implante de neocuerdas utilizando una modificación de la técnica de Sarsam1 para lograr un correcto ajuste de la longitud de las mismas en 40 casos, analizando los resultados clínicos y ecocardiográficos postoperatorios y a corto y medio plazo tras la cirugía.
La RVM se ha convertido actualmente en el procedimiento de elección para la corrección de casi todos los tipos de insuficiencia mitral (IM), siendo los resultados y beneficios a corto y largo plazo superiores a los de la sustitución valvular mitral, como se ha demostrado en varios artículos2,3.
El prolapso del velo posterior (P2) de la válvula mitral de causa degenerativa es el tipo más común, y puede ser tratado mediante una resección cuadrangular del segmento prolapsado4 con excelentes resultados tanto precoces como tardíos, por lo que se considera la técnica de elección o gold standard actual para la RVM de IM degenerativa de velo posterior.
Sin embargo, la corrección de un prolapso de velo anterior o de ambos velos es todo un desafío, precisando de técnicas quirúrgicas complejas, como la transferencia de cuerdas tendinosas desde el velo posterior, la resección triangular de hasta 1/3 del velo anterior y la plastia de cuerdas, estando todas ellas limitadas por la cantidad de tejido nativo sano disponible.
Recientemente, las neocuerdas de politetrafluoroetileno expandido (ePTFE) se han introducido como parte del arsenal quirúrgico disponible para sobrepasar estas dificultades y limitaciones5, siendo actualmente muy populares debido a su disponibilidad, seguridad, adaptación fisiológica y resultados precoces y tardíos excelentes, testados desde hace más de 10 años6.
Las complicaciones de la técnica de neocuerdas son las derivadas de lograr un correcto ajuste de la longitud de las mismas, habiéndose descrito múltiples técnicas7–10 para lograr un ajuste simple, efectivo y reproducible. En nuestro centro, la técnica de implante seleccionada para realizar las intervenciones y ajustar las neocuerdas es una modificación de la técnica de Sarsam1, descrita en 2002, que será comentada posteriormente.
Actualmente se están utilizando las neocuerdas tanto en la reparación del velo anterior como del posterior con éxito similar11–14. Sin embargo, las indicaciones para su utilización se revisan constantemente debido a sus buenos resultados, habiéndose extendido su aplicación a pacientes con enfermedad mitral reumática y algunos casos seleccionados de endocarditis activa15–17.
Por tanto, el objetivo del presente trabajo consiste en analizar nuestra experiencia y resultados con el implante de neocuerdas en la cirugía reparadora de la válvula mitral.
Material y métodoPacientesEntre julio de 2001 y febrero de 2009 fueron intervenidos 147 pacientes de cirugía reparadora mitral. De ellos, en 40 casos (27,2%), desde marzo de 2006 a febrero de 2009 la reparación valvular se realizó mediante el implante de neocuerdas de ePTFE junto a otras técnicas reparadoras en algunos casos (7 pacientes, 17,5%). Estos pacientes forman la cohorte del presente estudio.
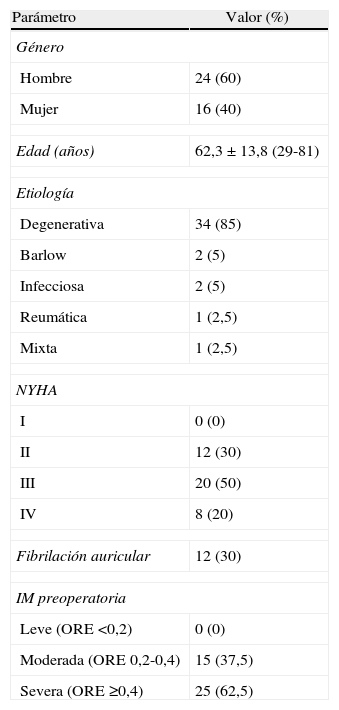
Había 24 hombres (60%) y 16 mujeres (40%), con una edad media de 62,3±13,8 años (rango 29-81). En cuanto a la etiología, en 34 casos era degenerativa (85%), en 2 síndrome de Barlow (5%), 2 endocarditis (5%), un caso reumático (2,5%) y uno mixto (degenerativo+isquémico, 2,5%). Hubo 32 reparaciones de velo posterior (80%), 4 del anterior (10%) y 4 reparaciones de ambos velos (10%), realizándose anuloplastia mitral en todos los pacientes (38 anillos flexibles y 2 rígidos, con un tamaño medio de 29,4±3 mm). Las características clínicas preoperatorias de estos pacientes se resumen en la tabla 1.
Características clínicas preoperatorias.
| Parámetro | Valor (%) |
| Género | |
| Hombre | 24 (60) |
| Mujer | 16 (40) |
| Edad (años) | 62,3±13,8 (29-81) |
| Etiología | |
| Degenerativa | 34 (85) |
| Barlow | 2 (5) |
| Infecciosa | 2 (5) |
| Reumática | 1 (2,5) |
| Mixta | 1 (2,5) |
| NYHA | |
| I | 0 (0) |
| II | 12 (30) |
| III | 20 (50) |
| IV | 8 (20) |
| Fibrilación auricular | 12 (30) |
| IM preoperatoria | |
| Leve (ORE <0,2) | 0 (0) |
| Moderada (ORE 0,2-0,4) | 15 (37,5) |
| Severa (ORE ≥0,4) | 25 (62,5) |
NYHA: New York Heart Association; ORE: orificio regurgitante efectivo.
El electrocardiograma preoperatorio reveló ritmo sinusal en 28 pacientes (70%) y fibrilación auricular en 12 (30%). El grado de la IM se determinó mediante ecocardiografía transtorácica (ETT), en función del orificio regurgitante efectivo (ORE), como leve (ORE <0,2), moderada (ORE 0,2-0,4), o severa (ORE ≥0,4).
Los estudios de ETT preoperatorios indicaron una IM severa en 25 pacientes (62,5%, ORE ≥0,4) y una IM moderada a severa (ORE 0,2-0,4) sintomática en otros 15 pacientes (37,5%) que presentaban una fracción de eyección deprimida (media 41±8%) o bien un diámetro telesistólico de ventrículo izquierdo superior a 40 mm (media 45±6 mm).
Se practicó coronariografía preoperatoria en todos los pacientes mayores de 40 años con factores de riesgo cardiovascular.
A 12 pacientes (30%) se les clasificó como clase funcional New York Heart Association (NYHA) II, 20 (50%) como clase III, y 8 pacientes (20%) como clase IV, presentando 4 de ellos una presión sistólica de arteria pulmonar (10%) de grado moderada (media 46±8,5 mmHg).
Procedimiento quirúrgicoExposición valvularSe realizó ecocardiografía transesofágica (ETE) con el paciente anestesiado en todos los casos, para asegurar una correcta evaluación preoperatoria y confirmar hallazgos previos.
En todos los pacientes se realizó un abordaje estándar, mediante esternotomía media, posterior disección de ambas venas cava, para canular posteriormente cada una por separado (canulación venosa bicava) y canulación arterial en aorta ascendente. Posteriormente se traccionó del borde derecho del pericardio abierto hasta cubrir completamente el borde esternal para conseguir una correcta rotación cardíaca y exposición valvular.
Se procedió a entrar en circulación extracorpórea (CEC) con canulación bicava para el drenaje venoso, parando el corazón con solución cardiopléjica mezclada con sangre oxigenada fría (cardioplejia hemática fría intermitente) en proporción 4:1, manteniendo flujos de 2 a 3 l/min/m2 y una presión arterial media por encima de 60 mmHg.
El abordaje de la válvula mitral se conseguía accediendo a través de la cresta interatrial de la aurícula izquierda (plano de Sondegaard) de la manera habitual, colocando posteriormente un separador de Cosgrove (Kapp Surgical Inc., Cleveland, OH, USA) con sus tres retractores para lograr una buena exposición valvular.
Posteriormente, de acuerdo con los principios de Carpentier4, se inspeccionaba cuidadosamente la válvula mitral y el aparato subvalvular, identificando las zonas de prolapso mediante inyección de suero fisiológico.
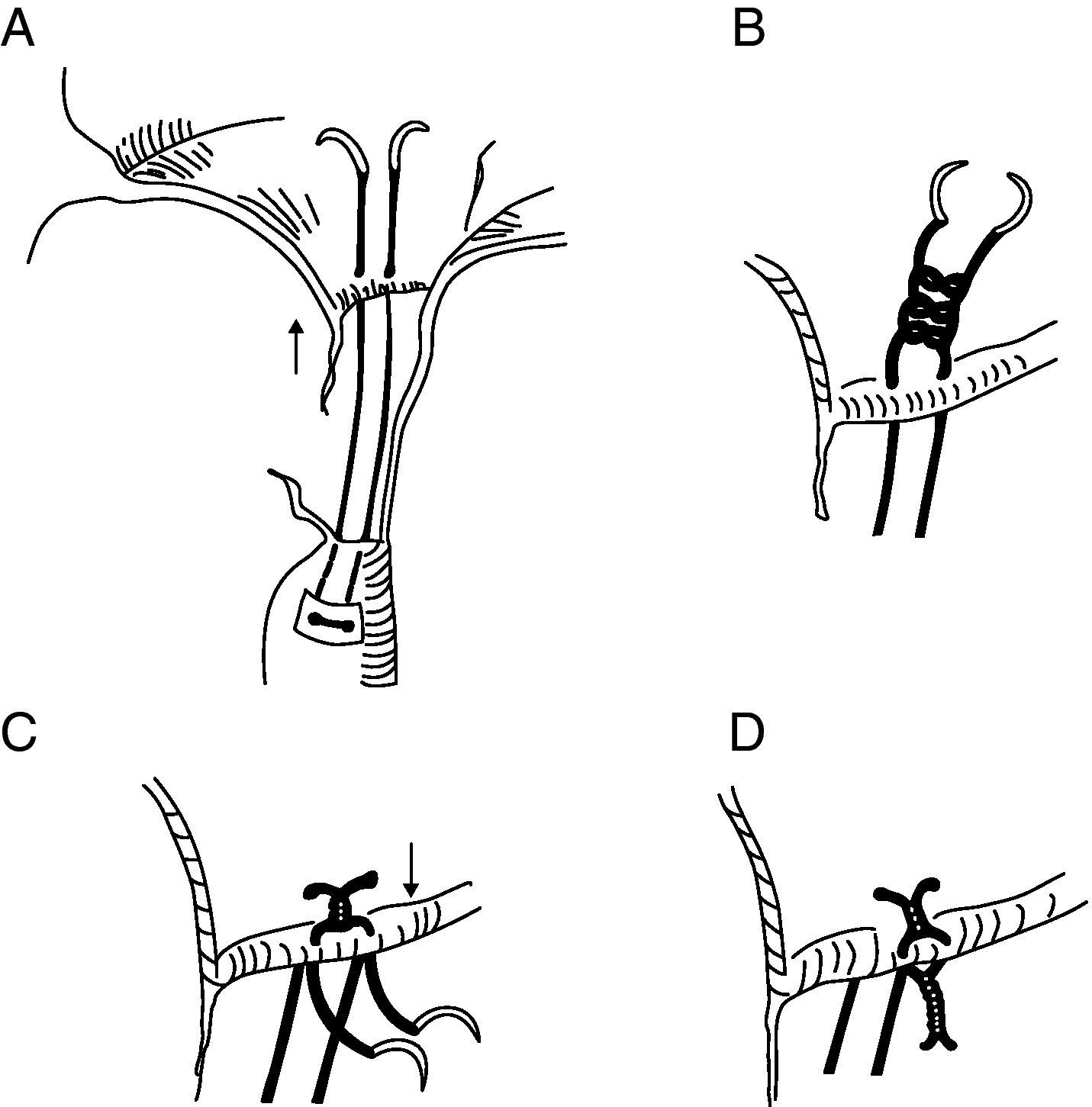
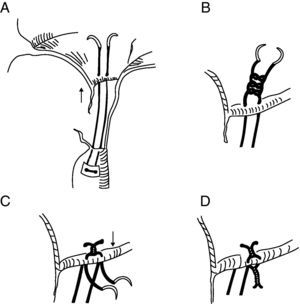
Estrategia de implante de las neocuerdas de ePTFEEn síntesis, la técnica quirúrgica del implante de neocuerdas (fig. 1) consiste en anclar a través de la porción fibrosa de la cabeza del músculo papilar una o más suturas de ePTFE de 4.0 (Gore-Tex, W.L. Gore & Assoc., Flagstaff, AZ, USA) que luego se fijan en el borde libre del segmento mitral afecto, para posteriormente realizar una anuloplastia mitral con anillo protésico7,18.
Técnica de Sarsam modificada para el ajuste de las neocuerdas. Una doble sutura de CV4 ePTFE se pasa a través de la porción fibrosa del músculo papilar, y posteriormente desde la cara ventricular a la cara auricular a través del borde libre de la valva, separadas unos 5-7mm (A). Se realizan dos o tres nudos no tensados para asegurar la longitud correcta de la neocuerda mediante la inyección de suero salino fisiológico (B). Ambos extremos de la sutura se vuelven a pasar desde la cara auricular a la ventricular a través del borde libre (C). Se realizan entre 8-9 nudos que se tensan con cuidado de no modificar la longitud escogida, en la cara ventricular (D).
Si fuera preciso efectuar otras técnicas, como las resecciones de tejido o maniobras adicionales (resecciones cuadrangulares, triangulares, plastias por deslizamiento…), éstas deben practicarse previamente a la implantación de las neocuerdas para así obtener una mejor visibilidad y exposición quirúrgica de la cavidad ventricular.
Una vez anclada la sutura de ePTFE al músculo papilar, se pasa cada aguja a través del borde libre del segmento prolapsado, desde la cara ventricular izquierda hacia la cara auricular izquierda, con unos 4-5 mm de separación.
Es en esta situación cuando realizamos el ajuste de la longitud de la neocuerda, que debe ser similar a la de las cuerdas tendíneas del velo opuesto sano.
Para ello en nuestro centro utilizamos una modificación de la técnica de Sarsam para evitar infra o sobrecorrecciones, tomando como referencia el plano de coaptación de ambos velos mitrales mediante el llenado del ventrículo izquierdo con suero salino. Aseguramos inicialmente dicha longitud realizando 2 o 3 nudos sin tensar y con cuidado extremo.
Una vez ajustada la longitud, se pasan nuevamente ambas agujas de la sutura de ePTFE a la cara ventricular, donde se realiza un nuevo anudado de 7-8 nudos, esta vez tensos para lograr una correcta fijación, repitiéndose este procedimiento para cada nueva cuerda que quiera implantarse.
Tras todo lo anterior, se practicó una anuloplastia mitral en todos los pacientes (38 anillos flexibles y 2 rígidos, con un tamaño medio de 29,4±3mm) utilizándose anillos flexibles St. Jude Medical Tailor, y rígidos St. Jude Rigid Saddle (St. Jude Medical, Inc., One Lillehei, MN, USA).
El análisis final de la válvula para asegurar una correcta reparación se realiza mediante ETE mientras el paciente es desconectado de la máquina de CEC.
En 7 casos (17,5%) fueron necesarias otras técnicas concomitantes de reparación mitral, como la resección cuadrangular de velo posterior en 5 casos (12,5%) y resección triangular de velo anterior en 2 casos (5%) debido a un exceso de tejido que podía provocar movimiento anterior sistólico de la válvula mitral. En otros 2 casos (5%) se precisó de punto de Alfieri central debido a un resultado subóptimo inicial.
Se realizaron otros procedimientos simultáneos en 4 pacientes, en 3 injertos coronarios por cardiopatía isquémica (7,5%) y reparación valvular tricúspide mediante anuloplastia en 1 caso (2,5%).
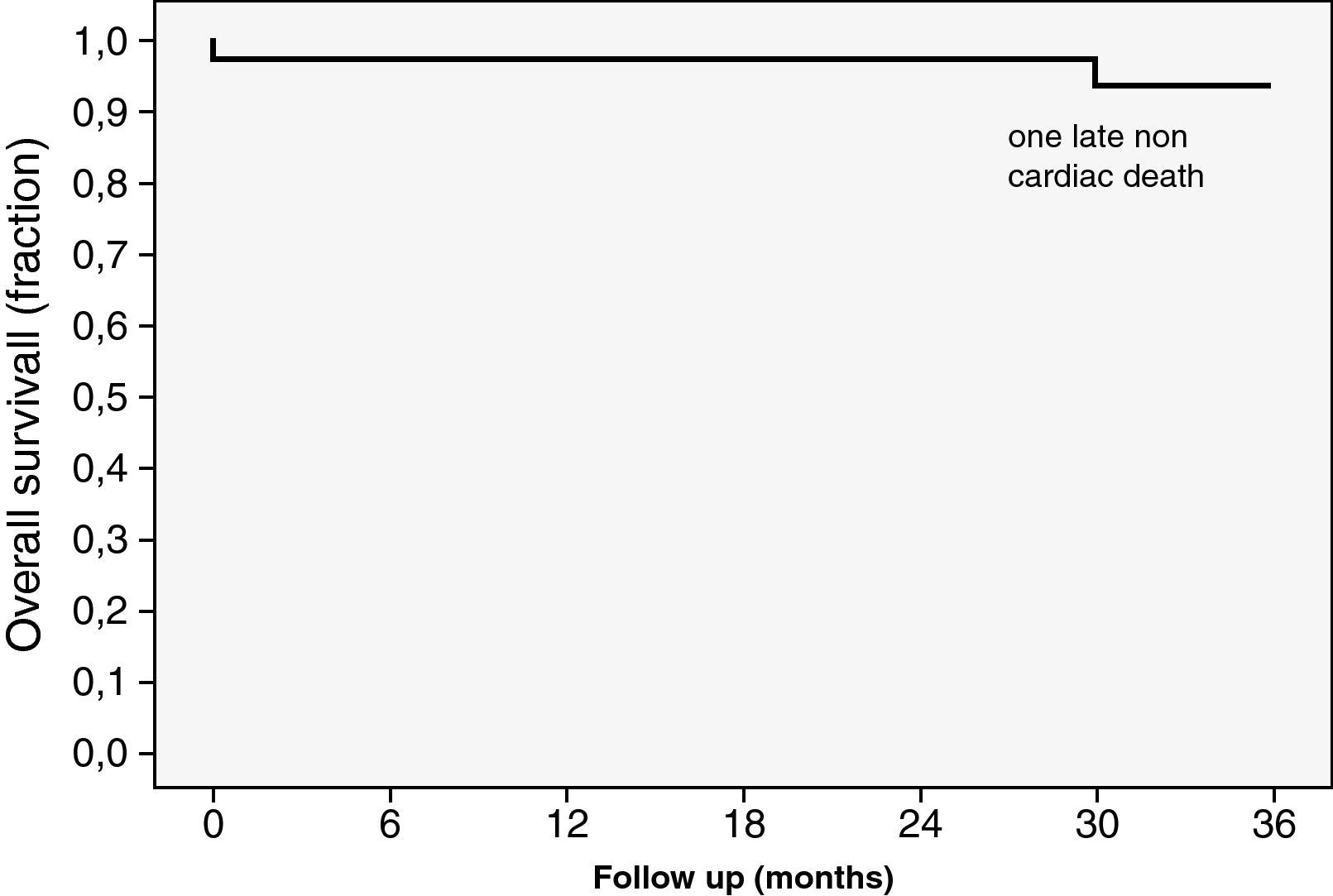
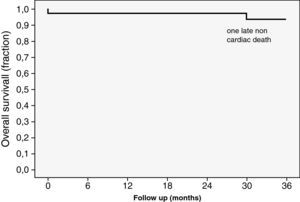
Análisis estadísticoPara todos los análisis estadísticos utilizamos el programa SPSS 15.0 software (SPSS Inc., Chicago, IL, USA). Las variables continuas se expresan en media±desviación estándar (DE), mientras que las cualitativas se expresan en porcentajes. El test de la t de Student para muestras apareadas fue utilizado con las variables continuas y el test no paramétrico de Wilcoxon para variables ordinales o escalas (NYHA, grado de IM). El análisis de supervivencia se realizó utilizando el método de Kaplan-Meier (fig. 2). Una p<0,05 fue considerada estadísticamente significativa.
ResultadosResultados a corto plazo (postoperatorio inmediato)No hubo mortalidad ni morbilidad intraoperatoria. Se registró una muerte precoz dentro de los 30 primeros días, que ocurrió en una mujer de 70 años que sufrió un síndrome de respuesta inflamatoria sistémica (SRIS) con bajo gasto cardíaco sin respuesta a altas dosis de aminas ni balón de contrapulsación intraaórtico.
En 2 casos (5%), para asegurar un resultado correcto fue necesaria la reentrada en CEC al objetivarse una IM moderada subóptima, resolviéndose con puntos de Alfieri en el mismo acto quirúrgico
Hubo una reintervención precoz por sangrado postoperatorio resuelto favorablemente. No hubo reintervenciones tardías ni eventos tromboembólicos. En 2 casos (5%) se desarrolló un fallo renal transitorio sin necesidad de hemodiálisis y 1 paciente (2,5%) sufrió un infarto de miocardio perioperatorio en relación con déficit de protección miocárdica.
El tiempo medio de isquemia fue de 84±16 min (rango 60-115) y el tiempo medio de CEC fue de 95,0±19,2 min (rango 65-125).
Como media por intervención se utilizaron unas 4,37±1,47 (rango 2-8) neocuerdas, y todos los datos relacionados con su implante se muestran en las tablas 2 y 3.
Técnicas adicionales de RVM.
| Técnica | Número de pacientes (%) |
| Resección cuadrangular | 3 (7,5) |
| Resección triangular | 2 (5) |
| Alfieri | 2 (5) |
| Anillos flexibles | 38 (95) |
| 25 mm | 4 (11) |
| 27 mm | 4 (11) |
| 29 mm | 17 (43) |
| 31 mm | 4 (11) |
| 33 mm | 4 (11) |
| 35 mm | 5 (13) |
| Anillos rígidos | 2 (5) |
| 28 mm | 2 (100) |
RVM: Reparación valvular mitral.
Los resultados precoces postoperatorios fueron muy satisfactorios; 37 pacientes (92,5%) presentaron ausencia de regurgitación, 2 pacientes (5%) una regurgitación residual trivial y un paciente una regurgitación leve (2,5%, ORE <0,2), teniendo por tanto un ratio de ausencia de regurgitación mitral significativa del 100%.
La estancia media en la unidad de cuidados intensivos fue de 4,3±2,6 días (rango 2-16), con una estancia hospitalaria media de 13,1±8,8 días (4-21).
Los resultados a corto plazo son por tanto excelentes, con una sola muerte precoz dentro de los 30 primeros días de postoperatorio.
Seguimiento y resultados a medio plazoEl seguimiento se completó en el 100% de los pacientes, con un rango de 6-36 meses (media 28±6,8 meses). Fue obtenido mediante entrevistas con los pacientes, momento en el que se les realizó una ETT de control, por parte de un experto ecocardiografista.
La supervivencia general a 6, 12 y 24 meses es del 97,5%, como podemos apreciar en la figura 2. La ausencia de IM mayor o igual que leve (ORE ≥0,2) es del 95% (38 casos), habiendo mejorado la clase funcional NYHA de manera significativa, de un valor preoperatorio medio de 2,9±0,63, a un valor postoperatorio medio de 1,16±0,38 (p<0,0001), encontrándose 34 pacientes (85%) en clase I y 6 (15%) en clase funcional II.
Se objetivó una muerte tardía, no relacionada con la cirugía, en un paciente de 63 años que murió de cáncer de páncreas a los 26 meses de la cirugía.
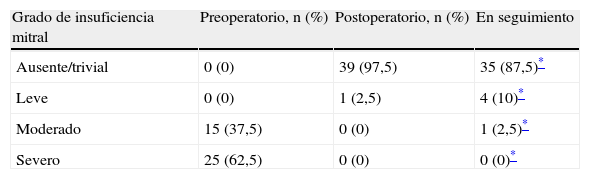
En este seguimiento, por tanto, se encuentra una ausencia de IM en 35 casos (87,5%), IM trivial-leve en 4 casos (10%, ORE <0,2) y moderada en un caso (2,5%, ORE 0,3), sin encontrarse IM de grados III ni IV.
Todos los pacientes recibieron terapia anticoagulante para mantener un international normalized ratio (INR) entre 2 y 2,5 durante 6 meses, salvo en los casos con fibrilación auricular crónica.
La IM postoperatoria en el seguimiento se encuentra muy mejorada de manera estadísticamente significativa (p<0,0001) comparado con sus valores preoperatorios evaluados por ETT, como se muestra en la tabla 4.
Insuficiencia mitral preoperatoria, postoperatoria y durante el seguimiento.
| Grado de insuficiencia mitral | Preoperatorio, n (%) | Postoperatorio, n (%) | En seguimiento |
| Ausente/trivial | 0 (0) | 39 (97,5) | 35 (87,5)* |
| Leve | 0 (0) | 1 (2,5) | 4 (10)* |
| Moderado | 15 (37,5) | 0 (0) | 1 (2,5)* |
| Severo | 25 (62,5) | 0 (0) | 0 (0)* |
ORE: orificio regurgitante efectivo.
Evaluado mediante ecocardiografía. Leve=ORE <0,2; moderada=ORE 0,2-0,4; severa=ORE ≥0,4.
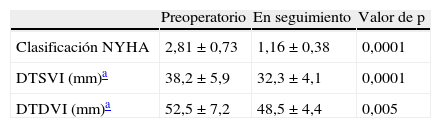
Por tanto, la clase funcional NYHA, el diámetro telediastólico (DTDVI) y el telesistólico (DTSVI) del ventrículo izquierdo mejoraron en todos los pacientes tras la cirugía, con una diferencia estadísticamente significativa (p<0,005 DTDVI, p<0,0001 DTSVI, y NYHA p<0,0001) de acuerdo con los hallazgos de ETT, como se muestra en la tabla 5. No se determinaron otras alteraciones ni calcificaciones en las neocuerdas.
Resultados clínicos y ecocardiográficos preoperatorios y en seguimiento tras reparación valvular mitral.
| Preoperatorio | En seguimiento | Valor de p | |
| Clasificación NYHA | 2,81±0,73 | 1,16±0,38 | 0,0001 |
| DTSVI (mm)a | 38,2±5,9 | 32,3±4,1 | 0,0001 |
| DTDVI (mm)a | 52,5±7,2 | 48,5±4,4 | 0,005 |
NYHA: New York Heart Association; DTSVI: diámetro telesistólico del ventrículo izquierdo; DTDVI: diámetro telediastólico del ventrículo izquierdo.
La reparación quirúrgica de la IM permite una completa preservación del aparato subvalvular y de la función ventricular con muy pocas complicaciones derivadas y excelentes resultados, como ha comunicado Carpentier en numerosas ocasiones4,19,20 (la «French Correction»).
La mayoría de las técnicas de RVM para el prolapso del velo posterior consisten en resecciones cuadrangulares con posterior reconstrucción y anuloplastia, estando asociadas a excelentes resultados perioperatorios y a largo plazo4,20, con aprobación unánime de su efectividad por parte de la comunidad científica (es considerada la técnica gold standard para RVM de velo posterior). El problema se presenta cuando hay que realizar resecciones superiores al 50% del velo, ya que requiere la aplicación de técnicas más complejas (folding plasty o sliding plasty, sobre todo cuando hay exceso de tejido o riesgo elevado de movimiento sistólico anterior de la válvula mitral).
Nuestros resultados indican que tanto el prolapso limitado como el extenso pueden ser solucionados con la técnica de implante de neocuerdas más anuloplastia, con excelentes resultados tanto a corto como a medio plazo.
La reparación del prolapso del velo anterior (PVA) requiere de una gran destreza, ya que es bastante más difícil de reparar que el prolapso del velo posterior, presentando una mayor tasa de recurrencia de la IM a largo plazo21, requiriendo de técnicas más complejas como la transferencia de cuerdas del velo posterior al anterior (chordal transfer), resecciones triangulares que no deben superar un tercio de la superficie del velo y resecciones o reimplante de músculos papilares. El acortamiento y plicatura de cuerdas elongadas se ha abandonado debido a la alta tasa de recurrencia de la IM.
Actualmente está aceptado que la técnica chordal transfer es efectiva para resolver PVA, pero en el último lustro hemos observado que la técnica de implante de neocuerdas de ePTFE está desbancándola por su efectividad, seguridad, reproducibilidad y mayor facilidad técnica, siendo por tanto considerada la de elección actualmente para el PVA17.
El implante de neocuerdas fue introducido en 1985 por Tirone David5 y colaboradores. Desde entonces se han comunicado diversas técnicas de implante para lograr un correcto ajuste de la longitud de las neocuerdas de ePTFE, utilizando como referencia el annulus o la valva opuesta no patológica, para asegurar un correcto plano de coaptación, ya que se ha visto que es el principal factor limitante quirúrgico para una correcta RVM1,7–11.
Actualmente, la versatilidad de las neocuerdas ha provocado que numerosos centros de todo el mundo hayan incrementado su uso y aplicación, como está sucediendo en nuestra institución.
El implante de neocuerdas con suturas de CV4 o CV5ha demostrado ser una técnica simple, perdurable y efectiva según nuestra experiencia quirúrgica y la de otras Instituciones, no existiendo limitación en el posible número de implante de las mismas, lo que es especialmente ventajoso cuando existe mucho tejido dañado o prolapsado, o cuando están afectos los dos velos.
En cuanto a la durabilidad del ePTFE, se ha demostrado efectivo por más de diez años sin incidencias, observándose que las neocuerdas se recubren de una capa de neoíntima dentro del primer año tras su implante, induciendo antitrombogenicidad, y una flexibilidad similar a las cuerdas tendíneas nativas6,14. Sin embargo, debido a algunos hallazgos como el engrosamiento de neocuerdas a lo largo del tiempo22, preferimos realizar el menor número de implantes posible. Además, recientemente se han comunicado 2 casos de ruptura espontánea de neocuerdas23,24, por lo que debemos estar alerta y realizar un correcto seguimiento en estos pacientes, para comprobar la seguridad de la técnica a largo plazo. Ninguno de estos hallazgos fue encontrado en nuestro estudio.
La técnica quirúrgica que describimos aquí es el abordaje sistemático que practicamos en nuestro centro para cada caso de IM. La diferencia principal en la técnica de Sarsam empleada en nuestro caso y modificada, consiste en que el tensado de los nudos lo realizamos en la cara ventricular, utilizando para lograr un correcto plano de coaptación la inyección de suero fisiológico. Los resultados clínicos y ecocardiográficos descritos en el presente estudio son similares a los descritos en estudios previos de uso de ePTFE6,25.
No se han descrito fallos ni complicaciones relacionadas con la válvula que puedan ser atribuidas a las neocuerdas artificiales. Si la valva posterior no es redundante, preferimos utilizar neocuerdas en lugar de la clásica resección cuadrangular, mientras que en el síndrome de Barlow intentamos realizar una resección con plastia de deslizamiento posterior y una triangular anterior previa al implante de neocuerdas y anuloplastia.
La principal limitación de este estudio estriba en el relativamente corto periodo de seguimiento, con una media de 28±6,8 meses, si bien la máxima duración supera los 3 años. Esto se debe a que fue a partir de 2005 cuando apreciamos un aumento de los pacientes referidos a nuestro centro para RVM.
En las series de la Cleveland Clínic, Gillinov et al16 refieren que el 50% de las reintervenciones por RVM subóptima suceden durante el primer año tras la cirugía. Debido a la ausencia de las mismas durante el seguimiento, somos optimistas acerca de los resultados que obtendremos en el seguimiento a largo plazo.
Nuestra experiencia confirma la experiencia de otros centros de reconocido prestigio5,6,13–15 en cuanto a que la técnica de implante de neocuerdas artificiales es una técnica perdurable y efectiva para la RVM, siendo los resultados similares tanto para el prolapso de velo anterior como posterior, si bien en nuestro medio este último es bastante más frecuente.
ConclusionesEl método de Sarsam modificado para el ajuste de las neocuerdas es más reproducible que otras técnicas, con excelentes resultados a corto y medio plazo. El análisis de la situación clínica de nuestros pacientes a medio plazo revela una supervivencia a 6, 12 y 24 meses del 97,5%, sin complicaciones relacionadas con la válvula. No se requirieron reintervenciones tardías, y la ausencia de IM mayor que leve (ORE >0,2) es del 97,5%, con clara mejoría tanto de la clase funcional NYHA como de los DTDVI y DTSVI.
En resumen, se han estudiado 40 casos de RVM tratados mediante el empleo de neocuerdas artificiales de ePTFE que resultaron exitosos, concluyendo que el uso de dicho material irá incrementándose, pasando a ser la técnica de elección en la mayoría de los casos. Sin embargo, es preciso realizar seguimientos a largo plazo para determinar su verdadera durabilidad, y estudios para determinar el momento más apropiado para la cirugía en pacientes asintomáticos con IM, haciendo para ello especial énfasis en la necesidad de que el cirujano de referencia sea capaz de asegurar una tasa muy elevada de éxito en la RVM, superior al 95%, particularmente en la población más joven26.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.