El síndrome de Brugada sigue siendo una de las principales canalopatías estudiadas en los principales laboratorios de investigación con la finalidad de encontrar un fármaco capaz de suprimir los episodios clínicos derivados. Las indicaciones actuales de estudio genético, las limitaciones del test de provocación y estudio electrofisiológico y las posibilidades terapeúticas son revisadas de forma más detallada.
Brugada syndrome is still one of the most important channelopathies studied in the major experimental laboratories with the aim of finding a drug capable of eliminating secondary damages. The current indications for genetic testing, the limitations of provocative drug challenge testing, and intracardiac electrophysiology study and the therapeutics possibilities are reviewed in detail.
Desde que en 1992 se publicó su primera descripción, son miles los artículos relacionados con el síndrome de Brugada1. Actualmente sigue siendo motivo de estudio en los principales laboratorios de investigación a nivel mundial, con la finalidad de encontrar un fármaco capaz de controlar las alteraciones derivadas de las mutaciones genéticas. Esto supondría un remedio para una de las principales causas de muerte súbita (MS) en pacientes jóvenes, cuya edad media de presentación es entre la tercera y cuarta décadas de la vida.
El síndrome de Brugada se encuentra catalogado por las distintas sociedades de cardiología dentro del grupo de las canalopatías, es decir, se trata de un trastorno eléctrico primario secundario a una alteración de la función de los canales iónicos del miocardiocito, en ausencia de cardiopatía estructural y asociado a un significativo aumento del riesgo de MS en individuos jóvenes.
EpidemiologíaActualmente, a nivel mundial la prevalencia se estima en 1-5/10.000 habitantes en los países occidentales2, describiéndose una mayor frecuencia en los países orientales, donde se presenta hasta en 1 de cada 2.500 habitantes.
Se caracteriza por presentar una transmisión autosómica dominante con baja penetrancia. A pesar de ello, el fenotipo es de 8 a 10 veces más frecuente en varones que en mujeres, lo que parece ser debido a la heterogeneidad en la expresión de los canales iónicos del miocardiocito. Diversos estudios de experimentación han demostrado la presencia de una mayor densidad de canales Ito en el ventrículo derecho (VD) de los perros macho3. Esto conllevaría desequilibrio de las corrientes iónicas durante la fase1 del potencial de acción, responsable de las alteraciones ECG características4.
PatogeniaLa teoría más defendida se basa en el disbalance o desequilibrio de cargas positivas por alteración de las corrientes iónicas de la fase1 del potencial de acción a nivel del epicardio del miocardiocito, ya sea por disminución de las corrientes de entrada de calcio ICaL, aumento de las corrientes de salida de potasio Ito o por disminución de las corrientes de entrada de Na (trastorno más secundario a las mutaciones en SCN5A), con la consecuente pérdida del domo del potencial de acción (meseta). Esto se debe finalmente al incremento (relativo o absoluto) de las corrientes de salida Ito. Puesto que la densidad de Ito es mayor a nivel del epicardio que en el endocardio, se produce una dispersión transmural de la repolarización y la refractariedad, un gradiente transmural de voltaje, responsable del patrón ECG típico (elevación del ST). La arritmogenicidad que caracteriza al síndrome se debe al desarrollo de un mecanismo de reentrada en fase2 secundario a la heterogeneidad y dispersión de la repolarización tanto a nivel transmural como epicárdica, con una mayor vulnerabilidad en la aparición de complejos ventriculares prematuros5.
Otra hipótesis que se baraja es la relacionada con la alteración de la despolarización secundaria al retraso de la conducción a nivel del TSVD, lo que se explica por la existencia de determinadas áreas de potenciales anormales con bajo voltaje, fraccionados, de duración prolongada y electrogramas tardíos, en la región anterior epicárdica del tracto de salida del VD, algo que no ocurre ni a nivel endocárdico anterior del tracto de salida, ni en otras áreas del VD ni del ventrículo izquierdo tanto endo como epicárdicas6.
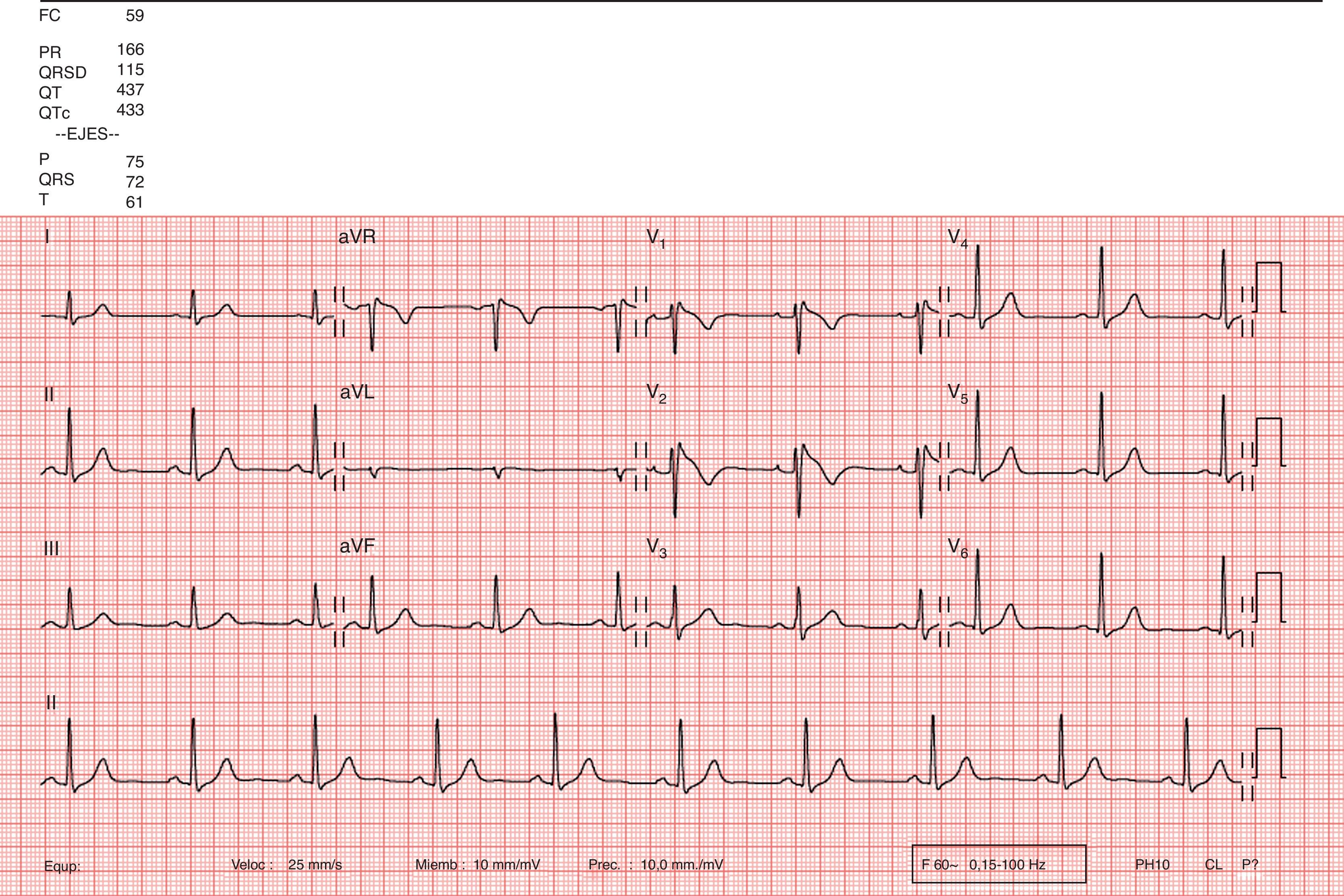
DiagnósticoEs definido inicialmente por 3 patrones ECG típicos, consistentes en una elevación cóncava del segmento ST en las precordiales derechas (V1-V3). En el tipo1 destaca la elevación convexa y descendente del segmento ST≥2mm en más de una derivación precordial derecha (V1-V3), asociado a la presencia de ondas T negativas, siendo el único en el que se considera su hallazgo en el ECG como elemento diagnóstico del síndrome de Brugada (fig. 1). En el patrón tipo2 se aprecia la elevación del segmento ST≥2mm en precordiales derechas seguida en esta ocasión de ondas T positivas o isobifásicas, por lo que se conoce como «patrón en silla de montar». El tipo3 puede presentarse como cualquiera de los 2 previos, pero en esta ocasión la elevación del segmento ST es≤1mm.
Existe un nuevo patrón electrocardiográfico, denominado patrón Brugada tipo0, el cual se caracteriza por ser un patrón tipo1 pero sin onda T negativa, definido en un modelo experimental reciente por Take et al.7. Otro hallazgo descrito en el ECG a tener en cuenta es la presencia de onda R final en aVR, con un voltaje>3mm, denominado «signo de aVR».
Cuando está presente, se relaciona con una mayor incidencia de episodios arrítmicos graves.
Poder reconocer dichas alteraciones en el ECG es de vital importancia, ya que, aunque la gran mayoría se mantienen asintomáticos durante toda su vida, el riesgo de desarrollo de arritmias ventriculares y MS secundaria se debe considerar siempre en estos pacientes5. Ha de tenerse en cuenta que, en algunas ocasiones, este patrón permanece oculto, presentándose únicamente bajo determinadas condiciones tanto fisiológicas8,9 —como son el síndrome febril, los agentes vagotónicos, las alteraciones iónicas (hiperpotasemia, hipopotasemia, hipocalemia)— como farmacológicas9 —betabloqueantes, antidepresivos tricíclicos, litio, anestésicos locales—, o bajo los efectos del alcohol y la cocaína, ya que aumentan el desequilibrio existente entre las corrientes iónicas durante la fase1 del PA descritas previamente.
Es fundamental realizar un diagnóstico diferencial4 con otras situaciones que producen alteraciones en la repolarización con patrones ECG muy similares al que nos atañe, como son bloqueo de rama derecha atípico, infarto agudo de miocardio, especialmente del VD, pericarditis/miopericarditis aguda, derrame pericárdico, intoxicación por cocaína, alcohol, tromboembolia pulmonar, aneurisma disecante de aortaI, trastornos de los sistemas nerviosos central y autonómico, distrofia muscular de Duchenne, ataxia de Friedreich, hipertrofia ventricular izquierda, displasia arritmogénica de VD, compresión mecánica del TSVD, tumor mediastínico, pectus excavatum tras cardioversión eléctrica, repolarización precoz —especialmente en atletas— e hipotermia.
La posibilidad de realización de análisis genéticos ha permitido la identificación de las mutaciones causantes del mismo. Los primeros estudios se realizaron en el gen SCN5A, concretamente en el locus del cromosoma 3p21-241,10, que codifica la trascripción de las proteínas que forman la subunidad α del canal de sodio del miocardiocito. Esto conlleva una pérdida de función del mismo con un resultado que comprende desde fallos de expresión, alteraciones del voltaje de activación hasta aceleración de la inactivación del mismo, con la consecuente disminución de las corrientes transmembrana de sodio (INa).
Desde que fue descrito, el número de mutaciones halladas en el mismo gen y relacionadas con la patogenia ha crecido exponencialmente. Los principales laboratorios de investigación en genética molecular no cesan en la descripción de nuevas aberrancias. Destacan así mismo mutaciones en otros genes como son SCN1B, relacionado también con la codificación de los canales de Na, con la consecuente pérdida de su función. Cuando se afectan los genes CACNA1C y CACNB2C, determina la pérdida de función de ICa, en cuyo caso se ha encontrado una relación con el acortamiento patológico del intervalo QT11. Otro gen descrito es el KCND3, que provoca un aumento de función en los canales de K Ito y KCNJ8 causante del aumento de función en los canales de IK-ATP. Sin embargo, existen otros muchos genes afectados con menor prevalencia en la población general9,11-14. La presencia de la gran diversidad genética que participa en la patogenia del síndrome justifica que sólo pueda identificarse la mutación causal en 20-30% de los pacientes.
Respecto a los criterios diagnósticos10 que definen el síndrome de Brugada, se resumen en: presencia de un patrón ECG tipo I (ST elevado [≥2mm] seguido de T negativa) en más de una derivación precordial derecha (V1 a V3) en presencia o ausencia de fármaco bloqueante de Na junto a uno de los siguientes factores: 1) FV o TVP documentada; 2) historia familiar de MS<45 años; 3) patrón ECG tipo1 en familiares; 4) TV inducible en EEF; 5) síncope; 6) respiración agónica nocturna.
Así mismo, en los casos en los que aparece un patrón ECG tipo 2 o 3 se debe considerar sin menosprecio la posibilidad de síndrome de Brugada siempre que cumpla los siguientes criterios: patrón ECG tipo2 o 3 en condiciones basales que se transforma a tipo1 tras la administración de fármacos bloqueadores de los canales de Na junto a al menos uno de los factores previamente mostrados.
Sin embargo, hay que tener en cuenta que la evolución ECG de patrón tipo3 a tipo2 no es concluyente para definir el síndrome de Brugada.
Debido al riesgo de MS que conlleva su diagnóstico, la idea de desenmascarar los casos en los que existe una sospecha es fundamental. Principalmente estaría indicado en los casos en que el paciente presenta datos clínicos compatibles en ausencia de un patrón ECG concluyente, ya que en determinadas ocasiones el patrón es transitorio. Contamos para ello con fármacos capaces de bloquear los canales de Na, que son de elección por su mayor efectividad y disponibilidad en el laboratorio de electrofisiología. Destacan principalmente la flecainida, la procainamida, la pilsicainida y la ajmalina, siendo esta última la que ha mostrado mayor eficacia para desenmascarar el patrón ECG tipo115, con una sensibilidad aproximada de la prueba del 80% y un valor predictivo negativo del 80% cuando el fármaco utilizado es la ajmalina. Estas cifras son mucho peores cuando utilizamos flecainida, ya que el VPN desciende hasta el 35% en distintas publicaciones16.
El estudio genético en esta patología es útil en algunas ocasiones aunque presenta ciertas limitaciones debido a la gran variabilidad genética que le caracteriza. La mayoría de los cribados genéticos estudian principalmente el gen SCN5A, que representa el 75% de los resultados positivos de dichos estudios, pero sólo el 25% de la los pacientes diagnosticados de síndrome de Brugada presentan mutaciones en este gen17. Según el último consenso publicado por la Heart Rhythm Society, el estudio genético puede ser útil para pacientes con patrón ECG tipo1 en los que se ha establecido un diagnóstico clínico de sospecha basado en la historia clínica, la historia familiar y la expresión ECG en reposo o inducida por un test farmacológico. En cambio, en los casos en los que sólo se presenta el patrón ECG tipo2 o 3 de forma aislada este no estaría indicado. En los familiares de primer grado del caso índice está recomendada la realización de un estudio genético dirigido a la mutación específicamente hallada18,19.
Estos hallazgos no aportan actualmente grandes ventajas en el pronóstico y las implicaciones terapéuticas de estos pacientes. Sin embargo, existe alguna evidencia bibliográfica en la que parecen presentar mejor pronóstico los pacientes diagnosticados de síndrome de Brugada en los que se detectan mutaciones missense en el gen SCN5A comparados con aquellos con una mutación que determina la producción de una proteína truncada, pues estos últimos se relacionan con una mayor incidencia de síncope16.
Por tanto, independientemente de la presencia o ausencia de síntomas, los individuos en los que se detecta una mutación asociada con síndrome de Brugada se les recomienda evitar todas las situaciones, fármacos o tóxicos involucrados con el desencadenamiento de episodios arrítmicos descritos para este tipo de pacientes.
Así, la presencia de mutaciones no impacta en la actitud terapéutica a seguir en el caso índice, pero se mantiene la recomendación de realizar estudios genéticos a los familiares de primer grado en los que se ha localizado el defecto genético causal en el caso índice con la intención de tomar las precauciones adecuadas en las situaciones precipitantes de episodios y continuar su seguimiento.
Estratificación de riesgoSin embargo, lo que siempre ha preocupado al cardiólogo es la actitud a seguir ante un paciente en el que sospechamos o diagnosticamos síndrome de Brugada. Se han publicado diagramas que resumen la actitud a seguir en función de los hallazgos tanto en la historia clínica como en los resultados de las pruebas complementarias dirigidas al desenmascaramiento del mismo como adyuvantes al patrón ECG espontáneo que presenta el paciente.
Clásicamente se han defendido como principales factores de riesgo de desarrollo de MS la presencia de síntomas, presentación de un patrón ECG tipo1 espontáneo, e inductividad en EEF, principalmente en varones. El antecedente de MS resucitada constituye un factor de riesgo independiente e indiscutible. Otros factores, como la presencia de FA y determinados datos del ECG, como hallazgos de la prolongación del intervalo QTc en V2, el signo aVR, la presencia de alternancia de la onda T, el patrón de repolarización en derivaciones inferiores o laterales y la anchura del complejo QRS, también se han relacionado con un peor pronóstico.
Sin embargo, ni los antecedentes familiares de MS ni la presencia de mutación en el gen SCN5A se han definido como factores de riesgo en ninguna de las grandes series descritas hasta ahora.
El papel del EEF para poder estratificar con mayor fiabilidad el riesgo de MS del paciente con diagnóstico de síndrome de Brugada sigue siendo motivo de debate, y existen opiniones a favor y otras en contra con relación al pronóstico. El principal desafío se basa en la ausencia de recomendaciones firmes sobre el manejo de pacientes que presentan patrón ECG compatible con síndrome de Brugada en ausencia de arritmias previas documentadas, es decir, pacientes en su mayoría asintomáticos. La incapacidad para presentar recomendaciones para el manejo de estos pacientes es debida a la persistente discordancia de opiniones sobre el valor de inducción de TV o FV para identificar pacientes con alto riesgo de MS y la falta de acuerdo acerca de la incidencia anual de las arritmias mortales.
Continuando las primeras directrices publicadas por los Drs. Brugada20, registros posteriores como el FINGER21, y más reciente el PRELUDE22, concluyen la incapacidad de la TV/FV inducida durante la estimulación programada en el EEF para identificar a los pacientes de mayor riesgo. Por tanto, al no añadir valor predictivo en estos pacientes, se propone una recomendación tipoIII (riesgo≥beneficio) para su realización cuando estamos ante un individuo asintomático.
Estos 2 registros mantienen como principales factores de riesgo la presencia de patrón ECG tipo1 espontáneo, historia de síncope, sobre todo cuando ambas coexisten en el mismo paciente, siendo estas las principales herramientas para considerar el implante de DAI profiláctico22.
Con respecto a la supervivencia, los datos que poseemos se deben a las series de pacientes con diagnóstico de síndrome de Brugada a los que se les ha realizado un seguimiento prospectivo. La presencia de síntomas previos y/o un patrón ECG tipo1 de forma espontánea se definen como marcadores de riesgo. En la serie publicada por Priori et al. en 2002 presentaban episodios el 6,5% de los pacientes con dichos factores de riego, con un seguimiento medio de 34±44 meses, y el 4,2% en la serie de Eckardt et al., con seguimiento de 40±50 meses. En el estudio publicado por Brugada et al. en el año 2003, en una serie de 547 pacientes con un seguimiento medio de 24±32 meses (423 asintomáticos y 124 con síncope previo; el 71,5% ECG basal tipo1 espontáneo), el 8,2% presentó un primer episodio cardiaco mayor (MS o FV documentada). Se definieron como factores de riesgo principales para el desarrollo de episodios: sexo masculino, antecedente de síncope previo, patrón ECG tipo1 espontáneo y la inducibilidad de arritmias ventriculares malignas en el EEF. En la serie publicada por Benito et al. en 2008 se presentaban datos de casi 500 pacientes en los que se observaron que los varones presentan con mayor frecuencia los otros FR que se han relacionado con mayor índice de episodios, por lo que en sus resultados mostraban que 31/272 varones (11,6%) y 3/212 mujeres (2,8%) desarrollaron episodios mayores durante un seguimiento medio de 58 meses (p=0,007)23.
ManejoAnte tales hechos, la búsqueda de un fármaco capaz de corregir las alteraciones iónicas que subyacen en dichos paciente es la principal meta a conseguir con la finalidad de evitar los casos de MS cardiaca asociada a dicha canalopatía. Por ello, la investigación del papel de la quinidina con tal fin está siendo actualmente objeto de investigación por su papel como bloqueador de la corriente de Ito, implicado en la mayor heterogeneidad de la fase1 del PA del miocardiocito que puede promover la aparición de extrasístoles ventriculares que actúan como activadores del desarrollo de TV/FV. Actualmente existen ensayos clínicos en marcha y se describen casos de su utilización para controlar las tormentas arrítmicas en pacientes portadores o no de dispositivos, aunque según las guías clínicas de la ACC/AHA/ESC 200624 la recomendación principal para el tratamiento de la misma sería con el isoproterenol.
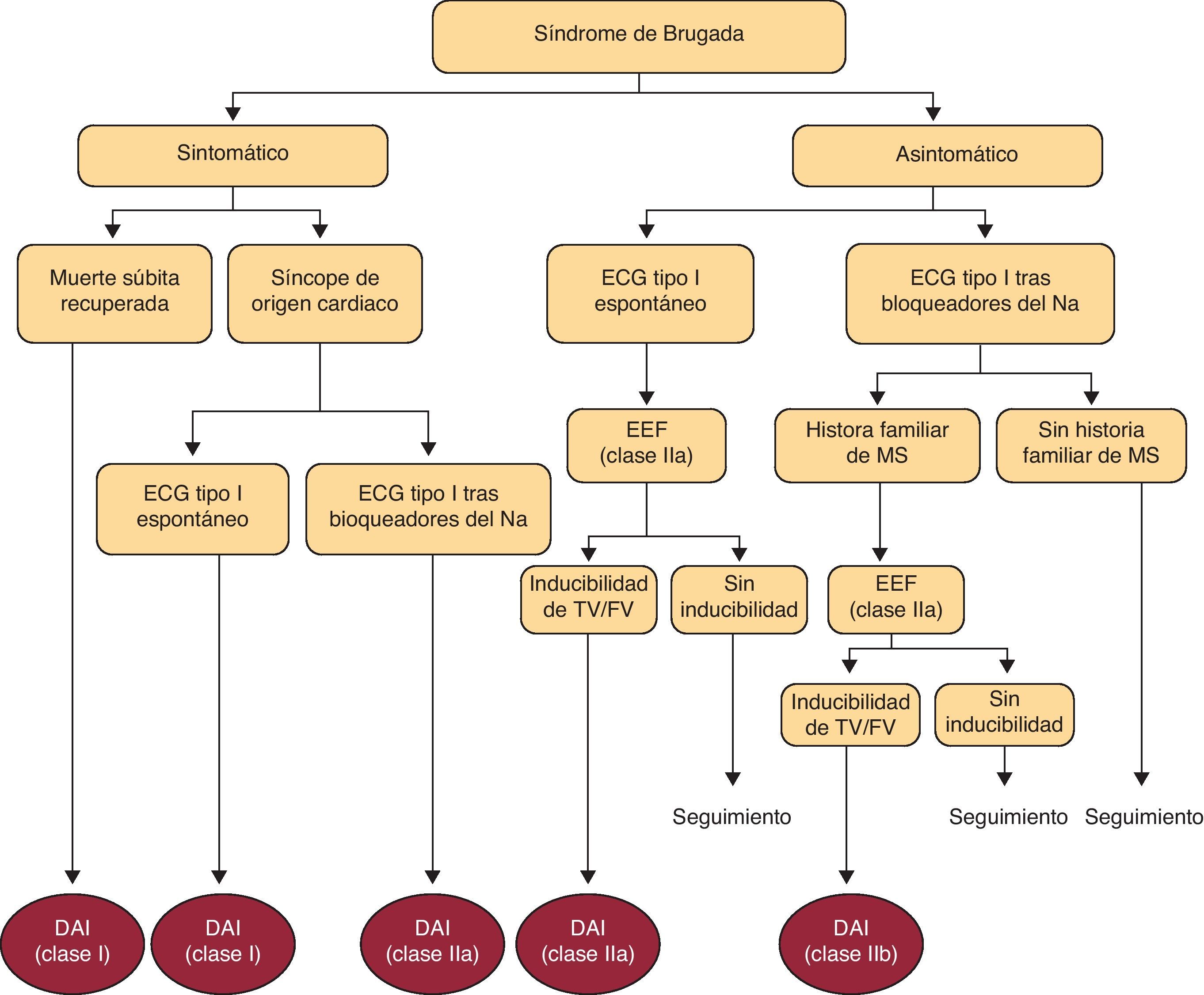
Con respecto a la implantación de DAI en estos pacientes, se han presentado directrices según el último consenso internacional de síndrome de Brugada en 200510 (fig. 2) y la revisión de la ACC/AHA/ESC en 200624, y las últimas actualizaciones de la ACC/AHA/HRS en 2008, concluyendo25,26:
- -
En los pacientes que han presentado muerte súbita resucitada existe indicación para la implantación de DAI.
- -
En los pacientes con diagnóstico de síndrome de Brugada y síncope o TV/FV documentada espontánea parece indicada la implantación de DAI, al tratarse de pacientes de alto riesgo de MS sin necesidad de realización de más estudios invasivos.
- -
En los casos en los que el individuo permanece asintomático, especialmente si presentaba patrón ECG tipo1 espontáneo o antecedentes familiares de MS o síncope, se puede plantear la realización del EEF, aunque con un bajo VPP, según muestran los últimos registros comentados22,23.
- -
En cambio, en ausencia de síntomas y de antecedentes familiares de MS, la actitud inicial sería continuar con un seguimiento estrecho del paciente sin necesidad de realizar más pruebas invasivas.
Resumen de las directrices a seguir para la implantación de desfibrilador automático implantable (DAI) en pacientes con diagnóstico de síndrome de Brugada. Tomada de Antzelevitch5.
Así mismo, en los pacientes con alta carga de episodios arrítmicos se ha propuesto la realización de ablación con radiofrecuencia en las zonas del TSVD que presentan potenciales anormales con bajo voltaje, fraccionados, de duración prolongada y electrogramas tardíos, siguiendo la teoría de la alteración de la despolarización, hasta la desaparición de los potenciales anormales o bien hasta que desapareciera el patrón espontáneo del síndrome en el ECG. Ha de tenerse en cuenta que este tratamiento se considera actualmente coadyuvante al desfibrilador en pacientes muy sintomáticos con síndrome de Brugada, puesto que los casos publicados son escasos27.
Por tanto, nos encontramos ante una patología en la que queda mucho camino por recorrer, que sigue acechándonos y mostrando la dificultad que supone encontrar en medicina la fórmula mágica para controlar los episodios derivados de «simples alteraciones» en los canales iónicos secundarias a mutaciones genéticas.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses.