La técnica de implante valvular aórtico transcatéter (que denominaremos TAVI en esta revisión) demostró ser altamente eficaz en pacientes con estenosis aórtica severa inoperables o de alto riesgo y ha tenido un crecimiento exponencial, que todavía no se ha detenido. Las circunstancias especiales o las patologías concomitantes de los pacientes han llevado al desarrollo de nuevas vías de implante para el TAVI. El objetivo de la presente revisión es presentar las diversas posibilidades técnicas de abordaje para realizar el TAVI y queremos dejar claro que en nuestra opinión la selección de la vía de abordaje debe realizarse por un grupo multidisciplinar con experiencia («heart team») en el que prime la mayor eficacia y seguridad para el paciente por encima de los intereses de una u otra especialidad.
The technique of transcatheter aortic valve implantation (TAVI which we call in this review) proved to be highly effective in patients with severe aortic stenosis inoperable or high risk and has had an exponential growth, which has not yet been stopped. Special circumstances or comorbidities of patients have led to the development of new avenues for TAVI implant. The aim of this review is to present the various technical possibilities of approach for TAVI, and we want to make it clear that in our opinion the selection of the approach should be performed by a multidisciplinary team with experience (“Heart Team”) in the that prime greater efficiency and patient safety above the interests of one or another specialty.
El primer implante percutáneo de una válvula artificial en un ser humano se realizó con una prótesis de yugular bovina en posición pulmonar y fue reportado por Bonhoeffler et al. en el 20001. Esta vía de tratamiento ofrecía un amplio panorama de posibilidades y en abril del 2002 Cribier et al.2 realizaron el primer implante de una prótesis artificial aórtica en un paciente. En la presente revisión, detallamos de forma estructurada los diferentes tipos de abordaje actualmente realizados para el implante de TAVI.
Abordaje anterógrado transeptal (transvenoso)Los primeros implantes realizados por Cribier et al. se realizaron por vía transeptal, siendo el abordaje vascular principal el de la vena femoral derecha, en el que se insertaba un introductor de 24 French (unos 8mm) de diámetro. Se realizaba una punción transeptal, a través de la cual las guías y los catéteres se deslizaban a través de la válvula aórtica nativa en sentido anterógrado. Posteriormente, se asoció un abordaje percutáneo arterial femoral para introducir en aorta un catéter Sones 7 French, que se ponía en contacto con la parte distal del dispositivo de implante de prótesis, para evitar el desplazamiento de la misma con el inflado del balón de expansión. Aunque esta vía es actualmente una curiosidad histórica, merece la pena recordarla porque nos puede ser útil para abordar un caso concreto si no disponemos de una posibilidad mejor.
Abordaje retrógrado transfemoralEs el abordaje de elección en la actualidad. El acceso transfemoral (TF) se puede realizar con anestesia local y sedación en un gran número de pacientes y permite disminuir la agresividad de la intervención y mejorar notablemente los tiempos de recuperación postimplante de los pacientes. Desde los primeros implantes descritos por Cribier, tanto las válvulas como los introductores y los dispositivos de liberación han evolucionado considerablemente, lo que nos ha permitido ampliar el número de pacientes candidatos para TAVI3,4. Dos tipos de válvulas transcatéter son las más utilizadas5 a nivel internacional para el abordaje TF: las prótesis Medtronic CoreValve, que son autoexpandibles, y las que precisan un dispositivo con balón para su implante (balón-expandibles), sistema SAPIEN de Edwards. La primera generación de Medtronic CoreValve se presentaba con un introductor de 24 French6. La primera generación de válvulas Edwards Sapien también requería dispositivos de hasta 24 French7.
Las complicaciones vasculares son frecuentes y están asociadas a un pronóstico desfavorable.
En una rama del estudio PARTNER, con válvulas de primera generación, las complicaciones vasculares mayores se presentaron en el 15,3% de los pacientes y el 11,9% de los pacientes tuvieron una complicación vascular menor. Las complicaciones vasculares mayores se asociaron con un mayor sangrado, transfusiones, fallo renal y un aumento significativo de la mortalidad8. En el estudio CHOICE9, a pesar de la selección de los pacientes, las complicaciones vasculares seguían estando en torno al 10% de los pacientes9.
Actualmente, la Medtronic CoreValve Evolut se presenta con un sistema de implante de 18 French. Según indicaciones de la compañía, la CoreValve Evolut R podría implantarse a través de arterias de diámetro>5mm en algunos tamaños de prótesis. La última generación de prótesis Edwards SAPIEN 3, más flexible y de menor perfil, permite su implantación a través de un sistema de 14 French (tamaños 23-26) que permite el acceso a través de lechos vasculares de 5,5mm. La evolución tecnológica ha sido como vemos muy importante y es de esperar que en los próximos años veamos mejoras de los diámetros y la navegabilidad de los dispositivos, lo que permitirá reducir las complicaciones vasculares.
Aunque se han reducido el número de eventos de sangrado mayor, complicaciones vasculares y traumatismo aórtico durante su paso intravascular, las complicaciones vasculares siguen siendo la principal limitación de este abordaje TF retrógrado, y en muchas ocasiones estas complicaciones se generan ya en la zona de punción si el implante es percutáneo, bien por daño arterial al pasar el sistema o por fallo de los sistemas de cierre percutáneo.
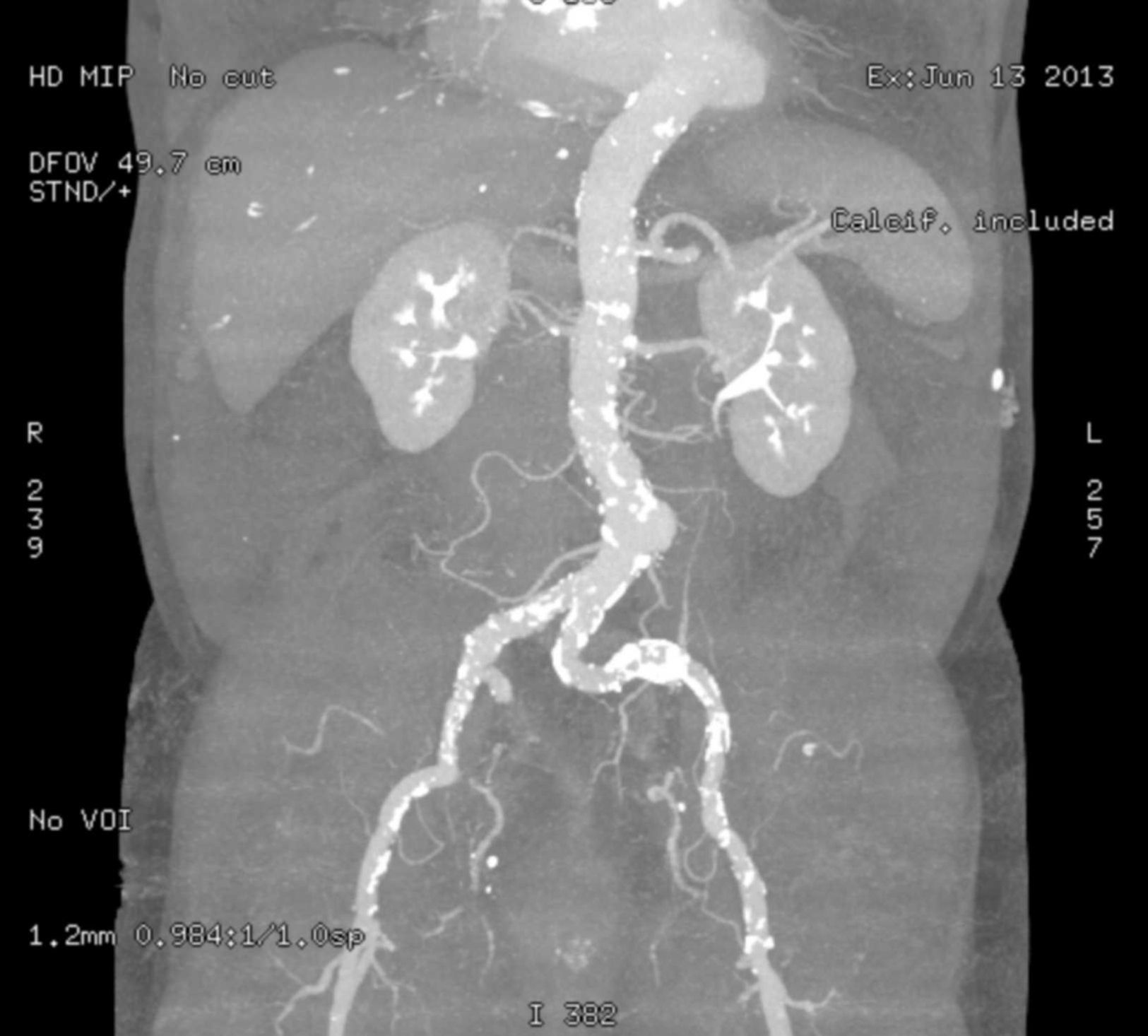
Necesitamos, por tanto, realizar un estudio exhaustivo de los diámetros, la tortuosidad y la calcificación de todo el eje vascular aorto-ilio-femoral para valorar la posibilidad de un abordaje TF satisfactorio.
Nosotros realizamos una angio-TAC toraco-abdomino-pélvica a los pacientes candidatos a TAVI con medición de los diámetros mínimos en todos los niveles para decidir la vía de abordaje. Hay que prestar especial atención no solo a los diámetros, sino a la distribución y la extensión de la calcificación del eje vascular, ya que es el único abordaje con posibilidad de embolización distal.
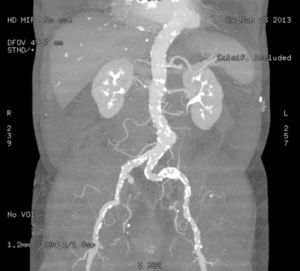
Un lecho vascular tortuoso y muy calcificado puede ser una contraindicación para el acceso femoral retrógrado (fig. 1). Los pacientes candidatos para TAVI suelen presentar una edad avanzada y comorbilidad asociada importante con riesgo considerable de presentar cierto grado de vasculopatía.
En nuestra experiencia, el abordaje con visión directa de los vasos femorales disminuye el número de complicaciones vasculares y permite solucionar de forma más rápida y sencilla estas complicaciones si se presentan. Para evitar el pinzado de la arteria femoral y la arteriotomía transversa, utilizamos un procedimiento sencillo que nos permite una hemostasia satisfactoria y con pocas complicaciones relacionadas con el abordaje arterial y que hemos reportado previamente10. Realizamos habitualmente una incisión en la piel de 4-5cm sobre el trayecto femoral común, longitudinal o paralela y por encima del pliegue inguinal, según la anatomía del paciente. Utilizamos 2 suturas de polipropileno 4-0 en U apoyadas en parches de teflón, intramurales, a ambos lados de la zona de inserción, paralelas al eje longitudinal del vaso. Ambos puntos en U serán adyacentes y tendrán una anchura que ocupe aproximadamente un cuarto de la circunferencia del vaso. Una vez efectuados, se apoyarán en sendos parches de teflón y se colocarán torniquetes. La inserción del sistema se realiza por técnica de Seldinger bajo visión directa equidistante a los pares de parches.
La extracción del introductor la realizamos tras una aortografía distal que descarte complicaciones vasculares a nivel aorto-iliaco, mediante anudado simultáneo de cada sutura en U a la vez que se retira el sistema.
La selección meticulosa y razonada de los pacientes para la vía TF por parte del «heart team» junto con la utilización de la vía abierta para el abordaje TF han hecho que las complicaciones vasculares en nuestra serie sean anecdóticas y ningún paciente ha requerido intervención en el lado del abordaje. Un paciente (cirrótico) que desarrolló un seudoaneurisma en el lado de punción contralateral al abordaje y una paciente que ha requerido revisión de la herida quirúrgica por linforragia son los únicos pacientes de nuestra serie que han requerido tratamiento quirúrgico de la complicación vascular en más de 100 abordajes TF. Los resultados obtenidos con el abordaje femoral nos permiten recomendar este acceso para todos los pacientes considerados candidatos a TAVI y que no presenten contraindicaciones claras para el mismo.
Abordaje transapicalEl abordaje transapical (TAP) es uno de los clásicos en el TAVI. Diseñado inicialmente para solucionar aquellos casos en que la vía TF no era posible, siempre se lo ha asociado a una mayor mortalidad y morbilidad que la vía TF. La vía apical se ofrecía habitualmente a pacientes con patología vascular periférica (o generalizada) severa y que en general podían tener mayor riesgo de inicio que aquellos en los que la vía TF era adecuada. Se ha indicado que, si se realiza en pacientes de riesgo similar, la vía TAP puede conseguir resultados bastante similares a la TF11,12 e incluso algunos estudios indican que podría verse favorecida en cuanto a presentar menores tasas de embolismo cerebral13. No obstante, similar no es lo mismo que igual o mejor. En un subestudio del PARTNER-I14 la vía TAP se asocia con mayor mortalidad inicial, más eventos adversos y un tiempo de recuperación más largo que en pacientes comparables intervenidos por vía TF. La vía TAP se vio favorecida en este subestudio por presentar menor regurgitación perivalvular postimplante. Por lo anteriormente expuesto, en nuestra opinión la vía TAP debería ser realizada solo si la TF no es adecuada. La vía TAP exige intubación orotraqueal y la recuperación tras la vía TF es más rápida, especialmente si se realiza con anestesia local o con otros sistemas de ventilación poco invasivos (mascarilla laríngea…)
La técnica ha sido bien descrita15,16 y se realiza a través de una minitoracotomía anterior, habitualmente a través del 6.° espacio intercostal, si bien se recomienda que la incisión se realice guiada por la zona de palpación del ápex, confirmada con ecografía o con fluoroscopia.
El campo quirúrgico debe estar dispuesto para permitir un abordaje por esternotomía si fuera necesario y las femorales accesibles para trabajar por ellas. Si bien algunos autores realizan el abordaje con intubación selectiva para poder colapsar temporalmente el pulmón izquierdo, en nuestra experiencia no ha sido necesario, aunque puede ser de ayuda en casos especiales. Tras abrir el pericardio y referenciarlo, se procede a localizar el ápex verdadero del ventrículo izquierdo, que es una zona de pared muy fina y cubierta habitualmente por una capa grasa. El ápex verdadero es muy frágil e inadecuado para el abordaje por que se desgarra con facilidad, y debe ser evitado.
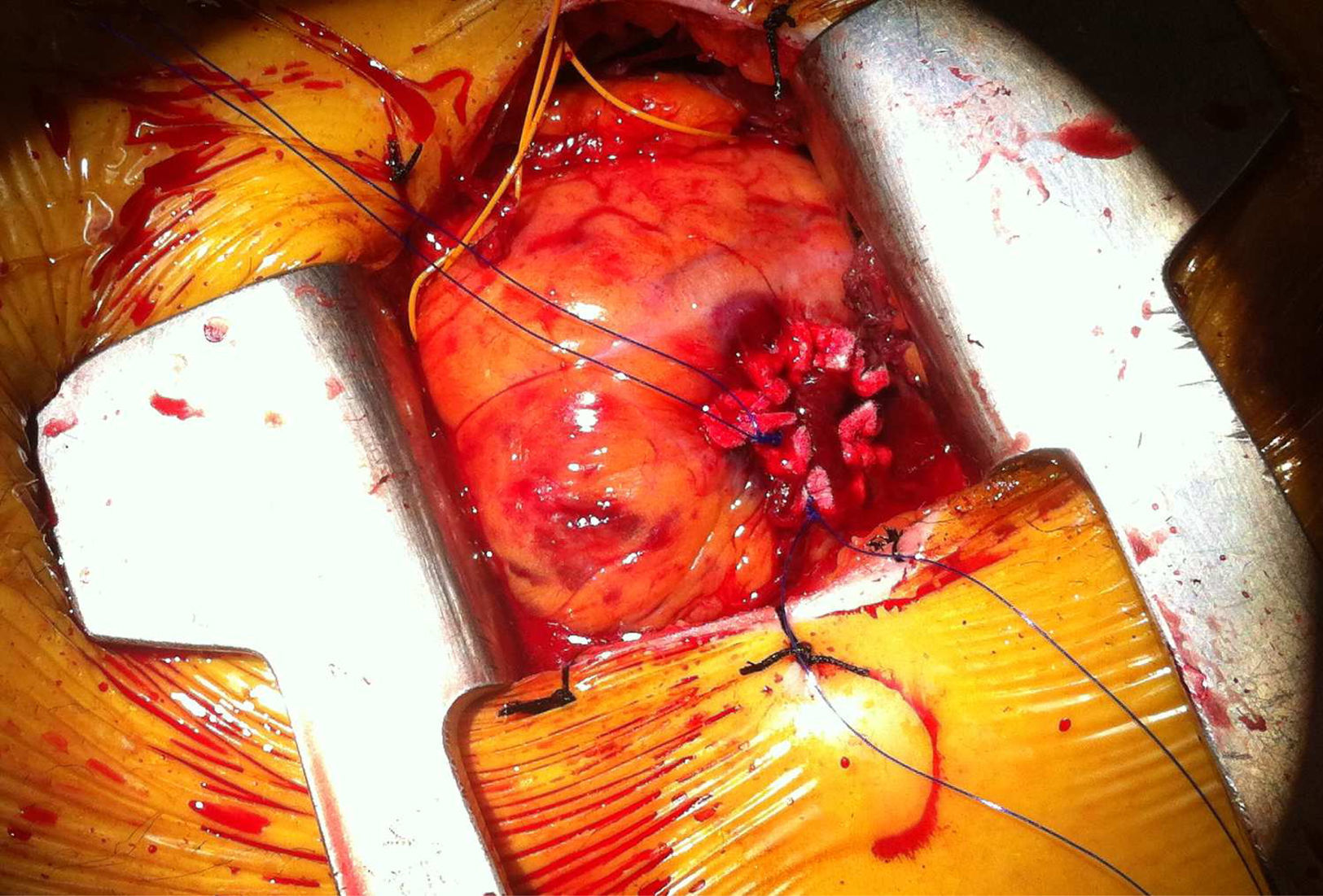
En una zona lateral y craneal al ápex verdadero, sobre tejido muscular no cubierto de grasa, se realizan a continuación 2 bolsas de tabaco (sutura de mattress ortogonal), habitualmente con polipropileno de 3/0, apoyando cada paso de aguja en un parche de teflón. La punción del centro de la bolsa, hasta alcanzar la cavidad ventricular, permite, mediante técnica de Seldinger, el paso de guías y catéteres hasta la aorta descendente. El paso de la válvula aórtica, en sentido anterógrado y por tanto a favor de flujo, es sensiblemente más fácil y rápido que en las vías retrógradas. El procedimiento a partir de este momento es similar a cualquier procedimiento de implante de una prótesis aórtica balón-expandible, y no nos vamos a extender al estar muy protocolizado y bien descrito en la literatura.
Hay que destacar el hecho de que, al ser el sistema de implante mucho más corto que en la vía TF, la prótesis tienda a desplazarse menos durante el posicionamiento y el implante, lo que puede ser la causa de que la vía TAP se asocie a menos regurgitación perivalvular que la TF.
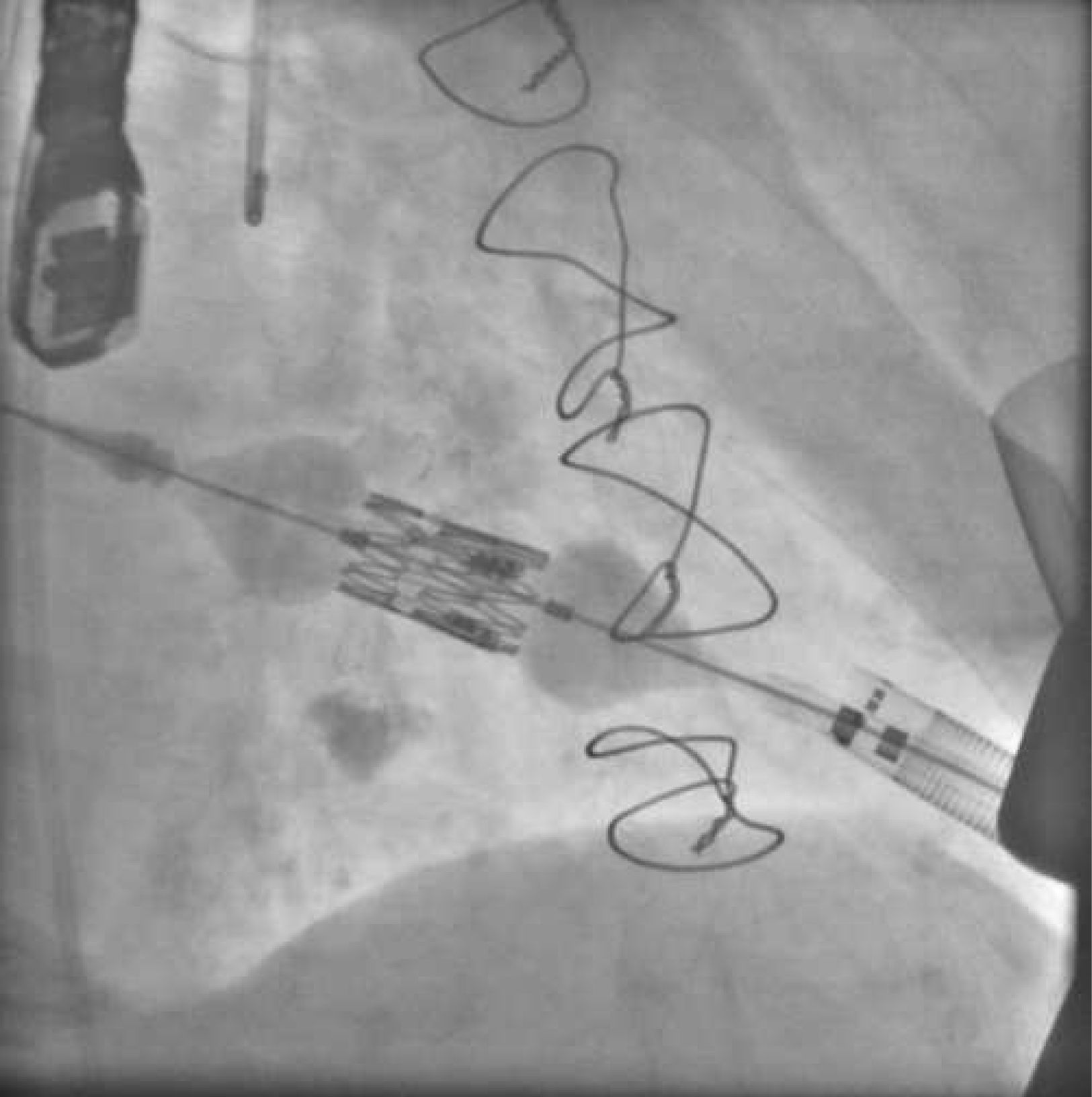
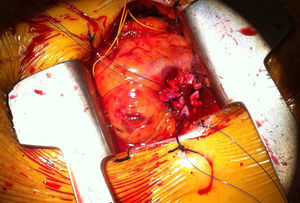
El implante se realiza bajo estimulación ventricular rápida, como en todos los procedimientos con prótesis balón-expandibles, y en este sentido en la vía TAP podemos utilizar electrodos epicárdicos izquierdos, que dejaremos exteriorizados al terminar el procedimiento, como es práctica habitual en la cirugía abierta por si se produce un bloqueo (fig. 2). Un pequeño truco que se utiliza en algunos centros, y que a nosotros nos ha sido de utilidad, es utilizar de nuevo la estimulación ventricular rápida para la retirada del introductor y el anudado de bolsas. Ello reduce la tensión de la pared en el ventrículo izquierdo en esta fase y disminuye el riesgo de desgarro de bolsas que puede ser una complicación difícil de solucionar. En general, y excepto por el riesgo de desgarro del ventrículo izquierdo, que obliga a una realización de bolsas meticulosa, el procedimiento en sí suele resultar incluso más sencillo que el implante TF en algunos aspectos: paso de la válvula, implante de electrodo para estimulación ventricular y menor tendencia a la movilización de la prótesis durante el implante.
En nuestro centro tendemos a evitar la vía TAP en pacientes respiratorios severos, si hay adherencias pleurales por cirugías torácicas izquierdas previas o en los casos de disfunción ventricular muy severa, en los que incluso la mínima disfunción producida por las bolsas en ventrículo pueda deteriorar la función de ventrículo izquierdo hasta un punto de no viabilidad. La presencia de estos factores tiende a dirigirnos a las otras vías alternativas, como la transaórtica o la transaxilar (TAX). Debemos también recordar que, en pacientes de alto riesgo, la vía TAP ha demostrado ser útil en el tratamiento de bioprótesis disfuncionantes en posición mitral17,18 mediante el implante en el interior de la misma de una prótesis TAVI. Nuestra experiencia inicial con esta indicación ha sido muy satisfactoria y creemos que es una herramienta útil que debemos tener a punto en nuestros servicios, en especial si consideramos el progresivo envejecimiento de la población.
Abordaje transaxilarEl abordaje TAX era una opción lógica en la evolución del TAVI ya que, dadas las evidentes ventajas del acceso endovascular, en determinados pacientes en los que la angio-TAC mostraba patología iliofemoral severa podían visualizarse arterias axilares relativamente sanas y, en ocasiones, con calibres adecuados para el paso de la prótesis. La arteria axilar es comúnmente utilizada en la práctica habitual de cirugía cardiaca para la canulación arterial en determinadas patologías, por ejemplo, el tratamiento quirúrgico de la disección de aorta tipo A o en la cirugía del arco aórtico. Aunque es posible utilizar tanto la arteria axilar derecha como la izquierda como vía de acceso para TAVI, se suele utilizar habitualmente la izquierda, ya que presenta mejor ángulo para avanzar el dispositivo hacia la raíz aórtica. Aunque se han descrito implantes exitosos vía TAX tanto con prótesis balón-expandibles (Edwards SAPIEN) como autoexpandibles (CoreValve), de momento solo la CoreValve ha recibido la certificación CE para este abordaje19,20.
Aunque la vía axilar se realiza habitualmente con abordaje quirúrgico, también se ha descrito con abordaje percutáneo21. En el caso del abordaje percutáneo, la complicación hemorrágica sobre una arteria difícilmente compresible por su situación anatómica puede producir una complicación vascular grave y se recomienda disponer medidas de precaución adicionales, como tener preparado una guía larga en aorta descendente. La guía puede ser dirigida al interior de la subclavia y servir de rail para colocar temporalmente un balón oclusor o dirigir un stent cubierto de tamaño adecuado para tratar la axilar dañada. En la «red de seguridad» requerida para el abordaje percutáneo, se suele añadir la canulación de la arteria radial ipsolateral para el paso y/o captura de guías si es preciso.
Aunque no requirieron de intervención quirúrgica para el control de la hemostasia, en la serie inicial un porcentaje alto de los pacientes (29%) requirieron el implante de un stent en axilar y un 8% de los pacientes presentaron un segundo procedimiento endovascular por disección o trombosis de stent. Por el contrario, el abordaje quirúrgico es sencillo y poco invasivo22, y permite un mejor control y manejo del vaso en caso de lesión. Se puede realizar con abordaje directo de la arteria controlada con torniquetes y arteriotomía directa, puncionando a través de bolsas de tabaco o anastomosando terminolateralmente un injerto de dacrón o Gore-Tex, a través del cual se introducirán las guías, los catéteres y las prótesis.
El resto del procedimiento es similar al implante de prótesis por vía TF. En nuestro centro hemos realizado en todos los casos el abordaje TAX utilizando un injerto de dacrón de 8mm anastomosado a la axilar. A pesar de que se invierte algo de tiempo en la anastomosis de la prótesis, el resto del procedimiento es muy cómodo y permite un excelente control arterial y un fácil cierre suturando el pequeño manguito residual de dacrón «a ras» de arteria al terminar la técnica. Se han aducido una serie de ventajas potenciales de la vía TAX: en los casos en que no hay abordaje femoral disponible, permite el implante de la prótesis sin realizar miniesternotomía ni minitoracotomía, lo que permite una más rápida movilización del paciente. En un paciente con patología respiratoria grave, el abordaje axilar afecta menos a la función respiratoria que la minitoracotomía.
Posiblemente también lo afecte menos que la miniesternotomía, aunque este último punto aún está por demostrar23. Se ha indicado también que el menor recorrido endovascular en este abordaje permite un mejor control del desplazamiento de la prótesis durante el implante, y una más fácil recaptura de la prótesis autoexpandible si fuese necesario. Las contraindicaciones al abordaje TAX son el calibre inadecuado, la tortuosidad excesiva o la calcificación severa del vaso.
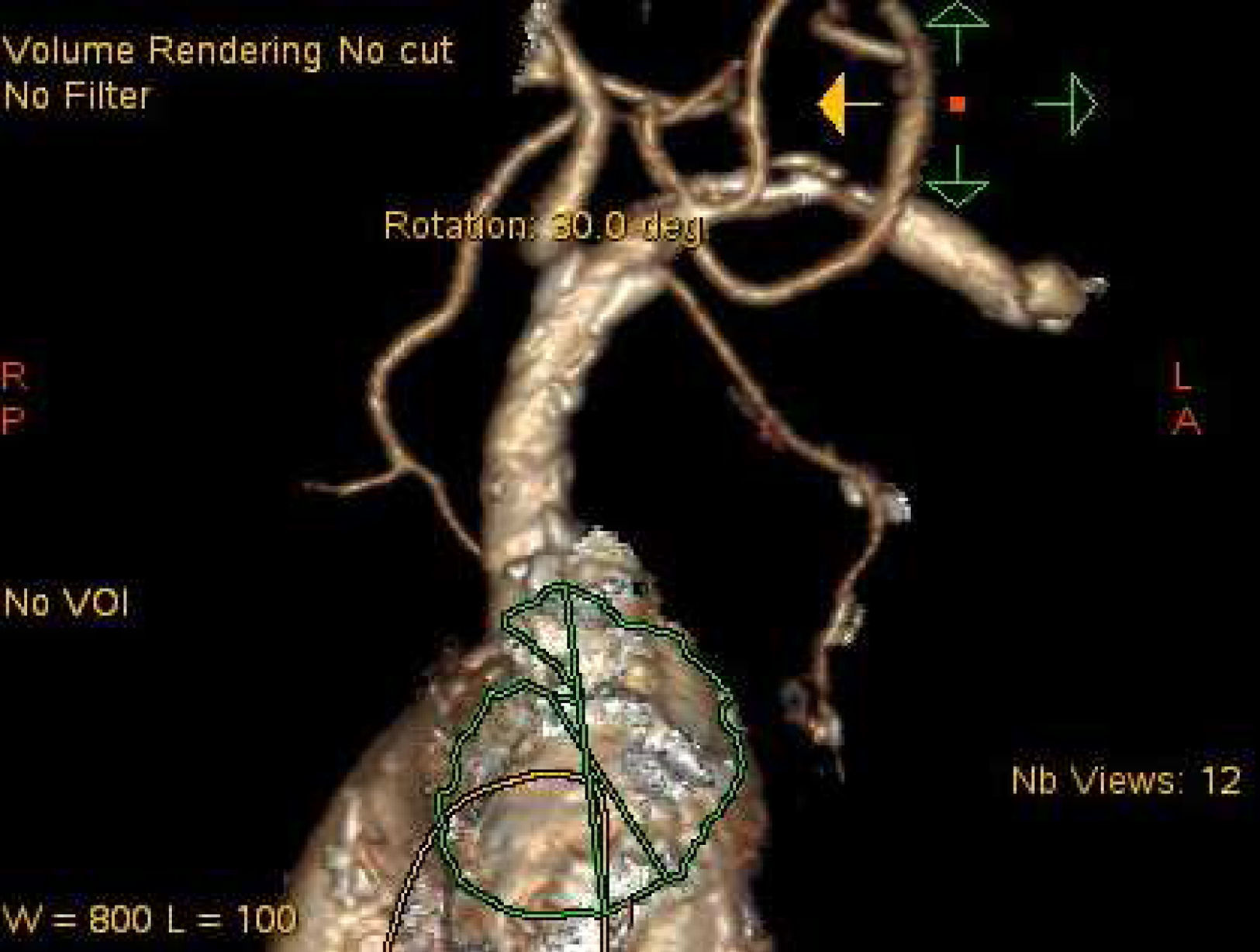
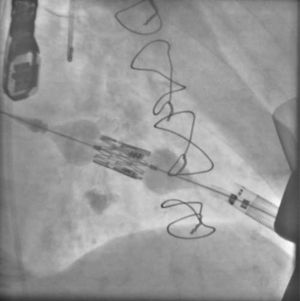
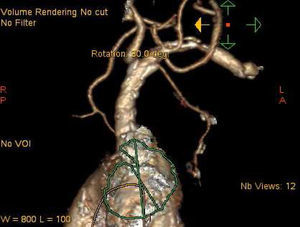
El antecedente de un pontaje permeable realizado con mamaria interna izquierda no contraindica el abordaje axilar izquierdo24, aunque en este caso concreto se deberían extremar las precauciones: en nuestra opinión, debería darse prioridad a otras vías si son adecuadas, y hay que asegurarse de que el calibre del vaso permite ampliamente el paso de la prótesis. En nuestra experiencia, hemos tenido un caso de oclusión de la axilar varios meses después del abordaje para TAVI (fig. 3), en un paciente en que se utilizó la vía axilar como último recurso. Afortunadamente, la oclusión de la axilar fue distal a la salida de la mamaria (fig. 4). La oclusión de pontajes de mamaria ha sido también reportada como complicación en la literatura25. El hecho de que en la vía TAX solo disponga de certificación CE la prótesis CoreValve puede tener, en nuestra opinión, una desventaja adicional, ya que este dispositivo se asocia a un mayor porcentaje de bloqueos cardiacos con necesidad de implante definitivo de marcapasos9,26, lo que no es una complicación banal por sus implicaciones en cuanto a costes, y lo que es más importante, calidad de vida e incluso supervivencia.
Abordaje transaórticoEl abordaje a través de la aorta ascendente (TAO) es una alternativa que ha ganado rápidamente terreno para el implante TAVI cuando la vía TF no es apta27,28. Dentro de este apartado, podemos considerar 2 opciones. El abordaje con miniesternotomía en «J» o con minitoracotomía derecha.
La miniesternotomía en «J» se ha popularizado desde hace años para el recambio valvular aórtico convencional; este abordaje es práctica habitual desde hace años en muchos centros en España29 y su uso se ha extendido al implante de TAVI si la vía TF no es adecuada30. El abordaje consiste en una incisión de pequeño tamaño, con hemiesternotomía que se abre hacia el tercer o cuarto espacio intercostal derecho, habitualmente. Permite una excelente exposición de la aorta y también de la vena cava superior y aurícula derecha. Cuando se realiza un TAVI por esta vía, el acceso del sistema se realiza a través de una doble bolsa de tabaco, similar a las de canulación convencional. Debe realizarse en una zona sana de la parte más distal de aorta ascendente, a poder ser ligeramente lateralizada hacia la curvatura mayor de la aorta para orientar mejor el introductor.
Como el sistema introductor es algo mayor que las cánulas que habitualmente empleamos, es recomendable que el cirujano que empieza a realizar esta técnica lo visualice para realizar las bolsas de un tamaño algo mayor de lo habitual, evitando excesos.
A partir de aquí, y por técnica de Seldinger, se pasan guías y catéteres, cruzando la válvula en sentido retrógrado. El resto del procedimiento es superponible a un implante por vía TF, con la ventaja de que los sistemas introductores más cortos facilitan que la prótesis no se desplace en el posicionamiento o el despliegue. Este abordaje puede utilizarse tanto con prótesis balón-expandibles como autoexpandibles.
A pesar de que resulta sencillo, este abordaje debe planificarse con meticulosidad: es conveniente comprobar que disponemos de una longitud de al menos 6cm entre la zona donde vamos a practicar las bolsas y el plano valvular. Longitudes menores pueden dar problemas de montaje y despliegue, especialmente en las prótesis de tamaño grande. La aorta ascendente debe estar libre de calcio y de placas de ateroma en la zona de manipulación. De hecho, entre las contraindicaciones de esta técnica están la ateromatosis o calcificación severa de la aorta ascendente, la dilatación significativa de aorta ascendente, la presencia de injertos aórticos coronarios de implante alto, o la presencia de injertos muy próximos o adheridos al esternón, que puedan lesionarse con la esternotomía.
En comparación a la minitoracotomía derecha, la miniesternotomía permite un mejor control de la aorta, es fácilmente convertible a esternotomía completa si surgen complicaciones y no requiere intubación con tubo de doble luz.
Respecto a la minitoracotomía derecha, es un abordaje que se ha utilizado para la cirugía de recambio valvular aórtico31,32. Se realiza habitualmente a través del segundo espacio intercostal, sin resección de costilla, aunque en ocasiones pueda ser necesario seccionar el cartílago si el abordaje no es suficiente. La técnica se ha utilizado como abordaje en el TAVI TAO con buenos resultados33,34. Si la comparamos con la miniesternotomía, el abordaje por minitoracotomía puede tener un acceso más limitado a las estructuras cardiacas en caso de complicación y requiere intubación selectiva. A su favor podría tener el evitar las complicaciones de la esternotomía. También puede permitir un mejor posicionamiento y coaxialidad del introductor del dispositivo, si el plano valvular aórtico está muy horizontalizado, o si la aorta ascendente está muy desplazada a la derecha del esternón. No obstante, si el plano valvular aórtico está extremadamente horizontalizado, ambos abordaje transaórticos están en desventaja respecto al TAP para el correcto posicionamiento y despliegue de la prótesis.
A la hora de decidir la realización del abordaje TAO (y el tipo del mismo) respecto a otras vías, la TAC puede darnos información muy precisa sobre la calidad, la posición relativa de la aorta, los injertos coronarios y la horizontalización del plano valvular35,36.
Otros abordajesEl implante de prótesis transcatéter ofrece otras posibilidades, que si bien no están tan regularizadas como las descritas previamente (y, por tanto, deben ser consideradas con precaución), pueden ser aplicadas en casos excepcionales. Así, se ha descrito el implante de TAVI a través de un abordaje carotídeo37, el implante TAO a través de un abordaje supraesternal38 o el implante de prótesis transcatéter sobre anuloplastias mitral y tricuspídea a través de una minitoracotomía anterior derecha39. Por tanto, debemos asumir que aún veremos otras posibilidades técnicas de las prótesis transcatéter para el tratamiento de la enfermedad valvular o combinaciones de las anteriores en los próximos años.
ConclusionesEl implante de prótesis transcatéter es una alternativa terapéutica en expansión. La vía TF es actualmente la de elección si es factible. En el reciente estudio PARTNER-II, algo más del 75% de los pacientes del estudio se trataron por esta vía. La progresiva mejora en la navegabilidad de los dispositivos, junto con la progresiva reducción del diámetro de los mismos, puede hacer que este porcentaje aumente en el futuro. Si la vía TF no es factible, tenemos un abanico de posibilidades, con 3 opciones claras hoy en día, la TAP, la TAX y transaórtica. Los servicios de Cirugía Cardiovascular y Hemodinámica deben estar familiarizados con todos estos abordajes.
En nuestra opinión, no hay que pensar en términos de una «opción alternativa favorita» a la TF, sino que es función del grupo multidisciplinar («heart team») realizar una valoración individualizada a cada paciente. Así, por ejemplo, la presencia de un injerto de mamaria izquierda permeable puede dar prioridad a otras vías respecto a la transaxilar, a pesar de un buen diámetro del vaso. La disfunción ventricular izquierda o la patología pulmonar severa pueden desaconsejar la vía TAP, y la presencia de patología aórtica o injertos coronarios en mala posición pueden desaconsejar la transaórtica. De hecho, en la práctica clínica podemos encontrar diversas condiciones desfavorables en un mismo caso, y deberemos optar por el «mal menor». Es necesario, con todos los datos en mano, seleccionar la mejor opción para cada paciente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.