En la miocardiopatía hipertrófica obstructiva, a la obstrucción del tracto de salida concurre, además de la hipertrofia, la insuficiencia mitral dinámica. Esta depende del movimiento sistólico anterior del velo anterior y de anomalías subvalvulares, a menudo infradetectadas.
ObjetivosResultados del tratamiento quirúrgico de la miocardiopatía hipertrófica obstructiva con abordaje sistemático del aparato subvalvular.
MétodosSe incluyeron todos los pacientes adultos intervenidos electivamente y cuyo estudio preoperatorio multimodal incluyó: ecocardiograma transtorácico y transesofágico (basal/de esfuerzo), tomografía cardíaca, resonancia magnética y estudio genético. La cirugía se realizó por abordaje transaórtico en tres pasos: miectomía septal extendida, resección de las cuerdas tendinosas aberrantes y reorientación y realineamiento posterior de los músculos papilares. Se analizaron variables demográficas, ecocardiográficas y clínicas pre y postoperatorias. Para el análisis estadístico se empleó Stata 16 (StataCorp LLC).
ResultadosDesde octubre de 2021 hasta mayo de 2023 se incluyeron 8 pacientes, 63% mujeres. Todos presentaban disnea de esfuerzo (2pacientes en clase funcionalII, 5 en claseIII y 1 en claseIV) e insuficiencia mitral significativa, debida a: movimiento sistólico anterior, anomalías subvalvulares y obstrucción dinámica, con gradiente basal mediano de 71mmHg y máximo de 103mmHg. El grosor septal medio fue de 19,8mm. Postoperatoriamente, ningún paciente presentó movimiento sistólico anterior residual ni insuficiencia mitral significativa. Ecocardiográficamente, el grosor septal mediano postintervención fue de 13,5mm, el gradiente medio de 19mmHg y el provocado de 31mmHg.
ConclusionesEl manejo quirúrgico del aparato subvalvular mitral, añadido a la miectomía extendida, permite la recuperación clínico-ecocardiográfica de la hemodinámica fisiológica.
In the hypertrophic cardiomyopathy, the outflow tract obstruction is due, in addition to the hypertrophy, to the dynamic mitral regurgitation. This depends on the anterior systolic motion of the anterior leaflet and on subvalvular anomalies, often underdetected.
ObjectivesResults of the surgical treatment of obstructive hypertrophic cardiomyopathy with a systematic subvalvular apparatus approach.
MethodsWe recruited all adults who underwent elective surgery and whose multimodal preoperative study included: transthoracic and transesophageal echocardiogram (baseline/stress), cardiac tomography, magnetic resonance imaging, and genetic study. The surgery was performed transaorticly in three steps: extended septal myectomy, resection of the aberrant chordae and posterior reorientation and realignment of the papillary muscles. Demographic, echocardiographic, and clinical pre- and postoperative variables were analyzed. Stata 16 (StataCorp LLC) was used for statistical analysis.
ResultsFrom October 2021 to May 2023, 8 patients were included, 63% women. All presented with dyspnea on exertion (2patients in functional classII, 5 in classIII, and 1 in classIV) and significant mitral regurgitation due to: anterior systolic motion, subvalvular anomalies, and dynamic obstruction, causing an average gradient at rest of 71mmHg, peak of 103mmHg. The average septal thickness was 19.8mm. Postoperatively, no patient presented anterior systolic motion or significant mitral regurgitation. Echocardiographically, the post-intervention mean septal thickness was 13.5mm, the average mean gradient was 19mmHg, and the provoked gradient was 31mmHg.
ConclusionsThe surgical management of the mitral subvalvular apparatus, added to the extended myectomy, achieves the clinical and echocardiographic recovery of physiological hemodynamics.
La miocardiopatía hipertrófica (MCH) es una de las enfermedades cardíacas hereditarias más prevalentes, y se estima que afecta a entre 1 de cada 200 y 1 de cada 500 personas en la población general1-3. Aunque el espectro de presentación genética y clínica es amplio y heterogéneo, el rasgo característico de la MCH es el engrosamiento patológico de la pared del ventrículo izquierdo en ausencia de condiciones de carga anormales4-6.
En la mayoría de los casos, la MCH puede ser paucisintomática en reposo o tener una evolución relativamente favorable. Sin embargo, esta condición puede manifestarse como muerte súbita, insuficiencia cardíaca progresiva o arritmia3.
Más de dos tercios de los pacientes con MCH presentan obstrucción del tracto de salida del ventrículo izquierdo que, en ausencia de un diagnóstico y un tratamiento adecuados, se asocia con una peor supervivencia en comparación con la MCH no obstructiva7.
A la obstrucción intraventricular suelen contribuir, por un lado, la hipertrofia, sobre todo a nivel del septo interventricular, y, por otro, la aparición de insuficiencia mitral con el esfuerzo2. Esta última suele depender de la presencia de movimiento sistólico anterior (SAM) mitral y de anomalías morfológica a nivel del aparato subvalvular mitral y de los músculos papilares1,8-10.
La cirugía está indicada en aquellos pacientes con severa obstrucción del tracto de salida que continúan siendo sintomáticos y obstructivos a pesar del tratamiento médico óptimo3.
El remodelado ventricular quirúrgico tiene como objetivo último aliviar la obstrucción dinámica a nivel del tracto de salida. A tal propósito, además de la reducción de la hipertrofia del septo interventricular, resulta fundamental enfocar la intervención hacia la completa reinstauración de las correctas relaciones del aparato valvular y subvalvular mitral7,9,11.
En respuesta a la creciente necesidad de más centros de excelencia de MCH en España, desarrollamos un programa dedicado, liderado por el Valley Hospital-Cleveland Clinic, centro de referencia para esta patología en Estados Unidos.
Presentamos los resultados de los pacientes intervenidos en las fases iniciales del programa.
MétodosSe incluyeron en el estudio todos los pacientes adultos con MCH obstructiva y sintomática, pese a tratamiento médico óptimo, intervenidos de forma electiva desde octubre de 2021 hasta mayo de 2023 en los dos centros participantes en el programa.
El estudio preoperatorio incluyó, además del protocolo estándar, la realización de ecocardiograma transtorácico (ETT) basal y con ejercicio, tomografía cardíaca computarizada (TC) sincronizada, resonancia magnética (RM) cardíaca, así como un ecocardiograma transesofágico (ETE) pre e intraoperatorio (realizado con EPIC CVx-3D, Philips, Países Bajos) con provocación farmacológica con nitroglicerina intravenosa e isoprenalina.
Las imágenes obtenidas con las diferentes técnicas fueron procesadas con softwares dedicados (QLAb version 9.0, 3DQ Advanced Software, Philips,Países Bajos, y TomTec 4DLV versión 4.1; TomTec, Alemania) para obtener reconstrucciones multiplanares.
Además de las pruebas de imagen mencionadas y del preoperatorio estándar, en todos los pacientes se realizó un estudio genético para identificar la eventual presencia de una de las más de 1.500 mutaciones conocidas relacionadas con la MCH12.
Respecto a la técnica quirúrgica adoptada, todas las intervenciones requirieron esternotomía media y circulación extracorpórea por canulación convencional central en régimen de normotermia. Tras el pinzamiento aórtico y la administración de cardioplejía cristaloide por vía anterógrada, se realizó una aortotomía transversa según técnica estándar. Se expuso la cavidad intraventricular con tres puntos de tracción anclados a nivel de las comisuras de la válvula aórtica, con especial atención en el manejo cuidadoso de los tejidos valvulares aórticos para evitar lesiones.
Con la ayuda de un separador aórtico plano maleable colocado a nivel del seno coronario derecho, se expuso el septo interventricular. Tras optimizar la visión del operador, se procedió a realizar el abordaje en tres pasos:
- 1.
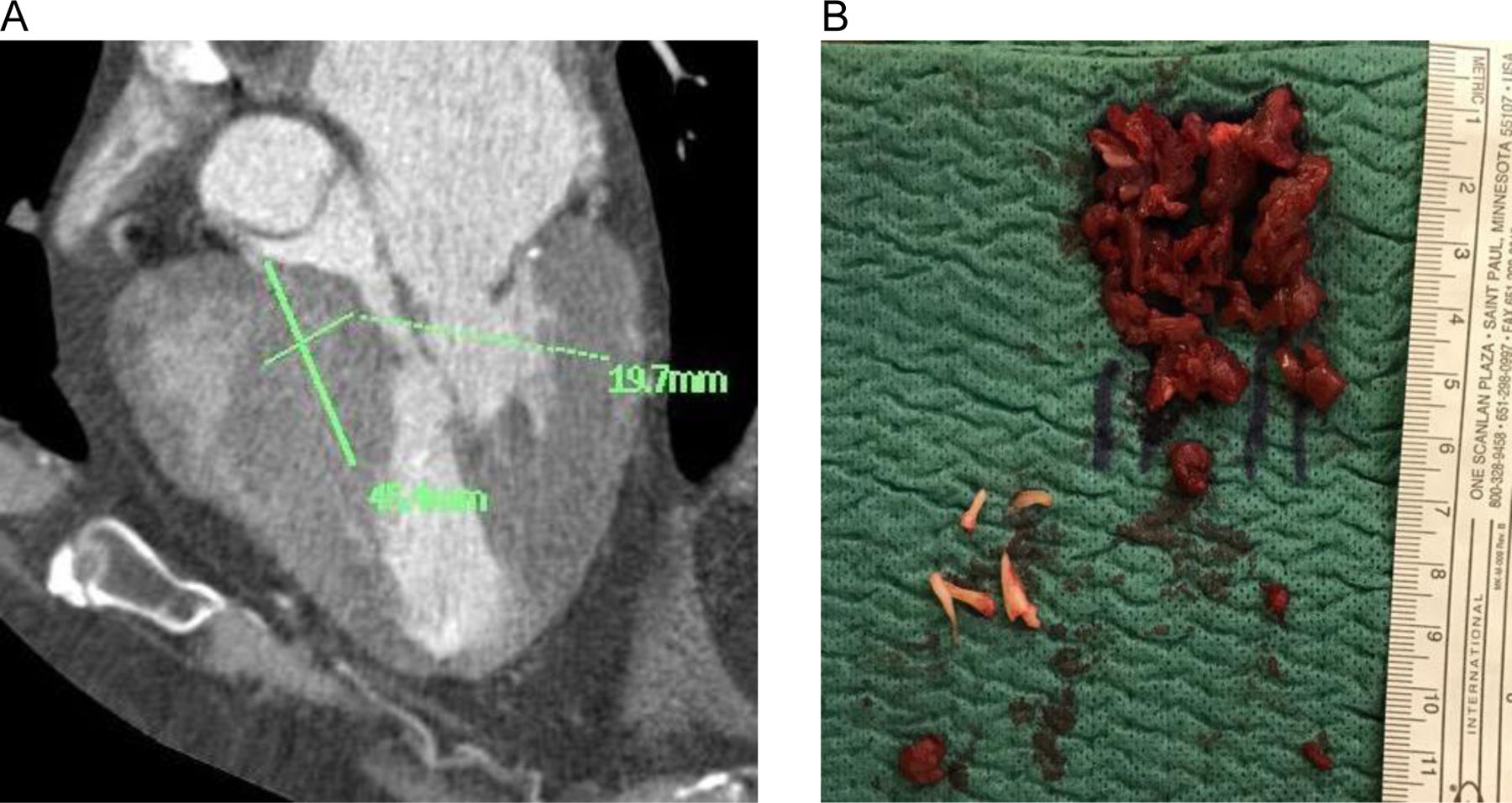
Miectomía septal extendida. Se trata de una miectomía realizada con corte frío según técnica convencional y extendida en sentido craneocaudal hasta las porciones medias del septo o, en casos específicos, hasta la base de implantación de los músculos papilares, procurando mantener un espesor mínimo de seguridad de 10mm para evitar el riesgo de complicación iatrogénica a nivel del septo interventricular. De esta forma, se consigue redirigir parcialmente el flujo hacia la pared anterior2,13. La extensión de la miectomía en términos de longitud y espesor (en mm) se decidió en cada caso en función del estudio de imagen multimodal preoperatorio, sobre todo haciendo referencia a las reconstrucciones 3D y a las mediciones obtenidas en la TC y la RM (fig. 1).
- 2.
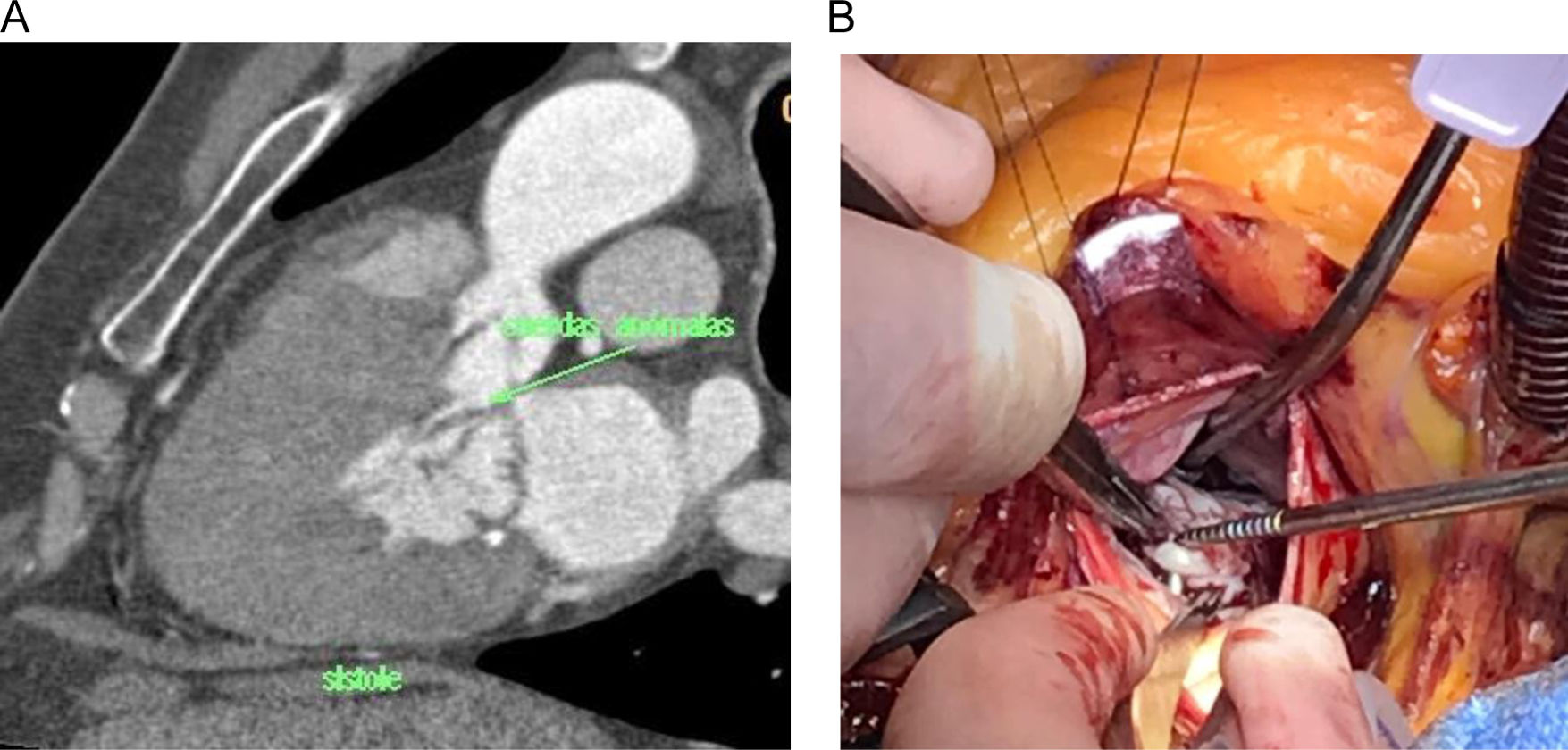
Resección de cuerdas tendinosas aberrantes. Entre las anomalías subvalvulares reportadas en MCH se incluyen cuerdas tendinosas anormales por inserción y/o tamaño. Se trata de conexiones fibrosas, a menudo de espesor/longitud anómalos, dirigidas hacia el septo o la pared libre del ventrículo izquierdo y ancladas a segmentos del velo anterior mitral distintos del borde libre10. La detección y la división con corte frío de estas cuerdas anómalas son de fundamental importancia para liberar el velo anterior y permitir el desplazamiento en sentido posterior de la superficie de coaptación mitral, reduciendo de esta forma el SAM. Las cuerdas anómalas se identificaron en el estudio multimodal preoperatorio y se resecaron por completo intraoperatoriamente tras un examen exhaustivo de las inserciones a nivel del velo anterior y distales (fig. 2).
- 3.
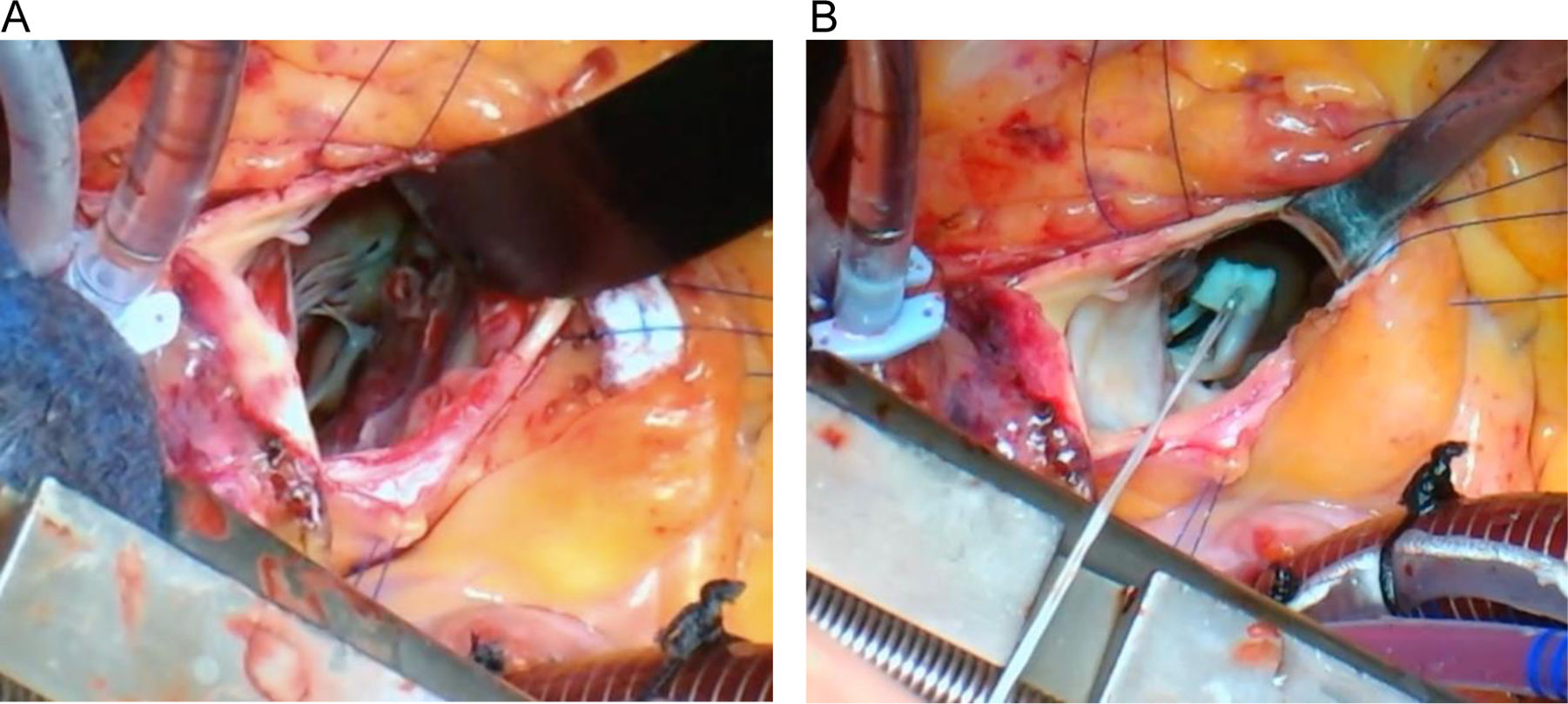
Reorientación de músculos papilares. El objetivo de este paso es conseguir el desplazamiento hacia posterior de la superficie de coaptación mitral. Al coaptar en un punto más lejano al septo, se reduce la posibilidad de que el velo anterior se desplace hacia el tracto de salida durante la contracción sistólica. La reorientación de la superficie de coaptación se obtuvo gracias al realineamiento en sentido posterior de los músculos papilares mediante una sutura no reabsorbibles de PTFE 4/0 apoyadas en 2 pledgets de 7mm. Se pasaron ambas agujas a través de todas las cabezas de ambos músculos papilares. En caso de observar posible fragilidad tisular (cabezas de pequeño tamaño, bífidas), se optó por atravesar con las agujas solo la cabeza más anterior y la más posterior, rodeando el resto. Durante la colocación de este punto se extremaron las precauciones para no interferir con ninguna cuerda tendinosa y se anudó ejerciendo la mínima tensión necesaria para aproximar entre ellos los papilares, sin estrangular ni seccionar las cabezas musculares2,6,8 (fig. 3).
Tras realizar los tres pasos de la técnica, se procedió al cierre de la aortotomía y a la desconexión de la circulación extracorpórea según técnica estándar.
El resultado de la operación se analizó con ETE intraoperatorio, incluyendo provocación farmacológica.
Los datos relativos a las variables preoperatorias, intraoperatorias y postoperatorias proceden de la base de datos específica para la especialidad, el Sistema de Información de Cirugía Cardio-vascular Sorín (SICCS). Este registro, aprobado por Orden Foral en 2014, consiste en un paquete de software que garantiza el almacenamiento y la extracción de la información de-identificada con el fin de someterla a análisis estadísticos más completos y complejos con programas estadísticos específicos.
La estadística descriptiva fue realizada con Stata 16 (StataCorp. 2019. Stata Statistical Software: Release 16. College Station, TX: StataCorp LLC).
Consideraciones éticasEl presente estudio ha sido aprobado por el Comité Ético del Hospital Universitario de Navarra con el número 55-2018. Además, los pacientes incluidos han firmado un consentimiento informado individual.
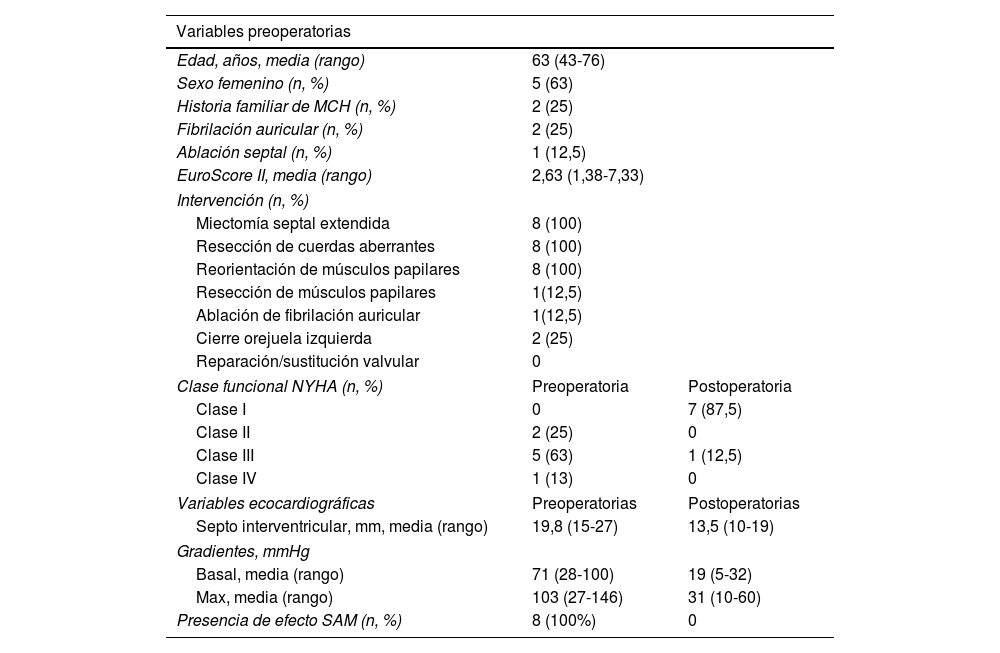
ResultadosLos resultados se resumen en la tabla 1.
Resultados
| Variables preoperatorias | ||
|---|---|---|
| Edad, años, media (rango) | 63 (43-76) | |
| Sexo femenino (n, %) | 5 (63) | |
| Historia familiar de MCH (n, %) | 2 (25) | |
| Fibrilación auricular (n, %) | 2 (25) | |
| Ablación septal (n, %) | 1 (12,5) | |
| EuroScore II, media (rango) | 2,63 (1,38-7,33) | |
| Intervención (n, %) | ||
| Miectomía septal extendida | 8 (100) | |
| Resección de cuerdas aberrantes | 8 (100) | |
| Reorientación de músculos papilares | 8 (100) | |
| Resección de músculos papilares | 1(12,5) | |
| Ablación de fibrilación auricular | 1(12,5) | |
| Cierre orejuela izquierda | 2 (25) | |
| Reparación/sustitución valvular | 0 | |
| Clase funcional NYHA (n, %) | Preoperatoria | Postoperatoria |
| Clase I | 0 | 7 (87,5) |
| Clase II | 2 (25) | 0 |
| Clase III | 5 (63) | 1 (12,5) |
| Clase IV | 1 (13) | 0 |
| Variables ecocardiográficas | Preoperatorias | Postoperatorias |
| Septo interventricular, mm, media (rango) | 19,8 (15-27) | 13,5 (10-19) |
| Gradientes, mmHg | ||
| Basal, media (rango) | 71 (28-100) | 19 (5-32) |
| Max, media (rango) | 103 (27-146) | 31 (10-60) |
| Presencia de efecto SAM (n, %) | 8 (100%) | 0 |
Ocho pacientes adultos, con una edad media 63años (mín. 43; máx. 76), fueron intervenidos durante el periodo de estudio. El 63% de los pacientes (n=5) eran mujeres.
El 25% de la muestra presentaba historia familiar de MCH (n=2).
El estudio genético encontró mutaciones conocidas en dos pacientes, concretamente evidenció en un paciente la variante MYBPC3/p.Arg891Alafs*160 y otro presentó heterocigosis Arg243Cys (c.727C>T) en el gen MYH7.
Dos pacientes estaban en fibrilación auricular permanente, mientras que el resto se encontraba en ritmo sinusal. Un solo paciente había recibido una ablación septal previa.
El riesgo quirúrgico se calculó usando el EuroscoreII.
Respecto a la situación clínica preoperatoria, dos pacientes estaban en clase funcionalII de la New York Heart Association (NYHA), 5 en clase funcionalIII y una paciente presentaba disnea en reposo.
En la ETT basal, solo un paciente no presentaba insuficiencia mitral, mientras 4 pacientes presentaban regurgitación gradoIII/IV y 3 pacientes gradoIV/IV. Todos los pacientes presentaban obstrucción en el tracto de salida, con gradiente basal medio de 71mmHg (mín. 28mmHg; máx. 100mmHg).
En la ecocardiografía de estrés, todos los pacientes presentaban aparición o empeoramiento de la insuficiencia mitral, debida al efecto SAM.
En el ETE preoperatorio no se evidenciaron anomalías estructurales de los velos mitrales, como calcificaciones, perforaciones o retracciones. Asimismo, no se evidenció en ningún paciente dilatación anular u otra causa de insuficiencia mitral orgánica. Tras el examen morfofuncional basal, se observó el gradiente obstructivo bajo provocación farmacológica, con gradiente máximo provocado de 103mmHg (mín. 27mmHg; máx. 146mmHg). El grosor septal medio resultó de 19,8mm (mín. 15mm; máx. 27mm).
El estudio multimodal con TC y RM permitió reconstrucciones 3D de la arquitectura ventricular y la detección de anomalías del aparato mitral, como cuerdas aberrantes y desplazamiento hacia anterior de los papilares.
En particular, gracias a la resolución espacial de estas técnicas, se analizaron en detalle la distribución y la extensión de la hipertrofia en cada paciente, sobre todo en referencia a la medición de la afectación septal en sentido longitudinal (mm). Todos los pacientes presentaban hipertrofia septal tanto del segmento basal como del segmento medio. Un paciente presentaba, además, extensión de la hipertrofia hasta los segmentos apicales.
En todos los pacientes se encontraron cuerdas aberrantes con inserción en la porción media del velo anterior mitral y anclaje a nivel del septo o de la pared libre del ventrículo izquierdo.
Concretamente, 3 pacientes presentaron una cuerda aberrante única, 2 presentaron 2cuerdas anómalas, uno presentó 3cuerdas anómalas, un paciente presentó 4, y un paciente presentó 6 cuerdas anómalas.
En todas las intervenciones se trató tanto la hipertrofia como las anomalías subvalvulares mitrales.
Adicionalmente, en 2 pacientes se realizó el cierre de orejuela izquierda con dispositivo de exclusión externo, y un paciente recibió crioablación de las venas pulmonares.
En ningún caso fue necesaria la reparación o sustitución mitral, ni se evidenciaron lesiones iatrogénicas de la válvula aórtica.
Respecto a los resultados del remodelado quirúrgico, en el control intraoperatorio transesofágico tras la desconexión de la circulación extracorpórea, se evidenció gradiente provocado medio de 31mmHg (mín. 10mmHg; máx. 60mmHg), y ningún paciente presentó insuficiencia mitral residual más que trivial.
En los 8 pacientes se apreció, además, desplazamiento de la superficie de coaptación mitral hacia posterior respecto al preoperatorio.
En ningún paciente se evidenció persistencia de SAM bajo provocación farmacológica.
En el control ecocardiográfico transtorácico prealta se evidenció grosor septal medio de 13,5mm (mín. 10mm; máx. 19mm) y gradiente intraventricular basal medio de 19mmHg (mín. 5mmHg; máx. 32mmHg). En 7 pacientes se evidenció insuficiencia mitral residualI/IV, y en una paciente, II/IV; ningún paciente presentó SAM residual.
Respecto a las complicaciones postoperatorias, un paciente requirió la implantación de un marcapasos definitivo, mientras que 5 pacientes presentaron un episodio de fibrilación auricular postoperatoria, que fue tratada farmacológicamente con reversión a ritmo sinusal.
Una paciente falleció durante el ingreso a los 3meses de la intervención debido a insuficiencia respiratoria refractaria y secuelas neurológicas post status epiléptico presentado en el postoperatorio precoz. Se realizaron TC craneales seriadas en las que no se evidenciaron signos de patología aguda isquémico-hemorrágica. En la revisión de la morbimortalidad, la evolución desfavorable se atribuyó a la infraestimación de la fragilidad preoperatoria y de la enfermedad respiratoria obstructiva crónica de base.
El seguimiento medio de los pacientes a fines del presente estudio fue de 1,01años (mín. 0,01; máx. 3,04), aunque todos los pacientes intervenidos siguen controles regulares en la Unidad de Miocardiopatías del Hospital Universitario de Navarra y de la Clínica Universidad de Navarra.
El protocolo de seguimiento de los pacientes operados incluye visitas tanto telefónicas como presenciales con valoración clínica y de imagen mediante ETT y TC al año, cribado de los familiares de primer grado y reevaluación del riesgo de muerte súbita con Holter y RM.
El protocolo de seguimiento de los pacientes con MCH sin criterio de intervención prevé ETT basal y de esfuerzo anual, así como Holter y RM periódica, cuya cadencia depende de la edad y del riesgo de muerte súbita.
A día de hoy, los 7 pacientes vivos incluidos en esta serie se mantienen en CFI y sin reaparición de obstrucción.
DiscusiónLos pacientes con MCH sin obstrucción presentan, a menudo, una esperanza de vida normal, sin repercusiones generalmente en términos de sintomatología o eventos adversos. Probablemente debido a esto, durante muchos años la MCH se ha considerado una enfermedad rara y poco común. Sin embargo, los avances en las herramientas diagnósticas y el creciente conocimiento sobre la patología revelan, por el contrario, que la MCH es una condición relativamente habitual dentro de las cardiopatías hereditarias, y sus implicaciones en términos de riesgo de muerte súbita o presentación arrítmica hacen de vital importancia la detección precoz del patrón obstructivo y un exhaustivo conocimiento de las estrategias de tratamiento10,13.
Muchos pacientes experimentan una mejoría de la obstrucción y una remisión de los síntomas tras las modificaciones del estilo de vida y la instauración del tratamiento médico adecuado, que se basa principalmente en betabloqueantes y antagonistas de los canales del calcio10.
Sin embargo, el tratamiento convencional, además de no ser curativo, implica para el paciente asumir de por vida cierta restricción de actividades de intenso esfuerzo isométrico y los posibles efectos adversos y limitaciones del uso del tratamiento farmacológico (como, por ejemplo, el problema de la tolerancia individual a la titulación). La entrada de nuevas moléculas prometedoras en el arsenal de herramientas a disposición del clínico para controlar e incluso revertir la hipertrofia puede ofrecer una solución para aquellos pacientes cuya obstrucción dependa mayoritariamente de la aceleración en el tracto de salida debida a la hipertrofia. Sin embargo, además del coste, de la disponibilidad y de los interrogantes sobre los resultados y los efectos adversos a largo plazo, los inhibidores de la miosina no constituyen una herramienta terapéutica frente las alteraciones anatómico-funcionales de tejidos no musculares10,13-15.
La opción de la ablación septal percutánea, si bien puede constituir una solución menos invasiva válida para pacientes seleccionados, presenta varias limitaciones, debidas a la experiencia del centro y a la técnica en sí. Esta, de hecho, no permite abordar los segmentos medio-apicales, ni corregir alteraciones valvulares o subvalvulares10,15.
El tratamiento quirúrgico, en cambio, ofrece excelentes resultados a largo plazo y bajo riesgo quirúrgico cuando se realiza en centros experimentados16.
Para garantizar el mejor de los resultados es esencial un estudio preoperatorio exhaustivo que identifique las causas de la obstrucción y de la insuficiencia mitral. La presencia de anomalías en las cuerdas o en los músculos papilares, así como el punto de coaptación de los velos respecto al septo, son elementos que deben ser atentamente analizados para permitir un abordaje integral4,11.
El remodelado ventricular quirúrgico, a diferencia de la idea generalmente asociada al término de miectomía, no está exclusivamente focalizado en la reducción del espesor septal, ya que la complejidad de las relaciones espaciales entre los elementos musculares y valvulares podría, en parte, justificar la persistencia de obstrucción tras la miectomía aislada4,8-10,13.
La técnica descrita por Morrow en 1968 preveía exclusivamente la resección de la porción basal subaórtica del septo. Al incrementar el diámetro del tracto de salida, se auspiciaba una disminución de la velocidad y, con ello, de la fuerza de atracción del velo anterior debido al efecto Venturi, que se consideraba en ese entonces la principal causa del SAM. De esta forma, sin embargo, se consigue solo un alivio parcial de la obstrucción, por lo que nuestra preferencia es extender la miectomía hasta las porciones medias del septo o, en casos específicos, hasta la base de implantación de los papilares, manteniendo siempre un espesor septal mínimo de al menos 10mm10.
Además del engrosamiento septal, uno de los mecanismos que contribuyen al SAM es la presencia de anomalías valvulares o subvalvulares. Los velos mitrales son habitualmente más redundantes, y los papilares pueden estar desplazados anteriormente, presentar hipermovilidad o tener cabezas bífidas8,10,11.
Debido a estos factores, la superficie de coaptación mitral suele estar desplazada hacia el septo, y la falta de corrección de estas alteraciones se traduce en la persistencia de causantes físicos del efecto SAM y, consecuentemente, de la obstrucción17.
El estudio preoperatorio multimodal realizado de forma sistemática en todos los pacientes de la serie ha permitido identificar, y consecuentemente corregir durante la intervención, todos los componentes de la obstrucción.
Previamente, en los escasos pacientes obstructivos aceptados para tratamiento invasivo, las técnicas empleadas consistían principalmente en abordar el músculo hipertrófico, y la evaluación del resultado no se realizaba de forma sistemática incluyendo el test de provocación. Estos factores pueden, en parte, explicar la persistencia de diferentes grados de patrón obstructivo y/o síntomas.
Por el contrario, bajo la tutorización telemática y presencial (desde el diagnóstico hasta la cirugía y el seguimiento) de los profesionales de una institución con amplia casuística sobre MCH, se ha podido crear en nuestra área una unidad multidisciplinar con procesos de diagnóstico, tratamiento y seguimiento protocolizados y reproducibles.
Al mismo tiempo, este canal de cooperación y formación ha permitido además el desarrollo de los profesionales involucrados.
El remodelado ventricular quirúrgico representa el gold standard en el tratamiento invasivo de la MCH obstructiva en pacientes refractarios a tratamiento médico óptimo18,19, y, en nuestra experiencia inicial, ha permitido una efectiva corrección de la obstrucción intraventricular y una reversión fiable de los síntomas en la mayor parte de los pacientes.
LimitacionesEl estudio propuesto presenta una serie de limitaciones.
En primer lugar, tiene todas las limitaciones inherentes al diseño observacional, como la imposibilidad de establecer relaciones causales.
La segunda limitación más importante es el número reducido de sujetos. Esto, por un lado, posiblemente impida llegar a conclusiones sólidas y, por el otro, implica que incluso pequeñas diferencias pueden tener un impacto considerable sobre los resultados. No obstante, consideramos que uno de los grandes problemas a la hora de enfrentarse a la MCH es la escasez de evidencia, y el proyecto presentado responde a la necesidad creciente de especialización en el diagnóstico y en el manejo, tanto clínico como quirúrgico, de esta patología. Iniciar un programa específico ha permitido protocolizar el proceso diagnóstico-terapéutico en nuestra área y ha promovido la creación de un grupo de trabajo dedicado que, a día de hoy, constituye una red de referencia para los clínicos.
No consideramos que sea una limitación la procedencia de los pacientes de dos hospitales diferentes, debido a que, en el Área del Corazón, las dos instituciones tienen circuitos establecidos de pacientes, también facilitados por la contigüidad de las infraestructuras. Los pacientes con MCH son discutidos en sesiones periódicas presenciales y telemáticas que incluyen los profesionales de ambas instituciones españolas, así como los compañeros de Estados Unidos; los protocolos de diagnóstico, así como las pautas de tratamiento, son consensuados y el personal implicado en las diferentes etapas del proceso es también compartido.
ConclusiónEn nuestra experiencia inicial, el tratamiento invasivo de la MCH obstructiva, cuando se realiza de forma sistemática y abordando, además de la hipertrofia, todos los factores implicados en la génesis de la obstrucción, permite la recuperación ecocardiográfica y clínica de la hemodinámica fisiológica.
FinanciaciónNinguna.
El presente trabajo ha sido presentado en el XVII Congreso de la Sociedad Española de Cirugía Cardiovascular y Endovascular.