La reparación del arco aórtico mediante prótesis híbridas, técnica denominada trompa de elefante congelada, constituye el patrón oro del tratamiento de los aneurismas extensos del arco y aorta torácica. Con las técnicas actuales de circulación extracorpórea y perfusión de órganos, es posible realizar este procedimiento manteniendo la perfusión cerebral, distal e incluso coronaria; de este modo se evita la isquemia miocárdica y la cirugía se puede realizar con menor grado de hipotermia o incluso en normotermia, al mantener la perfusión sistémica sin realizar parada circulatoria.
Objetivo y métodosExperiencia inicial en 2 casos con la técnica de trompa de elefante congelada a corazón latiendo, con descripción de la técnica quirúrgica y circuito de perfusión empleados.
ResultadosAmbos casos presentaron una evolución favorable, sin desarrollar bajo gasto cardíaco y sin complicaciones neurológicas salvo parálisis recurrencial en un caso.
ConclusionesLa trompa de elefante congelada a corazón latiendo permite el tratamiento integral de los aneurismas extensos del arco y aorta torácica, con menor daño miocárdico y muy bajo riesgo de complicaciones neurológicas, medulares, renales y viscerales.
Aortic arch repair with hybrid prosthesis, also known as frozen elephant trunk technique, is considered the gold standard treatment for extensive arch and thoracic aortic aneurysms. By using current extracorporeal circulation as well as organ perfusion techniques, it is possible to perform the procedure while maintaining cerebral, lower body and even coronary perfusion; therefore, myocardial ischemia is avoided, and surgery can be done with lesser degree of hypothermia or even in normothermia without circulatory arrest.
Objective and methodsBeating heart frozen elephant trunk initial experience in two clinical cases, describing both the surgical technique and the perfusion strategy.
ResultsThe postoperative course was uneventful in both cases, without low cardiac output syndrome and no neurological events except vocal cord palsy in one case.
ConclusionsBeating heart frozen elephant trunk is the one-stage solution for extensive arch and thoracic aortic aneurysms, with less myocardial damage and lower risk of neurological, spinal, renal and visceral complications.
Gracias al desarrollo tecnológico, a las innovaciones técnicas y al perfeccionamiento de las estrategias de perfusión y al manejo perioperatorio, la patología compleja del arco aórtico es hoy día un problema prevalente en hospitales terciarios y de referencia, donde la sustitución del arco completa, asociada o no a la extensión torácica mediante trompa de elefante clásica o congelada, constituye un procedimiento habitual en la población cada vez con mayor perfil de riesgo y/o con otras lesiones cardíacas susceptibles de reparación en el mismo acto, lo que conlleva tiempos de intervención prolongados.
La trompa de elefante congelada (TEC), desarrollada a partir de prótesis híbridas del arco introducidas en los años 90, permitió el tratamiento integral del arco y de la aorta torácica descendente proximal en un solo tiempo quirúrgico, y facilitó el abordaje endovascular posterior en los casos con enfermedad residual o de novo de la aorta distal. Este procedimiento, de gran interés y alta complejidad, se asocia no obstante a complicaciones cardíacas, neurológicas, renales y hematológicas, derivadas del uso de la hipotermia y de los tiempos prolongados de intervención, de parada circulatoria y de isquemia miocárdica, y conlleva una mortalidad que varía entre el 4,8 y el 20%1. En un intento de mejorar estos resultados, la tendencia actual persigue instaurar circuitos que permitan el mantenimiento de la circulación cerebral y sistémica durante la mayor parte del procedimiento, y de este modo evitar la hipotermia al reducir los tiempos de parada circulatoria.
Por otro lado, la protección miocárdica durante el procedimiento del arco se establece mediante parada cardíaca con el uso de cardioplejía cristaloide o hemática intermitente, por vía anterógrada y/o retrógrada. No obstante, la cirugía del arco no requiere necesariamente establecer o mantener la isquemia miocárdica con el uso de cardioplejía; de hecho, los tiempos prolongados de isquemia miocárdica necesarios para la reparación compleja del arco, asociada o no a la reparación cardíaca, pueden derivar en daño miocárdico, shock cardiogénico, fallo multiorgánico y mortalidad2. La perfusión coronaria no cardiopléjica se describió en los años 70 para la cirugía de válvula aórtica, aunque la incomodidad derivada de su uso llevó al abandono de la técnica3. En 1991, Bachet et al.4 describieron una técnica de perfusión continua hemática fría coronaria y cerebral para la cirugía del arco aórtico, con muy buenos resultados en términos de reducción de mortalidad y complicaciones neurológicas, técnica que tampoco se generalizó entonces. En el año 2016 el grupo de Hannover2 describió la técnica de perfusión coronaria continua (PCC) durante la realización de la TEC, técnica denominada TEC a corazón latiendo. En este número de la revista Cirugía Cardiovascular, describimos pormenorizadamente la técnica quirúrgica y de perfusión de la TEC, así como nuestra experiencia en los primeros 2 pacientes con perfusión coronaria continua.
Métodos. Trompa de elefante a corazón latiendo. Técnica quirúrgicaMonitorizaciónTras la inducción anestésica, el paciente es monitorizado mediante: presión arterial invasiva doble (radial derecha y femoral), vía venosa central de alto flujo para monitorización de presión venosa central e infusión de inotrópicos y volumen, catéter de Swan-Ganz si existe disfunción ventricular y/o hipertensión pulmonar, ecocardiograma transesofágico, termómetro para temperatura nasofaríngea/timpánica y vesical, oximetría cerebral y espinal (NIRS). En pacientes con cobertura amplia de la aorta torácica (TEC con endoprótesis largas de 150mm) o factores de riesgo de daño medular asociamos el empleo de potenciales evocados motores y somatosensoriales junto con drenaje lumbar de líquido cefalorraquídeo.
Vía de acceso y canulación para la circulación extracorpóreaEl acceso se realiza a través de esternotomía media con extensión cervical si se precisa de mayor abordaje de los troncos supraaórticos; este acceso permite la cirugía sobre el corazón, además de instaurar de forma segura la PCC. En cirugía aislada de arco se puede optar por hemiesternotomías superiores, en T, en L o en J, lo cual no obstante puede dificultar la PCC. La canulación arterial se puede realizar en diferentes accesos, siendo lo más generalizado la canulación de arteria axilar derecha, aunque se puede optar por el tronco arterial braquiocefálico, si no está afectado, la aorta ascendente (para el enfriamiento en cirugía electiva, técnica de Samurai en la disección aguda), la arteria axilar izquierda, la arteria femoral y con menos frecuencia la arteria carótida. La canulación de arteria axilar izquierda mediante injerto de Dacron® permite instaurar la circulación extracorpórea (CEC) y posteriormente usar el injerto axilar para su conexión a la rama correspondiente del injerto de arco tras tunelizarlo a la cavidad torácica (trayecto extra-anatómico), en casos de subclavia izquierda profunda cuyo difícil acceso no garantiza una anastomosis directa segura. El drenaje venoso se establece mediante canulación cavoatrial o bicava. La elección de una u otra técnica de canulación dependerá del hábito del equipo quirúrgico para la cirugía de arco y puede variar en caso de cirugía cardíaca asociada, reoperaciones, tipo de patología (aneurisma vs disección), afectación de troncos supraaórticos, etc.
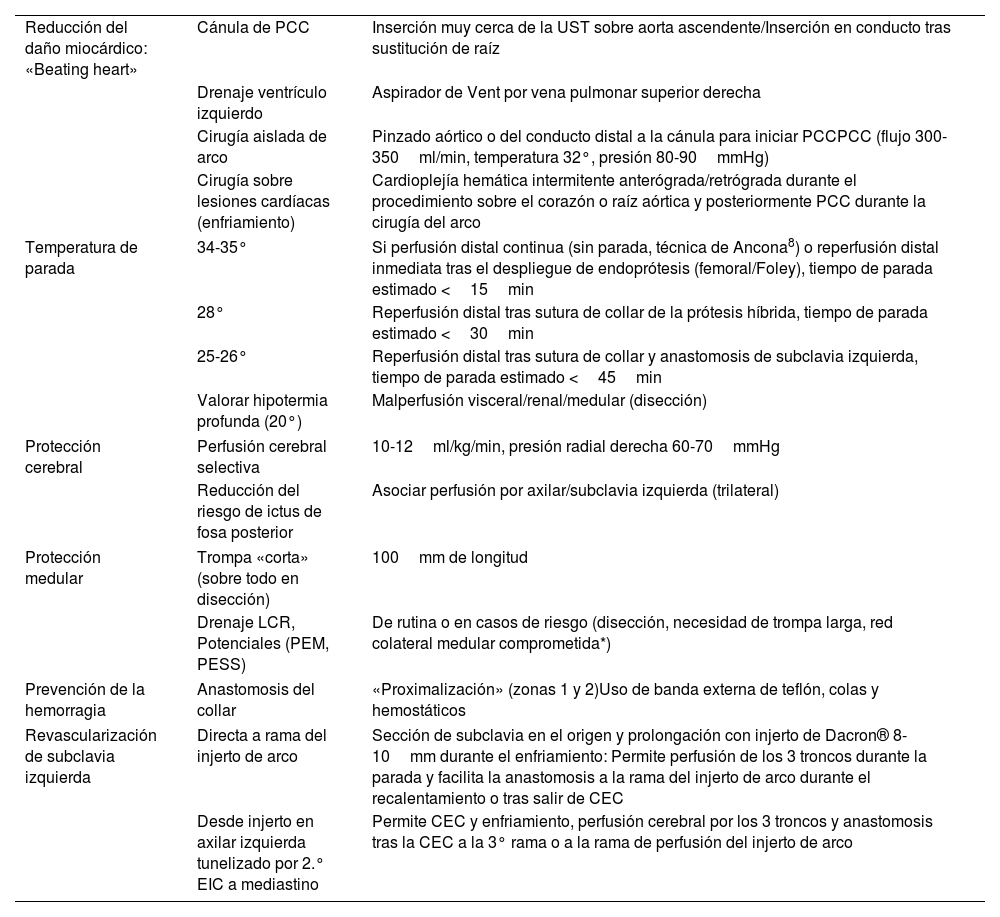
Estrategia de circulación extracorpórea, perfusión coronaria, cerebral y sistémicaLa reparación del arco mediante la TEC sigue las bases de la parada circulatoria con perfusión cerebral anterógrada, lo cual permitió pasar del umbral de la hipotermia profunda a niveles de menor enfriamiento con igual o mayor seguridad clínica. Actualmente, cambios en los circuitos y estrategias de la CEC permiten realizar la cirugía incluso en normotermia, con reperfusión precoz sistémica y tiempos de parada muy cortos o incluso sin parada circulatoria (tabla 1).
Trompa de elefante congelada a corazón latiendo. estrategia de protección de órganos
| Reducción del daño miocárdico: «Beating heart» | Cánula de PCC | Inserción muy cerca de la UST sobre aorta ascendente/Inserción en conducto tras sustitución de raíz |
| Drenaje ventrículo izquierdo | Aspirador de Vent por vena pulmonar superior derecha | |
| Cirugía aislada de arco | Pinzado aórtico o del conducto distal a la cánula para iniciar PCCPCC (flujo 300-350ml/min, temperatura 32°, presión 80-90mmHg) | |
| Cirugía sobre lesiones cardíacas (enfriamiento) | Cardioplejía hemática intermitente anterógrada/retrógrada durante el procedimiento sobre el corazón o raíz aórtica y posteriormente PCC durante la cirugía del arco | |
| Temperatura de parada | 34-35° | Si perfusión distal continua (sin parada, técnica de Ancona8) o reperfusión distal inmediata tras el despliegue de endoprótesis (femoral/Foley), tiempo de parada estimado <15min |
| 28° | Reperfusión distal tras sutura de collar de la prótesis híbrida, tiempo de parada estimado <30min | |
| 25-26° | Reperfusión distal tras sutura de collar y anastomosis de subclavia izquierda, tiempo de parada estimado <45min | |
| Valorar hipotermia profunda (20°) | Malperfusión visceral/renal/medular (disección) | |
| Protección cerebral | Perfusión cerebral selectiva | 10-12ml/kg/min, presión radial derecha 60-70mmHg |
| Reducción del riesgo de ictus de fosa posterior | Asociar perfusión por axilar/subclavia izquierda (trilateral) | |
| Protección medular | Trompa «corta» (sobre todo en disección) | 100mm de longitud |
| Drenaje LCR, Potenciales (PEM, PESS) | De rutina o en casos de riesgo (disección, necesidad de trompa larga, red colateral medular comprometida*) | |
| Prevención de la hemorragia | Anastomosis del collar | «Proximalización» (zonas 1 y 2)Uso de banda externa de teflón, colas y hemostáticos |
| Revascularización de subclavia izquierda | Directa a rama del injerto de arco | Sección de subclavia en el origen y prolongación con injerto de Dacron® 8-10mm durante el enfriamiento: Permite perfusión de los 3 troncos durante la parada y facilita la anastomosis a la rama del injerto de arco durante el recalentamiento o tras salir de CEC |
| Desde injerto en axilar izquierda tunelizado por 2.° EIC a mediastino | Permite CEC y enfriamiento, perfusión cerebral por los 3 troncos y anastomosis tras la CEC a la 3° rama o a la rama de perfusión del injerto de arco | |
CEC: circulación extracorpórea; EIC: espacio intercostal; LCR: líquido cefalorraquídeo; PCC: perfusión coronaria continua; PEM: potenciales evocados motores; PESS: potenciales evocados somatosensoriales; UST: unión sinotubular.
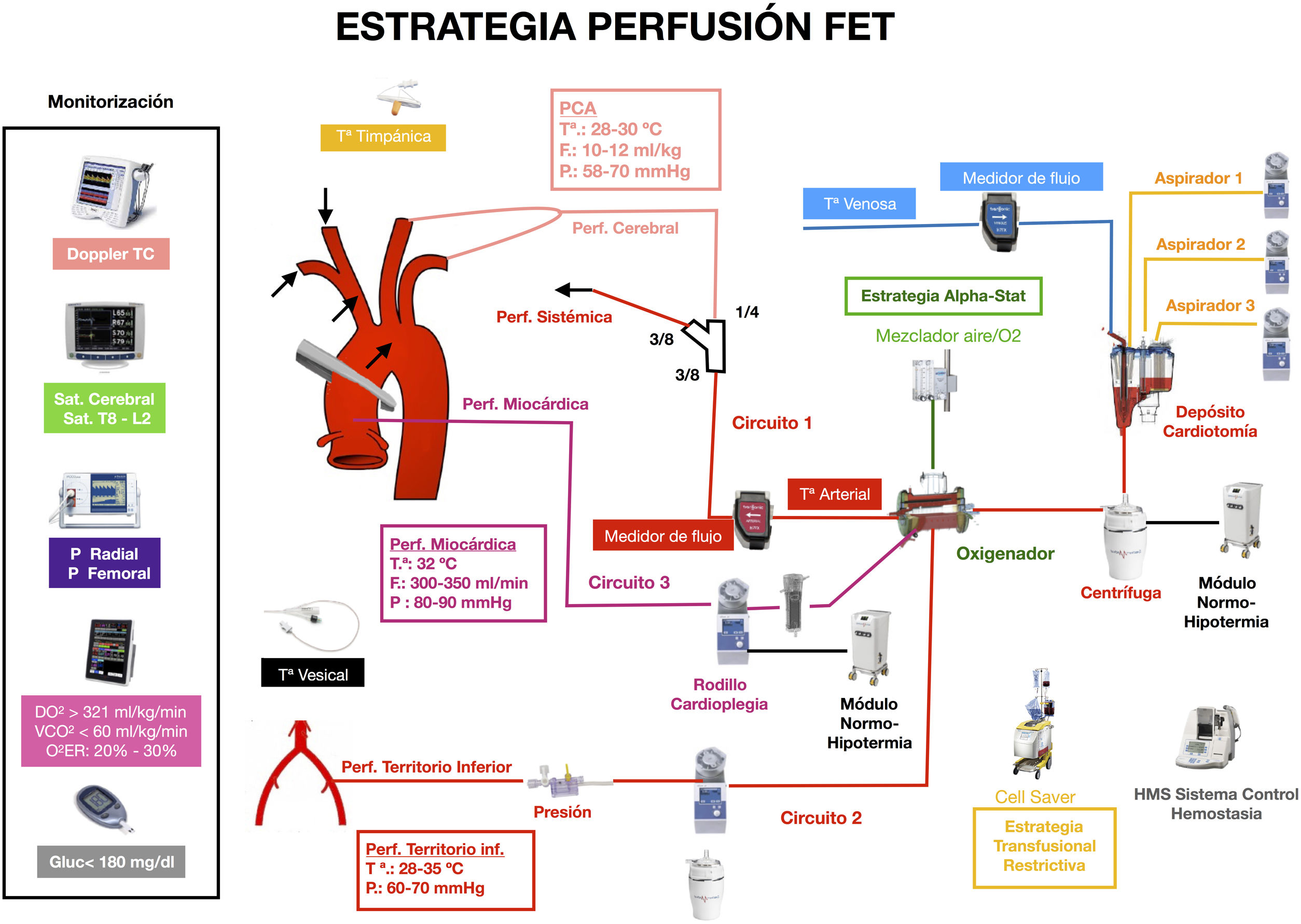
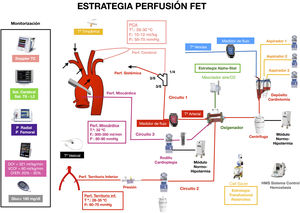
La estrategia de perfusión en la TEC a corazón latiendo debe contemplar, por tanto, circuitos para perfusión coronaria, cerebral y sistémica (fig. 1):
- -
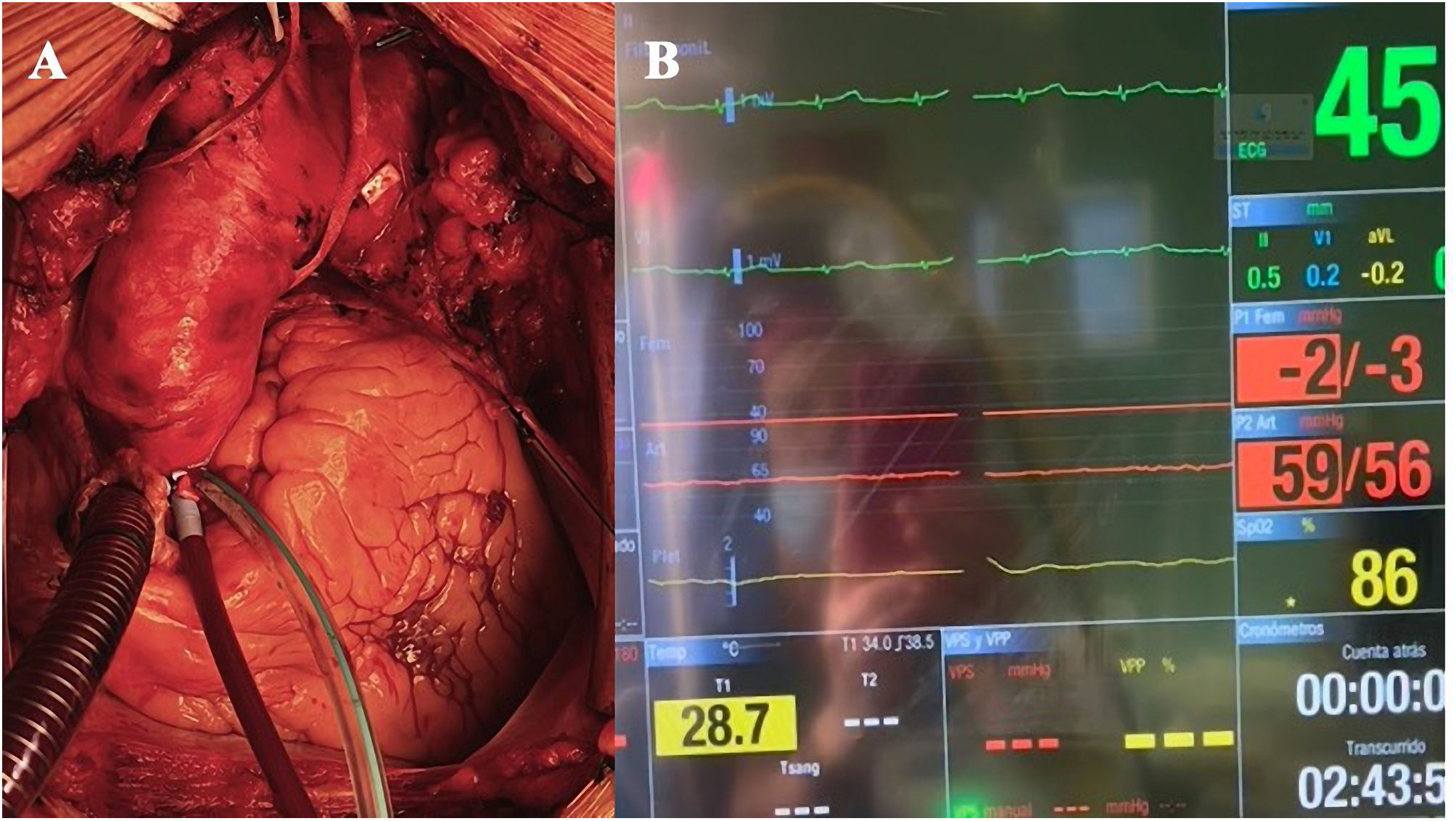
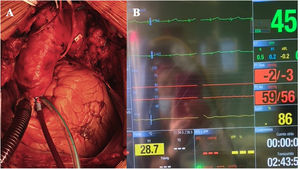
Perfusión coronaria continua: Durante el enfriamiento y en caso de cirugía cardíaca asociada, se realiza pinzado aórtico y parada cardíaca con cardioplejía hemática intermitente anterógrada y retrógrada. Tras ello, a través de la misma cánula de cardioplejía, insertada siempre cerca de la unión sinotubular (fig. 2A, video 1), se inicia PCC a 300-350ml/min con sangre a 32°C y presión de 80-90mmHg. Se usa siempre aspirador de ventrículo izquierdo introducido por vena pulmonar superior derecha. En caso de no asociar cirugía sobre el corazón la PCC se inicia inmediatamente tras el pinzado distal a la cánula de perfusión coronaria. Habitualmente el corazón mantiene ritmo sinusal estable a pesar de la hipotermia (fig. 2B, video 1), aunque en caso de fibrilación ventricular no es necesario desfibrilar, siempre que el corazón se mantenga vacío a través del Vent. Si se realiza cirugía sobre la raíz aórtica, la cánula para la PCC se inserta en el conducto de raíz una vez implantado, con pinzado distal al mismo. Por otro lado, en caso de insertar la cánula de la PCC sobre aorta ascendente patológica, se puede retirar la pinza aórtica tras la reparación de arco con pinzado del injerto, administración de cardioplejía, resección de la aorta ascendente y realización de la anastomosis proximal a la unión sinotubular, durante el recalentamiento.
- -
Temperatura objetivo: La temperatura de enfriamiento variará en relación al tiempo de parada circulatoria necesario estimado hasta reiniciar la perfusión distal y el recalentamiento, siendo necesaria una hipotermia moderada (25-26°C) para tiempos prolongados, pero es posible realizar la cirugía en hipotermia ligera (mayor de 28°C) o casi en normotermia (34-35°C) en caso de reperfusión rápida o CEC sin parada (tabla 1).
- -
Perfusión cerebral: A través de la arteria axilar derecha o mediante canulación selectiva de tronco arterial braquiocefálico y carótida izquierda. Ocasionalmente también se perfunde por axilar izquierda en los casos en los que se insertó un injerto para canulación y la CEC al inicio de la cirugía (perfusión cerebral trilateral). La perfusión adicional por axilar izquierda es apropiada sobre todo en caso de riesgo de ictus de fosa posterior (polígono de Willis incompleto), ya que permite perfusión por arteria vertebral izquierda. Se usa centrífuga o rodillo, a flujos de 10-12ml/kg/min y temperatura de 28-30°C.
Circuito de TEC a corazón latiendo.
Circuitos que permiten perfusión cerebral, coronaria y periférica simultáneas e independientes:
Circuito 1: Perfusión sistémica a través de línea arterial con bomba centrífuga en zona de canulación seleccionada. Esta línea se bifurca para perfusión cerebral anterógrada selectiva. Monitorización independiente de flujo, presión y temperatura.
Circuito 2: Perfusión territorio inferior a partir de línea obtenida de la recirculación del oxigenador conectada a acceso femoral, con bomba centrífuga o rodillo. Monitorización de presión y flujo independiente. Temperatura idéntica a la sistémica/cerebral.
Circuito 3: Perfusión coronaria continua hemática vía anterógrada a través de cánula en raíz aórtica y aspiración en vena pulmonar derecha, utilizando el sistema y rodillo de la cardioplejía. Monitorización independiente de presión, flujo y temperatura.
DO2: aporte de oxígeno; Doppler TC: Doppler transcraneal; F: flujo; Gluc: glucemia; O2ER: tasa de extracción de oxígeno; P: presión; PCA: perfusión cerebral anterógrada; Perf: perfusión; Sat.: saturación; Tª: temperatura; VCO2: producción de dióxido de carbono.
La prótesis se introduce de forma anterógrada en aorta torácica descendente bajo visión directa o tutorizada con guía; la guía, insertada desde arteria femoral, es especialmente útil en casos de disección aguda o crónica, ya que garantiza el despliegue de la endoprótesis en la luz verdadera. Antes del despliegue se debe asegurar una orientación correcta, lo que supone posicionar las 3 ramas del injerto de Dacron® de los troncos supraaórticos hacia la cabeza del paciente, y la rama de perfusión en posición anterior; el collar de sutura se debe dejar preferiblemente en zona 1 o 2 donde la sutura es más sencilla y segura que en zona 3 (video 2, correspondiente a un caso de la TEC en parada cardíaca y sustitución de aorta ascendente). Tras el despliegue se realiza control angioscópico del anclaje distal.
Reperfusión distal y recalentamientoInmediata tras el despliegue de la endoprótesis si se ha conseguido sellado distal efectivo (aneurismas), con reentrada en CEC a través de arteria femoral o de forma anterógrada por una sonda de Foley de 22-24F introducida a través de la endoprótesis (video 3); en disecciones, donde no es posible el sellado, se sutura el collar antes de iniciar la reperfusión por la cuarta rama del injerto.
Finalización de la perfusión coronaria continuaSe realiza la sutura proximal del injerto de arco a aorta ascendente, se purgan las cavidades cardíacas de aire y se retira la pinza vascular de aorta, restableciendo la circulación y finalizando la perfusión coronaria.
Cese de la CEC, decanulación, hemostasia y cierreLa tabla 1 muestra la estrategia de protección de órganos y prevención de complicaciones.
ResultadosSe presenta la experiencia inicial en 2 casos de TEC a corazón latiendo.
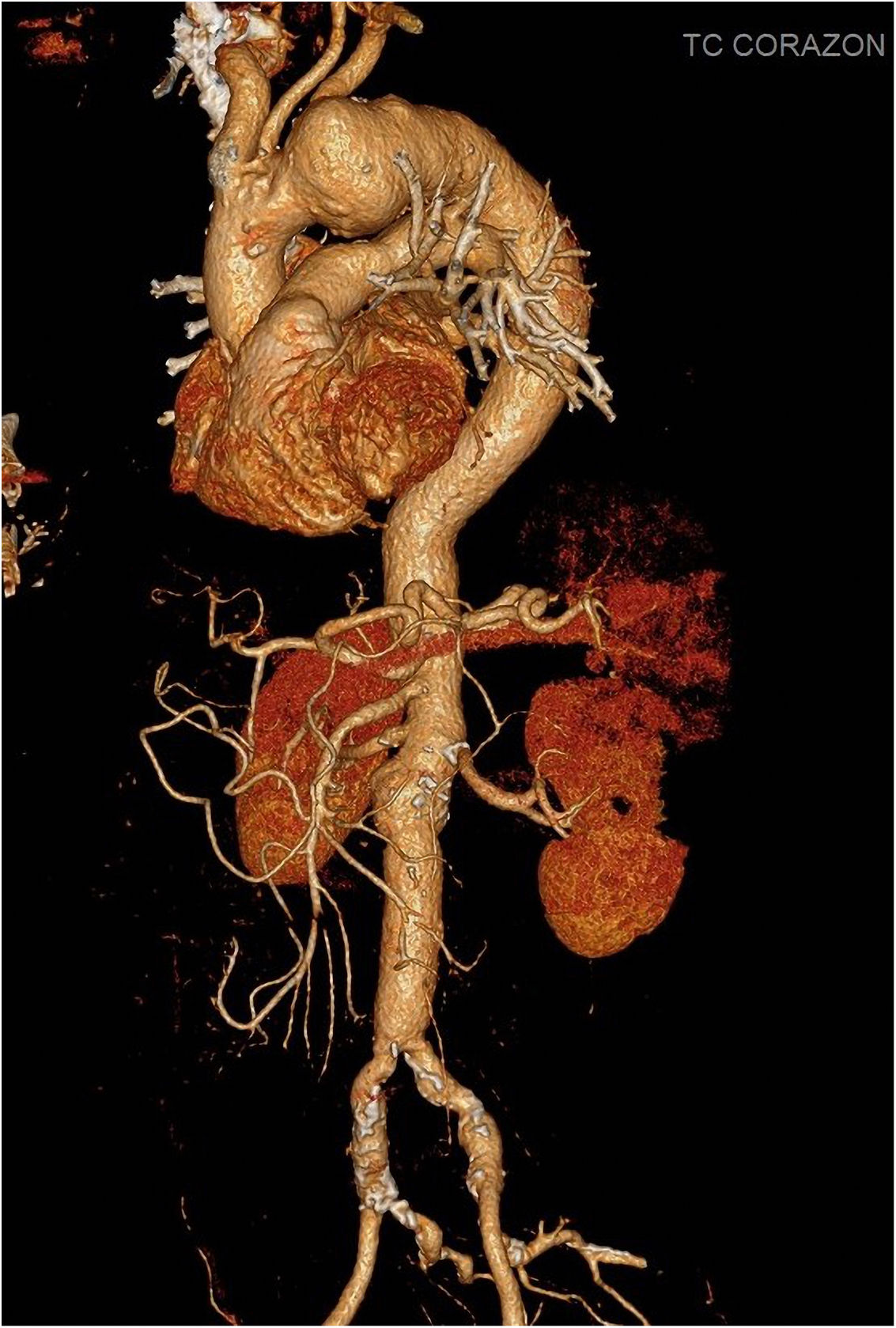
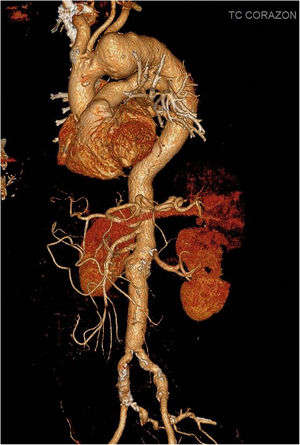
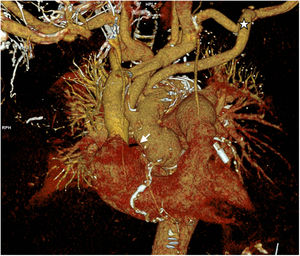
Caso clínico 1Varón de 69 años, con antecedentes de diabetes, dislipemia y reparación abierta previa de aneurisma de aorta abdominal. Ingresó de forma electiva para intervención de aneurisma de arco aórtico medio/distal de 61×48mm diagnosticado por angio-tomografía axial computarizada (fig. 3). El ecocardiograma y la coronariografía preoperatoria fueron normales.
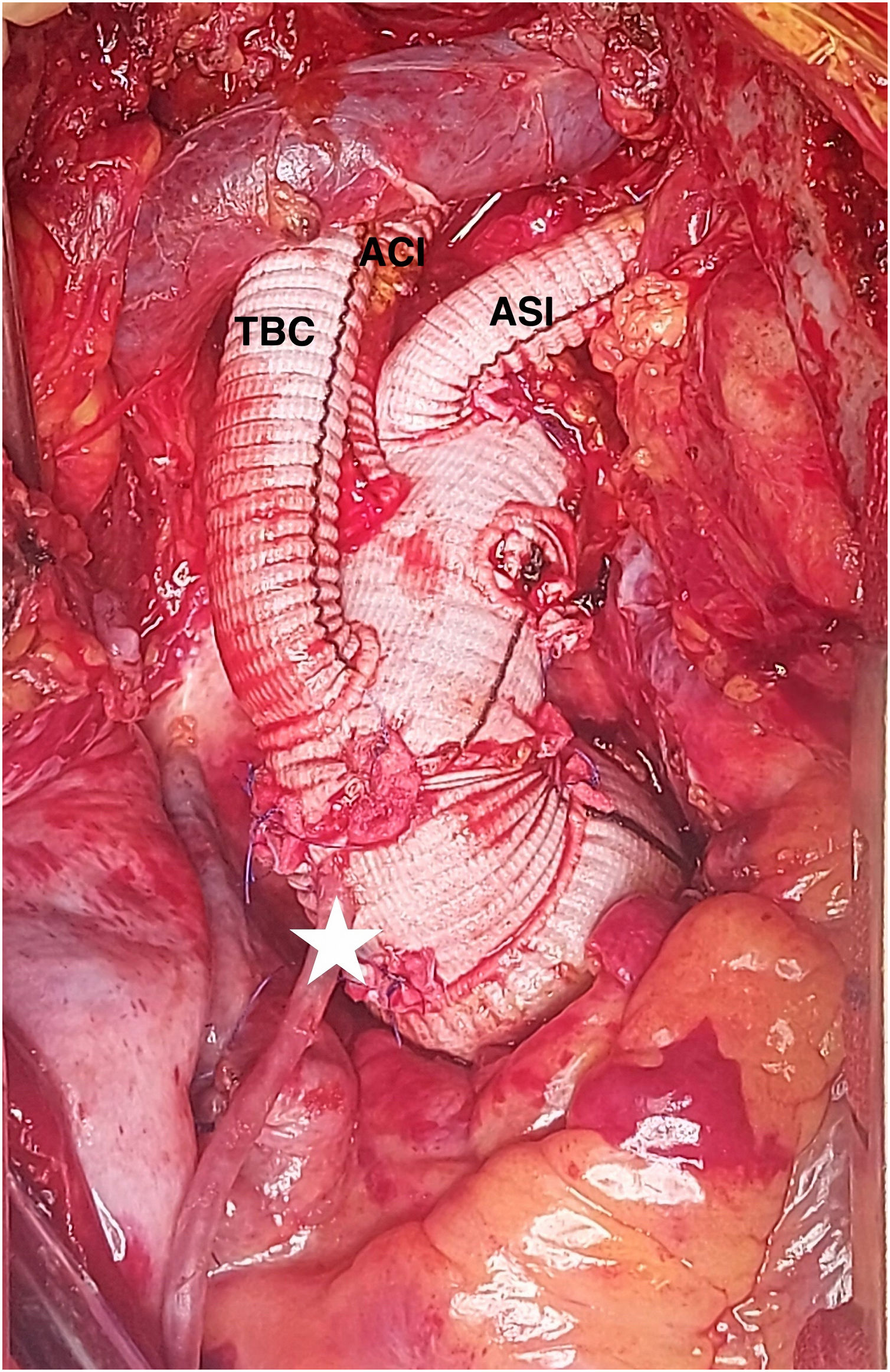
Se realizó cirugía con CEC a través de injerto de 10mm en arteria axilar izquierda y cánula cavoatrial en aurícula derecha, realizando parada circulatoria a 28°C, pinzado proximal de aorta ascendente y cánula en raíz para la PCC a razón de 250ml/min a 32°C, con aspirador de ventrículo izquierdo. Se realizó perfusión cerebral por tronco arterial braquiocefálico y carótida izquierda usando además el injerto de axilar izquierda. El origen de la subclavia izquierda se suturó con grapadora vascular (Echelon Flex®-PVS, Ethicon, Johnson&Johnson). Se implantó una prótesis híbrida de arco (Thoraflex® Hybrid Plexus, Terumo Aortic, Inchinnan, Scotland, UK) de 30mm de conducto × 38 y 150mm de diámetro y longitud de endoprótesis, respectivamente. Inmediatamente después se reinició reperfusión distal con bomba de rodillo y sonda de Foley insertada a través de la endoprótesis, con control angioscópico (video 3). La anastomosis del collar se realizó en zona 2 y posteriormente se usó la rama de perfusión del injerto de arco para continuar con el recalentamiento. El corazón mantuvo latido en ritmo sinusal durante la PCC. Tras finalizar el recalentamiento y salir de la CEC, el injerto axilar izquierdo se utilizó para el reimplante de la rama correspondiente del injerto de arco, tras la tunelización intratorácica del mismo.
El paciente fue extubado a las 4h de postoperatorio, sin déficits neurológicos. No precisó de inotrópicos y el pico de troponina T ultrasensible fue de 924ng/l. La estancia postoperatoria fue de 9 días. La angio-tomografía de control previa al alta fue normal.
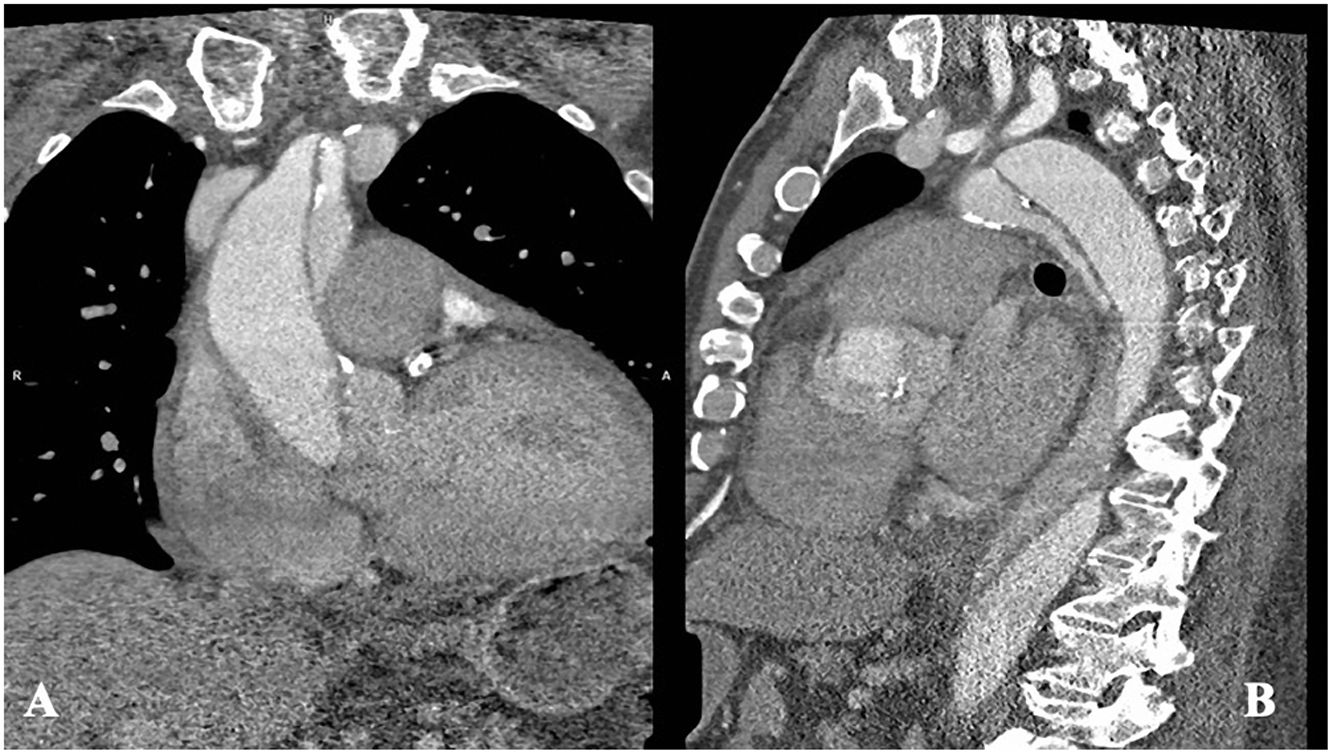
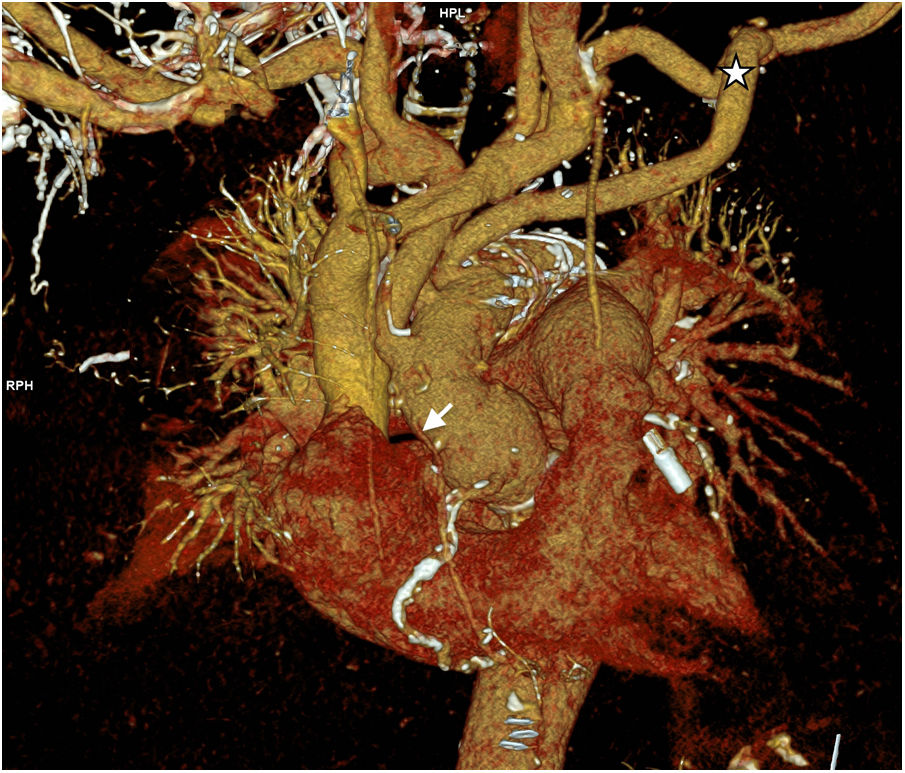
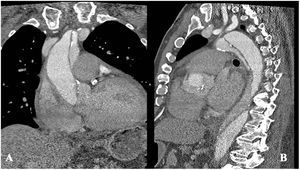
Caso clínico 2Varón de 70 años, con antecedentes de hipertensión, diabetes, dislipemia, ablación de flutter auricular y apnea obstructiva del sueño. Historia clínica de meses de evolución de disnea de esfuerzo y episodios autolimitados de hemoptisis. La angio-tomografía solicitada durante el estudio (figs. 4 A y B) mostró disección tipo A sobre aneurisma desde raíz aórtica hasta aorta torácica descendente, de evolución subaguda/crónica, asociada a derrame pericárdico e insuficiencia aórtica en el ecocardiograma. La función ventricular izquierda estaba conservada y se objetivó estenosis del 90% de coronaria derecha en la coronariografía. Las medidas de aorta fueron: 49mm en raíz, 56mm en aorta ascendente, 43mm en arco y 46mm en torácica descendente.
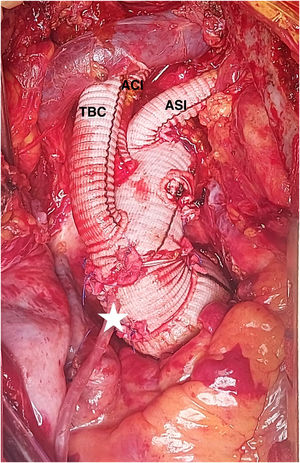
La intervención se llevó a cabo mediante CEC a través de arteria axilar izquierda con injerto de 10mm) y aurícula derecha. Se revascularizó la coronaria derecha con vena safena durante el enfriamiento y posteriormente se procedió a pinzado aórtico y administración de cardioplejía anterógrada, retrograda y por injerto coronario, realizando sustitución de raíz y válvula aórticas por conducto de Dacron® de 32mm y bioprótesis soportada de pericardio con reimplante de coronarias (Bentall biológico, modificación francesa). Tras ello se procedió a canulación del conducto y pinzado distal del mismo, iniciando perfusión coronaria continua a 300ml/min y 32°C. La parada se estableció a 25°C, resecando el arco y realizando perfusión cerebral por los 3 troncos a 1.000-1.300ml/min. Se ocluyó el origen de la subclavia izquierda con grapadora vascular. Se implantó una prótesis Thoraflex® hybrid plexus de 28×30×100mm, con sutura del collar en zona 2. Se realizó control angioscópico y posteriormente se inició el recalentamiento por la rama lateral del injerto de arco. Se conectó el injerto de arco al de raíz, retirando la pinza vascular y finalizando la perfusión coronaria. Tras el reimplante de los dos primeros troncos supraaórticos, el injerto de axilar izquierda se tunelizó por segundo espacio intercostal para su anastomosis intratorácica a la tercera rama del injerto de arco. La figura 5 muestra el estado final de la reparación.
El paciente fue extubado a las 24h de postoperatorio y requirió dosis bajas de inotrópicos, con pico de troponina T ultrasensible de 1.426ng/l. Desarrolló una parálisis de cuerda vocal izquierda que mejoró con rehabilitación. La estancia postoperatoria fue de 15 días. La angio-tomografía de control fue normal (fig. 6).
DiscusiónEl concepto de trompa de elefante clásica, descrito por Borst et al.5 en 1983, permitió un enfoque integral en el tratamiento de la afección multisegmento de la aorta torácica, si bien necesitaba de al menos 2 procedimientos separados en el tiempo para completar la reparación de la tríada aorta ascendente-arco-aorta descendente. El desarrollo de la cirugía endovascular, las prótesis ramificadas y en última instancia la aparición de las prótesis híbridas, llevaron a la modificación de la técnica hacia lo que se denomina TEC, descrita por Kato et al.6 e introducida por Karck et al.7, que permite el tratamiento integral del arco y aorta torácica en un solo tiempo. Esta técnica se ha convertido en el patrón oro para múltiples indicaciones8, como aneurismas de arco distal, aneurismas de aorta ascendente y torácica descendente, disección aguda tipo I, disección B aguda/crónica sin anclaje proximal para endoprótesis torácica (TEVAR), disección no A no B aguda complicada, dilatación de arco y/o aorta ascendente mayor de 40mm, disección residual tras cirugía de disección proximal, endofuga tipo Ia tras TEVAR y pacientes con nueva entrada inducida por stent (del inglés SINE). En la disección aguda, el procedimiento favorece la expansión de la luz verdadera y trombosis de la falsa, sella las puertas de entrada en la aorta torácica descendente, trata la malperfusión distal y reduce la posibilidad de remodelado adverso de la aorta distal, constituyendo además una magnífica zona de anclaje en caso de tratamiento endovascular distal posterior9. En la disección crónica los beneficios de la técnica son menos evidentes, existiendo mayor riesgo de roturas miointimales distales (dSINE) por el dispositivo10.
Los resultados de la TEC en las primeras series publicadas fueron buenos, aunque los procedimientos se hacían en parada circulatoria con hipotermia moderada o profunda y uso de perfusión cerebral; en un metaanálisis reciente11, la mortalidad precoz descrita era de un 8,3%, con un 4,9% de ictus y 5,1% de lesión medular. Estos mismos estudios mostraron que los tiempos prolongados de CEC, de parada circulatoria y de isquemia miocárdica aumentaban la mortalidad. Otras complicaciones asociadas a la técnica son la hemorragia, el fallo renal, la malperfusión visceral, las complicaciones respiratorias y el fallo cardíaco, todas ellas relacionadas en mayor o menor medida con aspectos derivados de la técnica, como la necesidad de hipotermia y parada circulatoria, así como los períodos, a veces prolongados, de isquemia miocárdica e hipoperfusión distal.
Precisamente, para reducir las complicaciones derivadas de la TEC se ha intentado modificar la estrategia de perfusión y de abordaje del arco, tratando de evitar o reducir al máximo la parada circulatoria y por tanto mantener la normotermia. Así, Di Eusanio et al.12,13, describieron recientemente la técnica de la TEC en normotermia y sin parada, mediante implante previo de una endoprótesis torácica y sustitución completa posterior del arco con injerto ramificado, con oclusión endoluminal del stent torácico y mantenimiento de perfusión distal por arteria femoral, asociada a perfusión cerebral anterógrada. Esta técnica requiere un sellado distal efectivo de la endoprótesis torácica que permita su oclusión endoluminal sin sangrado retrógrado, por lo que no es útil en caso de disecciones. Alternativamente, la canulación arterial axilar izquierda empleada en nuestra serie de casos, permite instaurar la CEC durante el enfriamiento hasta alcanzar niveles de hipotermia ligera, tras lo cual se establece una parada corta con perfusión cerebral por los tres troncos, despliegue de la prótesis híbrida y reinicio de la CEC y recalentamiento con perfusión anterógrada por sonda de Foley o por la rama lateral del injerto tras sutura del collar. Esta modificación requiere de una parada circulatoria distal que suele ser corta, inferior a 15min, pero es técnicamente menos compleja que la técnica en normotermia descrita por el grupo de Ancona. Por otro lado, la perfusión por tres troncos, incluida la arteria subclavia/axilar izquierda, mejora la protección cerebral y medular al perfundir la arteria vertebral izquierda y evitar el fenómeno de robo de la vertebral, manteniendo estable la presión de perfusión en ambos lóbulos cerebrales14.
El riesgo de daño medular se ha estimado en un 3% en un metaanálisis reciente15, siendo los factores más importantes el uso de trompas largas (150mm) o con cobertura por debajo de T8 y la hipotensión; otro estudio16 objetivó un 11,6% de daño medular para trompas de 150mm frente al 2,5% en caso de trompas de 100mm, diferencia que resultó estadísticamente significativa. Es por tanto de gran importancia usar trompas cortas, de 100mm, y en caso de necesitar mayor cobertura se debe emplear drenaje de líquido cefalorraquídeo e incluso potenciales evocados.
Por último, la cirugía de arco puede realizarse sin isquemia miocárdica, con el uso de la PCC, tal y como publicaron Martens et al. en el año 20162. En un estudio comparativo con pacientes operados mediante PCC y parada cardíaca con cardioplejía, el grupo de Hannover demostró ausencia de mortalidad de causa cardíaca, menor sangrado, menor bajo gasto postoperatorio y menor mortalidad hospitalaria en el grupo de PCC. En nuestra experiencia inicial, la PCC permite realizar la cirugía de arco sin aumentar la dificultad técnica ni la complejidad de los circuitos de perfusión, siendo por otro lado una técnica efectiva de protección miocárdica.
ConclusionesLa TEC, en casos seleccionados y con anatomía favorable, se puede llevar a cabo con perfusión distal, cerebral y coronaria, en umbrales cercanos a la normotermia, evitando la isquemia miocárdica y reduciendo al máximo los tiempos de parada circulatoria, con potencial reducción de la hemorragia y de las complicaciones cardíacas, neurológicas y sistémicas.
Consideraciones éticasAprobado por el Comité de Ética Hospitalaria. No se requiere Consentimiento Informado porque no aparecen datos identificativos de pacientes.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran que no tienen intereses económicos en competencia o relaciones personales conocidas que puedan haber influido en el trabajo informado en este documento.