El tumor del glomus carotídeo (TGC) forma parte de los paragangliomas, con incidencia de 3-4 por 100.000 habitantes por año. Estos suelen ser diagnosticados de forma incidental, aunque pueden presentarse con disfagia, disfonía, síntomas adrenérgicos y compromiso de vasos carotídeos. El diagnóstico se confirma mediante tomografía computarizada, y la única opción curativa es la cirugía, que puede conllevar distintos riesgos y complicaciones, y requiere de avanzada técnica por parte del cirujano.
Presentación del casoSe presenta a 2pacientes con TGC derivados al servicio de cirugía vascular. Ambos requirieron de cirugía, logrando extirpar con éxito el tumor. Un paciente evolucionó favorablemente, mientras que el otro desarrolló disfagia y disfonía por la sección de un asa del nervio hipogloso para liberar el tumor.
Discusión y conclusiónLos TGC suelen ser benignos y presentan la menor tasa de malignidad de todos los paragangliomas, descrita como menor de un 5%. La técnica quirúrgica estándar consiste en la resección periadventicial y presenta desafíos terapéuticos importantes de acuerdo con la localización y el grado de compromiso de estructuras adyacentes por el tumor. Las complicaciones más frecuentes incluyen daño a los nervios vago e hipogloso, y la hemorragia promedio puede ir desde 78 hasta 404ml. Dada la delicadeza de estas complicaciones, se requiere de cirujanos altamente especializados y por ello se han propuesto modificaciones a las técnicas quirúrgicas habituales y embolización previa del tumor.
.
Carotid body tumor (CBT) is a type of paraganglioma, with an incidence of 3-4 per 100,000 inhabitants per year. These tumors are often diagnosed incidentally, though they may present with dysphagia, dysphonia, adrenergic symptoms, and vessels compromise. Diagnosis is confirmed through computed tomography, and the only curative option is surgery, which carries various risks and complications and requires advanced surgical technique.
Case presentationTwo patients with carotid body tumor were referred to the vascular surgery service. Both underwent successful tumor resection. One patient had a favorable outcome, while the other developed dysphagia and dysphonia due to the sectioning of a loop of the hypoglossal nerve to free the tumor.
Discussion and conclusionCBTs are typically benign and have the lowest malignancy rate among all paragangliomas, reported to be less than 5%. The standard surgical technique involves periadventitial resection and presents significant therapeutic challenges depending on the tumor's location and involvement of adjacent structures. The most common complications include damage to the vagus and hypoglossal nerves, with average blood loss ranging from 78 to 404ml. Given the complexity of these complications, highly specialized surgeons are required, and modifications to conventional surgical techniques, including preoperative tumor embolization, have been proposed.
El tumor del glomus carotídeo (TGC) es una neoplasia benigna derivada de las células mesodérmicas del cuerpo carotídeo1. Forma parte de los paragangliomas, con incidencia de 3-4 por 100.000 habitantes por año, representando menos de un 0,5% de los tumores de cabeza y cuello2,3. Es más frecuente en mujeres, con una edad promedio de presentación entre la tercera y la sexta década de vida2 y se describe con mayor frecuencia en zonas de mayor altura1,4. La mayoría se presenta de forma esporádica, aunque un 10-25% de los pacientes tienen antecedentes familiares de paragangliomas5 y se relacionan con una presentación a edad temprana o bilateral. En estos casos, se ha determinado que la transmisión se da de forma autosómica dominante ligada al sexo masculino.
Las mutaciones presentadas en mayor frecuencia son aquellas relacionadas con el complejo succinato deshidrogenasa mitocondrial, más comúnmente con el gen de la subunidad D26, reportados hasta en un 40% de los casos4. Se ha estimado que mutaciones en estos genes aumentan la producción de especies reactivas de oxígeno, las que aumentan el trabajo de las células tipo 1 que conforman parte del glomus, produciendo hipertrofia, hiperplasia y finalmente crecimiento neoplásico2.
Los TGC se manifiestan como una masa indolora, pulsátil, adherida y de crecimiento progresivo, siendo diagnosticados usualmente de forma incidental7. Los pacientes pueden presentar disfagia, disfonía y disfunción autonómica2; en el caso de ser tumores productores de catecolaminas, se pueden manifestar con sintomatología hiperadrenérgica asociada8; también puede darse el síndrome de Horner, secundario al compromiso de los vasos carotídeos y los pares craneales X-XII2, aunque a menudo suele ser asintomático9.
El diagnóstico es clínico y se confirma mediante imágenes. Dentro de estas, destacan la ecografía, la tomografía computada (TC) y la resonancia magnética9. Mientras tanto, el seguimiento y planificación se beneficia de angiografía. Las imágenes permiten la clasificación de Shamblin, la cual define pronóstico y tratamiento según el grado de compromiso carotídeo4. El tratamiento de elección es quirúrgico, siendo el único curativo y el cual requiere una cuidadosa y avanzada técnica1,4.
Dadas la baja incidencia y la elevada complejidad en el manejo de los TGC, presentamos los siguientes casos, que requirieron intervención de cirujanos externos al centro asistencial para su resolución.
Presentación de los casosCaso 1Hombre de 53 años, con antecedente de lipoma supraclavicular izquierdo en control posterior a accidente vehicular con impacto en tórax. Durante control de lipoma para evaluar eventual cirugía, se pesquisó tumor de cuerpo carotídeo derecho en TC. Se realizó examen físico dirigido, encontrando aumento de volumen en ángulo mandibular derecho, de características gomosas y no pulsátil. No presentaba soplo carotídeo.
Se derivó al equipo de cirugía vascular, quienes confirmaron el diagnóstico de TGC derecho Shamblin III, programando intervención quirúrgica en un plazo de 3 meses.
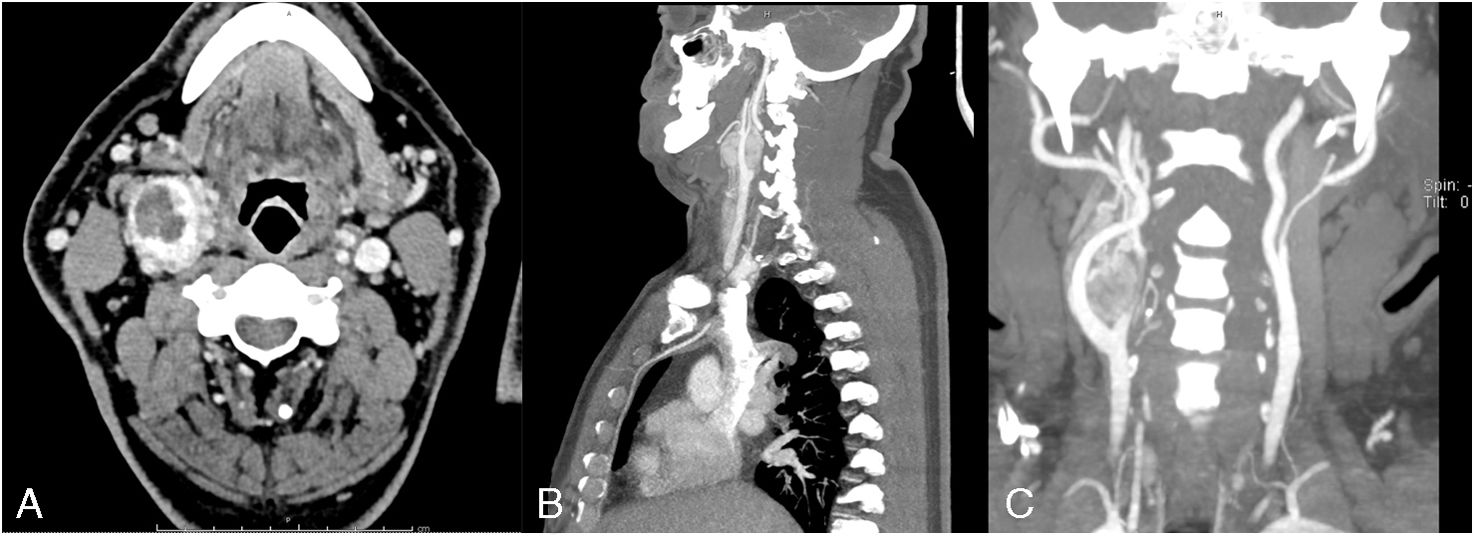
El paciente se ausentó a controles posteriores, volviendo a consulta médica 15 años después para reprogramar cirugía. Se realizaron estudios con el fin de reetapificar el tumor, en los cuales se observó de similares dimensiones (42×30×28mm) con clasificación Shamblin III (fig. 1). Se programó la cirugía en conjunto al paciente número para coordinar la asistencia de un cirujano externo.
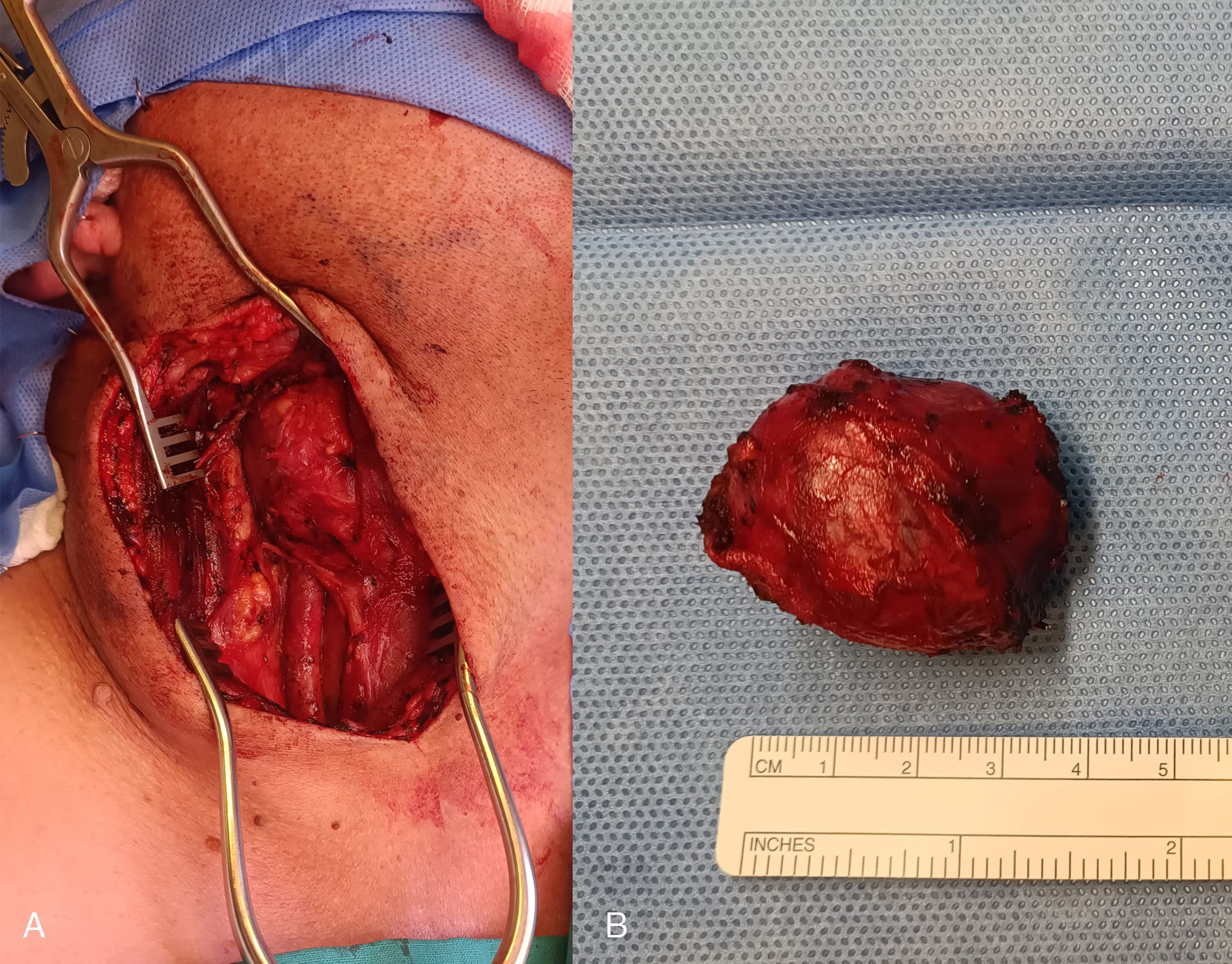
La cirugía se inició realizando una incisión en cara anterior del esternocleidomastoideo derecho, diseccionando a través de los planos hasta identificar la arteria carótida común y sus ramas interna y externa, junto al tumor que las envolvía. En el procedimiento, se observó adenopatía submandibular derecha de 2cm, que fue enviada a biopsia diferida. Se exponen los extremos proximal y distal de las arterias y se identifican los nervios vago, hipogloso, laríngeo superior y se apartan del tumor, para luego resecar el tumor en el plano subadventicial mediante electrocauterización bipolar. El tumor fue resecado completamente (fig. 2), respetando estructuras vasculares y nerviosas adyacentes, con hemostasia adecuada. Se comprobó el flujo carotídeo con ecografía Doppler, se colocó un drenaje por el borde caudal de la incisión y se cerró la incisión.
El paciente evolucionó favorablemente y sin complicaciones, siendo dado de alta al cuarto día postoperatorio. Al mes de postoperado fue evaluado en policlínico de cirugía vascular, encontrándose en buenas condiciones y sin complicaciones. El informe histopatológico concluyó paraganglioma de cuerpo carotídeo con inmunohistoquímica positiva para s100, cromogranina y sinaptofisina, con índice de replicación Ki67 del 12% y ganglio con linfadenitis crónica. Fue evaluado por oncología, quienes descartaron enfermedad linfoproliferativa y concluyeron que no requiere posterior seguimiento, dándolo de alta.
Caso 2Mujer de 48 años, con antecedente de diabetes mellitus 2 en tratamiento con metformina y atorvastatina. Consultó en servicio de Cirugía por aumento de volumen de 2 años de evolución en ángulo mandibular derecho. Al examen físico se palpó gomoso y pulsátil, movilizable en plano horizontal (signo de Fontaine positivo), sin soplos carotídeos.
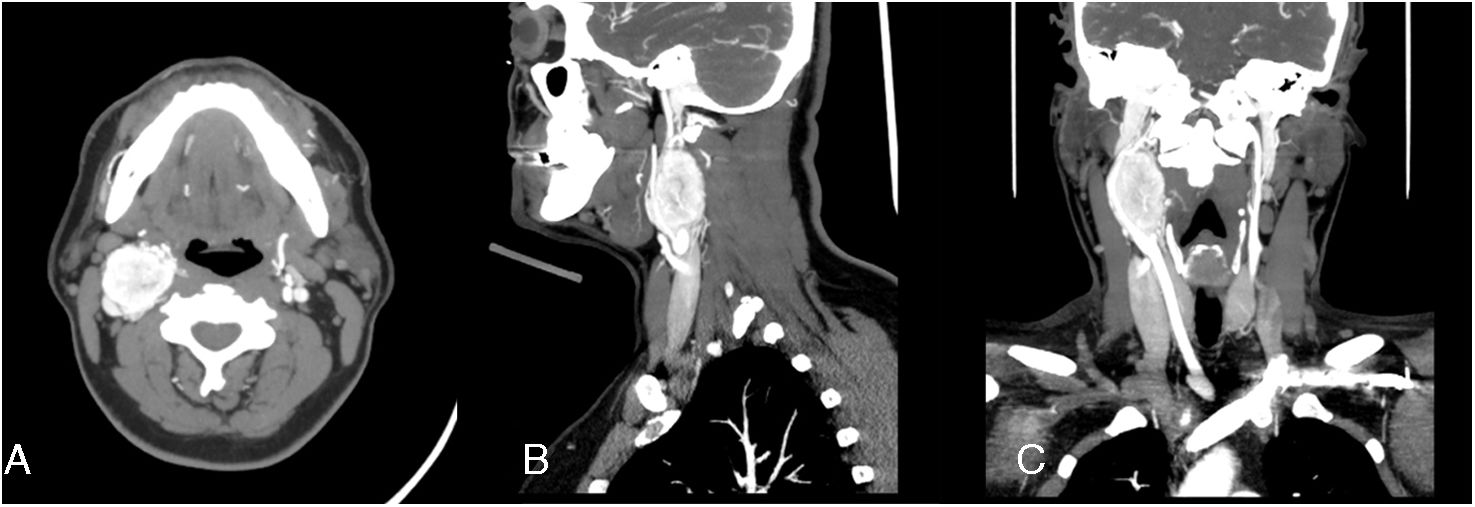
En primera instancia se realizó ecografía que evidenció una masa ovoidea en la bifurcación carotídea, de contornos lisos y regulares, hipoecogénica, hipovascular, de 23×32×45mm. Posteriormente se ordenó una TC que informó TGC derecho Shamblin II, con desplazamiento posterolateral de la vena yugular derecha (fig. 3). Se programó la cirugía en conjunto al paciente número para coordinar la asistencia de un cirujano externo.
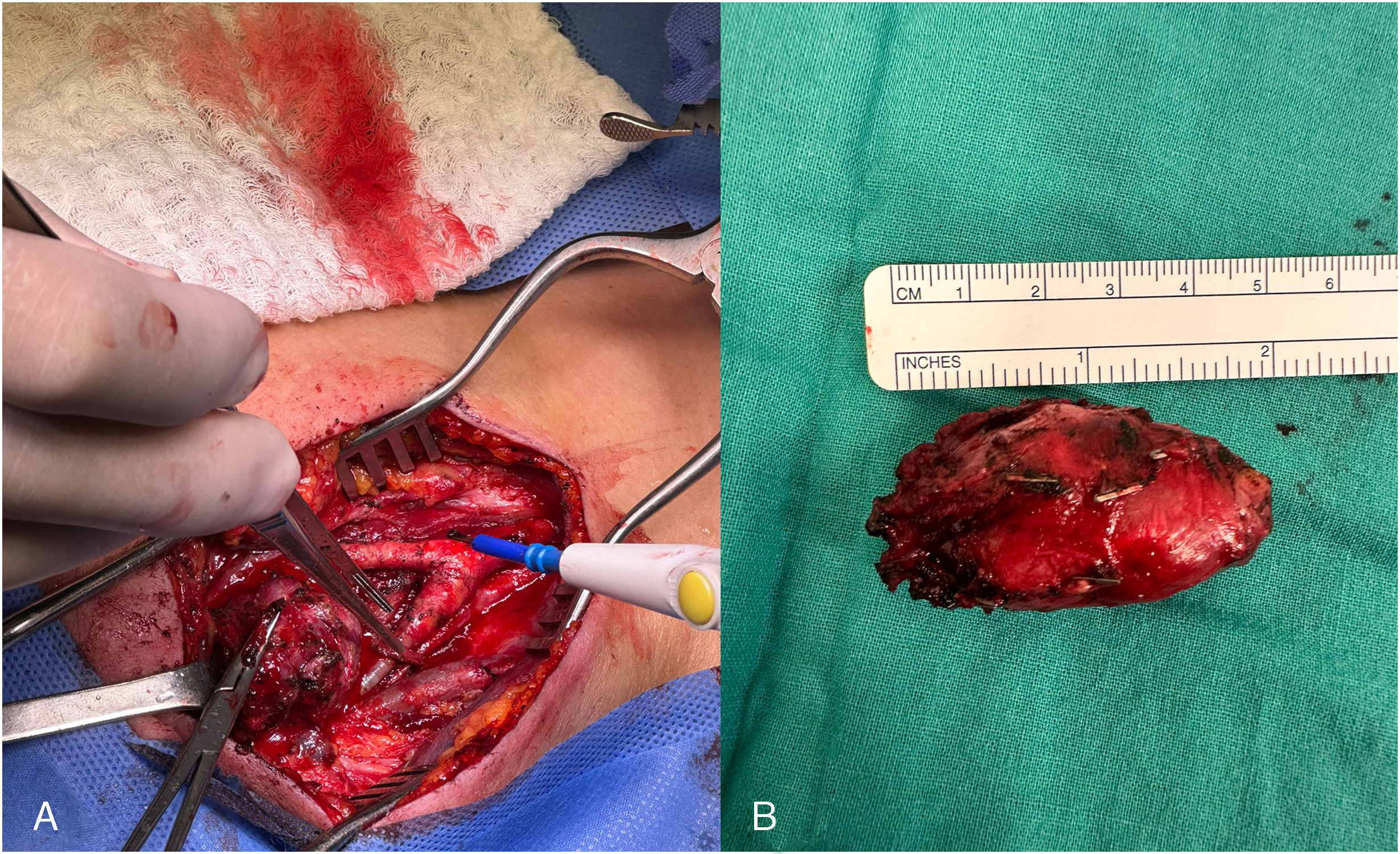
Para la cirugía se realizó una incisión por el borde anterior del esternocleidomastoideo derecho, disecando los planos hasta exponer el paquete vasculonervioso. Se expuso la vena yugular interna y se diseccionó por su borde medial. Se ligaron las venas lingual y facial, lateralizando la vena yugular hasta identificar la arteria carótida común y el nervio vago e hipogloso, apartándolos del tumor. Se identificó el tumor y se procedió a realizar la resección subadventicial mediante electrocauterización bipolar, requiriendo seccionar un asa del nervio hipogloso por su adherencia al tumor. Se logró la resección completa del tumor (fig. 4), con hemostasia adecuada. Para finalizar se comprobó flujo con ecografía Doppler y se dejó un drenaje por el borde caudal, cerrando la incisión.
La paciente evolucionó con disfagia y disfonía. En el examen físico presentó desviación a derecha de la lengua, con apertura mandibular desviada levemente a izquierda. Reflejos velopalatino, tusígeno y deglución de saliva presentes. Es dada de alta al cuarto día postoperatorio, con persistencia de disfagia.
Al mes de postoperada fue evaluada en policlínico de cirugía vascular, con persistencia de disfonía y aminoración de la disfagia. El informe histopatológico concluyó paraganglioma de cuerpo carotídeo, sin necesidad de seguimiento por Oncología. Actualmente se mantiene en terapia con fonoaudiología.
Discusión y conclusiónEl TGC se presenta como una masa de crecimiento lento, localizada a nivel del hueso hioides, anterior al esternocleidomastoideo2. Si bien la mayoría son asintomáticos, pueden ocasionar dolor, disfagia, sensación de masa pulsátil o parálisis nerviosa4. Por otro lado, dada la capacidad de algunos TGC de producir catecolaminas, pueden presentarse signos y síntomas como cefalea, palpitaciones, rubor, hiperglucemia, fiebre, hipertensión o arritmias, las cuales pueden resultar en complicaciones intraoperatorias o incluso la muerte del paciente8. Es por esto que, a pesar de su baja incidencia, es necesario medir metanefrinas y ácido vanilmandélico en orina en el preoperatorio, previniendo así inestabilidad vasomotora o crisis hipertensivas durante la inducción anestésica y fluctuaciones extremas de presión durante la manipulación del tumor3,10. El estudio genético comprenderá los genes VHL (von Hippel-Lindau), RET (neoplasia endocrina múltiple tipo 2), SDHA, SDHB, SDHC, SDHD y SDHAF22.
Los TGC suelen ser benignos y presentan la menor tasa de malignidad de todos los paragangliomas, descrita como menor a un 5%6,11. Su malignidad está definida por la invasión a órganos vecinos, metástasis o recurrencia5,6. La diseminación local representa el 46,7% de las metástasis. Otros sitios de metástasis incluyen pulmón, hueso, hígado y cerebro. En estos casos, los tumores se caracterizan histológicamente por presentar necrosis central, invasión de los espacios vasculares y mitosis11. La supervivencia en diseminación local alcanza el 98% a 3 años. Sin embargo, en tumores que han metastatizado a otras zonas, solamente alcanza el 56% a 6 meses12.
La técnica quirúrgica estándar para el tratamiento del TGC consiste en la resección periadventicial y presenta desafíos terapéuticos importantes de acuerdo con la localización y grado de compromiso de estructuras adyacentes por el tumor1. La clasificación de Shamblin categoriza los TGC en 3 subtipos, determinando así pronóstico y mortalidad. En la clasificación de Shamblin I, el tumor está confinado a la bifurcación de las carótidas; sin embargo, este no está adherido a las paredes de los vasos10, lo que conlleva un riesgo mínimo de complicaciones vasculares o nerviosas2. Un tumor Shamblin II se caracteriza por rodear parcialmente los vasos carotídeos, lo que puede hacer la resección más compleja2. Finalmente, un tumor Shamblin III tiene relación íntima con los vasos carotídeos, rodeándolos completamente; esto determina una disección con elevadas posibilidades de daño vascular o nervioso6, por lo que pueden ser necesarias técnicas para interrumpir el flujo carotídeo y extraer de la forma más segura el tumor1.
Si bien el tratamiento puede ser altamente efectivo y seguro, no está exento de complicaciones9. Las complicaciones más frecuentes en la resección de los TGC son la parálisis de pares craneales adyacentes. En una revisión, se determinó que los nervios vago e hipogloso se dañaron en un 19 y un 22% de los casos, respectivamente13. Los tumores Shamblin III, debido a su mayor grado de compromiso vascular, tienen mayor tasa de complicaciones. La hemorragia promedio en una cirugía para resección de un TGC Shamblin III se estima en 404ml, mientras que para un TGC Shamblin I solo de 78ml13. Además, mientras mayor sea la clasificación, mayores serán el tiempo operatorio y el tiempo de hospitalización1.
Otras complicaciones incluyen infarto cerebral que, aunque poco frecuente, es de las más inquietantes. Esta se reporta entre un 1,5 y un 1,95% de los casos12, variando considerablemente en su extensión. Las lesiones nerviosas que producen desviación de la lengua y ronquera son en su mayoría temporales, con incidencia del 23,1%. Otras complicaciones incluyen hipotensión (0,17%) y disfagia (0,11%)12. La mortalidad intraoperatoria varía entre el 0 y el 2% y en caso de resección incompleta del tumor existen altas tasas de recidiva. Incluso está descrita la aparición de metástasis después de 20 años3.
Dada la delicadeza de estas complicaciones, se requiere de cirujanos altamente especializados. Esta cirugía representa un gran desafío para el cirujano dada la compleja anatomía de la zona involucrada y por ello se han propuesto modificaciones a las técnicas quirúrgicas habituales. Santillán-Aguayo et al.14 describieron recientemente la técnica de disección transbulbar para TGC Shamblin I y II, descrita como de mayor sencillez, que puede ser llevada a cabo con pérdidas de sangre y un tiempo operatorio similar, previniendo con igual eficacia la aparición de complicaciones14.
El reconocimiento de la arteria nutricia del tumor es de relevancia en la planificación de la cirugía, la cual podría requerir su ligadura para el éxito del procedimiento (Singh et al.15). Esta corresponde con mayor frecuencia a la arteria faríngea ascendente, aunque también es posible que nazcan ramas nutricias desde la arteria occipital, arteria tiroidea superior e incluso desde la bifurcación carotídea (arteria glómica)15,16.
Se ha descrito que la embolización previa a la cirugía puede resultar de utilidad para disminuir el tiempo operatorio en TGC Shamblin I y II y el sangrado en TGC Shamblin III12,13,17. Sin embargo, otros estudios han concluido que no habría diferencia significativa en mortalidad, tiempo operatorio, sangrado ni complicaciones15,18,19, lo que podría deberse a la heterogeneidad en los métodos empleados en los centros hospitalarios para la embolización; por ello, aún no existe consenso al respecto15,17.
La cirugía temprana disminuye las complicaciones de los TGC, para lo cual se enfatiza en la importancia de identificar signos clínicos que orienten a la pesquisa precoz para una resolución oportuna. Dentro de estos, se describe el «signo de Fontaine», que consiste en una masa con movimiento lateral, pero que carece de desplazamiento cefalocaudal1, pudiendo ser pulsátiles y en ocasiones auscultarse un soplo6.
Responsabilidades éticasEl presente reporte de caso se llevó a cabo respetando la privacidad y confidencialidad de los datos, se siguieron los protocolos del centro hospitalario y los pacientes entregaron un consentimiento informado.
FinanciaciónN/A.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
N/A.