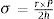La procalcitonina es un valioso biomarcador de infección y se ha confirmado su utilidad para el diagnóstico, el pronóstico y la monitorización del tratamiento en múltiples situaciones clínicas. La infección postoperatoria es una grave complicación tras cirugía cardiaca que aumenta significativamente la morbimortalidad, la cual se reduce con una detección y tratamiento precoces. La inflamación provocada por el trauma quirúrgico o la circulación extracorpórea, así como la hipotermia o los vasoconstrictores, estimulan la liberación de procalcitonina en el postoperatorio no complicado, por lo que su utilidad puede verse mermada. En esta revisión se expone el estado del arte en cuanto al poder predictivo de la procalcitonina como marcador clínico del diagnóstico y del pronóstico de infección en diversos contextos clínicos y la evidencia actual de la utilidad del biomarcador en el diagnóstico y el pronóstico de complicaciones infecciosas y no infecciosas en el postoperatorio cardiaco.
Procalcitonin is a valuable biomarker for the diagnosis and prognosis of infection and for antibiotic treatment monitoring in multiple clinical situations. Postoperative infection is a severe complication after cardiac surgery that increases morbimortality, which can be effectively reduced with early detection and appropriate treatment. Surgical trauma and cardiopulmonary bypass induced inflammation, as well as hypothermia or vasoconstrictors, stimulate the release of procalcitonin in uncomplicated postoperative patients, so its usefulness may be reduced. This review presents the state of the art regarding the predictive value of procalcitonin as a clinical biomarker for the diagnosis and prognosis of infection in various clinical contexts and the current evidence of the usefulness of this biomarker in the diagnosis and prognosis of infectious and non-infectious complications in the cardiac postoperative period.
Las complicaciones infecciosas tras cirugía cardiaca (C_CARD) aumentan enormemente la mortalidad, la estancia hospitalaria y el consumo de recursos, máxime cuando la infección es severa y se asocia a sepsis1. Está ampliamente demostrado que el tratamiento precoz y eficaz del paciente séptico reduce significativamente dicha mortalidad y que un tratamiento antibiótico (ATB) apropiado dirigido a germen y por un periodo de tiempo óptimo maximiza el efecto en la reducción de la morbimortalidad y reduce además los efectos secundarios y la aparición de resistencias bacterianas2. Sin embargo, la identificación microbiológica del germen y, sobre todo, su sensibilidad ATB se retrasan un mínimo de 48-72horas desde la toma de muestras, por lo que poder disponer de algún marcador infeccioso en plasma suficientemente sensible y específico de infección y, si fuera posible, de la etiología concreta de la infección, sería un tremendo avance en el tratamiento de estos pacientes. Si, además, dicho marcador sirviera para determinar de manera precoz la efectividad del tipo y régimen de tratamiento antiinfeccioso seleccionado se aproximaría al biomarcador infeccioso ideal.
La procalcitonina (PCT) es la molécula precursora de la calcitonina, que en condiciones normales es producida por las célulasC del tiroides bajo el control de gen1 del péptido relacionado con el gen de la calcitonina (CALC-1)3. Durante procesos infecciosos, en respuesta a antígenos bacterianos (predominantemente el lipopolisacárido de las bacterias gramnegativas [BGN], pero también componentes de la membrana de las bacterias grampositivas [BGP])4, se produce una sobreexpresión del gen CALC-1 en varios tipos de células y tejidos extratiroideos, incluyendo riñón, hígado, páncreas, leucocitos y tejido adiposo, lo que induce un rápido incremento de los niveles plasmáticos de PCT.
La producción de PCT presenta unos patrones bien establecidos en cuanto al tipo, la localización y la severidad de la infección, de manera que sus niveles plasmáticos aumentan significativamente más en:
- •
Pacientes con sepsis y shock séptico que en infecciones localizadas5.
- •
Pacientes con infecciones bacterianas que en pacientes con infecciones fúngicas, y todavía menos en infecciones parasitarias o víricas (a excepción de las hepatitis, dada la importante contribución del hígado a la producción extratiroidea de PCT).
- •
Pacientes con infecciones por BGN respecto a BGP. Dentro de las BGN, las que más estimulan su producción son las enterobacterias, máxime la Escherichia coli y la Klebsiella. Por su parte, Staphylococcus aureus es la BGP que más estímulo de PCT genera, comparable en ocasiones al de las BGN6, seguida de los estreptococos.
- •
Pacientes con infección intraabdominal o urinaria que en otras localizaciones.
El incremento de los valores de PCT en pacientes críticos con infecciones o traumatismos se demostró por primera vez en el trabajo pionero de Assicot et al.7 en el que se objetivaron niveles de PCT significativamente más elevados en pacientes con quemaduras, infección y sepsis que en pacientes sin estas patologías. Entre ellos se encontraba un paciente tiroidectomizado, lo que sugirió su producción extratiroidea. Posteriormente, Dandona et al.8 estudiaron la liberación de PCT en sujetos sanos tras inyección de endotoxina, y observaron que la PCT se hacía detectable en sangre a partir de las 3-4horas y permanecía elevada al menos 24horas, momento de la última determinación analítica que realizaron. La elevación de PCT fue independiente de los niveles de calcitonina y calcio y fue precedida por un incremento en las concentraciones del TNF-α y de IL-6.
Tras el estímulo infeccioso, los niveles plasmáticos de PCT aumentan y son rápidamente detectables en sangre a las 3-4horas desde el inicio de la sepsis, y alcanzan el pico entre 6 y 24horas. Posteriormente disminuyen inmediatamente con el control de la infección3 debido a una vida media corta de 24-30horas, de manera que el tratamiento ATB óptimo y el control del foco producen reducciones de hasta el 50% de sus niveles cada 24horas9. Por todo ello, se ha llevado a cabo una extensa investigación clínica para determinar el poder discriminativo de la PCT en el diagnóstico de infección y de su etiología en numerosos escenarios clínicos.
Sin embargo, como se ha comentado, la PCT también se incrementa ante estímulos inflamatorios producidos por traumatismos, cirugía, quemaduras extensas, etc.10, ya que citoquinas como IL-1 y TNF-α producen un intenso estímulo de su síntesis. De hecho, hay estudios que sugieren que la inducción de PCT en infecciones por gramnegativos no se produce por el lipopolisacárido en sí mismo, sino a través de la estimulación del TNF-α11. Por su parte, la circulación extracorpórea (CEC), la isquemia inducida por el pinzamiento aórtico y la hipotermia propios de la gran mayoría de las intervenciones cardioquirúrgicas inducen también la producción de PCT12, por lo que el poder discriminatorio del biomarcador tras C_CARD es aún más debatido.
El propósito de esta revisión es: 1)exponer someramente el estado del arte en cuanto al poder predictivo de la PCT como marcador clínico del diagnóstico y del pronóstico de infección en los diversos contextos en los que ha sido ampliamente estudiada, así como su valor en la monitorización de la eficacia y la duración del tratamiento ATB, y 2)exponer la evidencia actual de la utilidad del biomarcador en el diagnóstico y el pronóstico de complicaciones infecciosas y no infecciosas en el postoperatorio de C_CARD.
Valores «normales» de procalcitoninaLos valores de laboratorio normales de PCT y, por tanto, teóricamente discriminativos de ausencia de infección bacteriana se establecen sistemáticamente entre 0 y 0,5ng/ml. Sin embargo, los valores realmente normales de la población sana son habitualmente menores de 0,1ng/ml, prácticamente indetectables8, y en infecciones establecidas localizadas los valores pueden ser tan bajos como menores de 0,1-0,2ng/ml, incluso en pacientes diabéticos5. Por otro lado, los algoritmos de manejo de la patología más estudiada y validada en este campo, la infección respiratoria baja (IRB), establecen puntos de corte de 0,25ng/ml para el inicio y desescalada del tratamiento ATB9. Finalmente, valores tan bajos como de 0,4ng/ml se han identificado como puntos de corte de incremento muy significativo de mortalidad en el caso de infecciones estafilocócicas cuando se asocian a otros biomarcadores13. De hecho, la investigación actual considera como valores clínicamente significativos aquellos por encima de 0,1 y 0,5ng/ml14. Por todo ello, como primer punto a destacar consideramos importante que el valor «normal» de PCT se debe contextualizar en cada paciente y situación clínica, y en ningún caso se debe considerar como sistemáticamente «no patológicos» valores de PCT menores de 0,5ng/ml.
Procalcitonina en otros contextosInfección respiratoria bajaLa IRB es la situación clínica en la que más se ha validado la PCT como biomarcador infeccioso. En una revisión sistemática y metaanálisis Cochrane se analizaron más de 6.700 pacientes incluidos en 26 estudios aleatorizados que compararon una estrategia de inicio y finalización de tratamiento ATB guiada por PCT con un grupo sin determinación del biomarcador15. Se demostró una reducción significativa de la mortalidad a 30días (OR ajustada: 0,83; IC95%: 0,70-0,99; p=0,037) que se confirmó en los diferentes escenarios asistenciales clínicos, como atención primaria, servicios de urgencias y unidades de cuidados intensivos (UCI), así como en las diferentes entidades clínicas (neumonías comunitaria, nosocomial, asociada a ventilación mecánica [NAVM], y también bronquitis aguda) sin evidencia de heterogeneidad (I2=0%). No se evidenció reducción de las estancias hospitalarias o de UCI, pero se demostró una reducción de la exposición ATB media de 8,1 versus 5,7 días (coeficiente de regresión −2,43 días; IC95%: −2,71 a −2,15; p<0,001) y una reducción de los efectos secundarios (16,3% versus 22,1%; OR ajustada: 0,68; IC95%: 0,57-0,82; p<0,001) sin un aumento del fracaso de tratamiento. La variabilidad de los algoritmos utilizados es muy amplia, pero como norma general se utilizan puntos de corte para el inicio y retirada de la antibioterapia de 0,25-0,5ng/ml o, en el último caso, una reducción del valor de PCT del 80-90% respecto al valor inicial en el diagnóstico o una caída del 65% en los primeros 3días.
A raíz de esta evidencia, se ha extendido la aplicación de esta estrategia a documentos de consenso institucionales16 y a guías de práctica clínica, y ha sido aprobada por la Food and Drug Administration (FDA)17. En una reciente guía de la utilidad de la PCT para un uso racional de la antibioterapia consideran la PCT basal de poca utilidad para el inicio de la antibioterapia en este contexto pero sí muy útil para guiar la desescalada tanto en pacientes con neumonía comunitaria como nosocomial/NAVM. La seriación posterior se aconseja cada 72horas en pacientes estables y 48horas en críticos, y se propone desescalada ATB cuando la PCT sea <0,25ng/ml (o de 0,5ng/ml en caso de insuficiencia renal) o menor del 80% de la PCT basal, aunque siempre a partir de 5días en neumonía comunitaria y 7días en nosocomial/NAVM18.
Sepsis / shock sépticoLa PCT se ha usado extensivamente en múltiples trabajos como marcador diagnóstico y pronóstico en sepsis y shock séptico. Sin embargo, la evidencia acerca de la utilidad de la PCT para el inicio y la suspensión de la antibioterapia en el paciente con sepsis ha sido puesta en entredicho en las últimas guías de 2021 de la Surviving Sepsis Campaign1. En cuanto al inicio de la antibioterapia, se ha demostrado una baja sensibilidad (77%) y especificidad (79%) en un metaanálisis de 30 estudios con 3.244 pacientes, sin diferencias en mortalidad precoz (RR: 0,99; IC95%: 0,86-1,15), estancias en UCI ni hospitalarias. Además, la mortalidad tardía, el porcentaje de reingresos y estudios de costes no son consistentemente reportados. Por todo ello, en adultos con sospecha de sepsis o shock séptico el uso de PCT junto a la evaluación clínica para el inicio de la terapia ATB se ha desaconsejado frente al uso aislado del criterio clínico (recomendación débil con muy baja calidad de evidencia).
Por su parte, la discontinuación de la terapia ATB basada en PCT demostró mejoría de la mortalidad (RR: 0,89; IC95%: 0,80-0,99), con una menor duración de la ATB de manera consistente. Sin embargo, no se observó reducción de la estancia en UCI u hospitalaria, el impacto aparente en los costes se basó únicamente en los resultados de un estudio unicéntrico, y la duración de la terapia ATB todavía fue mayor de 7 días en casi todos los estudios. Además, los algoritmos utilizados, la frecuencia de monitorización de PCT y los umbrales para escalada y desescalada ATB entre los diferentes estudios fueron excesivamente heterogéneos, por lo que las guías recomiendan usar la PCT para discontinuación del tratamiento ATB en el paciente séptico exclusivamente en las situaciones en las que se haya conseguido un adecuado control del foco, cuando la duración del ciclo ATB no esté claramente establecida en recomendaciones validadas y siempre acompañado de una estricta valoración clínica. En un más reciente metaanálisis con 26 estudios aleatorizados y más de 9.000 pacientes sépticos, la terapia guiada por PCT redujo la mortalidad a 28 días (OR: 0,84; IC95%: 0,74-0,95; p=0,008) y la duración de la terapia antibiótica en casi 2días, sin impacto alguno en la estancias en UCI u hospitalaria2. Aunque no se observó incremento de las infecciones secundarias, se produjo un aumento de las infecciones recurrentes. La reducción de la mortalidad fue más evidente en los pacientes en los que se definió la sepsis según criterio de Sepsis-3, en pacientes médicos respecto a los posquirúrgicos y en aquellos estudios en los que se utilizó la PCT para la finalización del ATB, todo ello relacionado con una reducción significativa de la duración del tratamiento. La reducción de la mortalidad en este contexto podría deberse a la minimización de los eventos asociados a una prolongación inadecuada del tratamiento ATB, como la aparición de infecciones recurrentes o a distancia por gérmenes multirresistentes o efectos farmacológicos adversos19.
En este contexto se ha intentado mejorar el rendimiento diagnóstico de la PCT mediante el concepto de «aclaramiento de PCT», que, como veremos más adelante, también se ha estudiado en el contexto de la C_CARD. Patnaik et al.3 incluyeron 1.974 pacientes procedentes de 10 estudios en un reciente metaanálisis que analizó el impacto del aclaramiento de PCT en la mortalidad en el paciente con sepsis y shock séptico y evidenció que un aclaramiento reducido en las determinaciones seriadas era un predictor de mortalidad con un área bajo la curva (AUC) de 0,711 (IC95%: 0,662-0,760) y 0,708 (IC95%: 0,648-0,769) bajo los modelos de efectos fijos y aleatorios, respectivamente. Los puntos de corte fueron variables a lo largo de los estudios. El trabajo de Schuetz et al.20 fue el estudio con mayor número de pacientes (n=646) de todos los incluidos en este metaanálisis y, aunque observacional, se realizó de manera prospectiva y multicéntrica. Se determinó la PCT diariamente durante 5días tras el inicio de la sepsis y un aclaramiento menor del 80% al 4.° día respecto al valor basal del inicio de la sepsis duplicó la mortalidad a 28días. Por su parte, Karlsson et al. evidenciaron que un aclaramiento menor del 50% a las 72horas aumentaba la mortalidad hospitalaria (29,8% versus 12,2%)21.
Por todo ello, respecto a la sepsis y al shock séptico se debe seguir investigando en la utilidad de la PCT para el manejo del tratamiento ATB, siendo especialmente atractivo el concepto de la validación de la variabilidad de los valores de la PCT más que sus valores absolutos.
Infección urinariaEn el contexto de infección del tracto urinario (ITU) la PCT ha sido predominantemente estudiada para la diferenciación de la ITU febril respecto a la sepsis urinaria, que comporta un incremento significativo de la morbimortalidad. A este respecto, valores de 0,25ng/ml han demostrado una adecuada sensibilidad del 95% (IC95%: 0,89-0,98) para descartar sepsis urinaria22, mientras que por encima de 1,16ng/ml la sensibilidad se eleva al 100% y la especificidad también se comporta adecuadamente (97%), con valor predictivo positivo (VPP) y negativo (VPN) del 84% y del 100%, respectivamente, para el diagnóstico de bacteriemia23. Luo et al.24 han descrito que una ratio PCT/albúmina por encima de 0,44 es un predictor independiente de sepsis urinaria (OR: 1,029; IC95%: 1,013-1,045; p<0,001) con sensibilidad del 84,6% y especificidad del 96,0%.
En un estudio aleatorizado con 125 pacientes se evaluó un exhaustivo algoritmo basado en la determinación y la monitorización de PCT y piuria para inicio y desescalada del tratamiento antibiótico en ITU25. Se contemplaron la duración y la selección del ATB tanto en el contexto ambulatorio como en el hospitalario. Se observó una reducción del 30% de la exposición antibiótica con similares resultados de mortalidad, recurrencia/persistencia de infección, rehospitalización y muerte, excepto más infección recurrente en pacientes bacteriémicos en el grupo PCT/piuria, aunque sin mayor tasa de reingreso. Aunque es un estudio con pocos pacientes, denota de nuevo un potencial papel de la PCT en el manejo de los pacientes con ITU.
Endocarditis infecciosaLa PCT se eleva también en endocarditis infecciosa (EI). En pacientes con bacteriemia, los valores de PCT son mayores en pacientes diagnosticados de EI que en otras causas. Knudsen et al.26 extrajeron muestras de PCT a 759 pacientes con sospecha de EI, en 147 de los cuales se confirmó el diagnóstico. Los enfermos con EI presentaron valores de PCT significativamente superiores al resto en el momento del diagnóstico (0,21 [IC95%: 0,10-0,71] versus 0,13 [IC95%: 0,06-0,38]; p=0,001). En otra serie con menos pacientes se obtuvieron los mismos hallazgos pero con valores medianos de PCT superiores (6,56ng/ml versus 0,44ng/ml; p=0,001)27. El motivo de esta diferencia puede radicar en que en esta última serie casi el 60% de los pacientes presentaban EI por S.aureus, y se ha observado de manera consistente que este germen induce una elevación mayor de PCT que en EI por otros grampositivos y similar a bacteriemias por gramnegativos26-28. Adicionalmente, las EI por S.aureus inducen mayor elevación de PCT que las bacteriemias por dicho germen sin EI25.
En cuanto a la capacidad diagnóstica de la PCT en EI, Tascini et al.13 evidenciaron una capacidad predictiva elevada para el diagnóstico causal en pacientes con EI mediante la combinación de las cifras de PCT, leucocitos y proteínaC reactiva (PCR), de manera que con valores superiores a 1,7ng/ml, 130mg/l y 12.800 leucocitos/mm3, respectivamente, el riesgo de presentar una EI por S.aureus se incrementaba 20 veces. Por su parte, valores superiores a 0,4ng/ml, 85mg/l y 10.535 leucocitos/mm3 incrementaban el riesgo de muerte 27 veces.
A pesar de todo ello, en estos estudios y en un reciente metaanálisis29 se ha evidenciado un excesivo margen en los valores de la PCT en pacientes diagnosticados de EI, con gran solapamiento en relación con los valores obtenidos durante bacteriemias provocadas por otras etiologías, lo que hace muy difícil establecer puntos de corte lo suficientemente sensibles y específicos como para tener un valor predictivo y discriminativo clínicamente útil para el diagnóstico de EI y orientar en la estrategia terapéutica.
En cuanto a la estratificación pronóstica, los pacientes con mayores valores de PCT en el momento del diagnóstico de la EI podrían presentar un mayor riesgo de complicaciones. Cornelissen et al.28 observaron que una mayor PCT se relacionó con la aparición de eventos adversos como muerte, complicaciones infecciosas y no infecciosas graves (insuficiencia cardiaca, shock séptico, embolismo periférico, etc.) o necesidad de cirugía valvular. En el análisis ROC, una PCT de 0,5ng/ml presentó una sensibilidad del 73%, una especificidad del 79% y un VPP/VPN de 79/73%, respectivamente, para la aparición de estos eventos.
Finalmente, no existen trabajos que hayan estudiado el comportamiento de los valores de PCT durante el tratamiento ATB y la idoneidad de la suspensión del tratamiento como en otras patologías. El elevado riesgo de recurrencias hace difícil un estudio de este tipo con un diseño apropiado28. Kocazeybek et al.30 realizaron PCT basales a pacientes diagnosticados de EI y observaron que los pacientes que finalmente precisaron cirugía presentaron valores significativamente superiores a los 15 días del inicio del tratamiento que aquellos que evolucionaron favorablemente con tratamiento médico.
Por todo ello, las guías de 2023 de la Sociedad Europea de Cardiología establecen que tanto la PCR como la PCT pueden ser utilizadas para estimar la severidad de la sepsis asociada a la EI, pero que no son útiles para su diagnóstico31. Además, establecen que podría ser usada para estratificación del riesgo en pacientes críticos y para monitorizar la respuesta al tratamiento ATB (a pesar de la escasa literatura al respecto), como en el caso de otros pacientes sépticos, aunque para ello se necesitarían estudios controlados específicos a gran escala.
Procalcitonina en cirugía cardiacaValores normales de procalcitonina tras cirugía cardiacaComo se ha comentado, el trauma quirúrgico per se y, adicionalmente, la reacción inflamatoria inducida por la CEC, el pinzamiento aórtico y la hipotermia también elevan los niveles de PCT de manera significativa en el postoperatorio inmediato normal de C_CARD12. Por ello, la interpretación del valor de esta molécula en el diagnóstico de complicaciones infecciosas es aún más difícil.
La PCT tras C_CARD no complicada con CEC por esternotomía media presenta típicamente un pico a las 24horas de la cirugía y después desciende rápidamente hasta normalizar sus valores entre el 3.er y el 5.° día postoperatorio (DPO)32. Los valores pico medios normales a las 24horas se han descrito entre 0,8 y 2,0ng/ml11,33,34. En la serie de Prat et al.11 con 152 pacientes electivos coronarios (con y sin CEC) y valvulares que evolucionaron sin complicaciones postoperatorias, a las 24horas tan solo el 3,7% de los pacientes presentaban valores entre 1 y 2ng/ml y ningún paciente presentó valores superiores a 2ng/ml.
Los valores plasmáticos aumentan significativamente menos en pacientes sometidos a cirugía sin CEC35 y en aquellos operados por abordajes mínimamente invasivos32. Por el contrario, el uso de hipotermia moderada-profunda y la parada circulatoria induce niveles más elevados12,33.
Existe controversia en si el tiempo de CEC y de pinzamiento aórtico influyen en una mayor liberación de PCT en pacientes sin complicaciones. En el estudio de Loebe et al.12(Procalcitonin in Heart Surgery study, ProHearts) se determinó diariamente hasta el alta la PCT en 722 pacientes sometidos a todo tipo de C_CARD electiva bajo hipotermia leve (28-32°C) y encontraron que los niveles de PCT fueron directamente proporcionales al tiempo de CEC tanto en cirugía valvular como coronaria. De igual manera, Cheng y Chen36 observaron una correlación positiva entre el tiempo de CEC y los niveles de PCT tras C_CARD con CEC bajo hipotermia moderada a 28°C, electiva y predominantemente coronaria con tiempos medios de CEC elevados (147±32 y 135±22,3min), todo lo cual puede explicar valores basales de PCT medios de la población global exageradamente elevados a las 24horas (5,63ng/ml).
Sin embargo, en otra serie más contemporánea de pacientes intervenidos en normotermia, los valores de la prohormona no variaron según el tiempo de CEC o de pinzamiento aórtico en los pacientes no complicados11. Aparte del grado de hipotermia, entre ambos estudios, también hay diferencias significativas en el uso de vasoconstrictores, lo que se ha observado también como un consistente inductor de aumento de PCT33. Kilger et al.33 estudiaron los niveles de PCT en pacientes con postoperatorio no complicado de C_CARD, definido como aquellos pacientes dados de alta durante las primeras 48horas postoperatorias de la UCI y que no presentaron otras complicaciones médicas posteriores. Observaron que los pacientes que necesitaron noradrenalina por hipotensión con gasto cardiaco adecuado presentaron valores pico de PCT mayores que aquellos que no necesitaron vasoconstrictores) (3,5 [IC95%: 2,6-9,8] versus 2,0 [IC95%: 0,7-3,7] ng/ml (p<0,05), en ambos casos a las 15horas postoperatorias).
Predicción de mortalidad y complicaciones globalesLa PCT es un potente marcador de mortalidad10,12,37 y de complicaciones postoperatorias precoces38 y tardías39 en pacientes sometidos a C_CARD con CEC y sin CEC. En algunos trabajos se ha identificado como mejor predictor de mortalidad que el propio EUROSCORE10. En estos casos se produce una elevación patológica de PCT postoperatoria hasta niveles significativamente mayores y más prolongados que en un postoperatorio normal, sobre todo en relación con el síndrome de respuesta inflamatoria sistémica (SIRS) post-CEC34,40 e infecciones postoperatorias41,42, pero también trasfusión de hemoderivados39, bajo gasto cardiaco e hipoperfusión sistémica, uso de vasoconstrictores o de balón de contrapulsación12, entre otros. En la mayoría de los trabajos, la capacidad de la PCT para discriminar entre complicaciones infecciosas y no infecciosas es limitada37.
La detección precoz de niveles anormalmente elevados de PCT en pacientes aparentemente no complicados podría alertar de potenciales complicaciones, aumentar el nivel de vigilancia en estos pacientes, ayudar a prevenirlas o, en caso de producirse, propiciar una detección y tratamiento más precoces. A este respecto, Klingele et al.38 analizaron 751 pacientes electivos candidatos a C_CARD con CEC con un postoperatorio inicial sin complicaciones (definido como alta de UCI en las primeras 24horas, estabilidad hemodinámica y respiratoria, ausencia de ictus o reoperación por sangrado y con función renal normal). Mediante una única determinación de PCT a las 24horas de la cirugía intentaron predecir complicaciones postoperatorias tardías definidas como el evento compuesto de muerte, reingreso en la UCI o estancia hospitalaria mayor de 12días. Observaron valores de PCT mucho más elevados en pacientes que posteriormente presentaron complicaciones (8,6±13,5 versus 0,9±1,2; p<0,001) con un AUC de 0,90 y un valor óptimo de corte de 2,95ng/ml (sensibilidad 0,73, especificidad 0,97). En el análisis multivariante una PCT mayor de ese valor incrementaba muy significativamente el riesgo de complicaciones (OR: 110,2; IC95%: 51,5-235,5).
Predicción de síndrome de respuesta inflamatoria sistémica e infecciónTodos los pacientes sometidos a C_CARD bajo CEC presentan una respuesta inflamatoria sistémica debido a la interacción de la sangre con la CEC, la isquemia miocárdica, etc. Un porcentaje elevado presentan SIRS, definido como una respuesta exagerada a dicha reacción inflamatoria manifestada con dos de los siguientes criterios: 1)temperatura corporal >38°C o <36°C; 2)frecuencia cardíaca >90latidos/min; 3)frecuencia respiratoria >20 respiraciones/min o presión parcial de CO2 (pCO2) <32mmHg o necesidad de soporte ventilatorio mecánico, y 4)leucocitos >12.000/μl o <4.000/μl, o >10% de formas inmaduras43. De manera análoga a lo que ocurre en la sepsis, cuando se produce disfunción orgánica asociada se considera SIRS severo44. La PCT se eleva más en los pacientes con SIRS tras C_CARD que en aquellos no complicados34, pero como marcador es un mal predictor de SIRS aislado. Kerbaul et al.45 no encontraron diferencias entre el grupo control no complicado y el grupo con SIRS, salvo en aquellos pacientes que desarrollaron disfunción orgánica.
Se ha descrito que la lesión pulmonar asociada podría ser el mayor inductor de liberación de PCT en pacientes con SIRS. Hensel et al.44 observaron que 4horas tras la cirugía la PCT se elevaba significativamente más en pacientes con lesión pulmonar asociada a SIRS que en pacientes sin SIRS, y también que aquellos con SIRS sin lesión pulmonar. Por su parte, Cheng y Chen36 siguieron durante 7 días a casi 300 pacientes sometidos a C_CARD electiva con CEC y observaron que presentar una PCT muy elevada (>7ng/ml) en el 1.er DPO suponía un mayor riesgo de presentar síndrome de distress respiratorio del adulto (SDRA; 21,9% versus 5,6%; p<0,001) con una RR de presentar SDRA de 6,8 (IC95%: 2,7-7,4), y de SDRA moderado-severo de 57,3 (IC95%: 10,4 3-316,3). El AUC para detectar SDRA moderado-severo fue de 0,73, con una excelente sensibilidad y especificidad (del 100% y del 79,9%, respectivamente) para un punto de corte de 6,5ng/ml. Sin embargo, en este estudio son destacables unos tiempos medios de CEC y de ventilación mecánica elevados (1,7±1,7 días), que pueden explicar los valores basales de la población total (5,63ng/ml) y también de la cohorte con PCT «baja» (2,7±1,4ng/ml).
Los pacientes sometidos a C_CARD pueden tener graves infecciones postoperatorias que impactan significativamente en el pronóstico. Su detección y tratamiento eficaz precoces son esenciales para minimizar la morbimortalidad. Por desgracia, debido al solapamiento en los mecanismos de activación de la síntesis de PCT, la diferenciación entre SIRS e infección/sepsis tras el postoperatorio de C_CARD puede ser todavía dificultosa.
En los pacientes con infección se ha observado que los valores de PCT no regresan a la normalidad tras el 1.er DPO sino que siguen incrementándose42. Rosmarakis et al.41 observaron en un estudio con 216 pacientes coronarios sin bomba que en los pacientes sin complicaciones valores mayores de 2ng/ml en los días 1 y 2 fueron anecdóticos (5% de los casos), mientras que entre los pacientes que desarrollaron complicaciones infecciosas el 50% y el 62% presentaron valores por encima de esa cifra a las 24 y 48horas, respectivamente, y hasta un cuarto presentaron valores >10ng/ml a las 48horas.
Como en otros escenarios, la elevación de PCT tras C_CARD es máxima en cuadros de shock séptico (96,98±119,61ng/ml) donde la infección grave se suma a la reacción inflamatoria severa, y se eleva moderadamente en bacteriemias (3,57±2,98ng/ml) y neumonías (4,85±3,31ng)32. Por su parte y de manera llamativa, la PCT se eleva muy poco en casos de mediastinitis sin bacteriemia o shock séptico asociados (0,80±0,58 ng/ml)32 a pesar de la gravedad local de la infección, lo cual nos alerta acerca del escaso valor de la PCT en la evaluación de un paciente con signos locales de infección o inestabilidad esternal para el cribado entre infecciones superficiales o profundas o, incluso, entre procesos de inestabilidad esternal aséptica y mediastinitis.
Se han descrito varios puntos de corte para el rendimiento diagnóstico de infección postoperatoria mediante determinación de PCT. Aouifi et al.32, en un estudio que incluyó a 97 pacientes febriles tras el 2.° DPO de C_CARD con CEC electiva, siguieron prospectivamente su estatus infeccioso y encontraron que una PCT de 1ng/ml más tardía de las primeras 48horas presentó una sensibilidad del 85%, una especificidad del 95% y VPP/VPN del 96% y del 84%, respectivamente. La falta de especificidad puede deberse a elevaciones de PCT por SIRS persistente, sobre todo en caso de lesión pulmonar aguda asociada32. De hecho, se ha observado específicamente que la afectación respiratoria infecciosa potencia especialmente la liberación de PCT en caso de SIRS asociado. En una cohorte de 402 pacientes sometidos a cirugía coronaria sin bomba, en la que ninguno presentó SIRS severo, Liu et al.43 observaron que la PCT en el 1.er DPO se comportó mucho mejor para diagnosticar neumonía postoperatoria que en los pacientes con SIRS asociado que sin SIRS, con un punto de corte para predecir neumonía de 1,775ng/ml con sensibilidad (85%) y especificidad (89%) excelentes. Carrasco-Castilla et al.46 realizaron determinaciones de PCT a las 24 y a las 72horas postoperatorias en 142 pacientes adultos sometidos a C_CARD con CEC, de los cuales el 4,9% desarrollaron sepsis según la escala Sequential Sepsis-Related Organ Failure Assessment (SOFA) con confirmación microbiológica. El AUC de los niveles de PCT para el diagnóstico de sepsis a las 24 y a las 72horas fue de 0,921 (IC95%: 0,849-0,992, punto de corte 3,8ng/ml) y 0,868 (IC95%: 0,653-0,999, punto de corte 8,4ng/ml), respectivamente. La sensibilidad y la especificidad fueron de 0,857 (IC95%: 0,487-0,974) para el punto de corte de las 24horas y de 0,904 (IC95%: 0,842-0,943) para el de 72horas. Sin embargo, la población estudiada fue muy heterogénea, con un 7% de pacientes urgentes e inclusión de todo tipo de cirugías. Además, contrariamente a la práctica clínica habitual, en el 26,8% no se administró profilaxis ATB perioperatoria. Por su parte, en un metaanálisis con casi 3.000 pacientes sometidos a C_CARD con y sin CEC incluidos en 10 estudios observacionales unicéntricos, 5 de ellos de carácter retrospectivo17, se estableció un punto de corte óptimo para el diagnóstico de infección postoperatoria en 3ng/ml en el segundo DPO, aunque con unas pobres sensibilidad y especificidad medias de 0,67 (IC95%: 0,47-0,82) y 0,73 (IC95%: 0,65-0,79), respectivamente, y un AUC de 0,75 (IC95%: 0,29-0,95). El VPP fue a lo sumo del 50%, incluso con prevalencias estimadas del 30%, aunque un VPN entre 83 y 98% con prevalencias entre el 30% y el 5%, por lo que los autores concluyen que la PCT en tras C_CARD es útil para descartar infección pero no para confirmarla. Por tanto, al igual que ocurre para el SIRS aislado, la PCT como marcador de infección en determinaciones aisladas presenta valores predictivos y puntos de corte variables, lo que hace difícil una interpretación fiable definitiva.
Para intentar mejorar este valor predictivo, se ha estudiado el valor de la dinámica de los valores plasmáticos mediante el aclaramiento de PCR también en los pacientes sometidos a C_CARD. Miao et al.42 analizaron el impacto de los cambios dinámicos de la PCT y su aclaramiento en 210 pacientes adultos sometidos a C_CARD con CEC con ingreso postoperatorio superior a 7 días. En este caso el aclaramiento se definió mediante la siguiente fórmula:
El mejor rendimiento diagnóstico se alcanzó al 3.er DPO. Un aclaramiento de PCT menor del 16,3% al tercer día o una reducción absoluta menor de 2,11ng/ml predijo infección con AUC del 0,66 y del 0,72, respectivamente.
No existen trabajos que hayan estudiado el comportamiento de la PCT en las diversas situaciones previamente mencionadas (IRB, sepsis/shock séptico, EI, etc.) concretamente en el postoperatorio, por lo que la aplicabilidad de los diferentes algoritmos o puntos de corte sugeridos en pacientes no cardioquirúrgicos está por establecer.
Procalcitonina e insuficiencia renalEl fracaso renal agudo (FRA) altera los niveles de PCT debido a una disminución en su aclaramiento plasmático (sobre todo en las fases oligúricas pero incluso desde las fases más iniciales del daño renal) y a la elevación de citoquinas proinflamatorias como la IL-1, la IL-6 o el NFK-B47. Sin embargo, la PCT sigue siendo un excelente marcador de infección en estos pacientes, incluso en aquellos con terapia de sustitución renal48. De hecho, en caso de FRA, la PCT se comporta mejor en este sentido que otros marcadores validados de infección y sepsis como la presepsina49. Por su parte, Takahashi et al.50 observaron en 403 muestras sanguíneas de 91 pacientes que el rendimiento diagnóstico de infección es incluso mejor en pacientes con FRA que en aquellos con función renal normal, aunque los puntos de corte para el diagnóstico de sepsis fueron significativamente mayores. Por otro lado, los valores de PCT también pueden predecir el desarrollo de FRA en múltiples situaciones clínicas, y su capacidad diagnóstica en este contexto se ve mermada precisamente por la presencia de infección y, sobre todo, sepsis47.
En el perioperatorio de cirugía cardiaca, el FRA duplica los valores de la PCT5°. Concretamente se ha estimado que la cifra de PCT decrece en 0,3-0,4ng/ml por cada unidad de aumento de aclaramiento de creatinina52. En estos pacientes, la PCT también es un potente predictor de FRA53 y, a diferencia de los que ocurre en otras situaciones mencionadas previamente, el rendimiento diagnóstico de infección/sepsis puede reducirse en el caso de FRA. En un estudio observacional con 440 pacientes intervenidos con CEC se observó que en caso de FRA postoperatorio el rendimiento diagnóstico de la PCT para identificar pacientes con sepsis disminuía significativamente. En pacientes con función renal preservada con valores de PCT mayores de 2,5ng/ml la probabilidad de infección fue muy elevada, pero en caso de FRA con creatinina mayor de 2mg/dl los valores de PCT de los pacientes con y sin infección fueron similares54. Estos hallazgos pueden ser debidos a una mala correlación con los puntos de corte convencionales. A favor de ello, y en el caso concreto de la neumonía postoperatoria, De la Varga et al.52 observaron en un estudio prospectivo con más de 800 pacientes que la capacidad diagnóstica de la PCT no decrecía en pacientes con FRA postoperatorio, pero que los puntos de corte óptimos variaban (0,78ng/ml en función renal normal versus 1ng/ml en caso de FRA) y la precisión diagnóstica del biomarcador mejoraba significativamente cuando se adaptaban esos puntos de corte a la función renal.
Procalcitonina versus proteína C reactiva en cirugía cardiacaLa PCR se eleva más tardíamente en el postoperatorio cardiaco, con un pico alrededor de las 40-48horas55, y desaparece más tardíamente. De manera reiterada se ha demostrado que sus niveles no varían de manera significativa en pacientes con complicaciones infecciosas o inflamatorias tras la C_CARD respecto a los que no presentan dichas complicaciones, sobre todo en las primeras fases del postoperatorio, por lo que se considera un pobre marcador en este sentido, mucho menos rentable que la PCT12,32,41,51. Concretamente, Aouifi et al.32 encontraron que para la predicción de infección la PCR era razonablemente sensible (84%) pero muy poco específica (40%) para un punto de corte de 50mg/l. Las AUC de las curvas ROC fueron significativamente mejores para la PCT que para la PCR (0,82 versus 0,68, respectivamente). Heredia et al.56, en un estudio retrospectivo con 423 pacientes intervenidos con CEC, observaron que los valores de PCR fueron similares durante los primeros 7días en pacientes con y sin infección postoperatoria.
La cifra de leucocitos y su dinámica es igualmente errática y nada específica de procesos infecciosos y no infecciosos postoperatorios38.
Combinación de PCT con otros marcadores en el diagnóstico de infección postoperatoriaLa utilización de combinaciones de marcadores inflamatorios ha resultado en una mejoría de la predicción diagnóstica en diversas patologías infecciosas. Zhao y Li57 observaron que la determinación combinada de PCT, D-dímero e IL-6 discriminaban mucho mejor el diagnóstico de sepsis y sepsis severa en más de 650 pacientes admitidos en el departamento de urgencias (AUC de 0,866 para la combinación respecto a 0,758 para la PCT aislada, 0,740 para la IL-6 y 0,704 para el D-dímero en el caso de sepsis severa). En sepsis urinaria la combinación de PCT, PCR y amiloideA plasmático permite mejorar significativamente la especificidad diagnóstica a más de un 95,5%58.
Desde un punto de vista pronóstico, en 349 pacientes críticos diagnosticados de sepsis según la definición de sepsis 3.0, Huang et al.59 observaron que la combinación de CD64 con PCR predijo mejor la mortalidad a 28 días que la combinación CD64/PCT o que dichos marcadores aislados. Por su parte, Ryoo et al.60, en un estudio prospectivo con 1.772 pacientes con shock séptico, la combinación de PCT y PCR elevadas predijeron mortalidad a 28 días de manera mucho más eficaz que la elevación aislada de PCT. En endocarditis infecciosa, la combinación de PCT y PCR elevadas junto a baja albúmina plasmática en el momento del diagnóstico se ha usado para elaborar sistemas de puntuación de riesgo de mortalidad61.
En el caso concreto del postoperatorio de cirugía cardiaca, existe poca evidencia al respecto, por lo que, por el momento, solo la extrapolación de estos resultados, con las limitaciones que ello conlleva, podría ser de cierta utilidad. Heredia et al.56 observaron en la cohorte previamente mencionada que cuando la PCT y la cifra de leucocitos superaban de manera combinada en más de 3 veces los puntos de corte establecidos aumentaba el riesgo de infección postoperatoria 10 veces.
Procalcitonina como diana terapéuticaLa PCT ha sido involucrada en la amplificación de la respuesta inflamatoria inducida por la sepsis en animales de experimentación, por lo que se le ha achacado no solo el papel de biomarcador, sino también el de molécula mediadora tóxica durante la sepsis. Al igual que el lipopolisacárido, la PCT aumenta la expresión de marcadores de superficie en neutrófilos humanos y linfocitos (CD16 y CD14, respectivamente)62. Se ha observado, además, que el TNF-α, potente inductor de la producción de PCT, es el mediador que más incrementa su concentración, lo cual provoca un efecto cascada entre ambas moléculas y una exacerbación de la reacción inflamatoria. Por otra parte, la PCT disminuye la capacidad fagocítica de los neutrófilos de manera dosis-dependiente, inhibe la capacidad bactericida del suero humano ante cultivos de E.coli, suprime la transformación blástica de los linfocitosT activados, reduce significativamente la capacidad quimiotáctica de los polimorfonucleares y la capacidad fagocítica de los macrófagos62. La PCT modula además la síntesis de óxido nítrico-sintasa inducible (responsable de vasoplejía e hipotensión durante la sepsis) estimulado por TNF-α e IL-6 de una manera dosis-dependiente11.
La administración de PCT exógena a hámsteres sometidos a un modelo de sepsis por implante de pellets de E.coli intraabdominales aumentó la mortalidad de manera significativa63. Por otro lado, la inmunosupresión de la PCT en modelos animales de sepsis reduce llamativamente la mortalidad en modelos de roedores y porcinos63,64. La inyección de IgG purificada anti-PCT de manera precoz antes del inicio de la sepsis tanto tardía en estados avanzados de la misma redujo muy llamativamente la mortalidad de los animales. A nuestro entender, no se ha continuado con esta línea de investigación clínica posteriormente a estos trabajos experimentales.
ConclusionesLa elevación de PCT, y no la PCR o la cifra de leucocitos, es un potente predictor de complicaciones infecciosas y no infecciosas tras cirugía cardiaca, aunque los puntos de corte no están bien establecidos. En cirugía no complicada sigue patrones relativamente constantes, con un pico en el primer día POP y una normalización entre el 3-7.° día. Al igual que en otras aplicaciones clínicas, la PCT se debe considerar de manera dinámica en el tiempo más que como una determinación aislada. La alteración de la función renal eleva los valores basales de PCT y afecta al rendimiento diagnóstico en caso de infección. La PCT debería ser implementada de manera rutinaria entre las determinaciones analíticas de los pacientes sometidos a C_CARD con CEC y sin CEC a las 24 y 48horas para poder establecer valores pico basales que puedan ser utilizados posteriormente en caso de sospecha de infección postoperatoria.
Dado el grado de evidencia actual, sería fundamental la realización de estudios aleatorizados controlados que evaluaran la eficacia de la implementación de PCT para el diagnóstico de infección y algoritmos de inicio y desescalada de tratamiento ATB en las diferentes situaciones clínicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.