El carcinoma de células claras originado en la pared abdominal es una entidad rara y generalmente está asociado a implantes iatrogénicos de tejido endometrial, por una incisión quirúrgica durante la operación cesárea u otros procedimientos ginecológicos, su fisiopatología es compleja y controversial.
Caso clínicoPaciente del sexo femenino de 45 años con antecedente de 3 cesáreas, que acude con masa tumoral en la pared anterior del abdomen de 6 meses de evolución. Los estudios de imagen confirmaron su localización, con dimensiones de 9 por 7 cm que hicieron sospechar en un tumor del uraco; con ese diagnóstico se decidió llevar a resección amplia. El reporte final de patología fue de adenocarcinoma de células claras originado en foco endometriósico, con márgenes quirúrgicos negativos.
ConclusiónEsta entidad es excepcionalmente rara, hay pocos casos publicados, su conocimiento es esencial para incluirla en el diagnóstico diferencial de tumores de pared abdominal.
Clear cell carcinoma originating in the abdominal wall is a rare event. It is generally associated with endometrial tissue implants left behind after a caesarean section or other gynaecological operations. Its pathophysiology is complex and controversial.
Clinical caseThe case is presented of a 45 year-old female with history of three caesarean sections, who was seen due to having a tumour mass of 6 months onset in the anterior abdominal wall. Imaging studies confirmed its location, and due to measuring 9 by 7 cm it was suspected to be an urachal tumour. A resection with wide margins was performed. The histopathology report was of a clear cell adenocarcinoma originated in ectopic endometrial tissue, with negative margins.
ConclusionThis is a very rare case, with few cases reported in the literature. This diagnosis should be included in tumours of the abdominal wall.
La presencia y el crecimiento de tejido endometrial fuera del útero se denomina endometriosis y si forma una colección quística se conoce como endometrioma1; su prevalencia es variable2, en la edad reproductiva es del 10% y se eleva al 30-50% cuando está asociado a dolor pélvico e infertilidad. La edad promedio de presentación es 30 años (rango 25-35), el hueco pélvico es el sitio de afección principal (75% en el ovario); sin embargo, cualquier parte del cuerpo puede afectarse1 (pulmón, ojo, cerebro, tejidos blandos). La pared abdominal es el sitio extrapélvico más frecuente3,4, su fisiopatología es compleja y controversial, existen diversas teorías que explican su origen, tales como1: menstruación retrógrada, metaplasia del epitelio celómico, diseminación vascular y linfática, activación de restos embrionarios y los implantes iatrogénicos durante un procedimiento quirúrgico abierto o laparoscópico de cirugías ginecológicas como la cesárea (57% casos) e histerectomías.
Tiene una incidencia de 0.03 a 3.5%3,5,6, su transformación maligna es extremadamente rara7,8, pero está descrita desde 19259.
Se manifiesta10-13 como una masa tumoral subcutánea de crecimiento progresivo asociada a dolor cíclico durante la menstruación.
El abordaje diagnóstico incluye: ultrasonido de pared abdominal, biopsia para documentar la malignidad, que se complementa con una tomografía axial computada para evaluar la extensión y resecabilidad.
Los diagnósticos diferenciales incluyen causas benignas, como hernia incisional, hematoma de la vaina de los músculos rectos del abdomen, y neoplasias primarias de pared abdominal o metastásicas.
Su tratamiento es la resección amplia con reconstrucción de la pared abdominal, que generalmente aportan buenos resultados oncológicos; sin embargo, la experiencia es limitada por la rareza de esta entidad.
ObjetivoPresentamos un caso clínico que simuló un tumor de uraco.
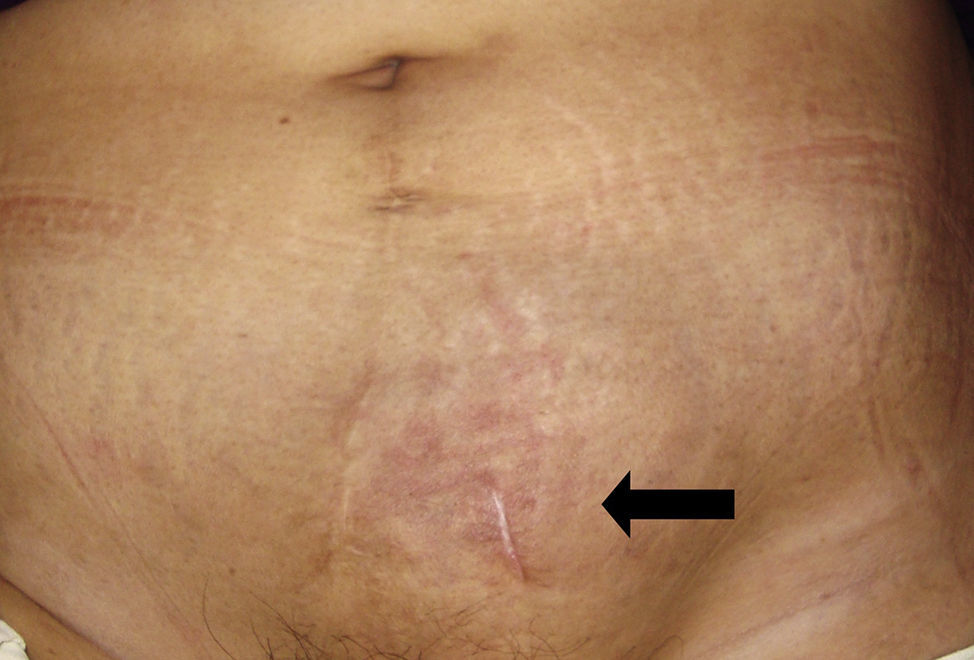
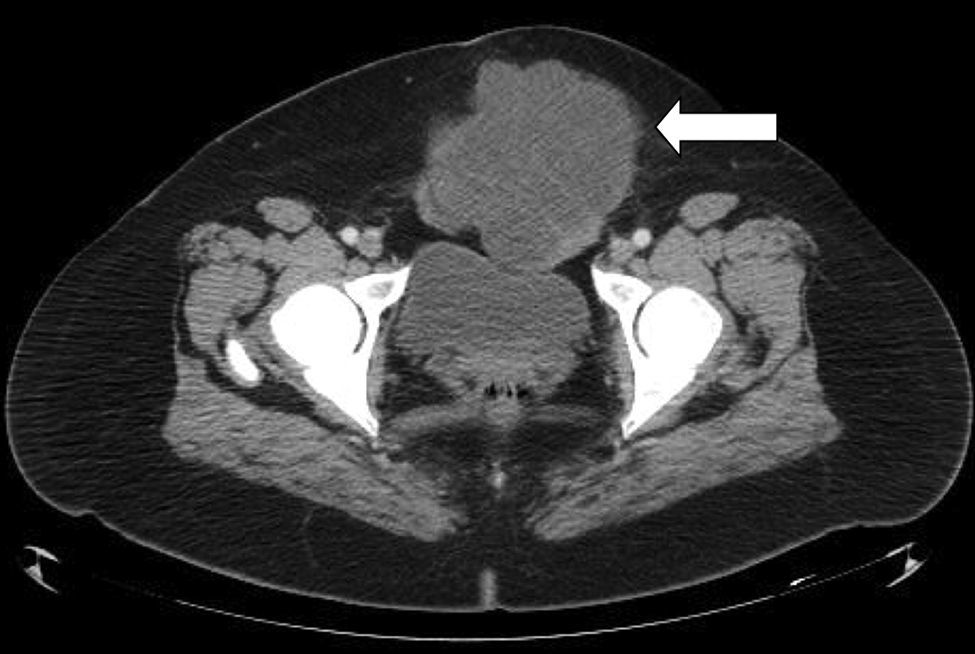
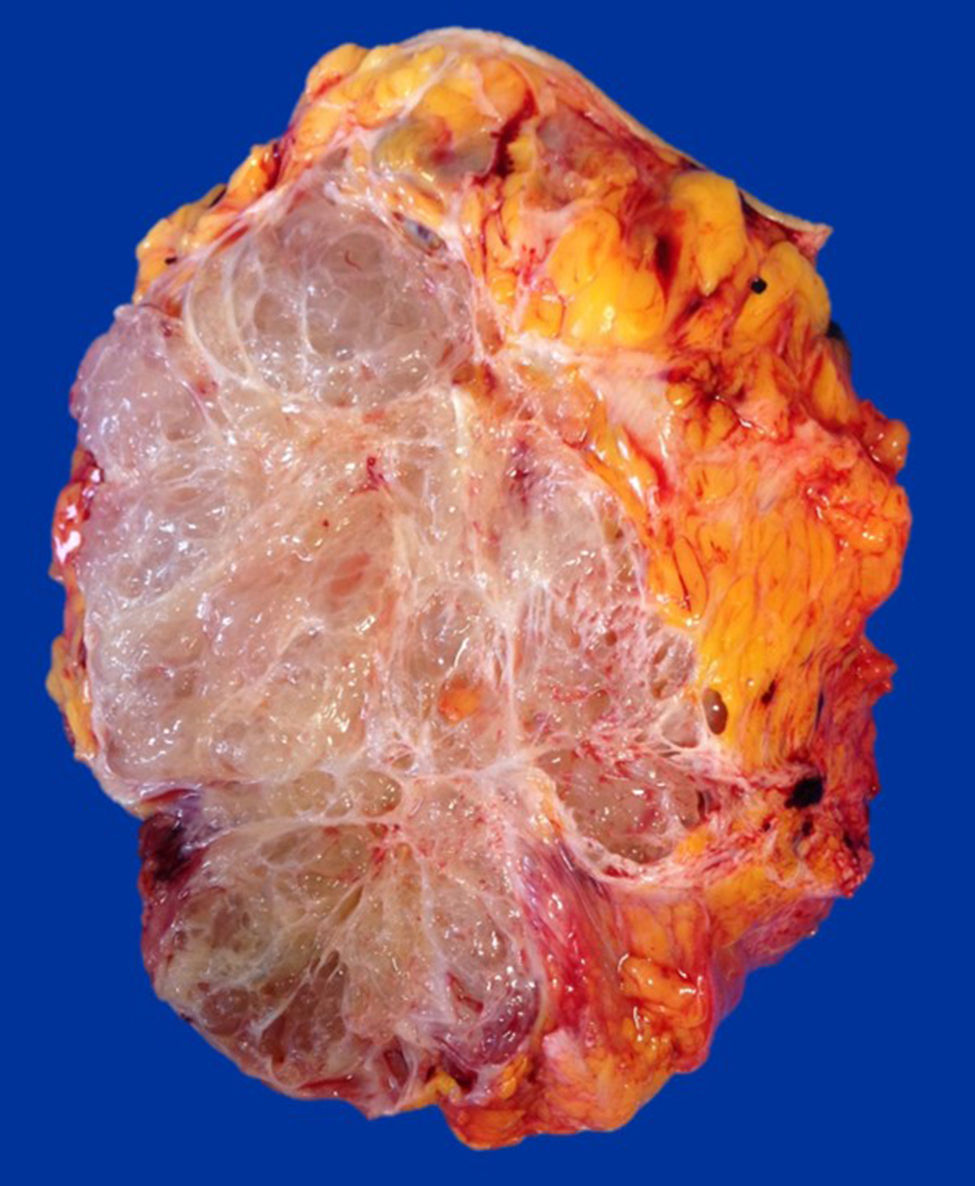
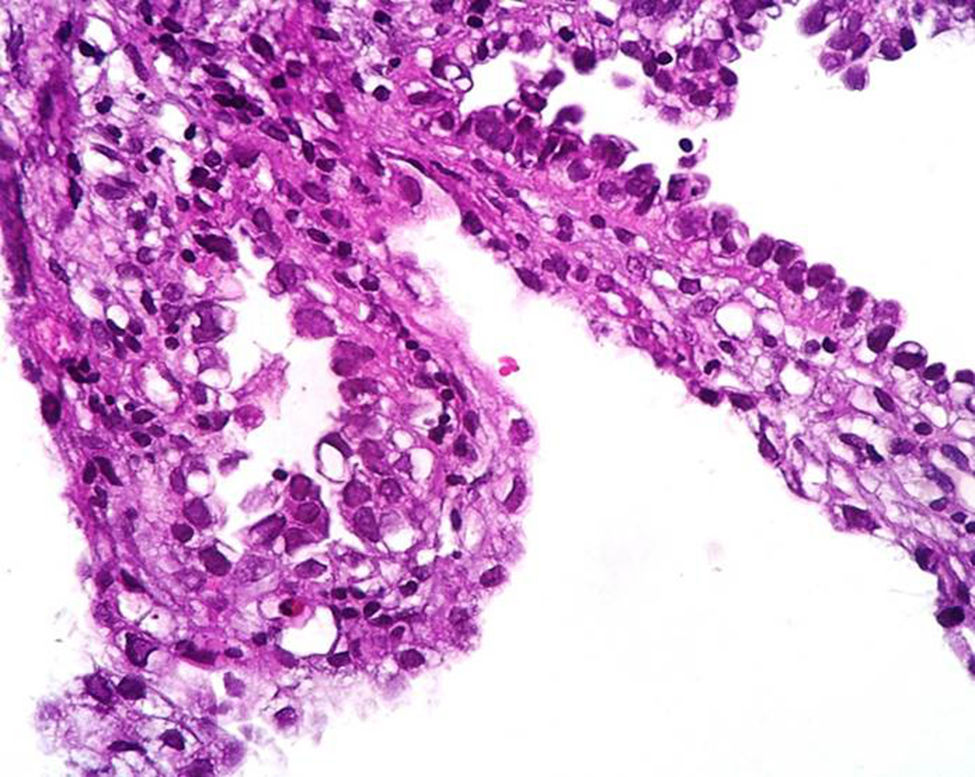
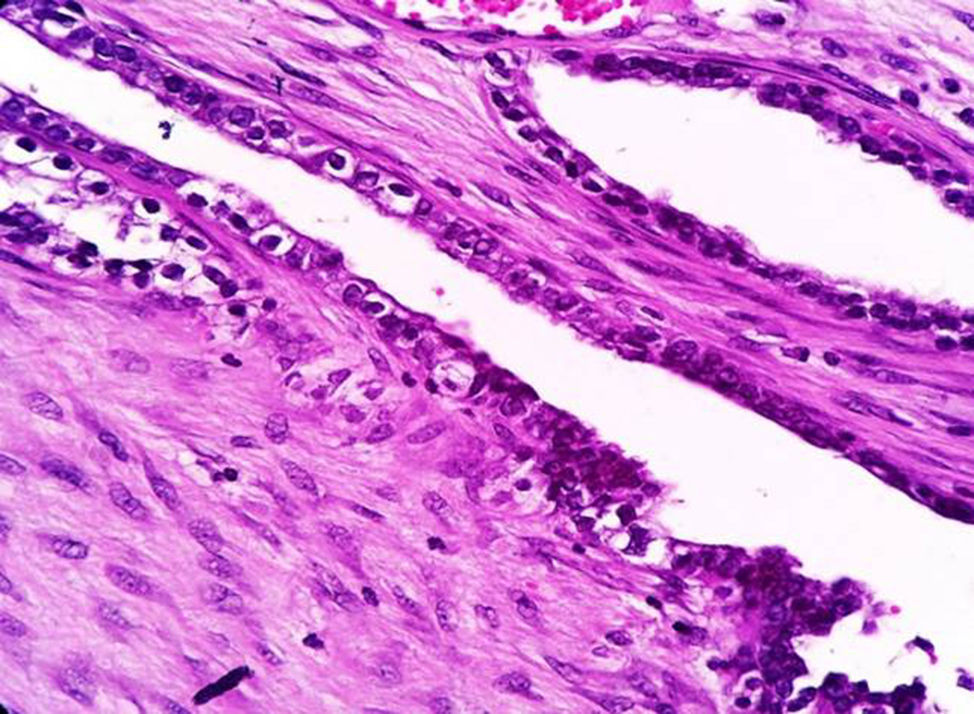
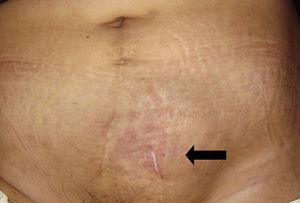
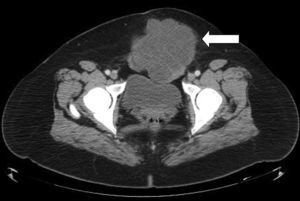
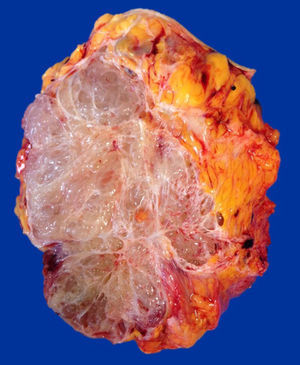
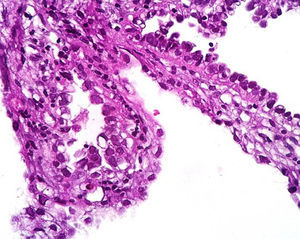
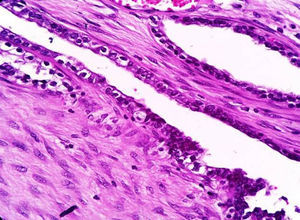
Caso clínicoPaciente del sexo femenino de 45 años de edad, con historia de dismenorrea y 3 cesáreas previas, que consultó por una masa tumoral en la región anterior del abdomen a nivel infraumbilical del lado izquierdo, de 6 meses de evolución (fig. 1), se confirmó su localización con la tomografía axial computada con dimensiones de 9 por 7 cm, con infiltración de músculos rectos del abdomen y tejido graso, así como compresión de la vejiga (fig. 2). Con el diagnóstico de tumor de uraco se llevó a laparotomía exploradora y resección en bloque de la pared abdominal con 2 cm de margen y reconstrucción de la pared abdominal (fig. 3). El diagnóstico histopatológico fue: carcinoma de células claras primario de pared abdominal originado en foco endometriósico, con márgenes quirúrgicos negativos (figs. 4-6).
Actualmente, la paciente está viva, sin enfermedad a 16 meses de su tratamiento.
DiscusiónLa endometriosis es una condición ginecológica crónica de tipo benigno, definida por la localización ectópica de glándulas y estroma endometrial, frecuente en edad reproductiva. El curso natural de la enfermedad es impredecible, infiltra, invade y tiene alta capacidad de diseminación, generalmente se resuelve en la menopausia7. Los implantes en pared abdominal durante una cesárea o una histerotomía tienen una incidencia menor al 1%3, se estima que al menos el 1% de los implantes endometriósicos presentan transformación maligna7; el mecanismo de progresión de atipia a carcinoma es desconocido14, al parecer está relacionado con la exposición hormonal y a la inflamación crónica que conlleva un daño genético. Hay 3 teorías que tratan de explicar la carcinogénesis y la primera propone que el epitelio endometriósico sirve como precursor del cáncer de la misma, de forma que el epitelio de la superficie ovárica normal da origen a los tumores ováricos, los cuales pueden ser tumores epiteliales, estromales o limítrofes. La segunda se refiere al parecido en el proceso carcinogénico de la neoplasia endometrial, el cual está bajo la influencia de estrógenos constante y conduce a un tumor endometrial. La tercera que es considerada la más precisa, sugiere que la carcinogénesis se debe a la influencia de un microambiente en el interior de la endometriosis que está expuesto al estrés oxidativo y a la inflamación crónica, que promueve tumores de fenotipo atrófico con crecimiento lento, tal como el carcinoma de células claras15.
El tipo histológico más común originado en endometriosis extraovárica es el adenocarcinoma de células claras (62%)16, solo se han reportado 15 casos desde 1980 hasta la fecha17,18.
La sospecha diagnóstica de un endometrioma o de su malignización se basa en la presencia de un tumor subcutáneo de la pared abdominal, con crecimiento progresivo y que es adyacente a una cicatriz quirúrgica; que además se asocia con dolor cíclico durante la menstruación (dismenorrea)19,20, y el se sustenta en los criterios histopatológicos de Sampson-Scott, que son: la coexistencia de tejido endometrial benigno y maligno en el tumor, apariencia histológica consistente con origen endometrial, demostrar la fase displásica en el tejido endometrial tumoral y excluir otro sitio primario tumoral. La fase displásica o endometriosis atípica fue descrita de acuerdo con Liu et al. en 198818, que se caracteriza por glándulas endometriales con atipia arquitectural y citológica (núcleos hipercromáticos con pleomorfismo moderado a marcado, con aumento de la relación núcleo-citoplasma, sobreposición celular y estratificación21). En nuestro caso los criterios de Sampsom-Scott fueron cumplidos, sin embargo, no siempre son valorables debido a que se requiere un amplio muestreo en múltiples niveles y la transformación maligna extensa impide observar los focos endometriósicos benignos17,18,22.
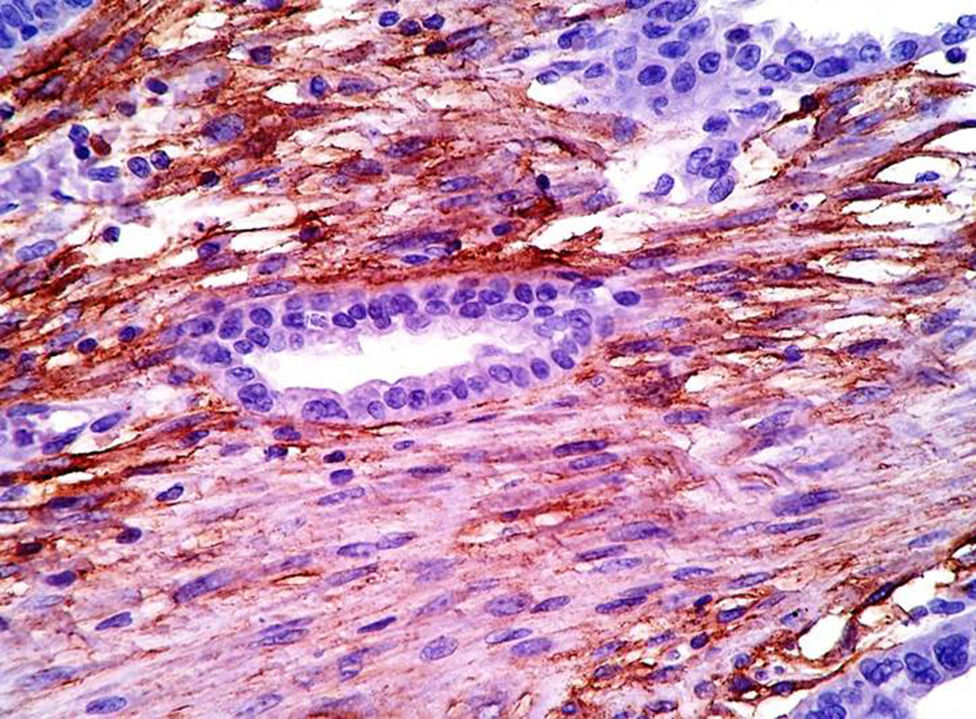
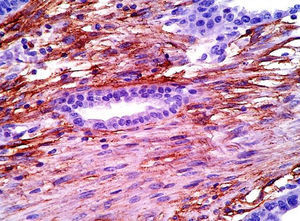
La demostración de las células del estroma endometrial es crucial; en ocasiones, puede simular reacción estromal o infiltrado inflamatorio crónico. Un inmunomarcador importante es la expresión de CD10 en las células estromales, ya que es sensible y específico de endometriosis en sitios extragonadales23,24. La expresión nuclear de P53 es también reportada por ser elevada en la zona de transformación maligna y ausente en la endometriosis benigna y tiene una sensibilidad del 87% y especificidad del 92% en endometriosis atípica y cáncer asociado a endometriosis23. En nuestro caso tanto CD10 como P53 fueron positivos.
Los diagnósticos diferenciales incluyen: metástasis de carcinoma de células renales a pared abdominal, pero es menos probable si se identifica pleomorfismo y células en estoperol. El mesotelioma puede presentarse con un patrón quístico o sólido con pleomorfismo marcado, aunque las células en estoperol y de citoplasma claro son poco frecuentes25, los marcadores de inmunohistoquímica son útiles para distinguirlos; el mesotelioma presenta positividad para CQ 5/6, calretinina, D240 mientras que en el carcinoma de células claras son negativos. Otro diagnóstico diferencial clínicamente en el presente caso fue el carcinoma del uraco, debido a la cercanía con el domo vesical, sin embargo, no fue compatible histológicamente ni inmunofenotípicamente en ninguna de sus subtipos, entre los más frecuentes están el mucinoso, entérico y células en anillo de sello, ya que nuestro caso fue negativo para CDX2 y CQ 20. Un tercer diagnóstico que se consideró fue el linfangioma quístico peritoneal, debido a las cesáreas previas de la paciente y al patrón de crecimiento quístico.
Histológicamente, se caracteriza por presentar nódulos linfoides, músculo liso en su pared y las células de revestimiento expresan marcadores como: D240, CD 31 y CD 34; sin embargo, nuestro caso fue negativo a estos marcadores y morfológicamente presentó áreas de células claras y en estoperol, las cuales son infrecuentes en el linfangioma quístico.
A pesar de la poca evidencia en la bibliografía consultada, por la rareza de esta entidad, el tratamiento recomendable es la resección quirúrgica con márgenes amplios26, que aporta buenos resultados y una sobreviva mayor del 80% a los 5 años.
ConclusiónLa transformación maligna de focos endometriósicos depositados durante una cirugía ginecológica está bien descrita. Se debe sospechar de cualquier nódulo grande, doloroso, de rápido crecimiento en cicatrices de cesáreas previas; el patólogo desempeña un rol muy importante en su diagnóstico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.