La diabetes mellitus tipo2 se ha convertido en un problema a nivel mundial. Se estima que del 15 al 25% de los pacientes desarrollarán una úlcera crónica a lo largo de su vida, y cerca del 33% de los costos directos de atención a diabetes mellitus tipo2 se gasta en la atención de estas úlceras. Las células troncales mesenquimales han surgido como una fuente celular prometedora para el tratamiento de este tipo de úlceras.
Caso clínicoMasculino de 67años con antecedentes de diabetes mellitus tipo2, infarto agudo de miocardio y úlcera crónica en miembro inferior derecho que involucra la cara interna del pie y parte de la pierna derecha; se le trató con células troncales mesenquimales, resultando una adecuada integración del injerto de piel y la cobertura total de la lesión.
ConclusiónLa implementación de células troncales mesenquimales para el tratamiento de la úlcera crónica es factible. El impacto en la población sería importante, al mejorar la calidad de vida de los pacientes y disminuir los costos de atención.
Diabetes mellitus 2 has become a global problem. It is estimated that 15% to 25% of patients could develop a chronic ulcer in their life, and nearly 33% of direct care costs of the diabetes mellitus 2 is spent on treating these ulcers. Mesenchymal stem cells have emerged as a promising cell source for the treatment of these ulcers.
Clinical caseThe case is presented of a 67 year-old male with a history of diabetes mellitus, acute myocardial infarction, and food ulcer chronic involving right foot and part of his leg. He was treated with mesenchymal stem cell management, resulting in skin graft integration and full coverage of the lesion.
ConclusionThe implementation of mesenchymal stem cell techniques for treatment of chronic ulcer is feasible. The impact on the population would lead to a significant improvement in their quality of life and reduce healthcare spending.
La diabetes mellitus tipo2 (DM2) se ha convertido en un problema a nivel mundial. Se estima que para el año 2030 el 70% de los pacientes con este padecimiento se concentrarán en países en vías de desarrollo, y México ocupará en la clasificación internacional el sexto o séptimo lugar1. Considerando las tendencias actuales y el comportamiento de los pacientes con DM2, las complicaciones derivadas de este padecimiento a largo plazo, entre las que se encuentran nefropatía, retinopatía, enfermedad vascular periférica y neuropatía, representan un verdadero reto a la medicina dada su complejidad2,3. Se estima que entre el 15 y el 25% de los pacientes con DM2 desarrollarán una úlcera crónica a lo largo de su vida, siendo además una población que tiene de 10 a 20veces más probabilidad de tener una amputación no traumática de algún miembro, comparada con la población que no presenta esta patología4-9. Es indispensable considerar el impacto social de este tipo de lesiones, ya que en promedio una úlcera tiene una duración de entre 12 y 13meses; cerca del 70% de los pacientes que han padecido una úlcera presentarán por lo menos la formación de otra úlcera a lo largo de su vida, estimando una pérdida de 2 millones de días de trabajo por incapacidad10. Tan solo en el año 2010, se estimó para México un gasto de $778,427,475USDólar para la atención de la DM211–17 ($343,226,541USDólar en costos directos y $435,200,934USDólar en indirectos)18, y cerca del 33% de los costos directos de la atención en DM211–17 se emplearon en la atención de las úlceras crónicas19.
Uno de los problemas a los que nos enfrentamos al tratar este tipo de lesiones es la baja probabilidad de éxito, ya que en las mejores condiciones solo el 50% del total de casos remiten, y para el otro 50% de los pacientes las úlceras son una de las principales causas de amputación, con una sobrevida estimada del 70% a un año y del 20% a 5años20. Atendiendo a las características orgánicas que dan origen a las úlceras, como la deficiente perfusión de los tejidos por daño en la microvasculatura2,3, recientemente se han propuesto tratamientos a base de células o sus productos (terapia celular) con el objeto de mejorar los mecanismos de reparación de la microvasculatura y favorecer la re-epitelización de los mismos21. Estas nuevas alternativas proponen un tratamiento a base de células troncales mesenquimales, con la premisa de que estas células producen moduladores tanto de la respuesta inflamatoria como de los factores de crecimiento que favorecen la regeneración tisular11,22.
Las células troncales mesenquimales se originan durante la vida embrionaria en el mesodermo, dando origen al tejido conectivo, hueso, músculo y cartílago. Una vez formado el embrión, quedan reservorios de células troncales en casi todo el organismo; estos se han podido identificar, al igual que su función, a partir de marcadores celulares específicos. Estas células se han aislado en médula ósea, cordón umbilical, tejido adiposo y tejido placentario. Clínicamente está justificada su aplicación en úlceras de diversa etiología, exceptuando las úlceras neoplásicas.
El objetivo de este trabajo es compartir la experiencia que registramos al tratar con células mesenquimales e injerto cutáneo autólogo a un paciente portador de una úlcera crónica secundaria a DM211-17.
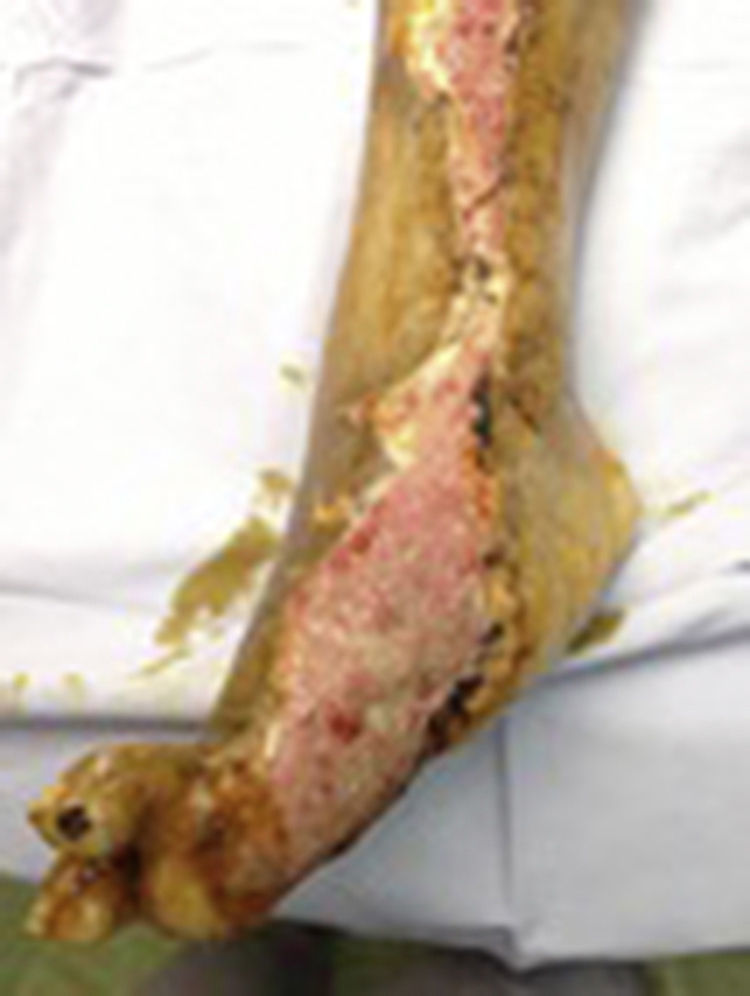
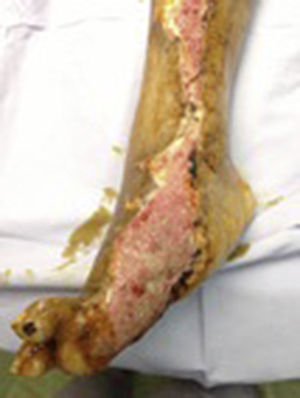
Caso clínicoPaciente masculino de 67años de edad con antecedente de DM2 de 15años de evolución, que fue valorado por el servicio de Ortopedia del Hospital General de Puebla por una úlcera crónica (un año de evolución) en miembro pélvico derecho, que se extiende desde la cara interna del pie en su porción plantar que involucra el primero y segundo ortejos, la cara interna de la pierna hasta el tercio medio de esta. El resultado del cultivo de la lesión es Staphylococcus sp. y Escherichia coli dadas las condiciones de la úlcera y tratándose de un paciente multitratado, se le propuso como opción terapéutica amputación o el empleo de células troncales mesenquimales con injerto mallado autólogo. Tras describir el procedimiento, los riesgos y las probabilidades de mejora de ambos procedimientos, el paciente eligió células troncales mesenquimales e injerto mallado autólogo, para lo cual otorgó su consentimiento bajo información.
El primer paso consistió en mantener hospitalizado al paciente mientras se controló la infección mediante el empleo de cefalosporinas de tercera generación; se realizó una primera desbridación, como la amputación del primer y segundo ortejos. Se realizaron 4 intervenciones más (con 15días de diferencia entre cada una de ellas); durante la primera intervención se realizó escarificación de la lesión así como punción de la cresta iliaca para la obtención de 60ml de médula ósea; para evitar la coagulación de la muestra y el mantenimiento de las células se empleó citrato fosfato dextrosa, la cual se sometió a procesamiento en el Laboratorio de Medicina Regenerativa en coordinación con el Laboratorio de Morfología de la Escuela Superior de Medicina del Instituto Politécnico Nacional para la obtención y cultivo de células troncales mesenquimales durante 30días de cultivo.
Aislamiento de las células troncales mesenquimalesLas células troncales mesenquimales fueron obtenidas del aspirado de médula ósea del íleon con una jeringa de 60ml con citrato fosfato dextrosa como anticoagulante. En un medio estéril, el aspirado se diluyó 1:2 con una solución de PBS1X estéril y fue sometido a un gradiente de NycoPrepTM 1.077g/ml, por 30min a 1,500rpm. De la interfase fueron separadas las células mononucleares, las cuales se lavaron en 2 ocasiones con solución PBS1X, centrifugadas por 10min a 2,000rpm y fueron sembradas en cajas de Petri de 25cm (CORNING) con 5ml de medio Poietics Human Mesenchymal Stem Cells, a 37°C y 5% de CO2; suplementado con antibiótico-antimicótico1X. A los 3días se realizó un lavado con la solución de citrato fosfato dextrosa1X para eliminar las células no adherentes y se adicionó medio fresco.
Alcanzada una confluencia celular del 70-80%, las células adherentes fueron despegadas utilizando una solución de tripsina-EDTA (0.025%, GIBCO) incubadas por 10min a 37°C. Las células se lavaron con PBS y se sembraron a una concentración de 2×103células/ml en cajas Petri de 100×20mm (CORNING), ahora con 10ml de DMEM/F-12 adicionado con 10% de SFB y antibióticos. Estas células se resembraron hasta un tercer pase para su evaluación de marcadores de membrana por citometría de flujo, y también fue evaluada su plasticidad/diferenciación celular hacia osteoblastos y adipocitos.
La caracterización de las células troncales mesenquimales se realizó evaluando los marcadores de superficie (anti-CD73, anti-CD90 anti-CD105, anti-CD14, anti-HLA-DR, anti-CD13 y anti-CD45) mediante citometría de flujo. Los resultados obtenidos demostraron que nuestras células expresan altos niveles de CD73, CD90, CD105 y CD13. Sin embargo, no expresan marcadores hematopoyéticos como CD45, CD14 y HLA-DR.
La plasticidad celular fue evaluada cultivando las células en presencia de medios diferenciadores específicos, StemPro Adipocyte Differentiation Basal Medium y StemPro Ostecyte/Chondrocyte Differentiation Basal Medium (GIBCO) por 15días. Los resultados obtenidos indicaron que nuestras células tienen la capacidad de diferenciarse tanto a adipocitos como a osteoblastos.
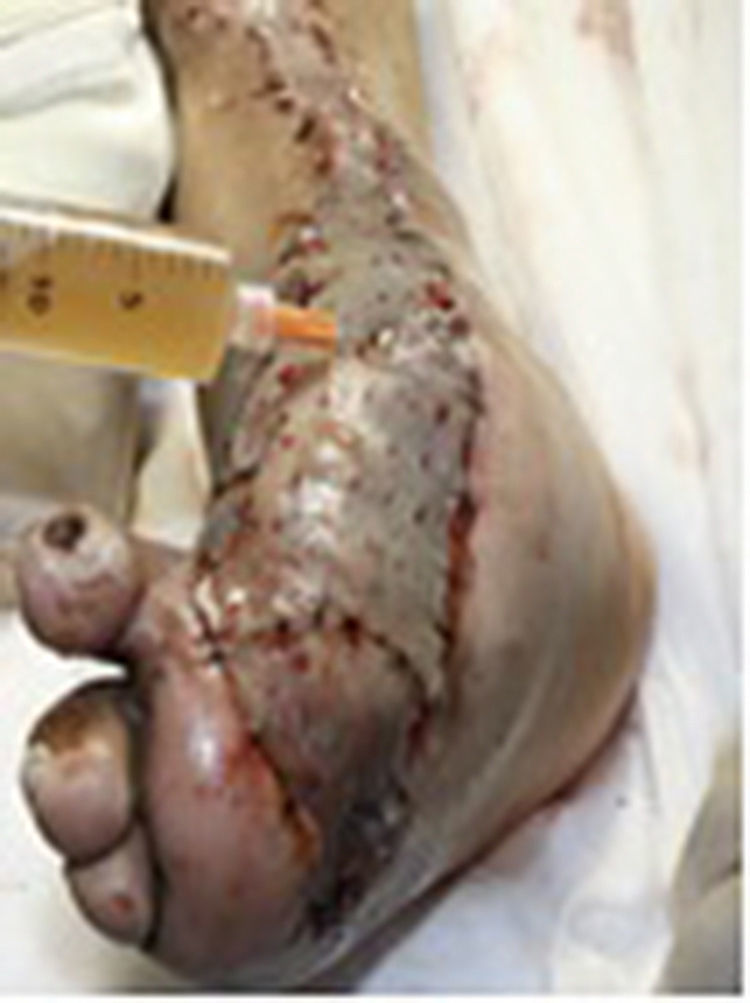
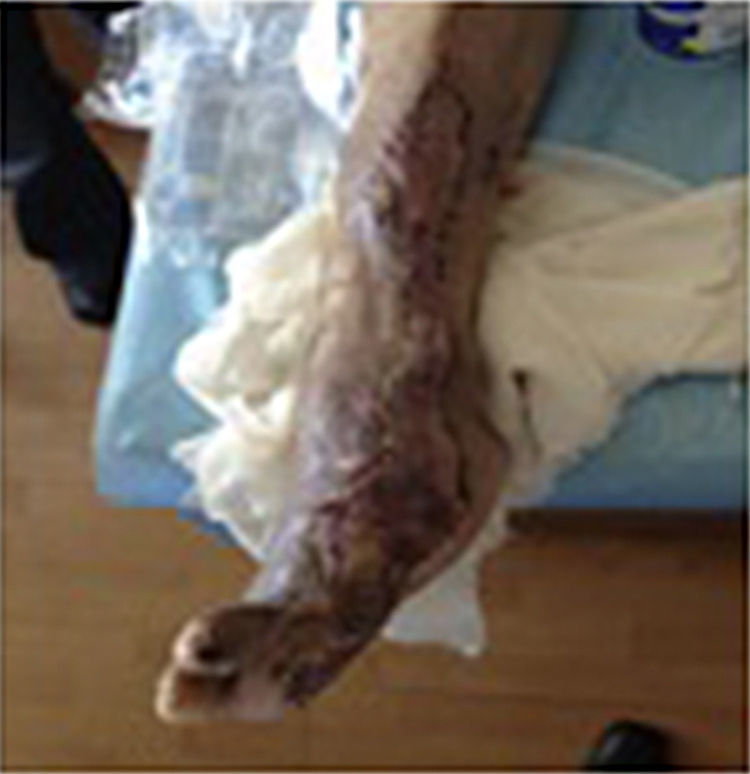
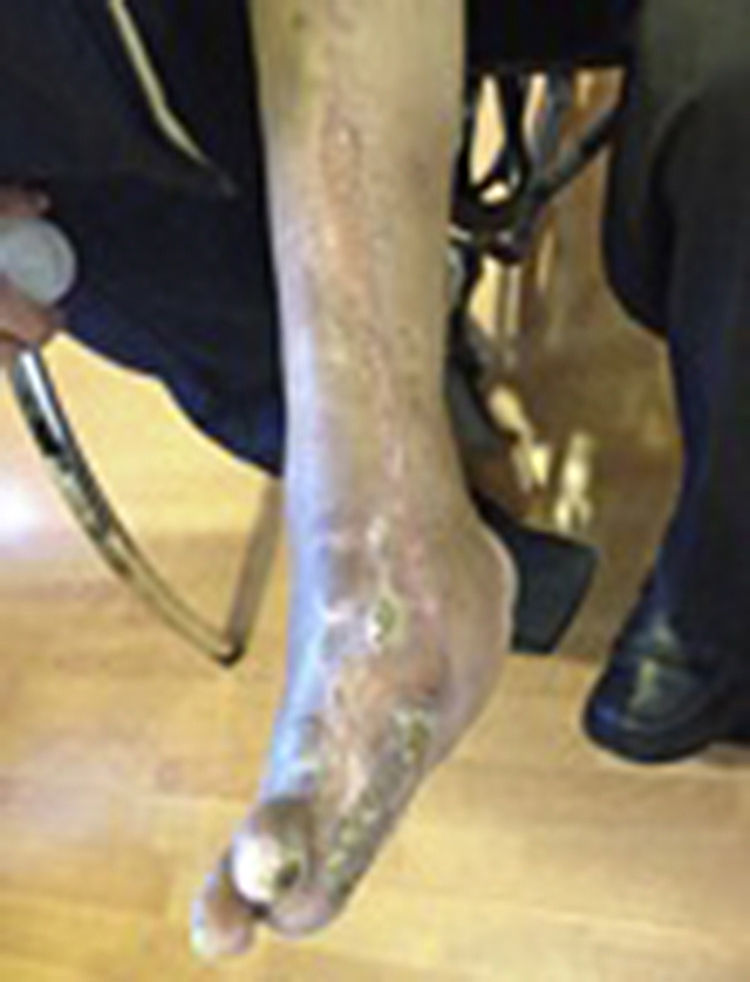
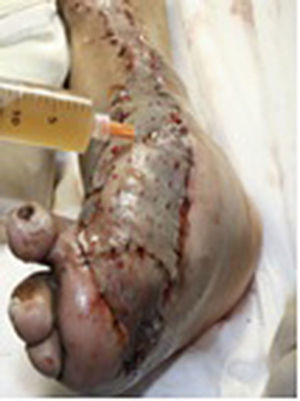
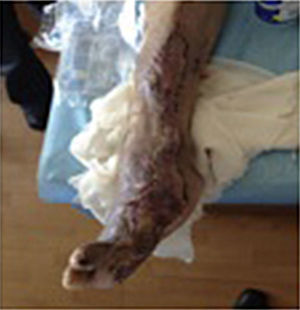
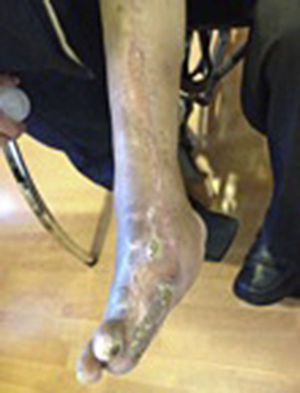
Durante la segunda y la tercera intervención se realizó limpieza quirúrgica de la zona, y en la cuarta intervención sobre un lecho limpio se colocaron células troncales mesenquimales autólogas suspendidas en plasma rico en plaquetas, procurando una distribución de 1millón de células por cm2, y posteriormente un injerto cutáneo autólogo de 15×10cm (mallado) tomado de muslo ipsilateral. Se cubrió el injerto con gasas vaselinadas y se manejó con ciprofloxacino 500mg durante 2 semanas. El paciente fue evaluado semanalmente, documentándose la integración total del injerto 2 semanas después; 6meses después el paciente apoyó la extremidad, y al año continuó sin presentar complicaciones. La evolución del paciente se muestra en las figuras 1-4.
Cabe mencionar que la preparación de células troncales mesenquimales autólogas a partir de médula ósea se realizó en el Laboratorio de Medicina Regenerativa y Cáncer en coordinación con el Laboratorio de Morfología, ambos de la Escuela Superior de Medicina del Instituto Politécnico Nacional, cumpliendo con los criterios de la Sociedad Internacional de Terapia Celular (ISCT), que incluyen la verificación de identidad por citometría de flujo expresando (positivas) principalmente marcadores CD105, CD73, CD90 y no expresando (negativas) principalmente CD45, CD34, HLA-DR12, además de verificar por azul tripan una viabilidad celular del 95% y comprobar mediante cultivo la presencia de un preparado libre de contaminación bacteriana, y con la verificación de la morfología celular mediante microscopia simple. Además, como medida de control se tomó una alícuota de las células troncales mesenquimales autólogas empleadas en la lesión, las cuales se lograron recuperar, sembrar y proliferar de nuevo en el laboratorio de Medicina Regenerativa y Cáncer del Instituto Politécnico Nacional, y se verificó que mantenían sus características biológicas (fig. 5).
DiscusiónLa DM211-17 y sus complicaciones representan una carga financiera importante para los sistemas de salud a nivel mundial, y México no es la excepción, ya que estará dentro de los primeros lugares en 2030 y la presión económica para la atención de este padecimiento aumenta desmesuradamente18,19. Dentro de las principales complicaciones encontramos las úlceras crónicas, que representan una de las principales causas de amputación por su difícil manejo y tratamiento, que es complejo6-10,18-20. En las últimas 3 décadas el surgimiento de terapias celulares ha permitido plantear otras opciones terapéuticas que han modificado este escenario, a tal grado que actualmente se consideran intervenciones con mejor costo-efectividad13,14, por lo cual se encuentran incluidas en las guías internacionales de manejo de úlceras como, la de la Sociedad de Atención de Heridas15-17, así como en los protocolos de algunos hospitales, como el Monte Sinaí en Nueva York.
Las células mesenquimales han sido empleadas con éxito en este tipo de lesiones debido a su capacidad de regular los procesos de inflamación y de regenerar el tejido a través de factores como la interleucina-10 y la interleucina-4, además de favorecer la neoformación de vasos por medio del factor de crecimiento vascular, el factor de crecimiento derivado de plaquetas, el reclutamiento de queratinocitos, la señalización para la migración de células troncales nativas y finalmente la remodelación de la lesión a través de la regulación de queratinocitos, y la presencia de factor de crecimientoβ y metaloproteinasas23, elementos clave para la regeneración de los tejidos.
El abordaje transdisciplinario dio como resultado en este paciente el que pudiera preservar su extremidad. El adecuado manejo por parte del equipo medicoquirúrgico del servicio de Ortopedia del Hospital General de Puebla para controlar la infección y limpiar el lecho, así como la obtención de células troncales mesenquimales autólogas por parte del Laboratorio de Medicina Regenerativa y Cáncer, en coordinación con el Laboratorio de Morfología, ambos de la Escuela Superior de Medicina del Instituto Politécnico Nacional y con las más altas características de calidad, que permitieron que el paciente integrara el injerto y se cubriera el lecho de la úlcera que bajo otras condiciones tendría que haber sido amputado. El punto más preponderante es la adecuada articulación en cada una de las funciones del equipo transdisciplinario, ya que si alguno no lleva a cabo de manera adecuada su parte, el éxito del tratamiento se ve comprometido.
Este tipo de abordaje transdisciplinario ha permitido tratar pacientes fuera de la terapéutica convencional, permitiendo ofrecerles una opción antes de la amputación.
ConclusiónLa implementación de la terapia basada en células —en este caso particular células troncales mesenquimales— es una realidad a nivel mundial, con los consecuentes beneficios a los pacientes y a los sistemas de salud. La implementación de estas técnicas en nuestro medio es factible, y el impacto en la población que se ve afectada por este tipo de padecimientos sería importante, al mejorar su calidad de vida y disminuir los costos de atención de los mismos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosAl Dr. Roberto J. Robles Ramirez por su apoyo en los cultivos bacterianos, al Q.F.B. Leonardo Fermín Acevedo Olvera por su apoyo en los cultivos celulares, y al C.P.R. Dr. Gerardo Rayón Nieva por su invaluable colaboración.