Los cambios biológicos degenerativos que frecuentemente generan lesiones en el cartílago articular de rodilla se asocian principalmente con defectos en la alineación de la articulación, y con cambios de tipo metabólico relacionados con la edad como ocurre en la osteoartrosis. Además, la capacidad de autorregeneración del cartílago se ve bastante limitada debido a la falta de vascularización del tejido. Hasta la fecha no se cuenta con un tratamiento ideal que logre estimular la regeneración del cartílago, por lo que es necesario buscar alternativas terapéuticas para el tratamiento de este tipo de padecimientos.
En años recientes se ha incrementado el número de publicaciones que intentan mostrar los beneficios terapéuticos y regenerativos al utilizar plasma rico en plaquetas como tratamiento en osteoartrosis de rodilla. A pesar de los resultados alentadores que se han observado, son todavía pocos los estudios controlados aleatorizados, con evidencia clínica contundente, quedando por esclarecer puntos como la formulación óptima o el mecanismo de acción del plasma rico en plaquetas. Hasta este punto, no todos los pacientes pueden tener un beneficio de esta terapia, basándonos en los resultados de los estudios clínicos, en donde es importante tener en cuenta aspectos como la edad y el grado de desgaste del cartílago.
El objetivo del presente trabajo es hacer una revisión de la literatura científica reciente, del tratamiento de la osteoartrosis de rodilla con plasma rico en plaquetas y de las bases biológicas de esta terapia, así como mostrar una opinión actual acerca de este tema.
The biological changes that commonly cause degenerative articular cartilage injuries in the knee are primarily associated to misalignment of the joint and metabolic changes related to age, as occurs in osteoarthritis. Furthermore, the capacity for cartilage self-regeneration is quite limited due to the lack of vascularity of the tissue. To date there is no ideal treatment capable to stimulate cartilage regeneration; thus there is a need to seek alternative therapies for the treatment of such conditions.
The number of publications demonstrating the therapeutic and regenerative benefits of using platelet-rich plasma as a treatment for knee osteoarthritis has been increasing in recent years. In spite of encouraging results, there are still only a few randomised control studies with strong clinical evidence, lacking clarity on points such as the optimum formulation or the mechanism of action of platelet-rich plasma. Up to this point and based on the results of clinical studies, not all patients can benefit from this therapy. It is important to consider aspects such as the age and grade of cartilage degeneration.
The aim of the present paper is to review the recent scientific literature on the treatment of knee osteoarthritis with platelet-rich plasma, and the biological bases of this therapy, as well as presenting the current opinion on this subject.
El cartílago articular es el tejido conectivo altamente especializado de las articulaciones móviles, cuya principal función es proveer una superficie articular con una baja fricción y un eficiente soporte contra la carga mecánica. Es un tejido desprovisto de vasos sanguíneos, linfáticos y de terminaciones nerviosas, por lo que su capacidad regenerativa intrínseca es muy baja1. Las lesiones producidas en este tipo de tejido son difíciles de tratar y en la actualidad continúan siendo un reto en el campo de la ortopedia.
Los cambios biológicos, incluidos los biomecánicos y metabólicos, así como traumatismos, pueden llevar a la pérdida de la homeostasis del cartílago, lo cual aumenta de manera significativa con la edad. Esto trae como consecuencia una disminución acelerada de la superficie articular, lo que da lugar a la presencia de osteoartrosis2.
Esta es la enfermedad crónica y degenerativa más común de las articulaciones, es la causa más frecuente de dolor y una de las principales causas de discapacidad y dependencia de la población adulta, que genera altos costos en el área de la salud3. La osteoartrosis es más frecuente en el sexo femenino (2:1), aunque después de la menopausia la relación hombre: mujer es 1:1. Su frecuencia aumenta con la edad, de manera que de acuerdo con los criterios radiográficos, el 30% de las personas entre 45 y 60 años de edad, y más del 80% de los mayores de 80 años, presentan osteoartrosis en al menos una articulación4. A nivel mundial es la cuarta causa de morbilidad en mujeres mayores de 60 años, y la octava en hombres5. En México, se estimó una prevalencia de osteoartrosis en población adulta de 10.5%6. De acuerdo a los reportes estadísticos del Instituto Mexicano de Seguro Social, la osteoartrosis constituye uno de los diez principales motivos de consulta en el primer nivel de atención médica4.
Clínicamente esta condición se caracteriza por dolor de la articulación, rigidez, limitación del movimiento, y grados variables de inflamación7. Por otro lado, también se caracteriza por un desbalance entre los procesos anabólicos y catabólicos8, lo que trae como consecuencia un daño progresivo del cartílago, y en última instancia la discapacidad del paciente.
En la actualidad, los tratamientos para la osteoartrosis van desde técnicas que únicamente alivian el dolor, como la artroscopía y el tratamiento farmacológico inicial con analgésicos y antiinflamatorios, hasta procedimientos que involucran la generación de implantes con andamios tridimesionales en el área de la ingeniería de tejidos. Sin embargo, hasta ahora, no se cuenta con un tratamiento efectivo para la regeneración del cartílago.
En los últimos años se ha considerado como una alternativa terapéutica, el uso de factores de crecimiento autólogos como tratamiento regenerador del tejido condral. Estos factores de crecimiento se pueden obtener de las plaquetas circulantes en sangre periférica. Es así que la terapia de plasma rico en plaquetas ha cobrado gran importancia en años recientes, y ha sido objeto de diversos estudios y aplicaciones. Su uso dentro de la regeneración de tejidos se ha extendido desde su aplicación en odontología, en cirugías maxilofaciales e implantes dentales, en la regeneración de tendones y ligamentos dentro del área de ortopedia, hasta su aplicación en cirugía plástica y cosmetología9.
Se ha propuesto el uso clínico del plasma rico en plaquetas como alternativa terapéutica en pacientes con osteoartrosis, aplicándolo en forma de infiltraciones intraarticulares directamente en las rodillas de pacientes afectados. La mayoría de los estudios realizados hasta la fecha indican resultados prometedores, con disminución del dolor y mejora de la función de la articulación. Hace un par de años comenzaron a publicarse trabajos sobre estudios controlados aleatorizados, que aportan mejor evidencia clínica con respecto a los primeros ensayos no controlados o en los que se analizaban series de casos.
Por otra parte, se han reportado propiedades proliferativas10, de diferenciación condrogénica11 y anabólica del plasma rico en plaquetas12 en estudios in vitro, a nivel de cultivos celulares y en estudios in vivo, principalmente en ratas y conejos, resaltando el papel del plasma rico en plaquetas en la regeneración del cartílago osteoartrósico.
¿Qué es el plasma rico en plaquetas?Es una preparación que concentra un número de plaquetas mayor que los valores normales en sangre. En la mayoría de los casos, el plasma rico en plaquetas se define únicamente por la cantidad absoluta de plaquetas, y no por la de otros componentes dentro de la sangre. El conteo normal de plaquetas en sangre va de 150,000 a 350,000 plaquetas/μL, mientras que el plasma rico en plaquetas a menudo se define como una concentración de 2 a 4 veces más que la concentración normal13. El plasma rico en plaquetas se puede obtener y preparar a partir de sangre venosa periférica de un individuo, mediante uno o dos pasos de centrifugación posteriores y con el uso de material o equipo de laboratorio básico. Este tipo de concentrado representa una fuente natural de factores de crecimiento de origen autólogo, siendo esta una de sus principales virtudes.
La lógica detrás del uso del plasma rico en plaquetas es que las plaquetas son las primeras en actuar en el sitio de la lesión en el tejido, y así, tienen la posibilidad de liberar, junto con otras moléculas activas, factores de crecimiento que desempeñan un papel fundamental en el proceso de cicatrización14.
Preparación del plasma rico en plaquetasDentro de los temas que presentan controversia en torno al plasma rico en plaquetas, resalta la falta de consenso en cuanto a la composición exacta y a las diferentes técnicas disponibles para su preparación. Estas se pueden clasificar como técnicas cerradas, en las que se utilizan estuches comerciales desechables, donde la muestra se trata dentro de un solo recipiente (tubo o jeringa), y las técnicas abiertas, en donde la preparación del plasma rico en plaquetas se realiza de forma manual en más de un tubo. En ambos casos la preparación incluye uno o más pasos de centrifugación.
Hay al menos 16 diferentes estuches comerciales para la preparación de plasma rico en plaquetas, los cuales pueden variar significativamente en la cantidad de plaquetas, leucocitos y eritrocitos presentes en el producto obtenido15. Pudiendo incrementarse la concentración de plaquetas hasta 9.3 veces sobre los niveles basales16. Por otra parte, en un proceso manual de doble centrifugación, la concentración de plaquetas puede aumentar hasta un 330%, lo que equivaldría a 3.3 veces17.
Todas las técnicas disponibles tienen varias características en común. La sangre del paciente se colecta en tubos con anticoagulante y es inmediatamente centrifugada. Esta centrifugación inicial separa a los glóbulos rojos del plasma, el plasma separado puede contener diversas concentraciones de plaquetas con o sin glóbulos blancos. Las plaquetas pueden ser activadas posteriormente usando trombina, cloruro de calcio, gluconato de calcio, congelación y descongelación, y esto es posteriormente aplicado en el área de la lesión como una inyección cuando aún está líquido. El procedimiento se puede llevar a cabo de una forma mínimamente invasiva y ambulatoria, proporcionando una preparación activada directamente en el lugar del daño con una liberación inmediata de los factores de crecimiento.
Formulación del plasma rico en plaquetasEn las plaquetas pueden estar presentes alrededor de 1,500 proteínas, entre las que se pueden encontrar algunos factores de crecimiento18. Las plaquetas son células anucleadas que contienen distintas estructuras intracelulares, tales como: glucógeno, lisosomas, y gránulos (densos y alfa), por mencionar solo algunas19. En particular, los gránulos alfa almacenan y secretan diversos tipos de proteínas, como proteínas de adhesión, factores de coagulación, factores fibrinolíticos, proteasas y antiproteasas, factores de crecimiento, citocinas, quimiocinas, glicoproteínas de membrana, y proteínas antimicrobianas entre otras20.
Ya se ha visto que algunas de las proteínas bioactivas que liberan las plaquetas son responsables de atraer macrófagos, células madre mesenquimales y osteoblastos, que no solo facilitan la remoción del tejido necrótico dentro de una lesión, sino que también participan en funciones biológicas avanzadas que van desde la cicatrización de heridas, hasta el crecimiento tumoral21.
El hecho de que las plaquetas secreten factores de crecimiento y metabolitos activos, puede tener una influencia positiva en situaciones clínicas que requieren una rápida cicatrización y regeneración tisular. Además, la presentación de los factores de crecimiento unidos a las plaquetas y/o en un andamio de fibrina puede dar como resultado una mejor actividad con respecto a las proteínas recombinantes solubles22.
Factores de crecimiento presentes en el plasma rico en plaquetasLos factores de crecimiento son macromoléculas solubles y difusibles, y son producidos por una gran variedad de tipos celulares. Poseen acciones específicas sobre el crecimiento, diferenciación y fenotipo de numerosos tipos de células, entre ellas los condrocitos.
Estas moléculas interactúan sobre los receptores de la membrana celular, los cuales transmiten una señal al interior de la célula que genera una cascada de reacciones que termina en la regulación de la expresión génica. Su mecanismo de acción más frecuente es paracrino o autocrino, y ocasionalmente endocrino, así la célula o células que reciben la señal pueden estar próximas o alejadas de la célula que ha sintetizado y liberado dicho factor23. Un factor de crecimiento ideal en la regeneración del cartílago deberá ser efectivo sin importar la edad del paciente o de la presencia de osteoartrosis y no perjudicará el cartílago, ni la membrana sinovial.
En el tabla 124–27 se muestran algunos de los factores de crecimiento presentes en la plasma rico en plaquetas, que han mostrado ser importantes en la reparación del cartílago. En general, dichas moléculas presentan características anabólicas que estimulan la síntesis de proteoglicanos, agrecanos y colágeno tipo II en los condrocitos; inducen la proliferación de sinoviocitos y células madre mesenquimales, y disminuyen los efectos catabólicos de citocinas como la interleucina-1 (IL-1), y de las metaloproteasas de matriz extracelular (MMP)28.
Principales efectos sobre condrocitos o cartílago de algunos factores de crecimiento encontrados en el plasma rico en plaquetas
| Factor de crecimiento | Efecto sobre condrocitos/cartílago | Referencia |
|---|---|---|
| Factor de crecimiento transformante-β (TGF-β) | Estimula la síntesis de matriz extracelular (proteoglicanos, colágeno tipo II) | 24 |
| Factor de crecimiento parecido a insulina-1 (IGF-1) | Estimula la síntesis de colágeno tipo II y proteoglicanos. Disminuye la presencia de colágeno tipo I | 25,26 |
| Factor de crecimiento de fibroblastos-2 (FGF-2) | Actúa como mitógeno (estimula la proliferación de condrocitos) | 27 |
| Factor de crecimiento derivado de plaquetas (PDGF) | Aumento de proliferación celular y producción de proteoglicanos | 28 |
El tratamiento ideal es multidisciplinario, y debe cumplir con los objetivos de lograr analgesia, disminuir la discapacidad, y mejorar la funcionalidad articular, así como la calidad de vida del paciente con la menor toxicidad de los medicamentos.
El manejo farmacológico comúnmente comienza con analgésicos, como el paracetamol (fármaco de primera línea para el manejo del dolor en osteoartrosis), agentes antiinflamatorios esteroideos, y otros fármacos antiinflamatorios no esteroideos29. Se han propuesto medicamentos como glucosamina, condroitín sulfato, ácido hialurónico (viscosuplementación), y glucocorticoides como soluciones no invasivas para el tratamiento del dolor, mejorando la movilidad de la articulación; todos con tasas de éxito variables. Los medicamentos antes mencionados pueden mostrar limitaciones para su correcta administración, como la potencial toxicidad cardiovascular y gastrointestinal, la aparente gran variación en la respuesta individual a cada fármaco, y la ausencia de datos clínicos claros con respecto al potencial terapéutico de estas sustancias30. Ninguno de los tratamientos actualmente disponibles puede ser considerado como un procedimiento ideal para el tratamiento de la condropatía crónica severa u osteoartrosis.
El plasma rico en plaquetas como terapia para la regeneración de tejidosEl plasma rico en plaquetas autólogo, se ha propuesto como una de las terapias biológicas que puede tener potenciales aplicaciones clínicas, dado su fácil aislamiento, disponibilidad, y la ausencia de reacciones inmunológicas o transmisión de enfermedades.
El uso del plasma rico en plaquetas se popularizó dentro del campo de las cirugías plásticas y maxilofaciales en la década de 199031. La cirugía de implantes dentales con regeneración ósea guiada, es una de las situaciones en las que, el plasma rico en plaquetas, claramente acelera la osificación después de la extracción de una pieza dental y/o alrededor de los implantes de titanio utilizados32. Por su parte, el uso de esta terapia en ortopedia comenzó a principios de la década del 2000 con el uso del plasma rico en plaquetas en injertos de hueso, para incrementar la fusión espinal, y la consolidación de las fracturas. Aunque el debate continúa con respecto al potencial beneficio del plasma rico en plaquetas para la recuperación del hueso33, un creciente número de evidencias a nivel experimental en diversos modelos animales apoya su uso para regeneración de tejidos blandos como tendones34. Por otra parte, en cultivos de explantes de tendones, y de ligamentos en presencia de plasma rico en plaquetas, se pudo apreciar una disminución en la expresión del gen que codifica para una proteasa de matriz extracelular (MMP-13), así como el aumento en la expresión de gen de la proteína oligomérica de matriz cartilaginosa (COMP) la cual forma parte de la matriz extracelular del cartílago35.
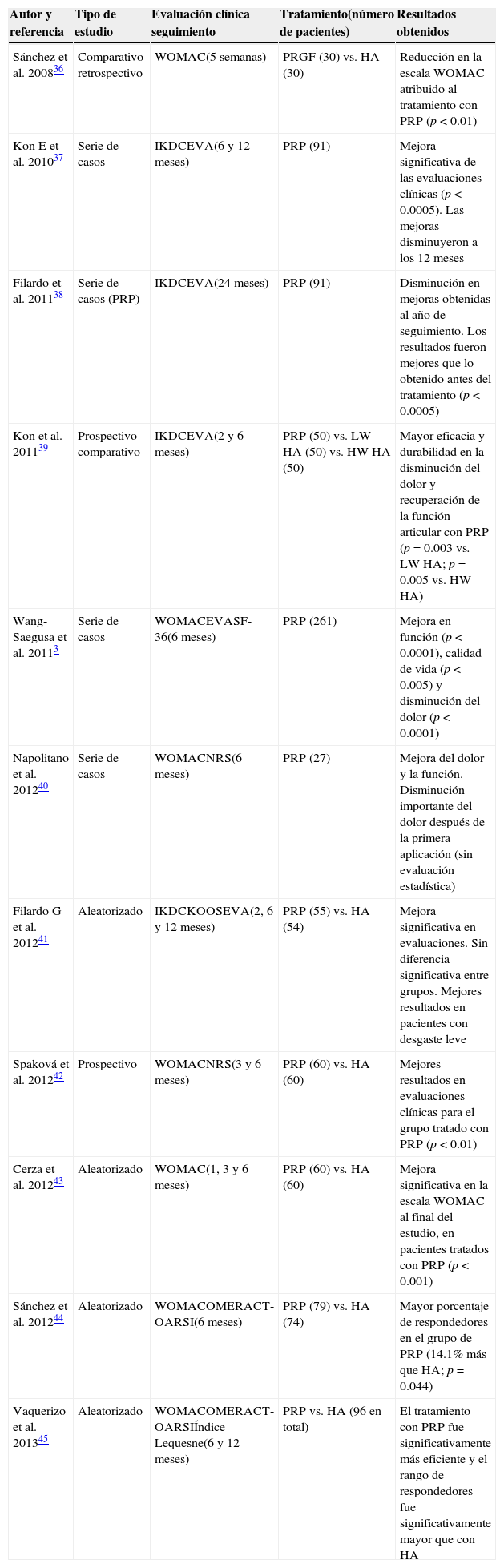
Estudios clínicos sobre el uso de plasma rico en plaquetas como tratamiento para osteoartrosisLos estudios clínicos actualmente disponibles en la literatura médica apoyan el uso del plasma rico en plaquetas para el tratamiento de las lesiones de cartílago en rodilla, aplicándolo en forma de infiltraciones intraarticulares. En todos ellos, se valen del uso de escalas clínicas o índices (WOMAC, IKDC, KOOS, NRS, entre otras) para valorar y medir el efecto del tratamiento.
Un resumen de los principales trabajos se muestra en la tabla 23,36–45. Se trata de estudios muy heterogéneos en cuanto al tipo de afección de los pacientes tratados, el intervalo de aplicación de las infiltraciones, así como el número de aplicación de las mismas, y el predominio de periodos de evaluación de corto a mediano plazo. A pesar de lo anterior se puede apreciar que, en la mayoría, el plasma rico en plaquetas ofrece mejores resultados en comparación con las otras estrategias de tratamiento empleadas (principalmente ácido hialurónico).
Ensayos clínicos sobre la aplicación de la terapia con plasma rico en plaquetas en osteoartrosis de rodilla
| Autor y referencia | Tipo de estudio | Evaluación clínica seguimiento | Tratamiento(número de pacientes) | Resultados obtenidos |
|---|---|---|---|---|
| Sánchez et al. 200836 | Comparativo retrospectivo | WOMAC(5 semanas) | PRGF (30) vs. HA (30) | Reducción en la escala WOMAC atribuido al tratamiento con PRP (p<0.01) |
| Kon E et al. 201037 | Serie de casos | IKDCEVA(6 y 12 meses) | PRP (91) | Mejora significativa de las evaluaciones clínicas (p<0.0005). Las mejoras disminuyeron a los 12 meses |
| Filardo et al. 201138 | Serie de casos (PRP) | IKDCEVA(24 meses) | PRP (91) | Disminución en mejoras obtenidas al año de seguimiento. Los resultados fueron mejores que lo obtenido antes del tratamiento (p<0.0005) |
| Kon et al. 201139 | Prospectivo comparativo | IKDCEVA(2 y 6 meses) | PRP (50) vs. LW HA (50) vs. HW HA (50) | Mayor eficacia y durabilidad en la disminución del dolor y recuperación de la función articular con PRP (p=0.003 vs. LW HA; p=0.005 vs. HW HA) |
| Wang-Saegusa et al. 20113 | Serie de casos | WOMACEVASF-36(6 meses) | PRP (261) | Mejora en función (p<0.0001), calidad de vida (p<0.005) y disminución del dolor (p<0.0001) |
| Napolitano et al. 201240 | Serie de casos | WOMACNRS(6 meses) | PRP (27) | Mejora del dolor y la función. Disminución importante del dolor después de la primera aplicación (sin evaluación estadística) |
| Filardo G et al. 201241 | Aleatorizado | IKDCKOOSEVA(2, 6 y 12 meses) | PRP (55) vs. HA (54) | Mejora significativa en evaluaciones. Sin diferencia significativa entre grupos. Mejores resultados en pacientes con desgaste leve |
| Spaková et al. 201242 | Prospectivo | WOMACNRS(3 y 6 meses) | PRP (60) vs. HA (60) | Mejores resultados en evaluaciones clínicas para el grupo tratado con PRP (p<0.01) |
| Cerza et al. 201243 | Aleatorizado | WOMAC(1, 3 y 6 meses) | PRP (60) vs. HA (60) | Mejora significativa en la escala WOMAC al final del estudio, en pacientes tratados con PRP (p<0.001) |
| Sánchez et al. 201244 | Aleatorizado | WOMACOMERACT-OARSI(6 meses) | PRP (79) vs. HA (74) | Mayor porcentaje de respondedores en el grupo de PRP (14.1% más que HA; p=0.044) |
| Vaquerizo et al. 201345 | Aleatorizado | WOMACOMERACT-OARSIÍndice Lequesne(6 y 12 meses) | PRP vs. HA (96 en total) | El tratamiento con PRP fue significativamente más eficiente y el rango de respondedores fue significativamente mayor que con HA |
EVA: escala visual análoga; HA: ácido hialurónico; HW: high weight; IKDC: International Knee Documentation Comitee; KOOS: knee injury and osteoarthritis outcome score; LW: low weight; NRS: numeric rating scale; OMERACT-OARSI: Rheumatology Committee and Osteoarthritis Research Society International Standing Committee for Clinical Trials Response Criteria Initiative; PRP: plasma rico en plaquetas; WOMAC: Western Ontario and McMaster Universities Index of Osteoarthritis;
En seis de estos estudios se presentan resultados acerca de series de casos o ensayos comparativos no controlados, lo que presenta una de las principales desventajas al momento de evaluar el plasma rico en plaquetas como terapia. Sin embargo, en todos ellos se pudo observar que esta aproximación terapéutica es segura, y que mejora los síntomas en los pacientes.
El resto de las publicaciones corresponden a ensayos más recientes, en donde se compara el tratamiento de plasma rico en plaquetas, contra el de ácido hialurónico en pacientes tratados de manera aleatoria. El primero tiene mejores resultados que el segundo en la disminución del dolor, mejora de la función articular, y la calidad de vida. Solo en uno de los estudios no hubo diferencias significativas entre grupos. La evidencia clínica de este tipo de estudios es más relevante, y se confirma la seguridad de la terapia propuesta. El número de pacientes tratados por grupo varía de 50-80 aproximadamente.
ConclusiónEl uso del plasma rico en plaquetas dirigido a la reparación de tejidos en diversas áreas de la medicina, se ha incrementado en años recientes, debido a los numerosos resultados positivos derivados de estudios con base clínica y científica, en cuanto a su aplicación directa. A pesar de ello, su eficacia como terapia en el tratamiento de la osteoartrosis no está del todo demostrada. Esto se debe sobre todo a que en un inicio la evidencia clínica provenía solo de estudios de series de casos, carentes de comparación con algún otro tratamiento y/o grupo control, con un número pequeño de sujetos tratados, o con una población de pacientes heterogénea en cuanto al tipo de lesión y/o grado de osteoartrosis. Los ensayos aleatorizados que arrojan evidencia relevante han comenzado a ser publicados recientemente, lo que ayudará a elucidar esta cuestión. No obstante, en general los estudios clínicos muestran mejoría en los pacientes tratados, al menos en lo que respecta a la sintomatología presentada. Lo que sí queda plenamente claro, es que el uso del plasma rico en plaquetas como terapia alterna es seguro, debido a la ausencia de reportes de eventos adversos serios en los pacientes tratados. También cabe señalar que en los estudios en donde se tratan diversos grados de alteración en la articulación, aquellos de menor edad y con un menor grado de lesión muestran los mejores resultados. Por lo que, es posible señalar que el tratamiento con plasma rico en plaquetas pudiera tener un mejor efecto si se aplica de manera preventiva, antes de que el desgaste sea irreversible, como lo que ocurriría en pacientes en donde la única opción de tratamiento es el reemplazo de la rodilla por una prótesis. Otra observación importante es que cuando se les ha dado seguimiento a largo plazo a los pacientes tratados con plasma rico en plaquetas, la mejora inicialmente observada va disminuyendo, por lo que aplicaciones subsecuentes podrían ser una opción.
Por otra parte, es importante tener en cuenta la evidencia científica a partir de estudios in vitro o de estudios en modelos animales, que demuestran que el uso del plasma rico en plaquetas puede revertir el daño generado en el cartílago dañado. En ellos se puede apreciar el beneficio que tiene el uso del plasma rico en plaquetas, sobre el ambiente articular; tales como revertir procesos inflamatorios o inducir la formación de matriz extracelular.
Por el momento, el tratamiento con plasma rico en plaquetas se tendrá que reservar para aquellos pacientes en los que, basados en la evidencia científica reciente, puedan obtener el mejor resultado de esta terapia, en caso de que el tratamiento convencional conservador haya fallado. Futuros estudios tendrán que estar encaminados a esclarecer aspectos como: cuál es la mejor formulación o cuáles son los mejores procedimientos para su administración (número de aplicaciones, intervalo de aplicaciones).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.