Los dispositivos de entrenamiento en punción percutánea renal son costosos, usan residuos biológicos infecciosos o emiten radiación. Diseñamos 2 dispositivos que eliminan algunas o todas estas características (ManiPERC e iPERC).
ObjetivoComparar la mejoría en el tiempo de acceso al colector posterior e inferior al practicar en los dispositivos.
Material y métodosEnsayo clínico cuasiexperimental con 16 residentes de urología. Se asignaron los sujetos a uno de dos modelos de dispositivo de entrenamiento para realizar 20 sesiones de punción y se analizaron los videos del entrenamiento antes y después de 20 sesiones.
ResultadosAmbos grupos mejoraron su tiempo de acceso; con iPERC pasó de 133.88±41.40 a 76±12.62s (p=0.006), y con ManiPERC, de 176.5±85.81 a 68.75±18.40s (p=0.007). Al comparar iPERC versus ManiPERC, no hay diferencia entre ellos en la mejoría del tiempo de acceso (ANCOVA: F Modelo (1.13)=1.598, p = 0.228).
ConclusionesAmbos modelos son equivalentes en la mejoría de las destrezas; sin embargo, aun cuando ninguno de ellos genera residuos biológicos, la ausencia de emisiones radiactivas hace del iPERC el modelo con mayor ventaja.
Training devices for percutaneous renal access are expensive, have hazardous biological materials, or radiation. Two devices were designed that eliminate some or all of these characteristics (ManiPERC and iPERC).
ObjectiveTo compare the improvement in access time to the posterior lower calix with 2 inanimate models in a group of Urology residents.
Material and methodsQuasi-experimental clinical trial with 16 Urology residents to compare the improvement over time of percutaneous renal access by training in 2 inanimate models (iPERC: simulated fluoroscopy and ManiPERC: real fluoroscopy).
ResultsSubjects were assigned to one of 2 groups (iPERC and ManiPERC) and a video analysis of all of them was performed before and after 20 training sessions. Both groups improved their access time; with iPERC from 133.88±41.40 to 76±12.62s (p=0.006) and from 176.5±85.81 to 68.75 to 18.40s (p=0.007) with ManiPERC. Comparing iPERC versus ManiPERC there was no difference between them in improving access time (ANCOVA: Model F (1.13)=1.598, p=0.228).
ConclusionsBoth models are equivalent in improving skills; however, even though none of them generated bio-waste, the absence of radioactive emissions makes iPERC the more advantageous model.
La probabilidad de desarrollar litiasis urinaria durante la vida se ha incrementado paralelamente a la obesidad y la diabetes tipo 2, siendo de un 12% para los hombres y de un 4.8% para las mujeres, y su recurrencia es de un 30-40%, representando un gasto en salud para litiasis calculado en 2 billones de dólares para el año 2000 en los Estados Unidos1.
La nefrolitotricia percutánea es la técnica de elección para la mayoría de los cálculos renales mayores de 2cm y su uso ha aumentado en 50.4% en los últimos 15 años por ser un procedimiento de mínima invasión2.
Esta cirugía tiene una tasa de complicaciones que no es despreciable, y se ha estimado que un 7.8% de los pacientes presentan sangrado significativo, requiriendo en el 5.7% terapia transfusional, un 3.4% presentan perforación importante del sistema pielocalicial, y hasta un 1.8% presentan hidrotórax; también se describen muertes asociadas al procedimiento3 y perforación de vísceras abdominales, como: duodeno4,5, vía biliar intra o extrahepática6, bazo7–9 y, más comúnmente, el colon10–12. Existen lesiones que pueden poner en riesgo la vida del paciente al dañar estructuras como la vena cava13.
La técnica de punción para el acceso percutáneo es el procedimiento que más se asocia a complicaciones, y en ella son factores determinantes el tiempo, así como el número de punciones para el acceso14,15.
El 86.3% de los accesos renales percutáneos a nivel mundial se realiza con control fluoroscópico por permitir una mejor orientación tridimensional del sistema pielocalicial, y de esta forma mejorar la precisión del acceso entre la compleja anatomía vascular y calicial del riñón16–19.
Otros factores que hacen del acceso percutáneo un procedimiento que requiere alta destreza son: la rotación externa del riñón en el plano coronal, la rotación posterior en el plano transversal y la gran variabilidad de la distancia del riñón a la piel por el contenido de grasa de cada paciente, así como la presencia de una doble fila de colectores en el polo inferior en más de la mitad de los casos20–22.
Por otro lado, en promedio por procedimiento in vivo, un médico se radia 0.28mSv (6.04min), y para el tutor la dosis sería aún mayor si estuviera presente en todos los entrenamientos23. Las dosis pueden llegar a ser para el médico en entrenamiento de hasta 5.2mSv en las manos, 7.5mSv en los dedos y 1.6mSv en los ojos en hasta 21.9min por evento24. De acuerdo con la International Comission on Radiological Protection, la dosis máxima recomendada de exposición ocupacional es de 20mSv al año25, por lo que los modelos en los que se use fluoroscopia para hacer secuencias de repeticiones de manera indefinida no parecen ser la mejor opción.
El tiempo para acceder al sistema pielocalicial durante una nefrolitotricia guiada por fluoroscopia es directamente proporcional al tiempo de exposición a radiación, y se ha estimado que una de cada 1,000 personas expuestas a por lo menos 10mSv a lo largo de su vida desarrollará cáncer26.
Se requieren desde 36 hasta 60 casos en la curva de aprendizaje para la realización de una cirugía renal percutánea27, pero un médico en entrenamiento se siente cómodo para realizar el acceso después de 21 procedimientos; dicha curva se lleva a cabo directamente en pacientes al carecer de un modelo adecuado para la práctica ex vivo28–31.
Cuando se realiza un entrenamiento formal en accesos percutáneos es más probable que después del entrenamiento, el médico proponga la nefrolitotricia percutánea como una opción a sus pacientes (27 vs. 11%), y quienes no la proponen argumentan que es un procedimiento que requiere mucha destreza en el acceso31.
Existen pocos modelos para acceso renal percutáneo guiado y generalmente son biológicos, que requieren entrenamiento mediante repeticiones en riñones de cerdo27,32,33 y exposición durante estas repeticiones a una dosis acumulada importante de radiación.
Por sus características, los modelos biológicos requieren, además, instalaciones apropiadas para procedimientos quirúrgicos en animales y un manejo adecuado de los residuos biológicos que se generan, así como consideraciones éticas importantes34.
Los modelos de entrenamiento deberían mejorar los puntos clave en el acceso renal percutáneo guiado por fluoroscopia, que son: el tiempo total de acceso y el tiempo de imagen35,36, este último relacionado directamente con la radiación acumulada del paciente y el equipo quirúrgico, pero el número de reposicionamientos del arco en C y el número de ajustes de la aguja con el arco en C a 0 y 30° pueden relacionarse con el trauma renal.
En nuestro medio no existe ningún modelo que reúna las características ideales para el entrenamiento en acceso renal percutáneo; los modelos exponen al usuario a riesgos por el manejo de materiales biológicos y el uso de radiación, y los que son libres de exposiciones son de alto costo debido al software y hardware que requieren.
La utilización de un modelo inanimado que simule el escenario clínico, que permita la adecuada orientación espacial de los sitios de acceso y evite el uso de materiales biológicos y de exposición a radiación al alumno y al profesor sería ideal.
Presentamos un estudio comparativo de 2 modelos inanimados desarrollados en nuestro hospital para mejorar el tiempo de acceso al colector posterior e inferior con la práctica en un grupo de residentes de Urología.
Material y métodosSe realizó un estudio cuasiexperimental en el Hospital de Especialidades Centro Médico Nacional Siglo XXI del Instituto Mexicano del Seguro Social durante el período comprendido del 3 de septiembre de 2013 al 1 de marzo de 2014, con 16 residentes, los cuales practicaron en alguno de los 2 modelos inanimados diseñados por nosotros (patente en trámite) para el entrenamiento en acceso renal percutáneo guiado por fluoroscopia.
Se incluyeron residentes cursando total o parcialmente su especialidad de Urología en el Instituto Mexicano del Seguro Social, sin práctica previa en cirugía renal percutánea. Se tomaron como criterios de exclusión: la experiencia en nefrolitotricia percutánea como cirujano con más de 5 casos y la ingesta de fármacos con efecto en el sistema nervioso central.
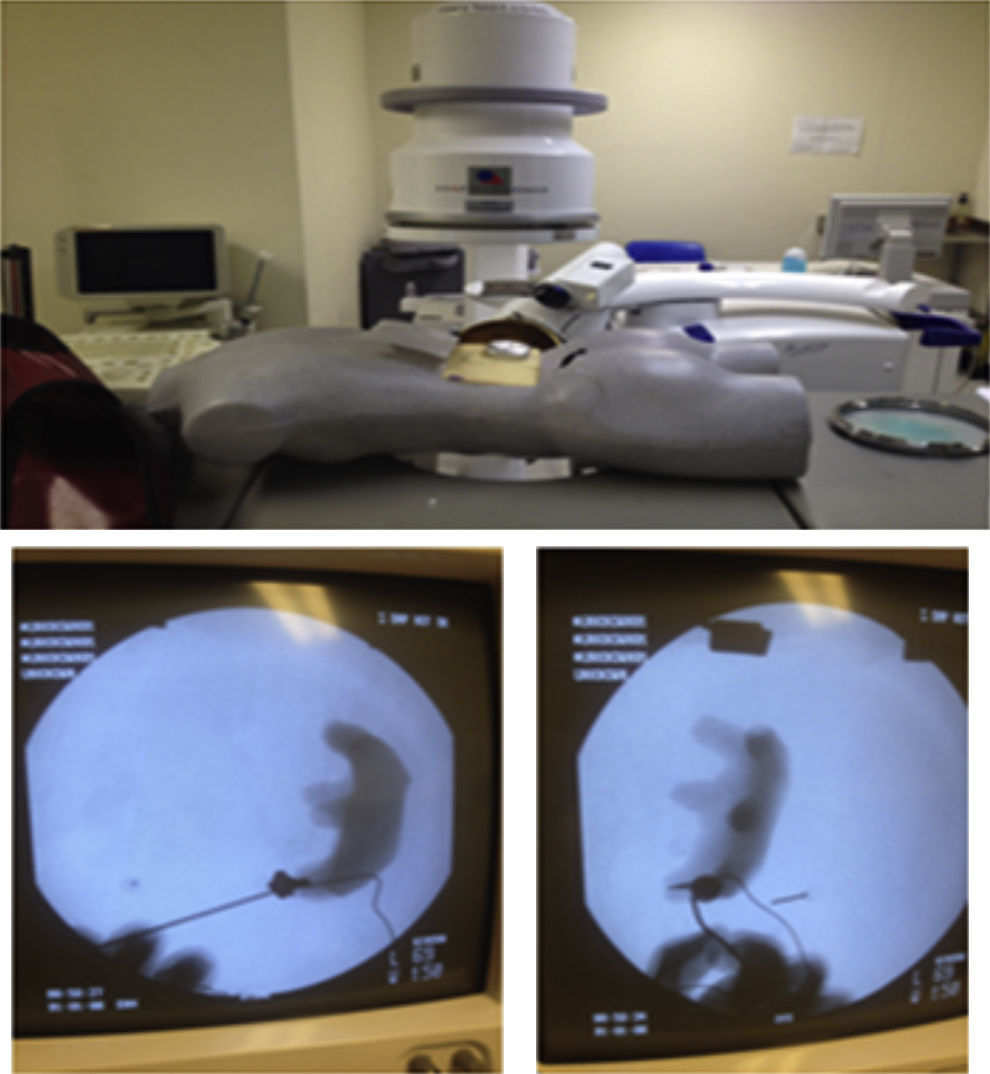
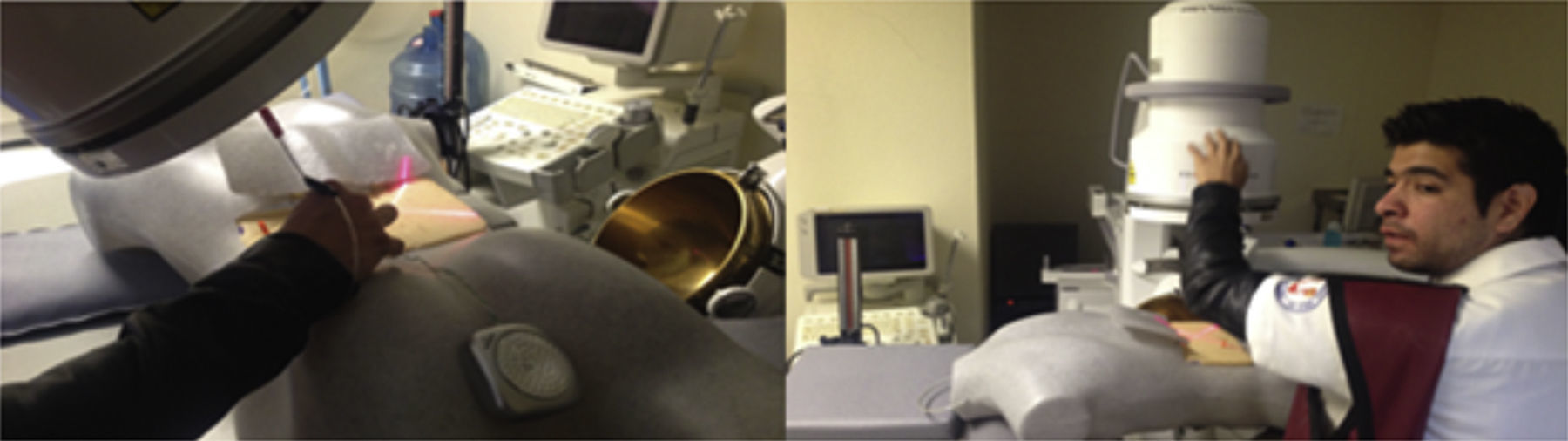
Los residentes realizaron 20 prácticas en alguno de los 2 modelos inanimados para entrenamiento en acceso renal percutáneo guiado por fluoroscopia con técnica de triangulación. El primero, denominado iPERC (patente en trámite), permite la simulación de emisión fluoroscópica al emitir luz por una lámpara fría de 15watts (corriente directa) al activar un interruptor y contiene un brazo rotativo en posición neutra (0°) y giro a 30°, con una plataforma superior para colocar un teléfono móvil (con cámara y función de grabación de vídeo) y utilizar la cámara de vídeo del mismo para la visualización de las maniobras a través de la pantalla en tiempo real; usa un sistema pielocalicial de resina radioopaco conectado a un circuito eléctrico que se cierra y activa una luz indicadora al llegar al objetivo a puncionar, contenido dentro de un cubo de acrílico opaco con una superficie para puncionar de polietileno. El segundo modelo se denominó ManiPERC, es un modelo tridimensional de entrenamiento con un maniquí de poliestireno que permite la colocación del mismo circuito y sistema pielocalicial de resina usados en el iPERC con las características de ángulos del sistema pielocalicial en humanos, dentro de un cubo radiolúcido de espuma de poliuretano dentro del maniquí, usando las imágenes fluoroscópicas a 0 y 30° obtenidas con el arco en C de la mesa de litotricia extracorpórea modelo Vision Edap Technomed del Servicio de Urología del Hospital de Especialidades Centro Médico Nacional Siglo XXI, del Instituto Mexicano del Seguro Social, documentando con una videocámara las imágenes fluoroscópicas y los ajustes del arco y la aguja de punción en tiempo real; el modelo se muestra en la figura 1.
Los moldes de resina del sistema pielocalicial fueron producidos en serie y fueron iguales para todos los procedimientos para evitar el sesgo que se genera por la punción en sistemas de complejidad variable.
Las punciones se realizaron posteriores a la explicación de las bases teóricas del procedimiento; los residentes realizaron los accesos percutáneos trabajando en parejas en ambos modelos inanimados. El alumno 1 realizó la punción, y el alumno 2 contribuye con el movimiento del arco en C y la emisión de «fluoroscopia» al tiempo que lo solicite el alumno que punciona, iniciando con el marcaje en la superficie de punción el punto de acceso al colector inferior con un ángulo de visión a 0°, y luego marcando el punto de acceso con un ángulo de visión a 30° con técnica de triangulación. Posteriormente se dirige la aguja ajustando el trayecto con cambios de ángulo de visión del brazo de fluoroscopia hasta acceder al colector inferior y posterior del sistema pielocalicial, llevando el control visual en la pantalla de fluoroscopia para el ManiPERC, y en la pantalla de su teléfono móvil para el iPERC. La activación para obtener imágenes en iPERC se realiza con un botón, y en el ManiPERC, con un pedal.
Se obtuvieron grabaciones de la práctica inicial y final posterior a las repeticiones y se analizaron las destrezas de tiempo de acceso, tiempo de visión (fluoroscopia), movimientos del arco en C y ajustes de la aguja a 0 y 30°. Para el modelo ManiPERC se realizó una encuesta de validación subjetiva al médico en entrenamiento clasificando el modelo por su uso en: desfavorable, favorable, bueno y excelente.
Todos los sujetos que practicaron en el modelo inanimado ManiPERC fueron provistos de chalecos y cuelleras de protección contra la radiación; así mismo, se les solicitó el consentimiento informado para su participación en el estudio.
Análisis estadísticoSe realizó prueba de normalidad de Shapiro a las variables numéricas. Las diferencias estadísticas dentro de cada grupo de sujetos se identificaron con la t de Student para muestras dependientes cuando tenían distribución normal, y para las variables de libre distribución, con Wilcoxon. Para comparar el tiempo de acceso y de fluoroscopia (imagen o visión) entre los 2 grupos se utilizó la prueba F (ANCOVA) para homogeneizar los dispares tiempos iniciales entre grupos. El resto de las variables nominales se describen con porcentajes. Se usó para el análisis el programa estadístico SPSS® v. 21 (SPSS Inc., Chicago, IL, EE. UU.).
ResultadosParticiparon 16 residentes. Asignados por simple disponibilidad, 8 realizaron prácticas en el modelo iPERC (fig. 2) y 8 en el ManiPERC (fig. 3). Las edades de los sujetos de investigación fueron comparables: 29.50 (29-31.5) años para el modelo iPERC y 29.00 (29.00-30.00) para ManiPERC (p=0.574). Las características demográficas de cada grupo fueron del siguiente modo: para el grupo iPERC (n=8), 3 residentes (37.5%) se encontraban en el quinto año de la especialidad, 2 (25%) en el cuarto, uno (12.5%) en el tercero y 2 (25%) en el segundo; en el grupo de entrenamiento en ManiPERC (n=8), 3 residentes (37%) se encontraban en el quinto año, 4 (50%) se encontraban en el cuarto, uno (12.5%) era de tercer año y no hubo residentes de segundo año.
Para el modelo iPERC se observó una mejoría para el tiempo de acceso de 133.88±41.40 a 76±12.62s (p=0.006). El tiempo de fluoroscopia simulada disminuyó de 78.71±37.25 a 39.88±11.34s (p=0.007). Los movimientos del arco en C disminuyeron de 8.5 (RIC 3.00-10.50) a 4.0 (RIC 3.00-5.00) (p=0.027); la mejoría en el número de ajustes de la aguja a 0° fue de 8.5 (RIC 1.00-4.00) a 1.0 (RIC 0.00-2.00) (p=0.031) y no hubo mejoría en los ajustes a 30° (p=0.344).
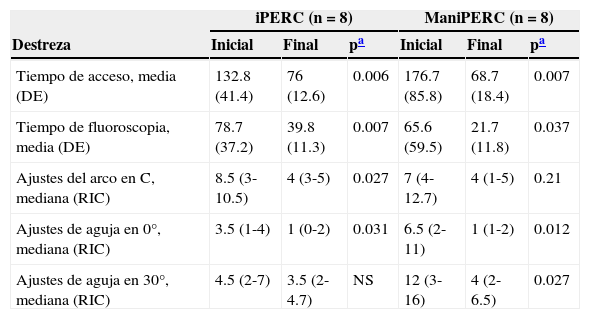
Para el ManiPERC hubo mejoría en el tiempo de acceso, de 176.5±85.81 a 68.75±18.40s (p=0.007); disminución en el tiempo de fluoroscopia de 65.63±59.50 a 21.75±11.87s (p=0.037); mejora en los ajustes del arco en C y de la aguja a 0 y 30° (p=0.021, p=0.012 y p=0.27, respectivamente). Los resultados para las destrezas evaluadas en cada modelo se describen en la tabla 1.
Mejoría en las destrezas evaluadas con cada uno de los modelos de entrenamiento
| iPERC (n=8) | ManiPERC (n=8) | |||||
|---|---|---|---|---|---|---|
| Destreza | Inicial | Final | pa | Inicial | Final | pa |
| Tiempo de acceso, media (DE) | 132.8 (41.4) | 76 (12.6) | 0.006 | 176.7 (85.8) | 68.7 (18.4) | 0.007 |
| Tiempo de fluoroscopia, media (DE) | 78.7 (37.2) | 39.8 (11.3) | 0.007 | 65.6 (59.5) | 21.7 (11.8) | 0.037 |
| Ajustes del arco en C, mediana (RIC) | 8.5 (3-10.5) | 4 (3-5) | 0.027 | 7 (4-12.7) | 4 (1-5) | 0.21 |
| Ajustes de aguja en 0°, mediana (RIC) | 3.5 (1-4) | 1 (0-2) | 0.031 | 6.5 (2-11) | 1 (1-2) | 0.012 |
| Ajustes de aguja en 30°, mediana (RIC) | 4.5 (2-7) | 3.5 (2-4.7) | NS | 12 (3-16) | 4 (2-6.5) | 0.027 |
DE: desviación estándar; NS: no significativo; RIC: rango intercuartílico.
El tiempo de acceso y de fluoroscopia se reporta en segundos, y los ajustes del arco en C y de la aguja se reportan en número absoluto.
Ambos modelos demostraron ser equivalentes en el porcentaje de mejoría para el tiempo de acceso al riñón, 38.09±20.40 vs. 55.77±18.17% para iPERC y ManiPERC, respectivamente (p=0.089); la mejoría en el tiempo de fluoroscopia fue equivalente, 43.91±16.90 vs. 59.73±14.29% para iPERC y ManiPERC, respectivamente (p=0.063).
Debido a que los tiempos de acceso inicial y el tiempo de fluoroscopia (visión) eran diferentes al inicio en iPERC y ManiPERC, utilizamos ANCOVA para realizar las comparaciones estandarizando con esto el tiempo inicial en ambos grupos. Para el tiempo de acceso, el resultado de la prueba F para el producto modelo y el tiempo de acceso inicial asume homogeneidad de la regresión, F modelo* tiempo de acceso inicial 1.12=0.46 (p>0.05), por lo que al no haber interacción, el efecto neto de ambos modelos sobre el tiempo de acceso al final de las prácticas es el mismo, F modelo 1.13=1.598 (p=0.228).
Para el tiempo de fluoroscopia (tiempo de visión) el resultado de la prueba F para el producto modelo y el tiempo de fluoroscopia inicial asume homogeneidad de la regresión, F modelo* tiempo de fluoroscopia inicial 1.12=0.314 (p>0.05), por lo que al no haber interacción, el efecto neto de ambos modelos sobre el tiempo de fluoroscopia al final de las prácticas fue diferente, F modelo 1.13=25.53 (p=0.000), mejor para ManiPERC.
En cuanto a la validación subjetiva por el sujeto en estudio para el modelo ManiPERC, el 50% (n=4) consideró el desempeño del modelo como bueno y el 50% (n=4) como excelente, opinando en su totalidad (100%) que la mayor desventaja del modelo es la exposición a la radiación y el movimiento de la superficie de punción. Para el modelo iPERC todos los sujetos evaluados (n=8) referían como principal ventaja la ausencia de radiación, pero con la desventaja de la ausencia de material de soporte entre la superficie de punción y el modelo de resina del sistema pielocalicial.
DiscusiónLa cirugía renal percutánea es una opción terapéutica de mínima invasión para el tratamiento de la mayoría de los cálculos renales2. Este tipo de cirugía tiene riesgos graves para el paciente hasta que se completa la curva de aprendizaje en este procedimiento. El tener que completar la curva sobre la marcha directamente en cirugías con pacientes ha hecho que en México no sea de uso general para el urólogo y, por lo tanto, no la proponga a su paciente a pesar de ser el estándar de oro27.
Nuestros modelos ofrecen una mejoría significativa en las destrezas de tiempo de acceso y de tiempo de fluoroscopia para cada uno, y al compararlos entre ellos, se puede observar que ambos modelos son equivalentes, a pesar de que el ManiPERC se encuentra más apegado a la realidad de acuerdo con la evaluación subjetiva de los sujetos en estudio; el modelo iPERC tiene la ventaja de la no exposición a radiación. Aunque el tiempo de exposición fluoroscópica (de imagen) fue menor para el modelo ManiPERC por 18s, el porcentaje de mejoría respecto a su tiempo inicial es equivalente en ambos modelos, lo que puede estar en relación con la toma progresiva de conciencia con respecto a la dosis acumulada de radiación en el grupo del modelo ManiPERC (radiación real).
Para los desenlaces secundarios del estudio, que fueron la comparación de movimientos del arco en C y los ajustes necesarios de la aguja a 0 y 30° tanto iniciales como finales, no hubo diferencia significativa entre ambos modelos, a excepción del número de ajustes de la aguja a 30° al inicio, que fueron mayores en el modelo ManiPERC, lo cual puede estar relacionado con la facilidad para la orientación de la aguja en el modelo iPERC, al permitir en algunas ocasiones la visualización directa a través de la superficie translúcida de punción. No obstante, esto pudiera ser una ventaja para el urólogo que se inicia en esta cirugía.
Los avances experimentados en el último siglo han determinado que el concepto «animal de experimentación» deba sustituirse por un concepto mucho más amplio, el de «modelo experimental». Como es lógico, la calidad de la información que se puede obtener de un modelo estará en relación directa con su complejidad. Cuando el modelo es más apegado a la realidad y, por lo tanto, es más complejo, ofrece al investigador menos grados de libertad al fijar los factores que pretende estudiar. De esta forma, al enfrentarnos con el estudio de un problema concreto, en este caso el acceso renal percutáneo guiado por fluoroscopia, probablemente habrá que plantear diferentes modelos experimentales que nos vayan acercando a la solución final global, considerando las limitantes de cada uno, para finalmente terminar confirmándolo en el ser humano37–40.
Existen numerosos modelos, como los publicados por De Sá Earp e Imkamp, entre otros, que ofrecen una simulación en riñones de cerdo con buenos resultados en la mejoría de sus destrezas hasta en el 83% de sus casos; sin embargo, ambos representan un riesgo por la exposición a materiales biológicos, y en el caso del modelo de De Sá Earp, la exposición a la radiación27,32,33. En nuestro caso ambos modelos ofrecen la posibilidad de realizar entrenamientos con la ventaja de no exponer a los sujetos de estudio a materiales biológicos, mimetizando de manera más precisa la anatomía calicial del humano, a la vez que son fácilmente reproducibles, de bajo costo y fácil accesibilidad, lo que representa ventajas para la docencia.
Debido a que todos los modelos del sistema pielocalicial eran idénticos con la intención de evitar el sesgo por punción en sistemas de complejidad variable, creemos que la mejoría en las destrezas también puede deberse en parte al aprendizaje espacial.
El modelo ManiPERC se asemeja a la realidad, sin embargo, presenta el inconveniente de la exposición a radiación, lo que limita su uso continuo; para el modelo iPERC esta desventaja no está presente; sin embargo, sacrifica un poco la similitud con el escenario clínico real. Habrá que validar la adquisición de habilidades posterior al entrenamiento en cada modelo en la cirugía in vivo.
ConclusionesAmbos modelos confieren una mejoría significativa para las destrezas estudiadas de manera equivalente, con las ventajas de la no exposición a materiales biológicos, a pesar de que el modelo ManiPERC mimetiza con mayor exactitud las maniobras fluoroscópicas y, por lo tanto, se apega más a la realidad; tiene la gran desventaja de la exposición a radiación real, lo cual es una ventaja en el modelo iPERC.
Se requiere validar ambos modelos y sus resultados con la práctica en vivo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.