El cáncer de mama ha incrementado la mortalidad en mujeres de 25 años y más, superando al cáncer cervicouterino. Es una enfermedad heterogénea, de presentación clínica e histológica variada con diferentes subtipos, por lo que es indispensable el diagnóstico preciso clínico y anatomopatológico (que incluye la inmunohistoquímica); solo así el tratamiento se individualizará y el pronóstico mejorará y se incrementará la sobrevida, con disminución de la mortalidad.
ObjetivoAnalizar la prevalencia de los subtipos del cáncer de mama y su asociación con las características clínicas e histopatológicas del tumor.
Material y métodosEstudio observacional, retrospectivo, transversal y analítico, realizado en 1,380 pacientes con diagnóstico de cáncer de mama que se clasificaron por inmunohistoquímica en 4 subtipos: luminal A, triple negativo, luminal B y HER2. Se analizó la asociación de las características clínicas e histopatológicas del tumor con la edad y los factores de riesgo.
ResultadosLas pacientes tuvieron edades de 53.3±11.4, la frecuencia de los subtipos fue: luminal A (65%), triple negativo (14%), luminal B (12%) y HER2 (9%): las características más frecuentes fueron: el rango de edad de 50 a 59 años, menopausia tardía, mama derecha, cuadrante superoexterno, la etapa II, los ganglios metastásicos y la mastectomía.
ConclusionesEl subtipo más frecuente fue el luminal A, y junto con el luminal B son los que tienen mejor pronóstico en comparación con el triple negativo y HER2.
Breast cancer mortality has increased in women 25 years and over, and since 2006 it has surpassed cervical cancer. Breast cancer is a heterogeneous disease, with several clinical and histological presentations that require a thorough study of all clinical and pathological parameters, including immunohistochemistry to classify it into subtypes, have a better prognosis, provide individualised treatment, increase survival, and reduce mortality.
ObjectiveTo evaluate the prevalence of sub-types of breast cancer and the association with the clinical and histopathological features of the tumour.
Material and methodsAn observational, retrospective, cross-sectional and analytical study conducted on 1380 patients with a diagnosis of breast cancer have been classified by immunohistochemistry into four subtypes: luminal A, triple negative, luminal B and HER2. An analysis was performed on the association with age, risk factors, and the clinical and histopathological features of the tumour.
ResultsThe mean age of the patients was 53.3 ± 11.4. The frequency was luminal A (65%), triple negative (14%), luminal B (12%), and HER2 (9%). The most frequent characteristics were the 50 to 59 age range, late menopause, the right side, upper external quadrant, stage II, metastatic lymph nodes, and mastectomy.
ConclusionThe most frequent sub-type was luminal A, and together with the luminal B are those which have better prognosis compared with the triple negative and HER2.
El cáncer de mama ha incrementado su frecuencia en las últimas décadas y es el más común mundialmente; representa el 16% de todos los cánceres femeninos, y aunque este padecimiento está considerado como una enfermedad del mundo desarrollado, la mayoría de las defunciones se registran en los países en desarrollo1,2. Las bajas tasas de sobrevida en estos países se explican principalmente por la falta de programas eficientes para la detección, diagnóstico y tratamiento3. El incremento de la mortalidad por cáncer de mama es un problema de salud pública, pues a partir del año 2006 superó al cáncer cervicouterino4. El cáncer de mama es una enfermedad heterogénea, que se presenta con diferentes características clínicas e histopatológicas en el momento del diagnóstico. Los factores pronósticos son características individuales del tumor y del paciente, y su análisis y evaluación son fundamentales para seleccionar el tratamiento más específico y eficaz para incrementar la sobrevida y disminuir la mortalidad5,6. En 2006 Carey et al.7 clasificaron el cáncer de mama por inmunohistoquímica (IHQ) en: luminal A (ER+ y/o PR+ y HER2−), luminal B (ER+ y/o PR+ y HER2+), basal-like (ER−, PR−, HER2−, citoqueratina 5/6 positivo o HER1+), HER2+/ER− (ER−, PR− y HER2+) y sin clasificar cuando fueron negativos para los 5 marcadores (RE, RP, HER2neu, HER1 y citoqueratina 5/6).
Este método representa una alternativa más factible debido a que la mitad de los casos de cáncer de mama acontecen en países donde el análisis de los factores pronósticos debe ser económico, fácil y reproducible. Los subtipos luminal A y B son de mejor pronóstico y responden a la terapia hormonal, el HER2 y triple negativo tienen peor pronóstico y solo son sensibles a la quimioterapia8,9. Varios estudios coinciden en que el subtipo luminal A es el más frecuente10–12. La clasificación histológica actual de los carcinomas de mama no refleja la heterogeneidad de los tumores en su comportamiento biológico, ni permite identificar a los pacientes que presentarán mejores respuestas y beneficios con las diferentes modalidades terapéuticas. La diversidad clínica y pronóstica de los carcinomas de mama que son semejantes y homogéneos en cuanto a sus factores pronósticos clásicos, pero que a nivel molecular expresan distintos genes que les confieren variabilidad biológica y pronóstica, el estudio de estos genes ha hecho posible comprender el comportamiento biológico del cáncer de mama e individualizar el pronóstico y el tratamiento de las pacientes13–15. En varios estudios sugieren que con un limitado número de marcadores de inmunohistoquímica se pueden clasificar los carcinomas de mama en subtipos equivalentes a aquellos basados en perfiles de expresión génica; la ventaja del estudio de inmunohistoquímica es que utiliza marcadores que se encuentran disponibles en la mayoría de los servicios de anatomía patológica16–18. Esta clasificación revela diferencias pronósticas con significación estadística, en la recurrencia, sobrevida y mortalidad en los subtipos triple negativo y HER2, en comparación con los subtipos luminal A y B19–21.
El objetivo de este trabajo fue analizar la prevalencia de los subtipos del cáncer de mama por inmunohistoquímica y analizar la asociación de la edad, los factores de riesgo, las características clínicas e histopatológicas del tumor.
Material y métodosEstudio observacional, retrospectivo, transversal y analítico de un periodo de 7 años, del 1 de enero de 2007 al 31 de diciembre de 2013 en el Hospital General Regional 72, del Instituto Mexicano del Seguro Social, que es hospital de referencia de las delegaciones México oriente, México poniente y Distrito Federal norte para el servicio de oncología en ese mismo periodo de tiempo, el servicio de oncología quirúrgica registró 9,058 consultas de primera vez, en comparación el Hospital General Regional 196 que se encuentra en la misma delegación, registró 4,787. Se incluyeron 1,380 pacientes que cumplieron con los criterios de inclusión: tener cáncer de mama en etapas I, II, y III, haber sido tratadas con cirugía radical curativa (cuadrantectomía o mastectomía con disección axilar) y tener resultados de inmunohistoquímica. De acuerdo a los resultados de inmunohistoquímica se clasificaron en 4 subtipos: luminal A (RE+, RP+, HER2−), triple negativo (RE−, RP−, HER2−), luminal B (RE+, RP+, HER2+) y HER2 (RE−, RP−, HER2+). Se analizó la asociación de los subtipos con las variables clínicas e histopatológicas como: edad, factores de riesgo, lado afectado, cuadrante, etapa clínica, tamaño del tumor, tipo de cirugía y ganglios metastásicos.
Se realizó estadística descriptiva para las variables de frecuencias y porcentajes, Chi cuadrado para analizar la asociación de las variables con los subtipos y se utilizó el programa SPSS versión 20.
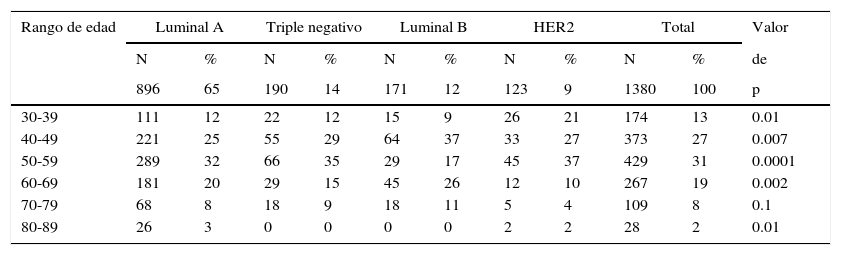
ResultadosFueron 1,380 pacientes con diagnóstico de cáncer de mama, el rango de edad fue de 30 a 86 años con media de 53.3±11.4, y se clasificaron en 4 subtipos por inmunohistoquímica; la frecuencia fue: el luminal A (65%), triple negativo (14%), luminal B (12%) y HER2 (9%), (tabla 1).
Al agruparse a las pacientes por rangos de edad, la mayor frecuencia se observó en el rango de 50 a 59 años (31%); al analizar la asociación de los subtipos con los rangos de edad se encontró entre el luminal A con el de 80 a 89 (3%), el luminal B con el de 40 a 49 (37%) y con el de 60 a 69 (26%), el HER2 con el de 30 a 39 (21%) y con el de 50 a 59 (37%) con una p significativa; no hubo asociación del rango de edad de 70 a 79 con ningún subtipo, ni del subtipo triple negativo con ningún rango de edad (tabla 2).
Frecuencia de los subtipos por rangos de edad
| Rango de edad | Luminal A | Triple negativo | Luminal B | HER2 | Total | Valor | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| N | % | N | % | N | % | N | % | N | % | de | |
| 896 | 65 | 190 | 14 | 171 | 12 | 123 | 9 | 1380 | 100 | p | |
| 30-39 | 111 | 12 | 22 | 12 | 15 | 9 | 26 | 21 | 174 | 13 | 0.01 |
| 40-49 | 221 | 25 | 55 | 29 | 64 | 37 | 33 | 27 | 373 | 27 | 0.007 |
| 50-59 | 289 | 32 | 66 | 35 | 29 | 17 | 45 | 37 | 429 | 31 | 0.0001 |
| 60-69 | 181 | 20 | 29 | 15 | 45 | 26 | 12 | 10 | 267 | 19 | 0.002 |
| 70-79 | 68 | 8 | 18 | 9 | 18 | 11 | 5 | 4 | 109 | 8 | 0.1 |
| 80-89 | 26 | 3 | 0 | 0 | 0 | 0 | 2 | 2 | 28 | 2 | 0.01 |
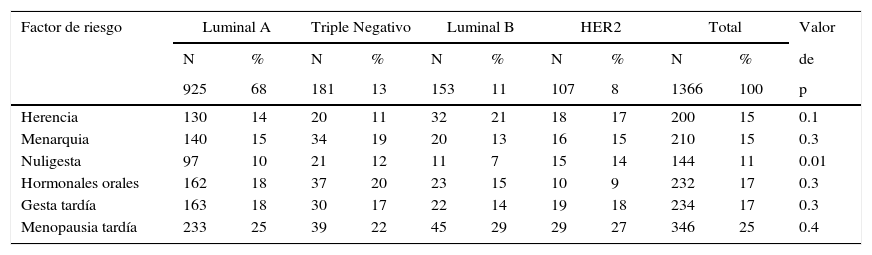
De los factores de riesgo el más frecuente fue la menopausia tardía (25%), aunque en el análisis estadístico no hubo asociación con ningún subtipo, solo la hubo entre el subtipo HER2 con la nuligesta (14%), con una p significativa (tabla 3).
Subtipos y factores de riesgo
| Factor de riesgo | Luminal A | Triple Negativo | Luminal B | HER2 | Total | Valor | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| N | % | N | % | N | % | N | % | N | % | de | |
| 925 | 68 | 181 | 13 | 153 | 11 | 107 | 8 | 1366 | 100 | p | |
| Herencia | 130 | 14 | 20 | 11 | 32 | 21 | 18 | 17 | 200 | 15 | 0.1 |
| Menarquia | 140 | 15 | 34 | 19 | 20 | 13 | 16 | 15 | 210 | 15 | 0.3 |
| Nuligesta | 97 | 10 | 21 | 12 | 11 | 7 | 15 | 14 | 144 | 11 | 0.01 |
| Hormonales orales | 162 | 18 | 37 | 20 | 23 | 15 | 10 | 9 | 232 | 17 | 0.3 |
| Gesta tardía | 163 | 18 | 30 | 17 | 22 | 14 | 19 | 18 | 234 | 17 | 0.3 |
| Menopausia tardía | 233 | 25 | 39 | 22 | 45 | 29 | 29 | 27 | 346 | 25 | 0.4 |
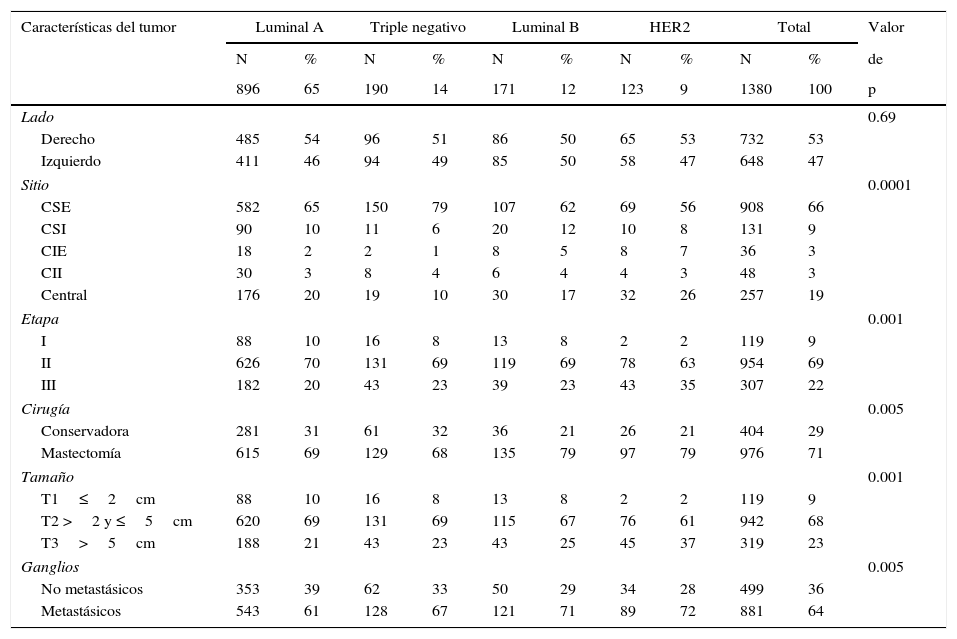
Las características del tumor más frecuentes fueron: el lado derecho 53%, el cuadrante supero externo 66%, la etapa II 69%, la mastectomía 71%, el tamaño T2 68% y los ganglios metastásicos 64%. La asociación de los subtipos con las características del tumor se encontró entre el luminal A con la etapa I (10%), la etapa II (70%), el tamaño T1 (10%), el tamaño T2 (69%) y ganglios no metastásicos (39%), el triple negativo con el cuadrante supero externo (79%) y la cirugía conservadora (32%), el luminal B con la mastectomía (79%), el HER2 con la etapa III (35%), el tamaño T3 (37%), la mastectomía (79%) y ganglios metastásicos (72%), con una p significativa; no hubo asociación entre el lado con ningún subtipo (tabla 4).
Subtipos y características del tumor
| Características del tumor | Luminal A | Triple negativo | Luminal B | HER2 | Total | Valor | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| N | % | N | % | N | % | N | % | N | % | de | |
| 896 | 65 | 190 | 14 | 171 | 12 | 123 | 9 | 1380 | 100 | p | |
| Lado | 0.69 | ||||||||||
| Derecho | 485 | 54 | 96 | 51 | 86 | 50 | 65 | 53 | 732 | 53 | |
| Izquierdo | 411 | 46 | 94 | 49 | 85 | 50 | 58 | 47 | 648 | 47 | |
| Sitio | 0.0001 | ||||||||||
| CSE | 582 | 65 | 150 | 79 | 107 | 62 | 69 | 56 | 908 | 66 | |
| CSI | 90 | 10 | 11 | 6 | 20 | 12 | 10 | 8 | 131 | 9 | |
| CIE | 18 | 2 | 2 | 1 | 8 | 5 | 8 | 7 | 36 | 3 | |
| CII | 30 | 3 | 8 | 4 | 6 | 4 | 4 | 3 | 48 | 3 | |
| Central | 176 | 20 | 19 | 10 | 30 | 17 | 32 | 26 | 257 | 19 | |
| Etapa | 0.001 | ||||||||||
| I | 88 | 10 | 16 | 8 | 13 | 8 | 2 | 2 | 119 | 9 | |
| II | 626 | 70 | 131 | 69 | 119 | 69 | 78 | 63 | 954 | 69 | |
| III | 182 | 20 | 43 | 23 | 39 | 23 | 43 | 35 | 307 | 22 | |
| Cirugía | 0.005 | ||||||||||
| Conservadora | 281 | 31 | 61 | 32 | 36 | 21 | 26 | 21 | 404 | 29 | |
| Mastectomía | 615 | 69 | 129 | 68 | 135 | 79 | 97 | 79 | 976 | 71 | |
| Tamaño | 0.001 | ||||||||||
| T1≤2cm | 88 | 10 | 16 | 8 | 13 | 8 | 2 | 2 | 119 | 9 | |
| T2 >2 y ≤5cm | 620 | 69 | 131 | 69 | 115 | 67 | 76 | 61 | 942 | 68 | |
| T3>5cm | 188 | 21 | 43 | 23 | 43 | 25 | 45 | 37 | 319 | 23 | |
| Ganglios | 0.005 | ||||||||||
| No metastásicos | 353 | 39 | 62 | 33 | 50 | 29 | 34 | 28 | 499 | 36 | |
| Metastásicos | 543 | 61 | 128 | 67 | 121 | 71 | 89 | 72 | 881 | 64 | |
Central: retro-areolar; CIE: cuadrante inferoexterno; CII: cuadrante inferointerno; CSE: cuadrante superoexterno; CSI: cuadrante superointerno.
En este estudio se encontró una prevalencia del subtipo luminal A (65%), triple negativo (14%), luminal B (12%) y HER2 (9%) ligeramente diferente a lo reportado por Uribe y su equipo10, que reportaron 60, 29, 9 y 2%, en tanto que Arrechea et al.11 obtuvieron 62.5, 8.4, 18 y 9.9%, mientras que Calderón y su equipo12 56, 19, 8 y 17%; en todos el subtipo luminal A fue el más frecuente, superando el 50%.
La asociación de los subtipos con los rangos de edad de las pacientes se encontró entre el subtipo luminal A con el de 80 a 89; esto se explica debido a que los receptores hormonales positivos son más frecuentes en las pacientes posmenopáusicas, a diferencia el subtipo HER2 que se asoció con el de 30 a 39, en donde los receptores hormonales positivos son menos frecuentes en las pacientes premenopáusicas.
De los factores de riesgo el más frecuente fue la menopausia tardía (25%), pero no se asoció con ningún subtipo. Solo el subtipo HER2 se asoció con nuligestas.
De las características del tumor que se asociaron con el subtipo luminal A fueron las etapas I y II, el tamaño T1 y T2 y los ganglios no metastásicos características que tienen mejor pronóstico, a diferencia del subtipo HER2 que se asoció con la etapa III, el tamaño T3, los ganglios metastásicos y la mastectomía características de peor pronóstico19–22.
Los subtipos luminal A y luminal B representan más del 75% en los cuales está indicada la terapia hormonal como otra modalidad de tratamiento sistémico, aunque en los subtipos luminal B por ser HER2+ no tiene la misma respuesta a la terapia hormonal como en los subtipos luminal A. En los subtipos luminal B y HER2 está indicada la terapia blanco con el anticuerpo monoclonal trastuzumab, mientras que en el subtipo triple negativo no está indicada la terapia hormonal ni el trastuzumab, solo la quimioterapia como tratamiento sistémico23–25.
Se han iniciado campañas de información en los medios masivos de comunicación para promover la autoexploración en las mujeres mayores de 25 años, así como la mastografía de detección en mujeres mayores de 40 años, con la finalidad de diagnosticarlas en etapas iniciales, cuando el tumor es menor de 1 cm y se trata eficazmente, se logra tener una sobrevida superior al 95% con lo cual la mortalidad disminuiría; en este estudio la etapa I solo representó el 9%.
ConclusionesEn este estudio, al igual que en otros, el subtipo luminal A es el más frecuente, superando la mitad de los casos; los subtipos luminal A y luminal B representan más de las 3/4 partes, y en los otros subtipos hay ligeras diferencias que podrían explicarse por el tipo de población estudiada. El subtipo luminal A es el de mejor pronóstico, seguido por el luminal B, luego el HER2 y por último el triple negativo. De los factores de riesgo la menopausia tardía fue el más frecuente, identificándose en la cuarta parte. De las características del tumor el tamaño menor de 2 cm, la etapa I y los ganglios no metastásicos son factores de mejor pronóstico y se asociaron al subtipo luminal A, a diferencia de los tumores mayores de 5 cm, la etapa III y los ganglios metastásicos, que son factores de peor pronóstico y se asociaron al subtipo HER2.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.