El almacenamiento de tejido es un proceso médico en fase de regulación y homogenización científica en el mundo. Los estándares internacionales exigen garantizar la seguridad y la eficacia de los aloinjertos humanos como piel y otros tejidos. En la actualidad las actividades de los bancos de piel y tejidos involucran la recuperación, procesamiento, almacenamiento y distribución como proceso de desarrollo, que se correlaciona positivamente con los avances tecnológicos y científicos presentes en las ciencias biomédicas actuales.
Se describe el modelo instaurado por el Banco de Piel y de Tejidos del Instituto Nacional de Rehabilitación como un caso exitoso para la procuración, recuperación y preservación de piel con fines terapéuticos, alta seguridad sanitaria y elevada calidad biológica. Se discuten los fundamentos y estándares empleados en el programa actual de recuperación de tejidos con base en la evidencia científica disponible, el contexto ético y el marco jurídico vigente de la donación de tejidos en México. Se concluye con algunas propuestas para mejorar la eficacia de los programas de trasplantes.
Tissue storage is a medical process that is in the regulation and homogenisation phase in the scientific world.
The international standards require the need to ensure safety and efficacy of human allografts such as skin and other tissues. The activities of skin and tissues banks currently involve their recovery, processing, storage and distribution, which are positively correlated with technological and scientific advances present in current biomedical sciences.
A description is presented of the operational model of Skin and Tissue Bank at INR as successful case for procurement, recovery and preservation of skin and tissues for therapeutic uses, with high safety and biological quality. The essential and standard guidelines are presented as keystones for a tissue recovery program based on scientific evidence, and within an ethical and legal framework, as well as to propose a model for complete overview of the donation of tissues and organ programs in Mexico. Finally, it concludes with essential proposals for improving the efficacy of transplantation of organs and tissue programs.
Si bien algunos intentos primitivos para realizar trasplantes se describieron rudimentariamente hace casi 2,500 años en los denominados «Manuscritos de Shuśruta»1, donde aparecen como una práctica quirúrgica incipiente frente a los estragos causados en los cuerpos de los combatientes, no es hasta principios del siglo xx cuando se logran los primeros procesos documentados del uso de tejidos preservados por varios días a bajas temperaturas, con su posterior reintroducción en el mismo sujeto donador2.
Estudios de Luyet (1937)3 y de Webster (1944)4 documentaron la congelación como un método efectivo para la preservación temporal de tejidos. De acuerdo a Wright et al.5 Falt y Marragonni (1959) describieron los primeros procedimientos para el almacenamiento de piel cadavérica mediante el uso de soluciones suplementadas con 10% de suero como agente preservador5,6. Todos estos pasos permitieron la creación de un nuevo tipo de establecimientos, capaces de almacenar piel y otros tejidos desde finales de los años cincuenta del siglo pasado. Tales instalaciones se conocieron desde entonces con el nombre genérico de «bancos de piel».
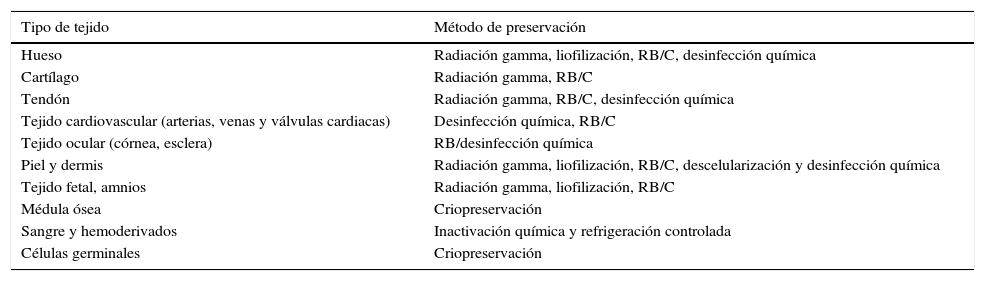
El uso de aloinjertos humanos se ha vinculado estrechamente al desarrollo de diferentes métodos para la preservación de tejidos (tabla 1). Tales estrategias están diseñadas para integrar procesos de recuperación de tejidos que buscan: 1) el mantenimiento de la viabilidad celular7; 2) la conservación de proteínas8; 3) la presencia de factores de crecimiento: el factor de crecimiento epidérmico (Epidermal Growth Factor), el factor de crecimiento endotelial vascular (Vascular Endothelial Growth Factor), factor de crecimiento transformante beta (Transforming Growth Factor beta) y de citocinas proinflamatorias (Il-2, Il-6, Il-10 TNF-α alfa); y 4) la preservación de la integridad de los tejidos. Todos estos factores se enfocan a generar productos de alta calidad biológica, elevada seguridad sanitaria y alto valor terapéutico9.
Métodos para la preservación de tejidos con fines de trasplante
| Tipo de tejido | Método de preservación |
|---|---|
| Hueso | Radiación gamma, liofilización, RB/C, desinfección química |
| Cartílago | Radiación gamma, RB/C |
| Tendón | Radiación gamma, RB/C, desinfección química |
| Tejido cardiovascular (arterias, venas y válvulas cardiacas) | Desinfección química, RB/C |
| Tejido ocular (córnea, esclera) | RB/desinfección química |
| Piel y dermis | Radiación gamma, liofilización, RB/C, descelularización y desinfección química |
| Tejido fetal, amnios | Radiación gamma, liofilización, RB/C |
| Médula ósea | Criopreservación |
| Sangre y hemoderivados | Inactivación química y refrigeración controlada |
| Células germinales | Criopreservación |
RB/C: recuperación biológica y criopreservación.
La procuración y preservación de tejidos es una actividad en acelerado proceso de desarrollo que se correlaciona positivamente con los avances tecnológicos y científicos presentes en las ciencias biomédicas durante el siglo xx. No obstante lo anterior, el aumento en la expectativa de vida y el concomitante incremento de las enfermedades crónico-degenerativas de la población hace que la demanda de aloinjertos con fines terapéuticos se proyecte como una tendencia en franco crecimiento. Este escenario vuelve imperioso el diseño de estrategias institucionales exitosas, capaces de fortalecer las actividades de donación y recuperación de tejidos10–12.
El objetivo del presente trabajo consistió en describir el panorama actual de la recuperación y almacenamiento de tejidos mediante el modelo institucional prototipo que ha permitido al Banco de Piel y de Tejidos del Instituto Nacional de Rehabilitación (INR) estructurar un sistema de recuperación y almacenamiento de alto valor terapéutico, gracias al empleo de fundamentos científicos aplicados a la autosustentabilidad de las necesidades del sistema de salud en México.
La regulación de los bancos de piel en el mundoCon el propósito de ordenar su establecimiento y operación se han creado diferentes asociaciones internacionales que promueven protocolos y directrices para la operación técnica de bancos de piel y de tejidos13–16. Al respecto destacan las siguientes: 1) la Asociación Americana de Bancos de Tejidos, creada en 1972; 2) el Euroskin Bank (Bewerjwick, NL) formado en 1976 y, desde 2010, denominado Euro Tissue Bank; 3) la Asociación Europea de Bancos de Tejidos, establecida en 1991; 4) la Asociación Española de Bancos de Tejidos, formada en 2002; 5) la Asociación de Bancos de Tejidos de Asia-Pacífico; y 6) la Asociación Latinoamericana de Bancos de Tejidos.
Todas estas organizaciones buscan regular —en conjunto con otras instancias gubernamentales, éticas y científicas— la estandarización de las directrices para el almacenamiento y uso terapéutico de tejidos con fines de trasplante. Entre los estándares internacionales destacan los siguientes puntos centrales: 1) aspectos éticos de la procuración de tejidos basados en el altruismo y la no comercialización; 2) regulación regional acorde a las leyes de salud vigentes. 3) organización administrativa; 4) estándares para las instalaciones físicas de los bancos de tejidos; 5) recuperación de tejidos con calidad y estándares farmacéuticos; y 6) trazabilidad de los procesos de preservación.
Los bancos de tejidos en MéxicoEn la República Mexicana las primeras actividades relacionadas con el almacenamiento de tejidos se realizaron con material óseo. Los procedimientos pioneros documentados tuvieron lugar en el Hospital Central Militar y en el Hospital Infantil de México en 1944. En la década de los años cincuenta iniciaron actividades similares en el Hospital Rubén Leñero y en el Hospital Regional de Monterrey.
En 1997 el Hospital Central de Petróleos Mexicanos y la Universidad Nacional Autónoma de México realizaron algunos procedimientos relacionados con el almacenamiento de tejidos, empleando los estándares internacionales entonces disponibles. Destaca en este rubro el Banco de Tejidos del Instituto Nacional de Investigaciones Nucleares (ININ), que comenzó a emplear la radiación gamma para esterilizar tejidos óseos, piel de cerdo y membranas amnióticas.
Hoy en día las actividades de los Bancos de Piel y de Tejidos involucran la procuración, procesamiento, almacenamiento y distribución de productos biológicos catalogados por la actual Ley General de Salud como «insumos biológicos», al conllevar un proceso de industrialización que garantiza su seguridad y eficacia.
El padrón nacional del Centro Nacional de Trasplantes, al 30 de enero del 2013, registró 56 establecimientos con la categoría de Banco, los mismos que están regulados de manera conjunta con la Comisión Federal de Protección contra Riesgos Sanitarios (COFEPRIS).
Marco jurídico de los bancos de tejidos en MéxicoEl Sistema Nacional de Trasplantes (SNT) es una estructura ubicada dentro del Sistema Nacional de Salud, constituida por todos los establecimientos y hospitales que cuentan con licencia sanitaria para realizar actividades de donación, de trasplante de órganos o tejidos y de banco de células o tejidos, otorgada por la COFEPRIS. Todas estas instancias están sujetas a la normatividad establecida en la legislación, específicamente, a la señalada en el Título XIV de la Ley General de Salud, en el Reglamento de la Ley en la materia y en otras directrices emitidas13.
A partir de la normatividad vigente, el Banco de Piel y Tejidos del Instituto Nacional de Rehabilitación está facultado para la disposición de órganos, tejidos y células con fines de trasplante, bajo la modalidad de extracción de órganos y tejidos, trasplante de piel y tejido músculo-esquelético, así como banco de tejidos (piel y tejido músculo-esquelético). El contexto legal le permite abordar con innovación y de manera completa un modelo de procesos involucrados en la procuración, preservación y trasplante de tejidos con fines terapéuticos, que incluye los aspectos sociales para el fomento de la cultura de la donación de órganos y tejidos, así como la formación de recursos humanos altamente especializados en materia de donación y preservación de tejidos.
El Comité de trasplantes como órgano regulador de las actividades de los bancos mexicanosLa piedra angular del SNT está constituida por los Comités Internos de Trasplante de cada hospital. De acuerdo con el artículo 316 de la Ley General de Salud, estos cuerpos colegiados deben estar conformados por un responsable sanitario y un grupo de profesionales de la salud expertos en la materia, por coordinadores de la donación y el trasplante, así como por el personal administrativo necesario para el soporte de tales procesos13,17.
Si bien en sentido estricto un banco tiene como principal función el resguardo de tejidos hasta su uso, esta actividad debe ser secundaria frente al desarrollo de las actividades de preservación con trazabilidad de procesos de manera transparente y segura para operarios y usuarios. La supervisión de tales actividades ha sido confiada a la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS).
Problemática de los bancos de piel y tejidos en MéxicoEn el país, dado el rezago existente en la adopción de este tipo de establecimientos, se presenta la siguiente problemática: 1) existe poca experiencia en la práctica del almacenamiento de tejidos; 2) se presenta una elevada curva de aprendizaje y altos costos asociados con la capacitación específica en el área; 3) falta de un programa activo de fomento y educación para la cultura de la donación de órganos y tejidos; 4) no se cuenta con un modelo integral de donación, procuración y procesamiento de piel cadavérica dentro del Sistema Nacional de Salud; 5) se presenta muy baja inversión económica en investigación científica destinada al almacenamiento de tejidos; 6) existen problemas derivados de la legislación y clasificación actual de los tejidos biológicos como «insumos» al interior de la Ley General de Salud; 7) se presenta un desarrollo competitivo alterno para la donación de tejidos por parte de empresas privadas; 8) no existe desarrollo industrial para la generación de insumos en el sector salud; 9) se presentan problemas éticos derivados de la operación de bancos privados, que compiten por los donadores, a través de prácticas sin suficiente regulación.
El Banco de Piel y Tejidos del Instituto Nacional de Rehabilitación como modelo prototipo para la recuperación de tejidosDesde marzo de 2009 el Banco de Piel y de Tejidos del Instituto Nacional de Rehabilitación constituye el primer banco de tejidos de la Secretaría de Salud que lidera la actividad de almacenamiento de tejidos dentro del marco de los Institutos Nacionales de Salud. Su misión es ser un centro de excelencia en materia de procuración, procesamiento y almacenamiento de piel y de otros tejidos, mediante el desarrollo de un modelo basado en la investigación científica, el uso de nuevas tecnologías biomédicas y moleculares de vanguardia; así como, la formación y entrenamiento de recursos humanos altamente especializados.
Adicionalmente, el banco provee asistencia quirúrgica especializada para la obtención de tejidos en hospitales procuradores o generadores de procuración, así como su empleo en programas de implantes de tejidos alogénicos, al tiempo que desarrolla campañas de difusión y fomento de la cultura de la donación.
El banco retoma las directrices y principios establecidos por el Centro Nacional de Trasplantes para implementar 5 principios éticos fundamentales: gratuidad, altruismo, solidaridad, confidencialidad e información.
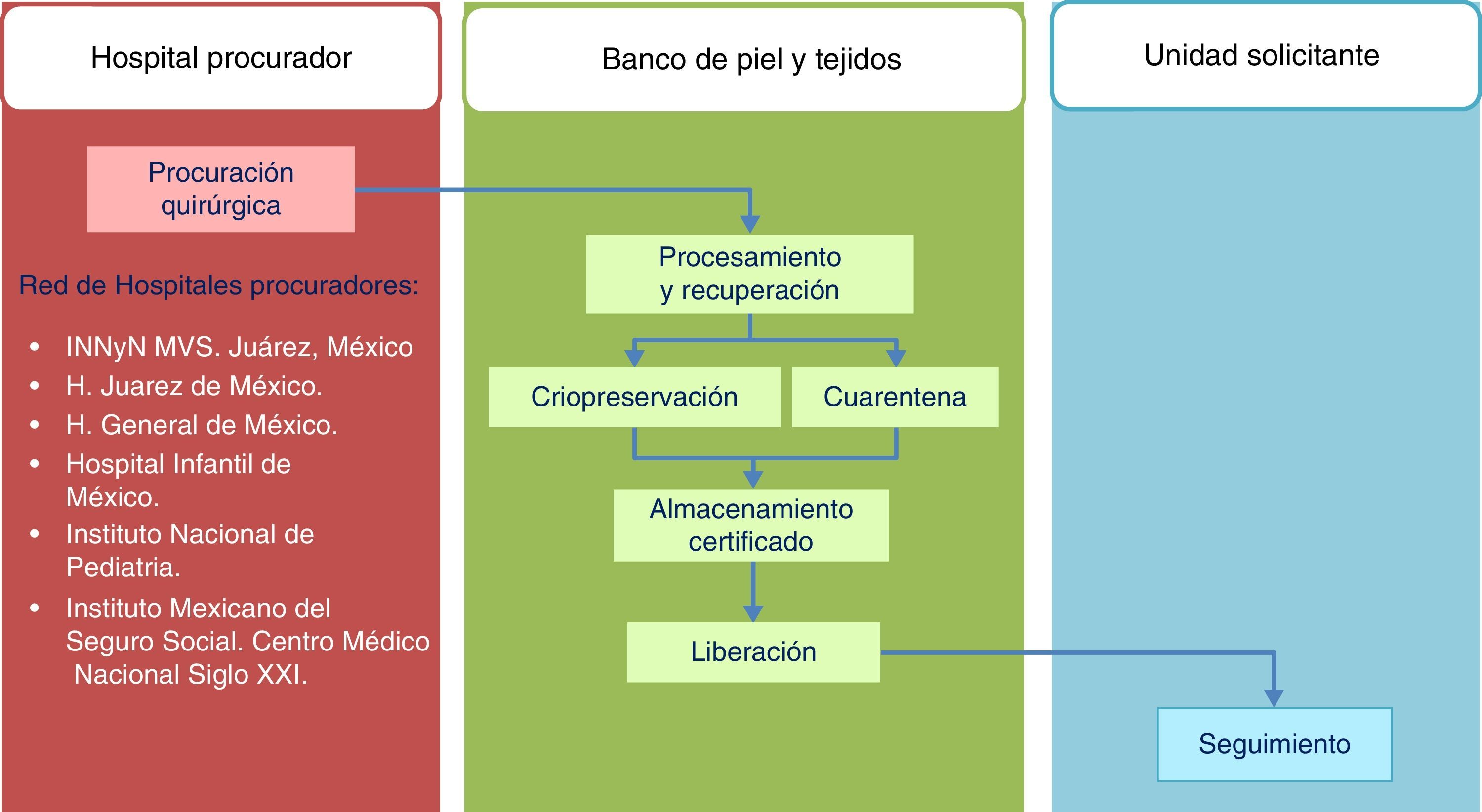
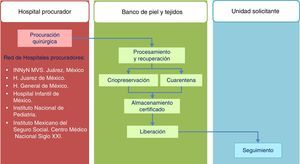
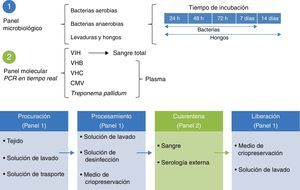
Estándares del Banco de Piel y de Tejidos para la procuración de aloinjertos de piel y tejidos con fines de trasplanteEl modelo seguido por el Banco de Piel y de Tejidos del Instituto Nacional de Rehabilitación se fundamenta en la integración completa de las fases involucradas en el sistema de donación y trasplante de tejidos, delineando con ello la trazabilidad de procesos acorde a la norma ISO-9000-2008 (fig. 1).
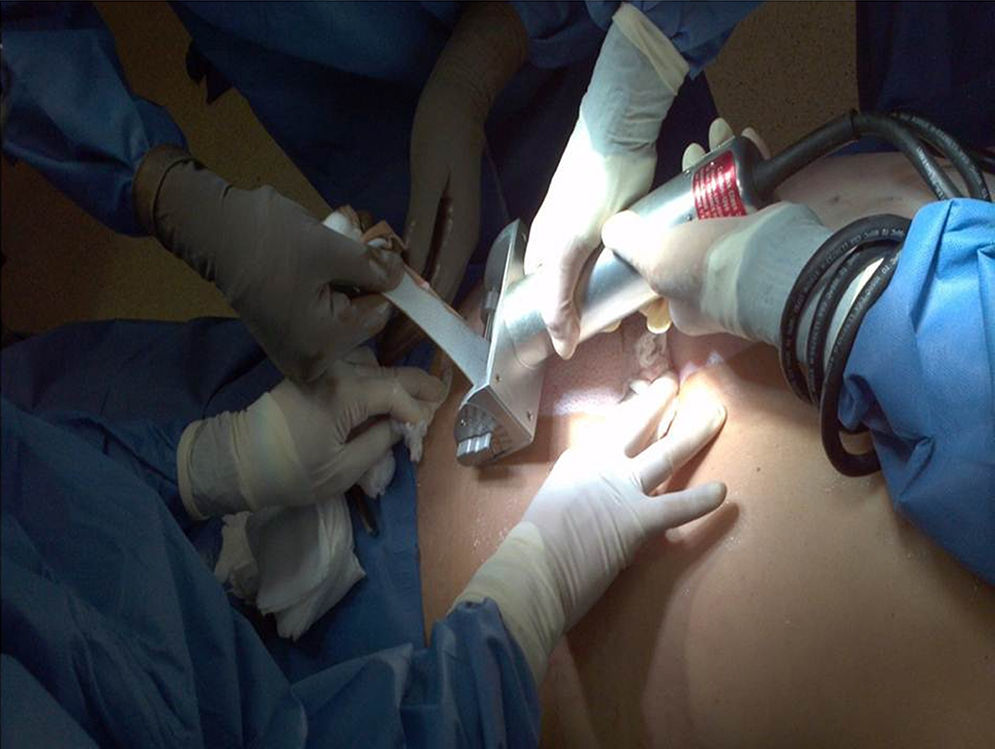
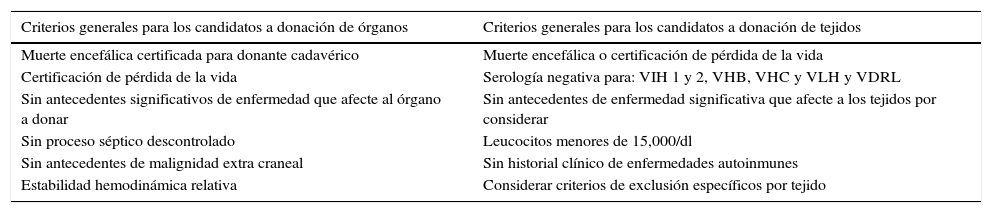
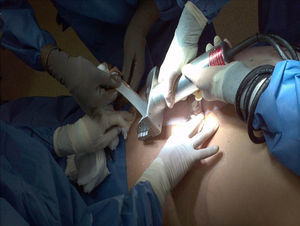
El proceso de obtención de piel y tejidos se da a través de la colaboración interinstitucional con diferentes programas de trasplantes que cumplen con los criterios establecidos para la donación de órganos y tejidos (tabla 2). Actualmente, la obtención de tejidos es definida como un evento quirúrgico (fig. 2). Como tal, es menester seguir los estándares de calidad para la cirugía de recuperación de piel18.
Criterios de inclusión y exclusión para la donación de órganos y tejidos
| Criterios generales para los candidatos a donación de órganos | Criterios generales para los candidatos a donación de tejidos |
|---|---|
| Muerte encefálica certificada para donante cadavérico | Muerte encefálica o certificación de pérdida de la vida |
| Certificación de pérdida de la vida | Serología negativa para: VIH 1 y 2, VHB, VHC y VLH y VDRL |
| Sin antecedentes significativos de enfermedad que afecte al órgano a donar | Sin antecedentes de enfermedad significativa que afecte a los tejidos por considerar |
| Sin proceso séptico descontrolado | Leucocitos menores de 15,000/dl |
| Sin antecedentes de malignidad extra craneal | Sin historial clínico de enfermedades autoinmunes |
| Estabilidad hemodinámica relativa | Considerar criterios de exclusión específicos por tejido |
VDRL: prueba serológica para la sífilis; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH: virus de inmunodeficiencia humana; VLH: virus linfotrópico humano.
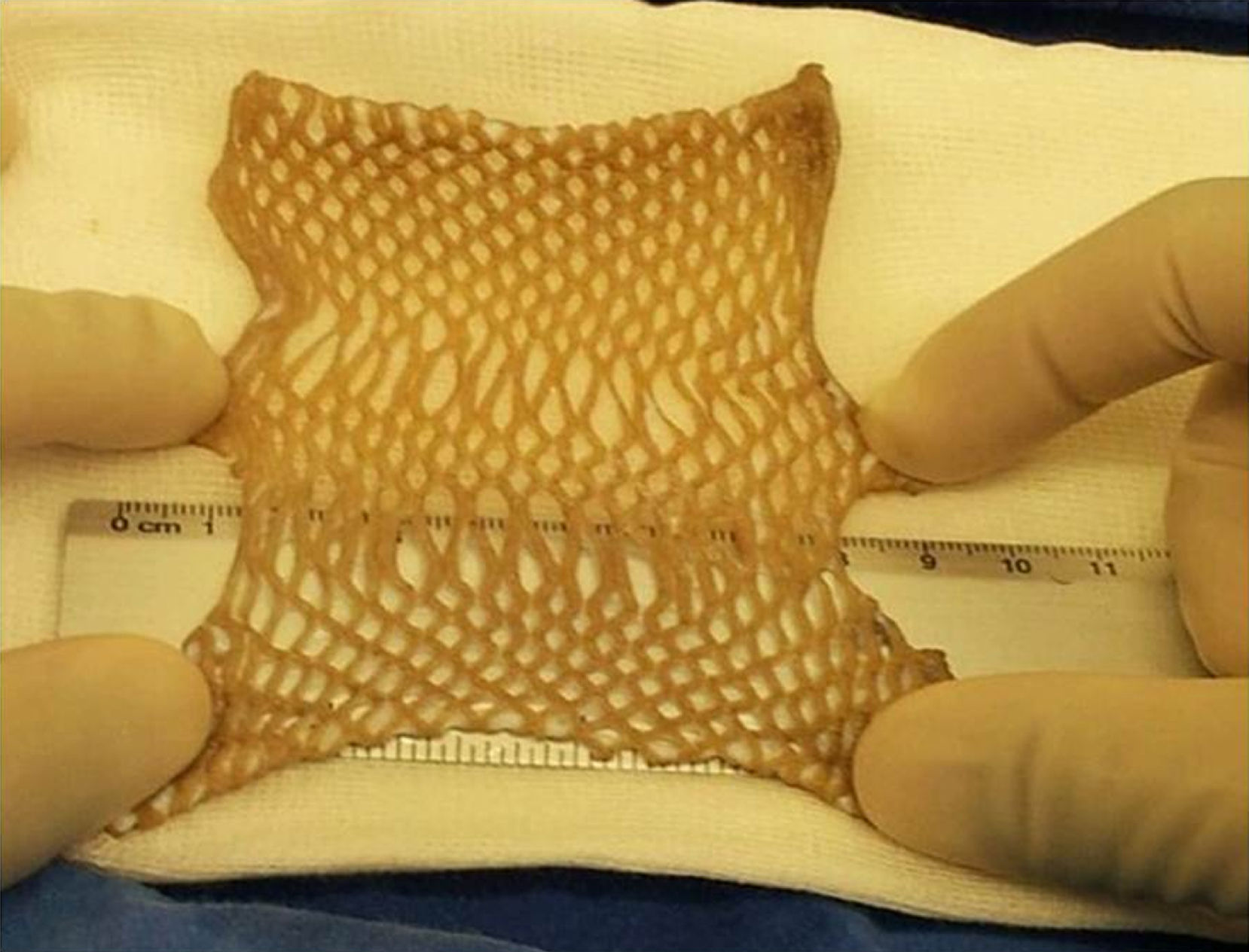
Una vez obtenido el consentimiento informado de los familiares de donadores multiorgánicos y con parada cardiaca que cumplen con los criterios de inclusión (tabla 3), en el caso específico de la piel se realizan procesos de desinfección superficial basados en soluciones de iodo y alcoholes en diferentes concentraciones (70-100%), en sala quirúrgica con técnica aséptica.
Directrices fundamentales para la recuperación de tejidos
| Estricto control y evaluación de potenciales donadores |
| Control de calidad de los sitios de procuración quirúrgica de tejidos |
| Procedimientos sistematizados de recuperación de la viabilidad celular de los tejidos basados en evidencia científica |
| Certificación microbiológica producto final |
| Preservación de las características físico-químicas y propiedades biológicas de los tejidos |
| Certificación molecular de donantes y tejidos, basado en pruebas moleculares que permitan la reducción de periodos de ventana para la generación de una respuesta antígeno-anticuerpo (PCR, PCR en tiempo real) |
| Trazabilidad de procesos |
| Criterios éticos en la donación, basada en altruismo y no comercialización |
PCR: reacción en cadena de la polimerasa.
El concepto de recuperación está enfocado a revertir o detener en lo posible el proceso de muerte celular, inducido por hipoxia tisular y la depleción de nutrientes, después del último latido cardiaco. Para lograrlo los tejidos se mantienen en soluciones formuladas con un pH fisiológico (7.4) y con amortiguadores de pH en presencia de nutrientes esenciales y antibióticos para iniciar el proceso de descontaminación microbiana. La preservación a mediano plazo se consigue mediante soluciones criopreservantes y estabilizadoras de pH, que permiten mantener el tejido estable a temperaturas por debajo de –80°C. La formulación de tales insumos se realiza en el laboratorio de preparación de insumos del propio banco, de acuerdo con las directrices de las buenas prácticas de laboratorio y manufactura (Good Manufacturing Practice y Good Laboratory Practice) y esterilizados por filtración.
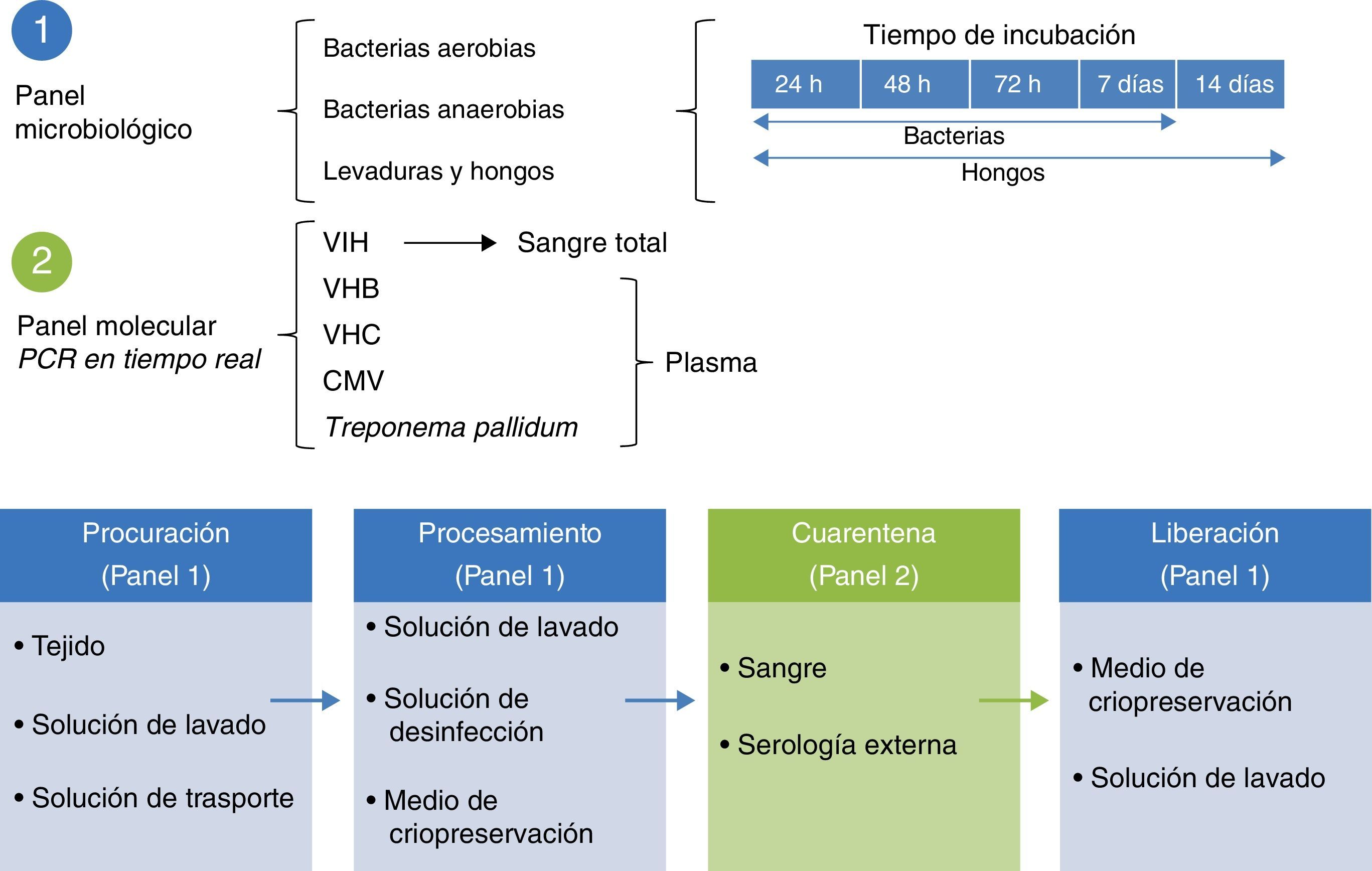
Certificación de calidad microbiológicaLa calidad biológica de los tejidos y la certificación microbiológica son estándares esenciales de la preservación de tejidos. El estándar para la identificación de aerobios, anaerobios y hongos realiza lecturas a los 7, 14 y, 21 días en medios específicos19. El esquema de control microbiológico se implementa en los protocolos de control de calidad de tejidos, mediante soluciones que mantienen contacto con el proceso de recuperación y preservación (fig. 3).
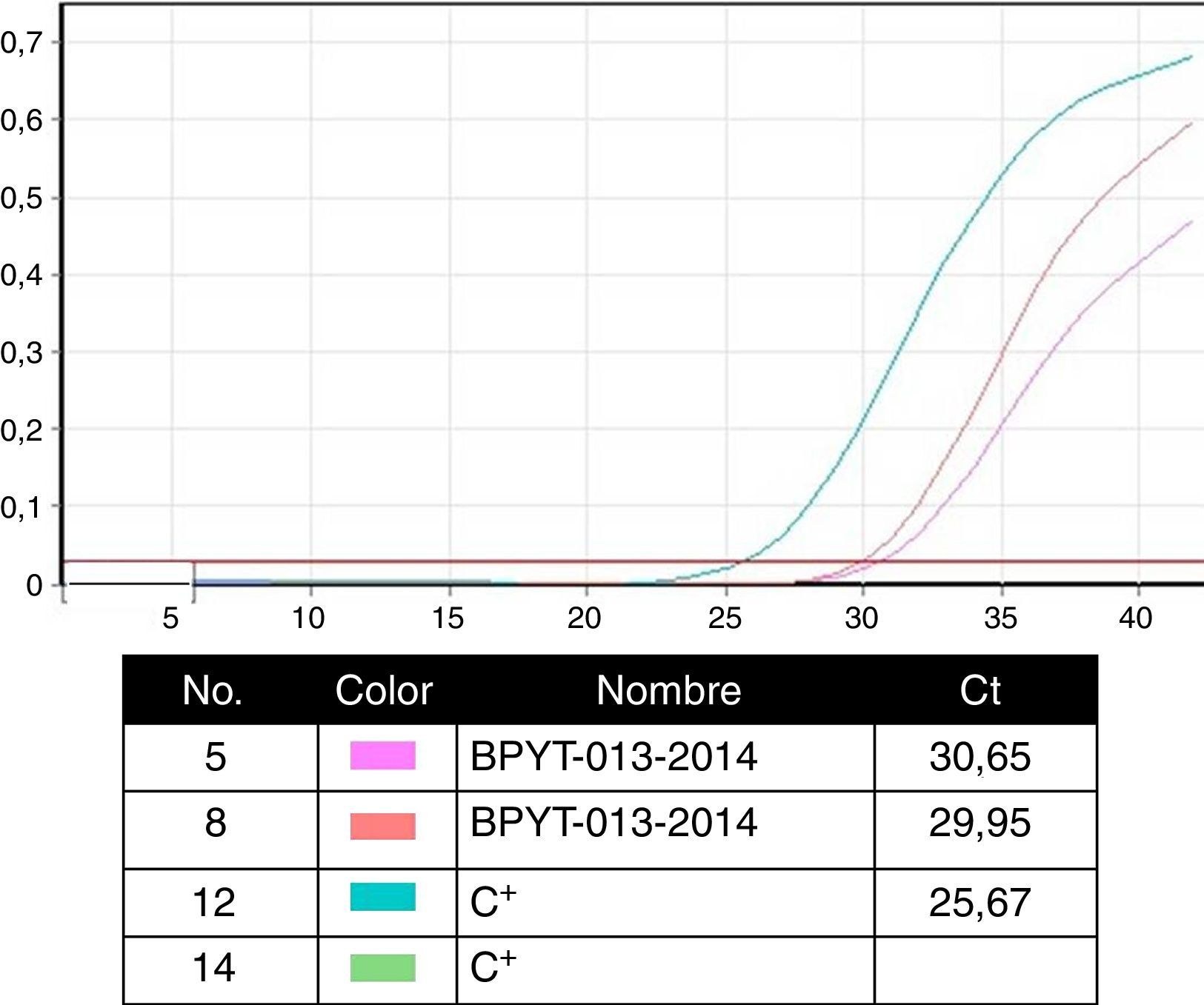
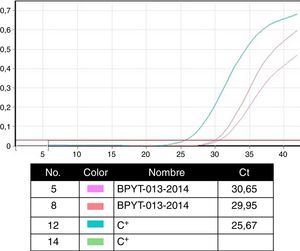
Técnicas de biología molecular para la identificación de agentes patógenosLa prueba de oro en la identificación de patógenos se realiza con la identificación de segmentos genómicos usando la técnica de reacción en cadena de la polimerasa (PCR). Esta técnica, descrita por Kubista Mullis y su equipo20 tiene una sensibilidad de 1×10-7; es decir, es capaz de identificar una célula infectada por cada 1×107 células sanas. En el caso de los protocolos de certificación, las pruebas que realiza el banco se efectúan en la modalidad de tiempo real para la búsqueda del virus de la inmunodeficiencia humana 1 y 2, hepatitis B y C; citomegalovirus y Treponema pallidum. Dada la alta especificidad y la sensibilidad de la técnica, los ensayos se realizan por triplicado en área blanca y gabinete de seguridad con flujo laminar, clase ii-AB. Tales ensayos están validados para uso diagnóstico y clínico en humanos e incluyen controles internos (negativo y positivos calibrados) para cada prueba con búsqueda en sangre y tejido de donantes (fig. 4)6,20.
Infraestructura físicaActualmente el banco está constituido por 5 laboratorios, que cumplen con la normatividad de clase 100 y operan con normatividad buenas prácticas de laboratorio y manufactura (Good Manufacturing Practice y Good Laboratory Practice). Dado que se trata de un centro de referencia nacional, el banco ha implementado su infraestructura física cumpliendo con las directrices de la Federación Española de Bancos de Tejidos y de la Asociación Europea de Bancos de Tejidos. Físicamente está estructurado en 3 áreas principales10: 1) cámara interna clase 100; 2) área administrativa; y 3) áreas de soporte e investigación.
Estructura de la cámara interna clase 100Laboratorio de preparación de insumos. Equipo e insumos para la preparación de soluciones de lavado, descontaminación y preservación a temperatura constante (18°C), aire filtrado (clase 100) y presión positiva.
Laboratorio de cuarentena. Sala blanca con temperatura constante (18°C), aire filtrado (clase 100) y presión positiva destinado a la recuperación y descontaminación de tejidos. Refrigeradores para mantener la temperatura constante (4°C) en procesos de descontaminación. Gabinete de seguridad biológica clase IIAB para manipulación de tejidos.
Laboratorio de proceso para tejido músculo-esquelético. Sala blanca de doble cámara, aislada con temperatura constante, aire filtrado (clase 100) y presión positiva destinado para la recuperación, corte y descontaminación de tejido músculo-esquelético.
Laboratorio de empaquetamiento. Sala blanca con temperatura constante (18°C), aire filtrado (clase 100) y presión positiva, destinado para el empaquetado final de tejidos antes de ser enviado a congelamiento final. Los procesos se realizan en gabinete de seguridad biológica clase IIA-B para manipulación de tejidos. La cámara interna conecta con un área de almacenamiento y custodia de tejidos.
Área de almacenamiento y custodia de tejidos (ultracongelación). Espacio de acceso controlado destinado para el almacenamiento de tejidos con sistemas de respaldo de temperatura, sistema de monitorización en tiempo real de registro de temperatura y sistema de televigilancia. Temperatura constante (18°C) y aire filtrado clase 100.
Central de Equipos y Esterilización (CEYE).. Equipo e insumos para validar los procesos de esterilización de materiales y equipos empleados en los procesos de procuración.
Área administrativa. Diseñado fuera de las instalaciones centrales y con acceso restringido.
Áreas de soporte e investigación. Constituida por un laboratorio de usos múltiples y una cámara de cultivo, para el desarrollo de protocolos de investigación relativos a la formulación de insumos, mecanismos de bloqueo de muerte celular y estrategias moleculares de criobiótica con fines de trasplante.
Discusión y perspectivasEn consonancia con la tendencia mundial de recuperación de tejidos con fines terapéuticos, el almacenamiento de piel y de otros tejidos en el contexto de las necesidades asistenciales y de investigación de la medicina mexicana actual requiere definir, con toda precisión, algunos de los siguientes puntos para obtener mejores resultados terapéuticos:
Conceptualizar la procuración y recolección de tejidos como un evento quirúrgicoEste punto requiere un cambio en la conceptualización de la obtención de tejidos como un evento quirúrgico, con particular énfasis en la calidad, tal como se ha descrito recientemente y de manera muy precisa en la última modificación de la Ley General de Salud, en lo relacionado con la disposición de órganos y tejidos (12 de diciembre de 2011).
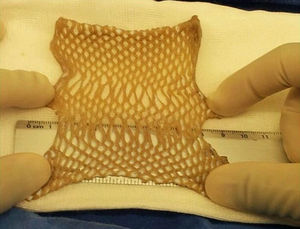
Definir el tipo de proceso empleado en la preservaciónCada método (descontaminación química, liofilización, esterilización gamma) incide de manera diferente en las características biológicas y fisicoquímicas del tejido (índice de viabilidad celular, pérdida de agua, de elasticidad y resistencia) y, finalmente, en su posterior uso. En nuestro modelo los datos preliminares indican que la recuperación biológica de tejidos representa el método con mejores resultados terapéuticos, después de un largo periodo de congelación a temperaturas por debajo de 80°C bajo cero (fig. 5).
Trazabilidad de procesosDocumentación de cada fase de la procuración, la preservación y la liberación del tejido, respetando los datos de privacidad y confidencialidad.
La trazabilidad de procesos debe documentar la ruta crítica de cada proceso e incluir documentos esenciales como: 1) manual de procedimiento específico para procuración; 2) manual de procedimiento específico para recuperación y preservación de tejidos; 3) manual de control microbiológico y de calidad tejido específico; 4) protocolo de procuración para hospitales procuradores de tejidos; 5) expedientes clínicos y formatos de servicios (laboratorio microbiológico, moleculares, patología, etc.); 6) manual y registros de mantenimiento preventivo de equipo e instalaciones; 7) registro y control de acceso para servicios generales y registros microbiológicos de controles ambientales; y 8) registro y reporte de actividades enviados al Centro Nacional de Trasplantes.
Adicionalmente, las siguientes líneas de acción pueden impactar de manera importante en el crecimiento de la actividad de banco de tejidos:
Integración y crecimiento de una red de hospitales para incrementar la afluencia regional de tejidosEstablecer una red de procuración de tejidos implica la realización de un mayor número de convenios de colaboración en materia de procuración de tejidos, con fines de trasplante con otras instituciones hospitalarias, con el propósito de incrementar la identificación de potenciales donadores de tejidos.
Implementación de un programa de investigación en fármaco-criobiótica de tejidos con fines terapéuticosPara impulsar la realización de protocolos de procuración y criopreservación de piel y de tejidos, así como promover la expansión de líneas de investigación científicas que permitan disminuir la dependencia de insumos importados y permitan la autosustentabilidad de su propia operación, enfocados a: 1) procedimientos científicos de preservación y criobiología de tejidos con el fin de obtener productos de alta calidad biológica y eficacia terapéutica; 2) generación de insumos y patentes que permitan la autosustentabilidad del banco; y 3) divulgación científica de procesos en otras instituciones.
Implementación de un programa académico de entrenamiento quirúrgico de procuradores de tejidosGestionar el registro y la realización de cursos de procuradores multitejidos avalado por instituciones académicas en conjunto con el Centro Nacional de Trasplantes en México para formar personal especializado y altamente entrenado. Además, incluir en los programas de estudios de pregrado módulos específicos de procesos quirúrgicos involucrados en la procuración y trasplante de tejidos.
Fomento de la difusión de la cultura de la donación de piel cadavéricaImpulsar el programa de formación de líderes promotores de la cultura de donación de órganos y tejidos en colaboración con organizaciones no gubernamentales y campañas de difusión en medios de comunicación masiva, uso de las redes sociales e Internet.
Por último, pero no menos importante, algunas consideraciones éticas deben replantearse, partiendo del hecho de que la obtención de tejidos es un acto de donación altruista sin fines de lucro ni de comercialización, por lo que deben regularse y definirse los aspectos de las cuotas de recuperación de procesos; este punto también está siendo abordado por la Organización Mundial de la Salud.
La coordinación e integración de los programas de donación y trasplantes de órganos y tejidos institucionales debe realizarse con participación funcional, responsable y equitativa de las áreas de investigación, formación de recursos humanos y los servicios asistenciales.
Este modelo es solo una de las propuestas a mediano plazo para modificar el escenario actual de la recuperación de tejidos, tal vez en un par de lustros, tal como lo ha experimentado el modelo español antes de posicionarse como el líder mundial de los programas de donación de órganos y tejidos.
FinanciaciónEste trabajo ha sido financiado por el Consejo de Ciencia y Tecnología a través de los Fondos Sectoriales de Investigación en Salud CONACYT-FOSIS 2011-1-161624.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.