El cáncer de vesícula biliar ocupa el quinto lugar entre los cánceres que afectan al tracto gastrointestinal; mundialmente es el tumor maligno más frecuente de las vías biliares. El adenocarcinoma es el hallazgo histológico principal. Se han referido en la literatura variedades histológicas menos frecuentes. El carcinoma neuroendocrino pobremente diferenciado de células pequeñas de la vesícula biliar es una neoplasia extremadamente rara y esta estirpe histológica se asocia a un pronóstico muy precario.
ObjetivoDemostrar que realizando una exploración sistemática de toda la cavidad peritoneal, en la totalidad de las cirugías laparoscópicas que se realicen, es posible encontrar cambios completamente inesperados, relacionados con una enfermedad no identificada. Además, se realiza una revisión detallada de nuestro hallazgo inesperado, el carcinoma neuroendocrino de células pequeñas de vesícula biliar.
Caso clínicoPresentamos el caso de una paciente de 40 años de edad con un embarazo ectópico roto, que fue tratado mediante cirugía de urgencia, abordada laparoscópicamente. Se encontró como hallazgo incidental un carcinoma de células pequeñas en la vesícula biliar.
ConclusionesNuestro grupo quirúrgico aconseja que, al introducir el laparoscopio, se revise sistemáticamente toda la cavidad peritoneal, en busca de diagnósticos diferenciales y enfermedades no identificadas. Deben aprovecharse las cualidades exploratorias, diagnósticas y terapéuticas de la laparoscopia. Los tumores endocrinos biliares suelen permanecer silentes hasta estadios avanzados. El pronóstico suele ser desfavorable, especialmente cuando son irresecables. La neoplasia endocrina de vesícula biliar, a pesar de ser infrecuente, debe tenerse en cuenta como posibilidad diagnóstica ante las implicaciones terapéuticas y pronósticas.
Gallbladder cancer ranks fifth among oncological diseases affecting the gastrointestinal tract; nevertheless, it is the world's most common malignant tumor of the bile ducts. It is usually diagnosed after cholecystectomy and tends to have bad prognosis. Adenocarcinoma is the main histological finding, although other rare histologic types have been described among the actual literature. Poorly differentiated squamous-cell neuroendocrine gallbladder carcinoma is an extremely rare neoplasm. A poor prognosis is associated with this histological type.
AimThe aim of this paper is to show that performing a systematic exploration of the entire peritoneal cavity in all laparoscopic surgeries can lead to find completely unexpected changes related to an unidentified disease. Also, a detailed review of our unexpected finding is made: The neuroendocrine small cell carcinoma of gallbladder.
Clinical caseWe hereby report the case of a 40-year-old patient with a ruptured ectopic pregnancy that underwent emergency laparoscopic surgery, presenting the incidental finding of a small-cell carcinoma of the gallbladder.
ConclusionsOur surgical group advised that by introducing the laparoscope, the entire peritoneal cavity must be systematically reviewed, in search of differential diagnoses and unidentified pathologies. We must use the diagnostic and therapeutic qualities of laparoscopy. Bile duct endocrine tumors tend to remain silent until advanced stages, making the prognosis usually unfavorable, especially when they are unresectable. Endocrine neoplasias of the gallbladder, although uncommon, should be taken into account as possible diagnoses due to its therapeutic and prognostic implications.
La cirugía laparoscópica se situó en la primera línea de los avances tecnológicos que han facilitado la introducción de nuevas técnicas quirúrgicas; por tanto, su desarrollo señala un hito quirúrgico histórico que abrió la nueva era de la cirugía dependiente de la tecnología. A pesar de la controversia que acompañó a la introducción de la cirugía laparoscópica, esta técnica ha modificado en tan solo 2 decenios la práctica quirúrgica, hasta el punto de superar las expectativas que tenían los pioneros de esta. No hay ninguna especialidad quirúrgica que no haya recibido la influencia de la cirugía laparoscópica, que es una técnica que en la actualidad está firmemente establecida en la práctica quirúrgica. La cirugía laparoscópica ha madurado en muchos aspectos, y es ahora una herramienta indispensable en la cirugía, debido a su menor morbilidad en procedimientos como colecistectomía, apendicetomía, funduplicatura, reparación de hernias abdominales e inguinales e, incluso, bypass gástrico. La laparoscopia tiene la dualidad de poder utilizarse tanto con fines diagnósticos para la estadificación laparoscópica del cáncer, abordaje diagnóstico del abdomen agudo, diagnóstico de condiciones crónicas y otras revisiones generales, y de complicaciones, como con fines terapéuticos. Siempre deben aprovecharse ambas cualidades, porque, como se demostrará en nuestro caso, eso puede resultar en beneficios inimaginados para los pacientes.
ObjetivoDemostrar que realizando una exploración sistemática de toda la cavidad peritoneal, en la totalidad de las cirugías laparoscópicas que se realicen, es posible encontrar cambios completamente inesperados relacionados con una enfermedad no identificada. Además, se realiza una revisión detallada de nuestro hallazgo inesperado, el carcinoma neuroendocrino de células pequeñas de vesícula biliar.
Caso clínicoPresentamos el caso de una mujer de 40 años de edad, con los siguientes antecedentes: carga genética para diabetes mellitus tipo 2, sin carga genética para padecimientos oncológicos. Tabaquismo negativo, consumo de bebidas alcohólicas de manera social, sin llegar al estado de embriaguez. Otras toxicomanías fueron negadas. Hemotipo O Rh (+), COMBE negativo. Nivel máximo de estudios: licenciada en Derecho. Antecedentes ginecoobstétricos: menarca a los 12 años, ritmo irregular, opsomenorrea con ciclos de 36–37×6 días, con vida sexual activa y sin uso de método anticonceptivo alguno. Informó que su última menstruación se presentó 38 días antes de su ingreso. Gesta 3, cesáreas 2, aborto 1. Su último Papanicolaou y mastografía, fueron reportados sin datos de malignidad, según lo referido por la paciente. Sin datos de alergias, con antecedentes quirúrgicos de 2 cesáreas, traumáticos y transfusionales negados y crónico-degenerativos. La paciente refiere migraña la cual trata con ibuprofeno y cafeína.
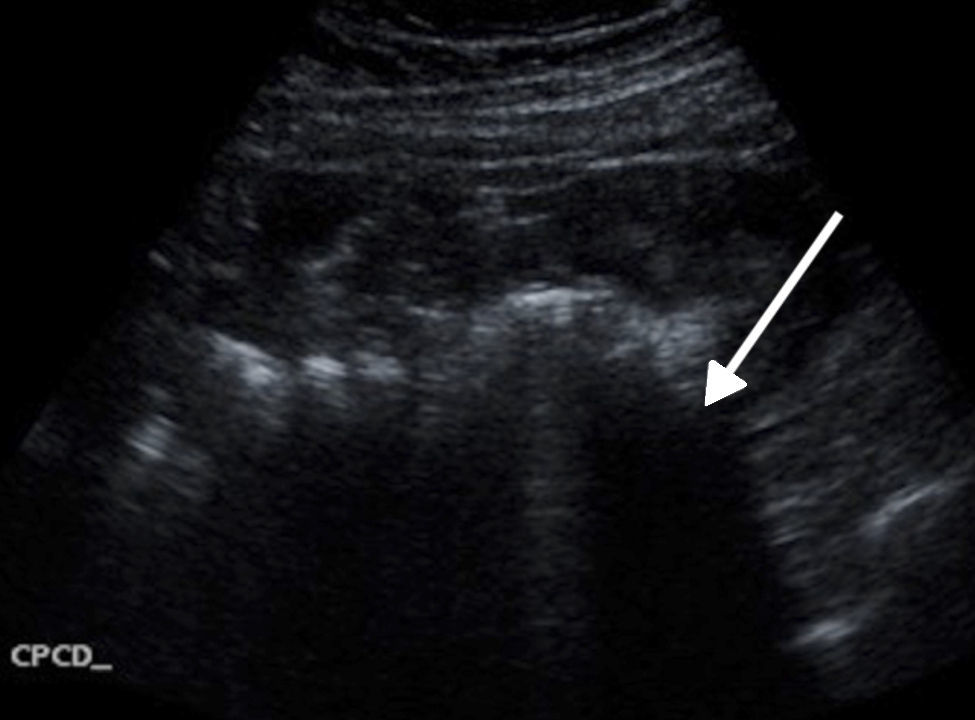
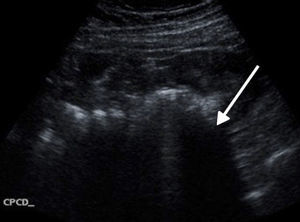
Acude a Urgencias refiriendo 2 semanas de evolución con epigastralgia de tipo cólico, intermitente, de intensidad 5/10, que se irradia al hipocondrio y a la región dorsal del lado derecho, sin exacerbantes. El día de la consulta acude con dolor abdominal, de varias horas de evolución, localizado en hemiabdomen inferior, predominantemente en hipogastrio y fosa ilíaca derecha, de gran intensidad desde el inicio, 7/10 en la escala verbal análoga, de instalación súbita e intensidad creciente, persistente, tipo cólico, incapacitante, sin claros atenuantes ni exacerbantes, sin irradiaciones, el cual se acompañaba de escalofríos, sin fiebre; náusea y arqueo, sin vómito. Negó sintomatología urinaria, alteraciones del hábito intestinal o flujo vaginal. A la exploración física, se encontró a la paciente hemodinámicamente estable con los siguientes signos vitales: FC de 90 latidos por minuto, FR de 20 respiraciones por minuto, tensión arterial de 135/88mmHg, saturación de oxihemoglobina del 95% mediante oximetría de pulso, y temperatura de 36.8°C, alerta, consciente, orientada, pálida y con mucosas deshidratadas. A la exploración física, se evidenció un abdomen globoso a expensas de panículo adiposo y distensión, con resistencia muscular, además de dolor a la palpación superficial generalizada, con datos francos de irritación peritoneal, timpánico y con peristalsis presente hipoactiva. Motivo por el cual se solicitaron estudios paraclínicos que evidenciaron los siguientes hallazgos: hemoglobina 12.9mg/dl, plaquetas 236,000/mm3, leucocitosis de 20,700/mm3 a expensas de neutrofilia 18,800/mm3, glucosa 148mg/dl. Además de un examen general de orina no patológico y una determinación cuantitativa de fracción β de gonadotrofina coriónica humana que resultó en 1,464 mUI/ml. Se decidió abordaje diagnóstico mediante ultrasonido transvaginal y abdominal, donde se observó abundante líquido libre en cavidad abdominal, compatible con probable hemoperitoneo (fig. 1).
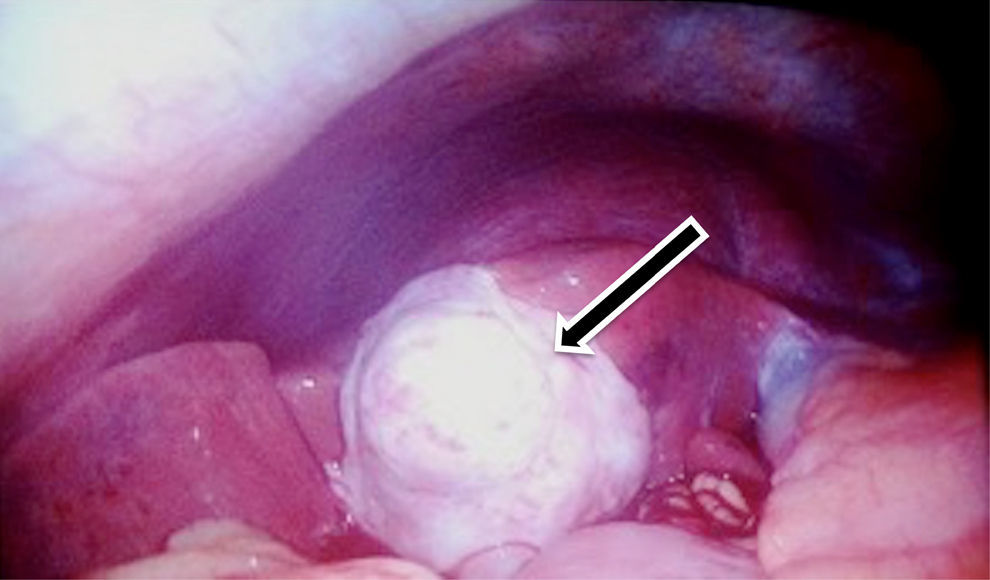
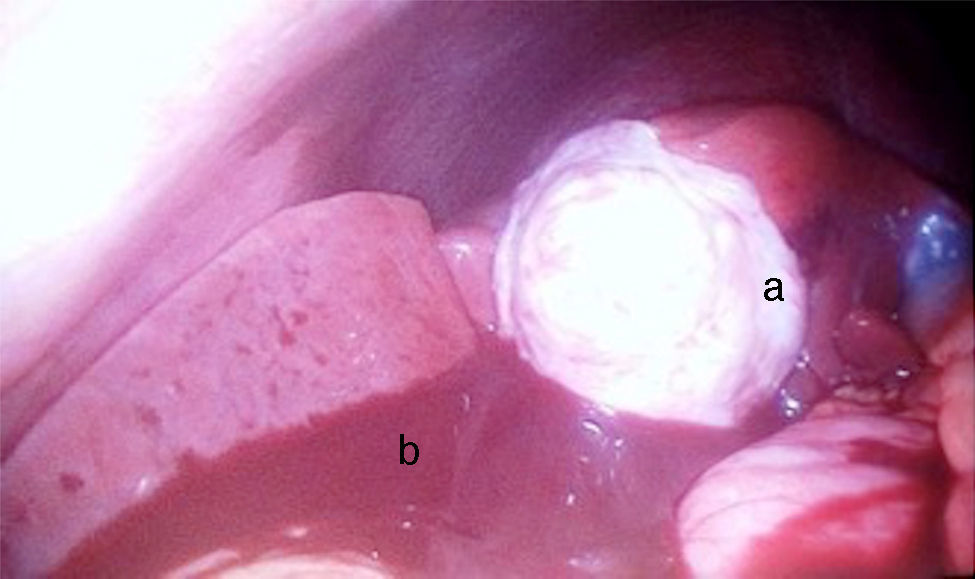
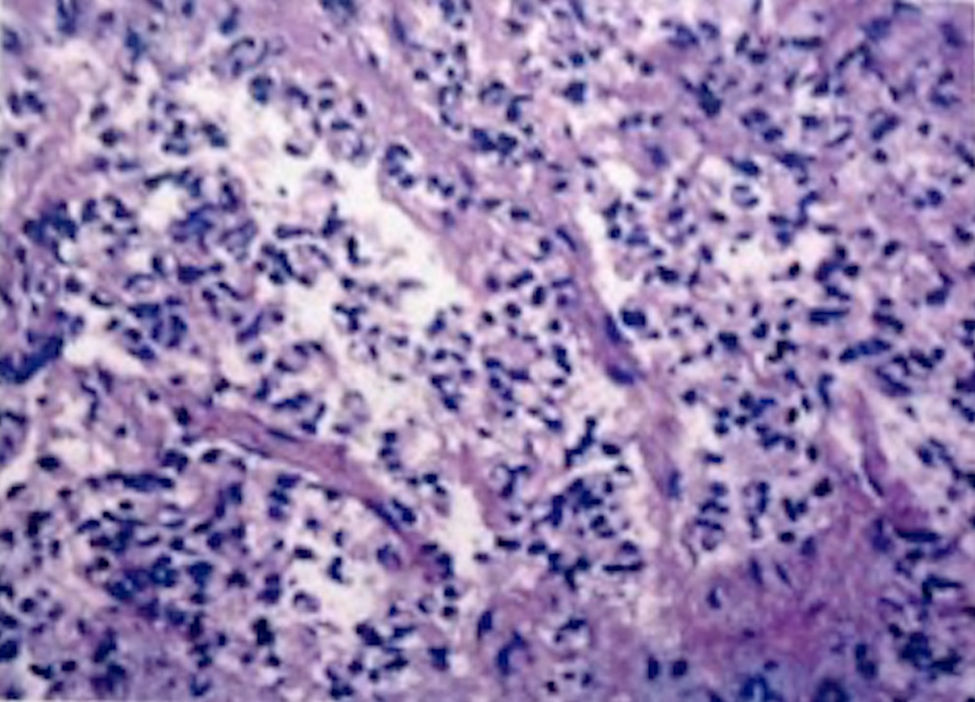
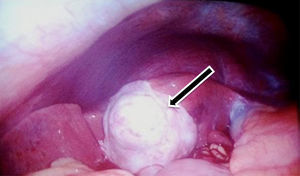
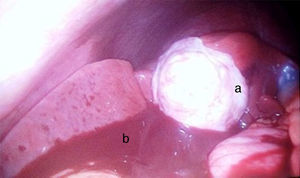
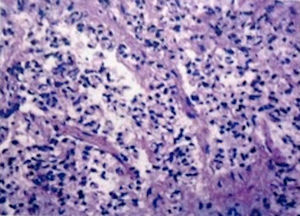
Se decidió manejo quirúrgico mediante abordaje laparoscópico en el que se encontraron como hallazgos intraoperatorios: a) hemoperitoneo de aproximadamente 1,500-2,000 cc, secundario a embarazo ectópico ampular derecho roto. Se realizó salpinguectomía derecha con hemostasia estricta, lavado y drenaje de cavidad abdominal; b) apéndice cecal de apariencia normal, y c) una neoformación a expensas de la totalidad de la vesícula biliar, blanca, de superficie irregular, firme, pétrea, la cual se extendía hacia el segmento hepático IV A de Couinaud, que invadía el pedículo vesicular, parte de la rodilla duodenal y parte del estómago (figs. 2 y 3). La laparoscopia diagnóstica no arrojó evidencia de enfermedad metastásica, por lo que se obtuvo una biopsia incisional vía laparoscópica y la muestra se envió a estudio histopatológico. El reporte de Patología reveló que se recibió: a) como embarazo ectópico varios fragmentos de tejido que juntos miden 3×2×1cm y son irregulares entre ellos; se identifica salpingue de 2×1.3cm de serosa café rojiza, al corte se aprecia la luz dilatada ocupada por material hemático. Se concluye con el diagnóstico de embarazo ectópico tubario roto. b) En el trasoperatorio se envió fragmento irregular de tejido designado como vesícula biliar que midió 0.7×0.6×0.5cm, de color blanco gris y de consistencia firme. Se determina el diagnóstico de carcinoma neuroendocrino de células pequeñas (fig. 4), y el análisis inmunohistoquímico confirmó el diagnóstico. Las inmunotinciones para cromogranina y sinaptofisina fueron intensa y difusamente positivas, mientras que la inmunotinción para CD56 fue negativa.
Con el diagnóstico establecido y dadas las condiciones particulares de la paciente, se decidió dar por concluido el procedimiento quirúrgico y se solicitó interconsulta a Oncología Médica para, en conjunto con Cirugía, definir el manejo definitivo de la paciente.
Los resultados de laboratorio posquirúrgicos revelaron: Hb 10.3mg/dl, Hto 30.6%, plaquetas 142,000/mm3, leucocitos 10,300/mm3, Na+ 129 mmol/l, K+ 3.1 mmol/l, glucosa 108mg/dL, Cr 0.3mg/dL, Alb 2.3g/dL, BT 1.98mg/dL, BI 1.75mg/dL, TGO 26U/l, TGP 31U/l, DHL 125U/l, GGT 21U/l y FA 35U/l.
El Servicio de Oncología decidió que se dejará convalecer a la paciente de la cirugía realizada y reinternarla en una o 2 semanas para realizar una PET-TC y, con los resultados, definir la conducta a seguir; en caso de que la enfermedad estuviera localizada se le realizaría cirugía, o bien si se identificaran metástasis se iniciaría quimioterapia con paclitaxel + carboplatino + etopósido. Se analizaron las opciones de tratamiento con la paciente y sus familiares. Por no contar con un seguro de gastos médicos, se determinó trasladar a la paciente a un hospital de la Seguridad Social, a la que tenían derecho.
Debido a que se perdió el contacto con la paciente, se desconoce su evolución actual.
DiscusiónVentajas de realizar siempre la laparoscopia diagnósticaEl advenimiento de la laparoscopia representa un hito en la cirugía, que nos mueve de la era de la cirugía abdominal abierta a la revolución de la cirugía mínimamente invasiva. La laparoscopia, aunque se realice con intenciones terapéuticas de un diagnóstico ya establecido por otro método, puede ser diagnóstica y cuando se hace con intenciones diagnósticas puede volverse terapéutica y permitir en muchos de los casos resolver completamente la enfermedad que aqueja al paciente y todo por mínima invasión. Deben siempre aprovecharse las cualidades exploratorias, diagnósticas y terapéuticas de la laparoscopia. Con la laparoscopia se puede visualizar gran parte de la superficie peritoneal y de los órganos intraabdominales y a su vez explorarlos. Además, permite la toma de biopsia, cultivos e incluso evaluar espacios profundos de los órganos abdominales, que no son susceptibles de inspección, para, de esta forma, realizar diagnósticos expeditos, normar conductas, tomar decisiones y actuar en consecuencia, teniendo en cuenta la capacidad para proporcionar intervención terapéutica.
Realizando una exploración sistemática de toda la cavidad peritoneal, en la totalidad de las cirugías laparoscópicas que se realicen, es posible, a veces, encontrar cambios completamente inesperados relacionados con una enfermedad no identificada. Por lo mismo, nuestro grupo quirúrgico aconseja que, al introducir el laparoscopio, se revise sistemáticamente toda la cavidad peritoneal, en busca de diagnósticos diferenciales y enfermedades no identificadas.
En el caso clínico presentado, el abordaje laparoscópico permitió al equipo quirúrgico multidisciplinario, mediante la revisión sistemática de la totalidad de la cavidad abdominal, establecer el diagnóstico de carcinoma neuroendocrino de células pequeñas de vesícula biliar; patología que ni siquiera se sospechaba en el contexto de la atención urgente que requería la paciente: carcinoma neuroendocrino de células pequeñas de vesícula biliar.
Carcinoma neuroendocrino de células pequeñas de vesícula biliar. RevisiónEl cáncer de vía biliar incluye: colangiocarcinoma, al cáncer del ámpula de Váter y al cáncer de la vesícula biliar. El cáncer de vesícula ocupa el quinto lugar entre los padecimientos oncológicos que afectan al tracto gastrointestinal, pero mundialmente es el tumor maligno más frecuente de las vías biliares. Generalmente suele diagnosticarse tras una colecistectomía y se considera de mal pronóstico1. Se calcula que el porcentaje de pacientes diagnosticados con cáncer de vesícula, después de una colecistectomía por presunta colecistopatía litiásica, es 0.5-1.5%. El adenocarcinoma es el hallazgo histológico principal en el 80-85% de los carcinomas de vesícula biliar, con varios subtipos histológicos descritos: papilar, nodular e infiltrativo. Se han referido en la literatura tipos histológicos menos frecuentes de cáncer de vesícula, entre los que se incluyen: el sarcoma, melanoma, linfoma, tumores carcinoides y el cáncer de células escamosas. Los conductos biliares extrahepáticos son una localización inusual de presentación de los carcinomas neuroendocrinos extrapulmonares. Los tumores neuroendocrinos primarios de la vesícula biliar son particularmente raros, en el Surveillance, Epidemiology, and End Results Program (SEER) del National Cancer Institute de Estados Unidos solo se han reportado 278 casos entre 1973 y 2005, lo que representa el 0.5% de todos los tumores neuroendocrinos2,3. El carcinoma neuroendocrino pobremente diferenciado de células pequeñas de la vesícula biliar, descrito en 1984 por el Dr. Albores Saavedra et al.4, es una neoplasia poco frecuente que pertenece al grupo de los tumores carcinoides4,5, con 54 casos descritos en la literatura mundial. Esta estirpe histológica se asocia a un pronóstico muy precario6.
La incidencia de cáncer de vesícula biliar aumenta con la edad y frecuentemente se diagnostica en la séptima década de la vida, con una edad media entre los 62-66 años7, predominando en el sexo femenino, a excepción de los carcinomas endocrinos, que son más frecuentes en el sexo masculino y que se presentan a una edad más temprana8. El cáncer de vesícula biliar, generalmente, se origina en un contexto de inflamación crónica. En la mayoría de los pacientes, esta inflamación se explica por la presencia de cálculos biliares de colesterol. La sola existencia de litos intravesiculares incrementa el riesgo de cáncer de vesícula biliar entre 4 y 5 veces9. Otras causas inusuales de inflamación crónica de la vesícula biliar son: las infecciosas, como los trematodos biliares (Fasciola hepática, Clonorchis sinensis), o las infecciones crónicas por Helicobacter pylori, Salmonella typhi y paratyphi, así como las autoinmunes, como la colitis ulcerativa y la colangitis esclerosante primaria10–12.
Existen factores de riesgo ocupacionales, como es el caso de los trabajadores en las fábricas de papel, industria petrolera, textil y del calzado. Así mismo, son factores de riesgo la vesícula en porcelana, los pólipos vesiculares mayores a 1 cm, la obesidad, medicamentos tales como: isoniazida, anticonceptivos, orales y α-metildopa; el consumo de agua contaminada con pesticidas orgánicos; la exposición a ciertos químicos: pesticidas, caucho, cloruro de vinilo; a metales pesados, y a la radiación13,14.
En los tumores neuroendocrinos la etiología no está clara, por lo tanto hay varias hipótesis sobre el origen de los tumores neuroendocrinos de la vesícula biliar. La primera establece que la mucosa vesicular normal no contiene células neuroendocrinas, los tumores neuroendocrinos se producen solo en la mucosa vesicular con metaplasia intestinal o gástrica, y dicha metaplasia es secundaria a colelitiasis y colecistitis crónica3. La segunda establece que también es posible que los tumores neuroendocrinos surjan en tejido pancreático ectópico, en tejido pancreático heterotópico presente en la vesícula biliar, condición extremadamente rara. Las células del sistema neuroendocrino difuso son células que poseen un origen embriológico común en la cresta neural (neuroectodermo); son aquellas capaces de producir hormonas y péptidos activos, muchos de los cuales actúan sobre un entorno local, sin influencia sistémica. Dichas células poseen características metabólicas particulares, por su afinidad para la captación y descarboxilación de precursores de aminas, a las cuales se las denomina amine precursor uptake descarboxilase (APUD)15. A pesar de estar localizadas en varios órganos del cuerpo, han sido destacadas por su importancia funcional las células del tracto respiratorio y gastrointestinal (células enteroendocrinas-enterocromafines), en este último se concentran sobre todo en el estómago y en el intestino delgado. También existen en el esófago inferior, intestino grueso, en la vía biliar y en el páncreas16. Si se encuentran en una localización distinta, estas células pueden presentarse, desde un punto de vista anatomopatológico, como hiperplasias, hiperplasias adenomatosas, adenomas o carcinomas (APUDOMAS); tal es el caso de los feocromocitomas, paragangliomas y gastrinomas. Todos los tumores neuroendocrinos tienen potencial maligno. Dentro del grupo de los tumores neuroendocrinos se incluyen: los bien diferenciados (tumores carcinoides clásicos), los carcinomas neuroendocrinos bien diferenciados tumores carcinoides clásicos, los carcinomas neuroendocrinos bien diferenciados como los carcinoides atípicos o carcinoides malignos; los carcinomas neuroendocrinos pobremente diferenciados como los carcinomas de alto grado, de células pequeñas y de células grandes, y los carcinomas mixtos endocrinos–exocrinos.
Histológicamente, los tumores neuroendocrinos extrahepáticos representan el 0.2% del total, frente al 80-90% de los adenocarcinomas. Las formas más frecuentes son: la papilar, nodular y tubular con implicaciones pronósticas peculiares17,18. El diagnóstico de carcinoma neuroendocrino requiere elementos epiteliales malignos tales como: atipias, mitosis o núcleos pleomórficos)19. Focos de displasia o adenocarcinoma in situ pueden asociarse con el cáncer neuroendocrino.
Los marcadores inmunohistoquímicos más sensibles del carcinoma de células pequeñas de vesícula biliar son la enolasa neuronal específica que expresan el 75% de carcinomas, sinaptofisina y cromogranina A. Así mismo, la serotonina o la hormona adrenocorticotropa pueden estar presentes, de manera infrecuente. Las neoplasias neuroendocrinas de vesícula presentan características morfológicas atípicas y son quimiosensibles7. Clínicamente, los síntomas de un tumor en la vesícula biliar se sobreponen a los de un cólico biliar, que pueden presentarse como dolor abdominal más difuso y persistente que el clásico dolor en hipocondrio derecho de la litiasis vesicular; la ictericia, anorexia y la pérdida de peso generalmente indican una enfermedad más avanzada. A la exploración física podemos encontrar: ictericia, masa palpable en hipocondrio derecho con signo de Courvoisier, linfadenopatía periumbilical (nódulo de la hermana María José) o adenopatía supraclavicular izquierda denominada nódulo de Virchow.
El diagnóstico preoperatorio de los carcinomas neuroendocrinos de la vesícula biliar es sumamente difícil, debido a que se manifiesta con síntomas inespecíficos que incluyen dolor o molestias a nivel del hipocondrio derecho y pérdida de peso. La presencia de síndrome carcinoide es rara y la mayoría de las lesiones se identifican incidentalmente en el momento de la colecistectomía laparoscópica por colecistopatía litiásica. En cuanto a los estudios de laboratorio, el marcador tumoral CA 19-9, se puede encontrar elevado en el colangiocarcinoma y en el cáncer de vesícula. Las pruebas de función hepática, fosfatasa alcalina y bilirrubinas se encuentran frecuentemente elevadas. En ocasiones se encuentran datos de anemia, en los casos con enfermedad crónica o en pacientes con enfermedad más avanzada. Se sabe que la medición de cromogranina A es útil para el diagnóstico preoperatorio de los tumores neuroendocrinos. La cromogranina A está elevada en el 90% de los tumores neuroendocrinos del intestino, y los niveles se correlacionan con la carga tumoral y la posibilidad de recurrencia y, por lo tanto, la cromogranina A puede ser un marcador biológico eficaz para el diagnóstico preoperatorio de los tumores neuroendocrinos. La cromogranina preoperatoria para el diagnóstico de tumores neuroendocrinos de vesícula biliar no es costo-efectiva20.
El ultrasonido es el estudio de primera elección en pacientes con dolor en hipocondrio derecho, ya que en el 50-75% de los pacientes con cáncer de vesícula se encuentra una masa. También es útil para determinar si existen metástasis en el hígado. La tomografía computada puede evidenciar invasión tumoral en la periferia de la vesícula, existe invasión hepática en el 60% de los pacientes. La resonancia magnética es de utilidad para valorar metástasis, invasión vascular y definir de manera precisa la localización de conductos biliares y vasculares. El ultrasonido endoscópico es de utilidad para determinar la extensión y la invasión a ganglios regionales. Mientras que para las neoplasias biliares, el ultrasonido abdominal puede ser diagnóstico; la tomografía axial computada, la tomografía por emisión de positrones y la colangiorresonancia permiten determinar el estadio y la extensión tumoral. En los tumores endocrinos biliares la biopsia endoscópica tiene mayor relevancia, al permitir la estadificación, seguimiento y el diagnóstico, el cual es es importante para adecuar el régimen quimioterápico y plantear tratamientos aditivos, como los análogos de somatostatina.
La colecistectomía es el único tratamiento que puede ofrecer la cura para esta enfermedad, siempre y cuando no exista invasión local o metástasis. Desafortunadamente, la mayoría de los pacientes se diagnostican en estadios avanzados. Las neoplasias que además presenten metástasis a ganglios fuera del área regional (vena porta, ligamento gastrohepático y área retroduodenal) no son resecables. En el caso de ser candidato a resección tumoral, el procedimiento deberá incluir colecistectomía, resección hepática y linfadenectomía regional. La extensión de la resección hepática actualmente no está definida. Sin embargo, el 25% de los tumores T2 tienen involucro hepático, dato este último de mal pronóstico21. Para los tumores endocrinos biliares, la resección completa es el tratamiento de elección y dependerá de la localización, habitualmente son irresecables con enfermedad metastásica o afectación vascular. Lo más frecuente es la resección biliar extrahepática con hepatoyeyuno anastomosis, pancreatoduodenectomía o colecistectomía, pudiendo precisar incluso la resección hepática o el trasplante22,23. Según Moskal et al.24 los sitios a los que más comúnmente metastatiza el carcinoma neuroendocrino de vesícula biliar son a ganglios (88%), hígado (88%), pulmón (23%) y el peritoneo (19%).
No es claro el papel de la quimio- y radioterapia en el tratamiento de los tumores neuroendocrinos de células pequeñas de vesícula biliar. En general, este tipo de tumores es insensible a la radioterapia tradicional. Los agentes quimioterapéuticos utilizados en varias series de casos publicadas incluyen: cisplatino, gemcitabina y etopósido más 5-fluorouracilo que, según los estudios publicados, pueden conducir a un resultado parcial de carácter paliativo con escasa ventaja marginal25,26.
ConclusiónNuestro grupo quirúrgico aconseja que, al introducir el laparoscopio, se revise sistemáticamente toda la cavidad peritoneal, en busca de diagnósticos diferenciales y enfermedades no identificadas. Deben aprovecharse, siempre, las cualidades exploratorias, diagnósticas y terapéuticas de la laparoscopia.
Los tumores endocrinos biliares permanecen silentes hasta que metastatizan o invaden órganos vecinos, razón por la cual es infrecuente su diagnóstico en estadios iniciales debido a su baja incidencia, ausencia de marcadores séricos y falta de síntomas hormonales.
El pronóstico es desfavorable, especialmente cuando son irresecables. La neoplasia endocrina de vesícula biliar, a pesar de ser infrecuente, debe tenerse en cuenta como posibilidad diagnóstica ante las implicaciones terapéuticas y pronósticas. En este caso, fue gracias a la laparoscopia diagnóstica rutinaria que realizó el equipo quirúrgico involucrado que se detectó una enfermedad que, de otra forma, hubiera pasado desapercibida, ensombreciendo aún más el pronóstico de la paciente. Por lo mismo, consideramos que la laparoscopia diagnóstica debe realizarse en todos los procedimientos laparoscópicos, independientemente de su indicación.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesNo existe ningún conflicto de intereses real, potencial o potencialmente percibido que pueda resultar en un sesgo en la publicación de este trabajo.