Las citoquinas proinflamatorias desempeñan un papel importante en la retinopatía diabética; existe evidencia contradictoria sobre la elevación sérica de las mismas en esta condición y el posible rol que tienen como su marcador sérico.
ObjetivoEvaluar la presencia de citoquinas séricas proinflamatorias en pacientes con y sin retinopatía diabética.
Material y métodosSeries de casos comparativas. Se incluyeron 36 pacientes divididos en 3 grupos: 12 pacientes con diabetes mellitus con retinopatía diabética (grupo 1), 12 pacientes con diabetes mellitus sin retinopatía diabética (grupo 2) y 12 pacientes sin diabetes mellitus como grupo control. Se midieron los niveles séricos de las siguientes citoquinas proinflamatorias en todos los pacientes: TNF-α, IL-1β e IL-6. También se realizó medición de biomarcadores proinflamatorios o reactantes de fase aguda, como velocidad de sedimentación globular y proteína C reactiva.
ResultadosLos niveles de TNF-α e IL-6 resultaron mayores en el grupo 1 (TNF-α: 19.4±10.9pg/ml, IL-6: 5.75±7pg/ml) comparados con los de los otros 2 grupos, aunque la diferencia resultó estadísticamente significativa solo en el caso del TNF-α (grupo 1: 19.4±10.9pg/ml, grupo 2: 14±4.3pg/ml y grupo control: 8.49±3.69pg/ml, p=0.001). No hubo diferencias entre biomarcadores proinflamatorios como velocidad de sedimentación globular y proteína C reactiva entre los 3 grupos (p>0.05).
ConclusionesLos niveles séricos de citoquinas proinflamatorias fueron mayores en el grupo 1. Se requieren mayores estudios para establecer mejor el impacto de este hallazgo.
Pro-inflammatory cytokines play an important role in diabetic retinopathy. There is conflicting evidence about their serum elevation in this condition and that they also may be possible serum inflammatory biomarkers of diabetic retinopathy.
ObjectiveTo evaluate the presence of serum pro-inflammatory cytokines and acute phase reactants in the serum of patients with and without diabetic retinopathy.
Material and methodsComparative case series with 36 patients divided into three groups were included: 12 patients with diabetes mellitus and diabetic retinopathy (group 1), 12 diabetic patients without diabetic retinopathy (group 2), and 12 healthy patients as a control group. Serum levels of the following pro-inflammatory cytokines were measured in all patients: TNF-α, IL-1β and IL-6. Pro-inflammatory biomarkers measurements were also performed, such as erythrocyte sedimentation rate and C-reactive protein.
ResultsThe levels of TNF-α and IL-6 were higher in group 1 (TNF-α: 19.4 ± 10.9 pg/ml, IL-6: 5.75 ± 7 pg/ml) compared to the other two groups, although the difference was statistically significant only in the case of TNF-α (group 1: 19.4 ± 10.9 pg/ml, group 2: 14 ± 4.3 pg/ml and control: 8.49 ± 3.69 pg/ml, p = 0.001). There were no differences among pro-inflammatory biomarkers such as erythrocyte sedimentation rate and C reactive protein. among the three groups (p > 0.05).
ConclusionsPro-- inflammatory serum cytokine levels were higher in the diabetes mellitus with diabetic retinopathy group. Larger studies are warranted to establish the real impact of this finding.
La etiopatogenia de la retinopatía diabética incluye varias teorías dentro de las que se encuentran: la de la vía de la aldosa reductasa1,2, daño tisular por radicales libres3,4 y la glucación no enzimática de proteínas5,6, entre otras.
Una de las teorías que ha cobrado mayor importancia en épocas recientes es la que tiene que ver con el concepto de que en la diabetes y sus complicaciones tardías, como la retinopatía diabética, ocurre un proceso inflamatorio «de bajo grado», en donde las citoquinas proinflamatorias desempeñan un papel importante7–14. Por otro lado, algunas de estas citoquinas tienden a presentar elevaciones tanto a nivel de cavidad vítrea como sérico, en complicaciones tardías de la diabetes15. Lo anterior podría hacerlas candidatas a llegar a ser marcadores séricos de estas, incluida la misma retinopatía diabética como parte de la evaluación de los pacientes.
El objetivo de este estudio es describir los niveles de algunas de estas citoquinas y reactantes de fase aguda, en pacientes diabéticos con y sin retinopatía.
Material y métodosEl tipo de estudio fue el de series de casos comparativas. Se escogieron 36 pacientes del Hospital General «Dr. Miguel Silva” de la ciudad de Morelia, Michoacán, México, en forma aleatoria simple, formándose 3 grupos de estudio de 12 pacientes cada uno.
Los criterios de inclusión fueron: pacientes con diagnóstico de diabetes mellitus, pacientes con retinopatía diabética de cualquier grado y pacientes sanos.
En base a lo anterior, el primer grupo correspondió a pacientes con diabetes mellitus que tenían retinopatía diabética, el segundo a pacientes con diabetes mellitus sin retinopatía diabética y el tercero correspondió a pacientes del grupo control.
Los criterios de exclusión fueron: pacientes con enfermedad ocular como uveítis, enfermedad tiroidea, autoinmune, del tejido conectivo o maligna, nefropatía terminal, enfermedad isquémica cardiaca conocida, enfermedades crónicas inflamatorias (colitis ulcerativa crónica inespecífica, enfermedad de Crohn, procesos infecciones crónicos o agudos).
A los pacientes se les sometió a exploración oftalmológica completa, que incluyó toma de agudeza visual corregida, biomicroscopia con lámpara de hendidura, tonometría y examen de fondo de ojo bajo dilatación farmacológica.
Se clasificó la retinopatía diabética de acuerdo a su presencia y ausencia según los criterios del Early Treatment Diabetic Retinopathy Study (ETDRS).
Las características demográficas de los pacientes estudiados incluyeron: edad, sexo, tabaquismo, índice de masa corporal, circunferencia de cintura, hipertensión arterial sistémica, tensión arterial sistólica, tensión arterial diastólica, presencia de síndrome metabólico, (NCEP-ATPIII) y riesgo de evento cardiovascular a los 10 años.
Este estudio fue aprobado por el Comité de Ética del Hospital General «Dr. Miguel Silva», obteniéndose el consentimiento informado de todos los pacientes de acuerdo con la declaración de Helsinki.
Las muestras y medición de citoquinasLos niveles séricos de citoquinas fueron medidos en todos los pacientes de los 3 grupos estudiados. Las muestras séricas frescas fueron evaluadas empleando kits de ELISA R&D (Systems, Inc., Minneapolis, MN; and Endogen, Rockford, IL, EE. UU.). Las citoquinas y reactantes de fase aguda que se midieron fueron: velocidad de sedimentación globular (mm/h), proteína C reactiva (mg/dl), TNF-α, IL-1β e IL-6 (pg/ml).
Se realizó análisis con estadística descriptiva, obteniéndose medias y desviación estándar. En cuanto a estadística inferencial, se empleó prueba de Kruskall-Wallis como prueba global y la U de Mann-Whitney como prueba post-hoc para comparaciones entre grupos específicos.
Respecto a pruebas de correlación, se sacaron coeficientes de correlación de Spearman (ρ de Spearman).
Se consideró una p<0.05 como estadísticamente significativa. Se utilizó el programa SPSS para MAC versión 20 para realizar las pruebas estadísticas.
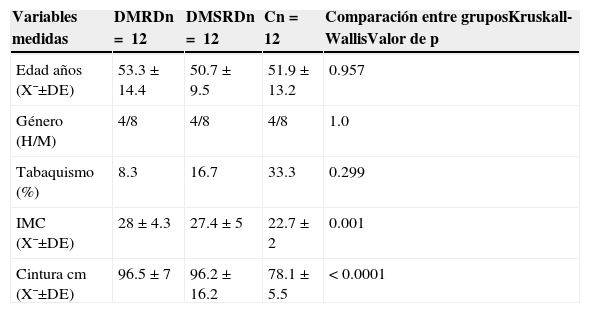
ResultadosEn cuanto a las características demográficas, entre los 3 grupos no hubo diferencias estadísticamente significativas, ni diferencias en el hábito tabáquico. El índice de masa corporal se mostró en promedio normal en el grupo control (tabla 1).
Características demográficas, antecedentes, índice de masa corporal y cintura de los pacientes estudiados
| Variables medidas | DMRDn= 12 | DMSRDn= 12 | Cn= 12 | Comparación entre gruposKruskall-WallisValor de p |
|---|---|---|---|---|
| Edad años (X¯±DE) | 53.3±14.4 | 50.7±9.5 | 51.9±13.2 | 0.957 |
| Género (H/M) | 4/8 | 4/8 | 4/8 | 1.0 |
| Tabaquismo (%) | 8.3 | 16.7 | 33.3 | 0.299 |
| IMC (X¯±DE) | 28±4.3 | 27.4±5 | 22.7±2 | 0.001 |
| Cintura cm (X¯±DE) | 96.5±7 | 96.2±16.2 | 78.1±5.5 | <0.0001 |
C: grupo control; DE: desviación estándar; DMRD: grupo de diabetes mellitus con retinopatía diabética; DMSRD: grupo de diabetes mellitus sin retinopatía diabética; IMC: índice de masa corporal; n: número de pacientes por grupo; X¯: media.
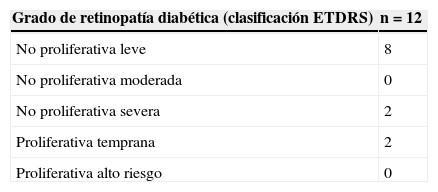
En la estratificación de la retinopatía de acuerdo a la escala de severidad del ETDRS destaca la ausencia de casos de retinopatía diabética proliferativa de alto riesgo (tabla 2).
Grado de retinopatía diabética en los pacientes del grupo con diabetes mellitus y retinopatía diabética
| Grado de retinopatía diabética (clasificación ETDRS) | n=12 |
|---|---|
| No proliferativa leve | 8 |
| No proliferativa moderada | 0 |
| No proliferativa severa | 2 |
| Proliferativa temprana | 2 |
| Proliferativa alto riesgo | 0 |
ETDRS: Early Treatment Diabetic Retinopathy Study; n: número de pacientes.
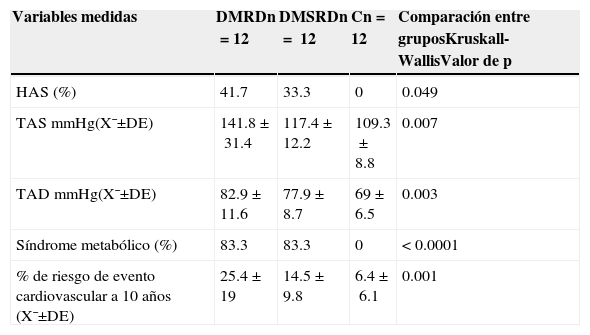
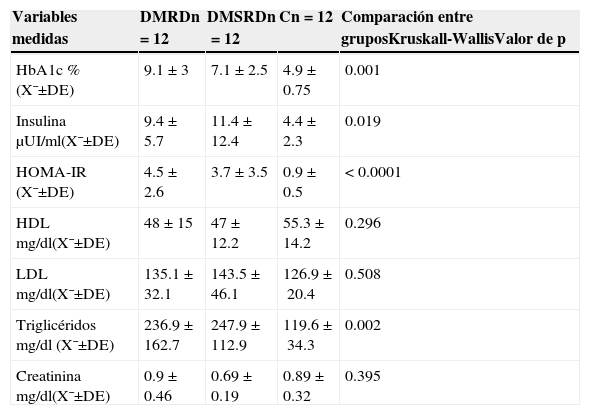
Los valores de tensión arterial, síndrome metabólico, niveles séricos de glucosa, insulina y niveles de lípidos mostraron diferencias significativas entre los 3 grupos de pacientes estudiados (tablas 3 y 4).
Variables clinicometabólicas y de riesgo cardiovascular en los pacientes estudiados
| Variables medidas | DMRDn=12 | DMSRDn= 12 | Cn= 12 | Comparación entre gruposKruskall-WallisValor de p |
|---|---|---|---|---|
| HAS (%) | 41.7 | 33.3 | 0 | 0.049 |
| TAS mmHg(X¯±DE) | 141.8±31.4 | 117.4±12.2 | 109.3±8.8 | 0.007 |
| TAD mmHg(X¯±DE) | 82.9±11.6 | 77.9±8.7 | 69±6.5 | 0.003 |
| Síndrome metabólico (%) | 83.3 | 83.3 | 0 | <0.0001 |
| % de riesgo de evento cardiovascular a 10 años (X¯±DE) | 25.4±19 | 14.5±9.8 | 6.4±6.1 | 0.001 |
C: grupo control; DE: desviación estándar; DMRD: grupo de diabetes mellitus con retinopatía diabética; DMSRD: grupo de diabetes mellitus sin retinopatía diabética; HAS: hipertensión arterial; n: número de pacientes por grupo; TAD: tensión arterial diastólica; TAS: tensión arterial sistólica; X¯: media.
Variables de laboratorio de los pacientes estudiados. Hemoglobina glucosilada, niveles de insulina y perfil de lípidos
| Variables medidas | DMRDn=12 | DMSRDn=12 | Cn=12 | Comparación entre gruposKruskall-WallisValor de p |
|---|---|---|---|---|
| HbA1c %(X¯±DE) | 9.1±3 | 7.1±2.5 | 4.9±0.75 | 0.001 |
| Insulina μUI/ml(X¯±DE) | 9.4±5.7 | 11.4±12.4 | 4.4±2.3 | 0.019 |
| HOMA-IR (X¯±DE) | 4.5±2.6 | 3.7±3.5 | 0.9±0.5 | <0.0001 |
| HDL mg/dl(X¯±DE) | 48±15 | 47±12.2 | 55.3±14.2 | 0.296 |
| LDL mg/dl(X¯±DE) | 135.1±32.1 | 143.5±46.1 | 126.9±20.4 | 0.508 |
| Triglicéridos mg/dl (X¯±DE) | 236.9±162.7 | 247.9±112.9 | 119.6±34.3 | 0.002 |
| Creatinina mg/dl(X¯±DE) | 0.9±0.46 | 0.69±0.19 | 0.89±0.32 | 0.395 |
C: grupo control; DE: desviación estándar; DMRD: grupo de diabetes mellitus con retinopatía diabética; DMSRD: grupo de diabetes mellitus sin retinopatía diabética; HbA1c: hemoglobina glucosilada; HDL: lipoproteínas de alta densidad; HOMA-IR: modelo homeostático de evaluación de la resistencia en insulina; LDL: lipoproteínas de baja densidad; n: número de pacientes por grupo; X¯: media.
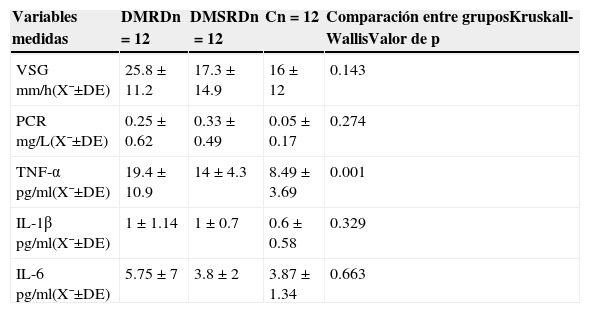
Se encontraron únicamente diferencias estadísticamente significativas en los niveles de TNF-α entre los 3 grupos siendo los niveles más altos los hallados en el grupo de pacientes con diabetes mellitus con retinopatía diabética (19.4±10.9pg) con respecto a los otros 2 grupos (los del grupo de pacientes con diabetes mellitus sin retinopatía diabética [14±4.3pg] y el grupo control [8.49±3.69pg] [p=0.001]) (tabla 5).
Comparación entre los 3 grupos de los niveles séricos de citoquinas proinflamatorias y reactantes de fase aguda
| Variables medidas | DMRDn=12 | DMSRDn=12 | Cn=12 | Comparación entre gruposKruskall-WallisValor de p |
|---|---|---|---|---|
| VSG mm/h(X¯±DE) | 25.8±11.2 | 17.3±14.9 | 16±12 | 0.143 |
| PCR mg/L(X¯±DE) | 0.25±0.62 | 0.33±0.49 | 0.05±0.17 | 0.274 |
| TNF-α pg/ml(X¯±DE) | 19.4±10.9 | 14±4.3 | 8.49±3.69 | 0.001 |
| IL-1β pg/ml(X¯±DE) | 1±1.14 | 1±0.7 | 0.6±0.58 | 0.329 |
| IL-6pg/ml(X¯±DE) | 5.75±7 | 3.8±2 | 3.87±1.34 | 0.663 |
C: grupo control; DE: desviación estándar; DMRD: grupo de diabetes mellitus con retinopatía diabética; DMSRD: grupo de diabetes mellitus sin retinopatía diabética; IL: interleucina; n: número de pacientes por grupo; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular; TNF-α: factor de necrosis tumoral alfa; X¯: media.
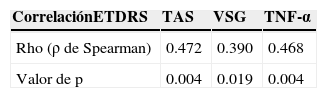
Hubo algunas correlaciones estadísticamente significativas: la primera, entre el grado de retinopatía diabética y el TNF-α, así como entre el grado de retinopatía y la velocidad de sedimentación globular (tabla 6).
Correlaciones estadísticamente significativas entre grado de severidad de retinopatía diabética y TAS, TNF-α, VSG
| CorrelaciónETDRS | TAS | VSG | TNF-α |
|---|---|---|---|
| Rho (ρ de Spearman) | 0.472 | 0.390 | 0.468 |
| Valor de p | 0.004 | 0.019 | 0.004 |
ETDRS: Early Treatment Diabetic Retinopathy Study; TAS: tensión arterial sistólica; TNF-α: factor de necrosis tumoral alfa; VSG: velocidad de sedimentación globular.
La teoría inflamatoria, que actualmente se considera como parte de la patogénesis de la retinopatía diabética, ha sido en los últimos años tema de intenso debate en todo el mundo9.
De acuerdo a esta teoría, las citoquinas proinflamatorias desempeñan un papel esencial en dicha patogénesis. Por otro lado, se han encontrado tanto en cavidad vítrea como en sangre en pacientes que sufren de esta complicación tardía de la diabetes, niveles elevados de dichas citoquinas15.
En cuanto a otros estudios que se han realizado abordando este tema, Meleth et al.15 encontraron niveles aumentados de algunas citoquinas de manera proporcional a la gravedad de la retinopatía, aunque en su estudio, a diferencia del nuestro, no hubo grupo control con sujetos sanos.
Por otro lado, Chen et al.16 encontraron niveles aumentados de IL-22 en pacientes diabéticos con retinopatía, pero también a diferencia de nuestro estudio, no hallaron diferencias estadísticamente significativas entre el grupo de pacientes con retinopatía y el grupo control en las mediciones del TNF-α. En concordancia con nuestros hallazgos no evidenciaron tampoco diferencias entre grupos en los niveles de IL-6 e IL-1β. Cabe mencionar también que solamente reportan 2 grupos que son el de pacientes diabéticos pero sin estratificación de acuerdo a la retinopatía diabética como nuestro estudio y un grupo control. Por el contrario, en el estudio de Mirza et al.17 realizado en población mexicana como la nuestra, concuerda con nuestro estudio en el hecho de que encontraron niveles séricos más elevados de TNF-α. Sin embargo, una diferencia con nuestros hallazgos fue que los niveles de IL-6 que encontraron tuvieron diferencias estadísticamente significativas entre el grupo de pacientes con retinopatía diabética y el grupo control.
Otro estudio con resultados similares es el de Koleva-Georgieva et al.18, quienes encontraron diferencias estadísticamente significativas en los niveles de IL-1β e IL-6 en el grupo de pacientes con retinopatía. En contraste, nuestros resultados muestran que no hubo diferencias en los niveles de estas citoquinas. En este estudio se realizó estratificación de la retinopatía de acuerdo a su severidad, encontrando diferencias estadísticamente significativas en los niveles de IL-1β y TNF-α entre los diferentes subgrupos de pacientes. Nuestros resultados mostraron que solo hubo una correlación significativa en el caso del TNF-α.
Doganay et al., en su estudio realizado también en pacientes diabéticos y controles sanos encontraron una correlación positiva entre algunas citoquinas como sIL-2R, IL-8, TNF- α (como en nuestro estudio) y el grado de retinopatía diabética19.
Otro de los estudios que propone como marcador sérico de retinopatía diabética proliferativa al TNF-α es el realizado por Gustavsson et al. en donde también se apreció una correlación estadísticamente significativa entre este grado de retinopatía y esta citoquina en pacientes con diabetes mellitus tipo 120. Nosotros encontramos también esta correlación, así como una correlación positiva entre la velocidad de sedimentación globular y el grado de retinopatía. No así con las otras citoquinas proinflamatorias aquí evaluadas.
En suma, encontramos lo siguiente al comparar nuestros resultados con lo reportado en la literatura9,10,16–20; además de hallar una diferencia estadísticamente significativa entre los diferentes grupos estudiados de pacientes en los niveles de TNF-α, es el primero en encontrar una correlación significativa entre la velocidad de sedimentación globular y el grado de retinopatía diabética.
En otro orden de ideas, una de las limitaciones de nuestro estudio es que no se realizó un cálculo de la muestra, lo que lo puede hacer proclive a tener errores de tipo sistemático tipo ii y tipo i; es decir, que en el caso del error tipo i se pueden encontrar diferencias estadísticamente significativas cuando en realidad no las hay, y viceversa en el caso del error sistemático tipo ii. También las correlaciones que se realizaron por medio de la ρ de Spearman pueden ser susceptibles a presentar este tipo de sesgo, que no sea compensado por la aplicación de esta prueba no paramétrica de correlación.
Un aspecto importante de los resultados que vale la pena resaltar es el hecho de que los 3 grupos se encontraron balanceados en cuanto a sus características demográficas así como de antecedentes como el tabaquismo, por lo cual los podemos descartar como factores de confusión en el análisis estadístico.
Como se mencionó previamente, el TNF-α fue la única citoquina proinflamatoria en donde se presentó una diferencia estadísticamente significativa; esto probablemente no sea específico de retinopatía diabética, ya que la diferencia entre los grupos de pacientes con diabetes mellitus con retinopatía diabética y de pacientes con diabetes mellitus sin retinopatía diabética resultó ser no significativa en las pruebas post-hoc. Sin embargo, hubo una correlación estadísticamente significativa entre grado de retinopatía diabética de acuerdo a la clasificación de ETDRS y los niveles séricos de TNF-α (ρ de Spearman=0.468, p=0.004).
Lo anterior se podría explicar por el hecho de que hay otras condiciones asociadas en los pacientes diabéticos, que pueden elevar los niveles de citoquinas proinflamatorias como la dislipidemia o la hipertensión arterial independientemente de la presencia de complicaciones tardías como la retinopatía diabética.
Preguntas que quedan pendientes derivadas de la anterior aseveración son, en primer lugar, si habría algunas diferencias estadísticamente significativas de los niveles de citoquinas séricas entre el grupo de pacientes con diabetes mellitus y retinopatía diabética y el grupo de pacientes con diabetes mellitus sin retinopatía diabética al aumentar el tamaño de la muestra.
En segundo lugar, también surge la pregunta de si habría alguna diferencia de los niveles de citoquinas proinflamatorias y reactantes de fase aguda entre los diferentes grados de retinopatía diabética, pregunta que queda sin respuesta también por la falta de potencia de la muestra para detectarla
En tercer término, la familia de TNF-α es una familia de citoquinas que tiene una amplia variedad de isoformas. Sería interesante, en vista de lo anterior y ya que fueron los niveles de esta citoquina los que presentaron diferencias estadísticamente significativas en la prueba global, ver si alguna de estas isoformas presenta mayor sensibilidad y especificidad en la retinopatía diabética en relación con sus diferentes grados de severidad.
Por último, valdría la pena investigar sobre la presencia de mayores niveles de algunas citoquinas de acuerdo a determinados grupos étnicos como lo propone el estudio de Mirza et al.17.
Todo lo anterior abre un campo muy amplio en cuanto a diagnóstico de la retinopatía diabética se refiere, con implicaciones por demás interesantes: existiría a este tenor de ideas la posibilidad de determinar mediante la elevación de algunas de estas citoquinas proinflamatorias y/o reactantes de fase aguda qué pacientes pudieran tener mayor probabilidad de padecer retinopatía diabética en el futuro, tal y como lo han llegado a proponer algunos autores21.
ConclusionesEn este estudio encontramos diferencias estadísticamente significativas entre los 3 grupos de pacientes en cuanto a niveles de TNF-α se refiere, aunque la diferencia entre los grupos con diabetes mellitus sin retinopatía diabética y los de diabetes mellitus con retinopatía diabética en las pruebas post-hoc no fueron concluyentes.
Las diferencias entre los niveles de otras citoquinas proinflamatorias fueron no significativas entre los 3 grupos.
Se requieren estudios con mayor cantidad de sujetos, aleatorizados, para determinar con mayor precisión la asociación entre las diferentes citoquinas proinflamatorias y la retinopatía diabética.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses
Los autores desean agradecer al personal académico del posgrado de la Facultad de Medicina de la Universidad Michoacana de San Nicolás de Hidalgo el apoyo en la realización de este trabajo, sobre todo en el análisis bioestadístico.