La quimioterapia adyuvante en el tratamiento del cáncer colorrectal no está exenta de complicaciones. Los anticuerpos monoclonales se han asociado a sangrado y a perforaciones intestinales.
ObjetivoPresentar el caso de un paciente tratado con un antiangiogénico por una neoplasia colorrectal avanzada, que presentó una grave complicación asociada al tratamiento.
Caso clínicoPaciente de 42 años intervenido de neoplasia rectal en obstrucción con metástasis en el momento del diagnóstico. Dieciséis meses después de la cirugía, durante el tratamiento adyuvante de segunda línea, presentó una perforación intestinal acompañada de rectorragia y fístula intestinal a retroperitoneo y a extremidad inferior izquierda. A pesar del intenso tratamiento quirúrgico y médico, esta complicación tuvo fatales consecuencias.
ConclusionesLas futuras investigaciones deberán estar encaminadas a la obtención de biomarcadores, para adecuar el uso de este tipo de antitumorales con el fin de disminuir el índice de factores adversos.
The use of a new chemotherapy as adjuvant treatment of colorectal cancer is not free of complications. Monoclonal antibodies are associated with bleeding and intestinal perforations.
ObjectiveTo report the case of a patient who developed a serious complication after treatment with an antiangiogenic drug for colorectal neoplasm.
Clinical caseThe case is presented of a 42-year-old male operated on due to subocclusive rectal cancer with metástasis at the time of diagnosis. Sixteen months after surgery during second-line adjuvant therapy, an intestinal perforation was observed with haemorrhage and intestinal leak to retroperitoneum and left lower extremity. Despite intensive medical and surgical treatment this complication had fatal consequences.
ConclusionsFuture research should be directed at obtaining biomarkers for the specific use of antiangiogenic agents in order to decrease the rate of adverse factors.
La mortalidad del cáncer colorrectal ha disminuido de manera espectacular en los últimos años1. Uno de los factores que ha contribuido a este hecho, junto a los programas de detección, es la aparición de nuevos tratamientos quimioterápicos. En los últimos años la incorporación a los tratamientos de las terapias antiangiogénicas, entre ellas el aflibercept, ha permitido en pacientes con neoplasias colorrectales avanzadas mejorar el tiempo libre de progresión de la enfermedad y la supervivencia global2. Sin embargo, estas nuevas terapias conllevan toxicidades que difieren de las de la quimioterapia habitual y que en ocasiones pueden resultar fatales2, por lo que deben ser tenidas en cuenta.
ObjetivoPresentar el caso de un paciente tratado con un antiangiogénico por una neoplasia colorrectal avanzada que presentó una grave complicación y realizar una revisión bibliográfica a propósito del mismo.
Caso clínicoPresentamos el caso de un varón de 42 años sin antecedentes de interés ni alergias medicamentosas conocidas. En agosto de 2013 ingresó por un cuadro suboclusivo intestinal secundario a una neoplasia estenosante de recto-sigma con metástasis hepáticas en el estudio de extensión. Se decidió su intervención quirúrgica como tratamiento inicial y se le realizó una resección anterior de recto laparoscópica, con reconstrucción mediante anastomosis colorrectal mecánica (CEEA 28mm) y metastasectomía de los segmentos hepáticos vi, viii y iv. El estudio anatomopatológico reportó adenocarcinoma de recto de grado medio (G2) que infiltraba serosa con invasión perineural pT4 N1 (GL 2+/12) M1, y 2 de los fragmentos hepáticos con metástasis de 1.5 y 1.2cm con márgenes libres de 0.5 y 0.1cm, respectivamente (segmentos vi y iv).
Durante el seguimiento en junio de 2014, se detectó la aparición de nuevas metástasis hepáticas en segmento viii, realizándose una hepatectomía derecha reglada. Dos meses más tarde y ante la persistencia de elevación de marcadores, se inició tratamiento adyuvante con varias tandas de quimioterapia, pese a lo cual persistió con elevación de los marcadores tumorales (CEA, Ca 19-9), motivo por el que se le realizó una tomografía por emisión de positrones, que mostró captación a nivel de la espina ilíaca anterosuperior, por lo que se inició tratamiento mediante radioterapia pélvica. En sucesivos controles se diagnosticó de metástasis hepáticas y pulmonares múltiples no resecables quirúrgicamente, por lo que se optó, tras plantear el caso en el Comité de Tumores, por iniciar nueva terapia citostática con aflibercept (dosis 4mg/kg de peso cada 2 semanas).
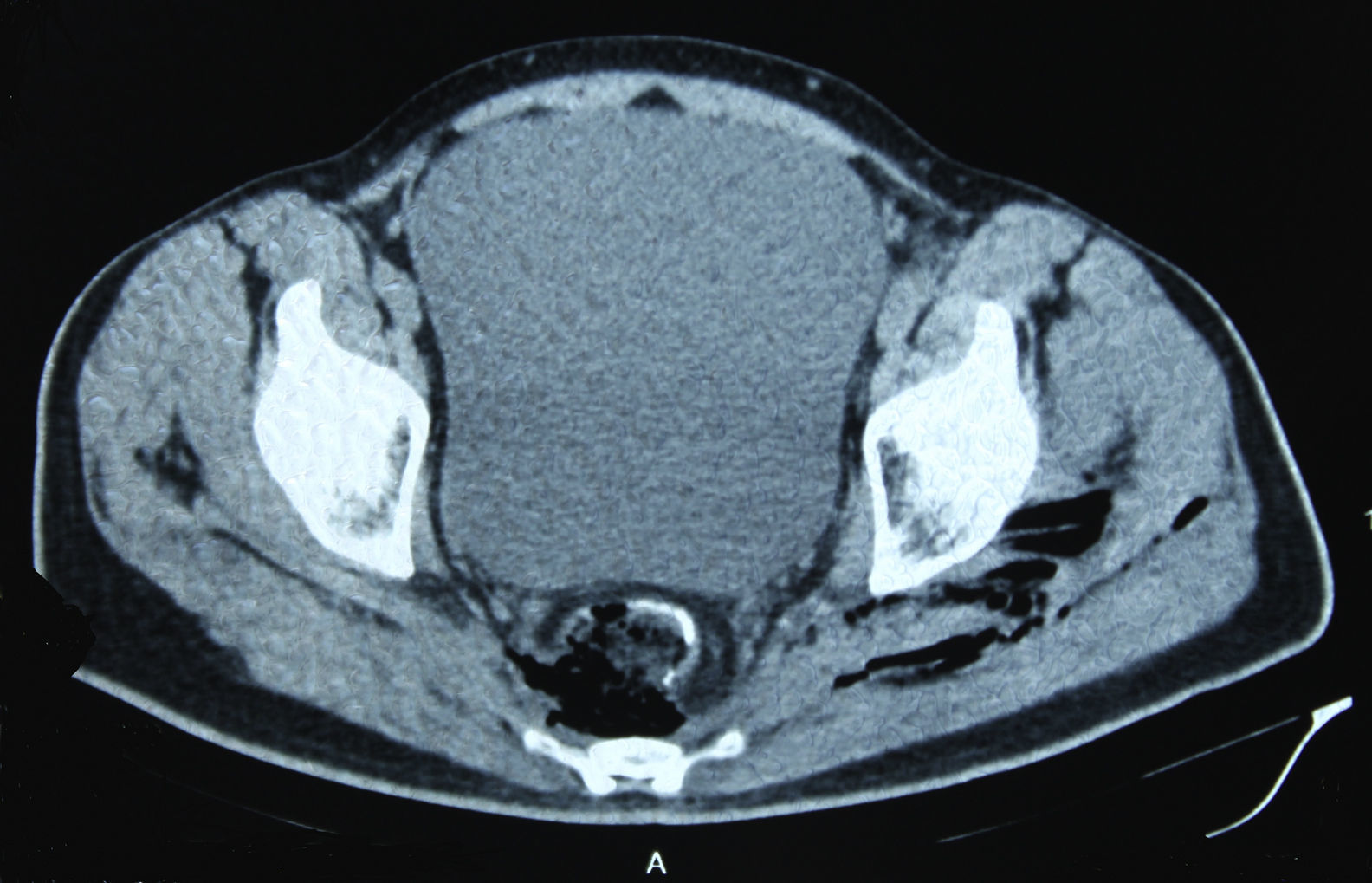
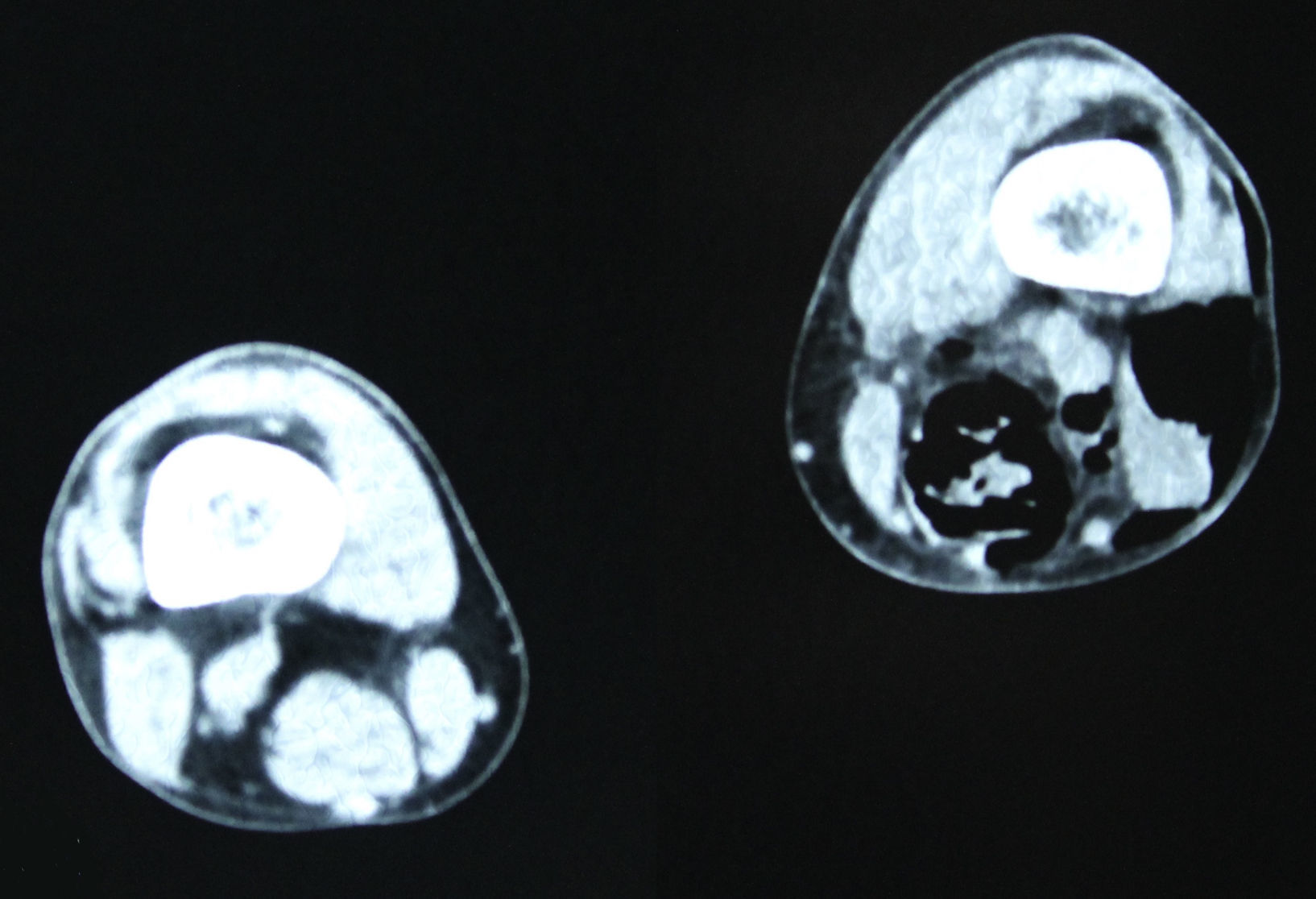
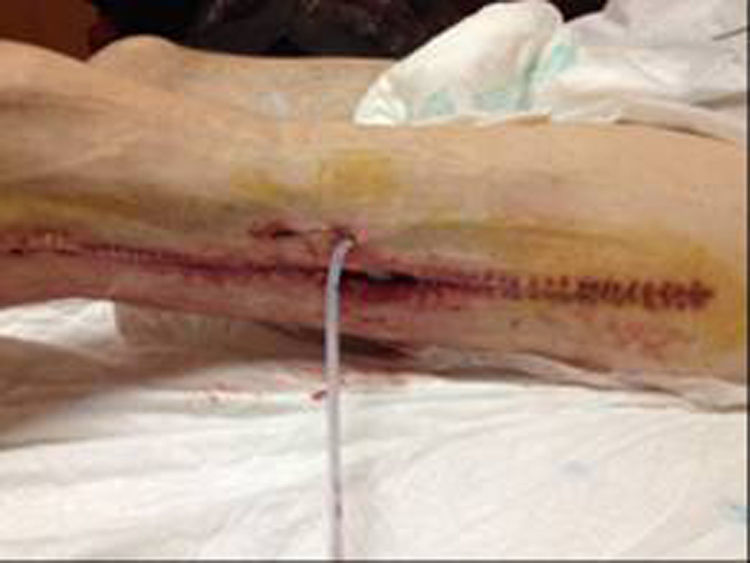
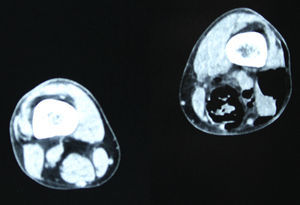
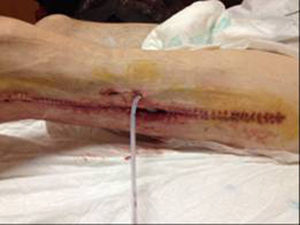
En diciembre de 2014 durante el tratamiento con aflibercept (4 ciclos), el paciente acudió a Urgencias por presentar dolor de miembro inferior izquierdo, asociado a aumento de calibre y crepitación en cara lateroexterna, desde la raíz del muslo hasta el área rotuliana. La tomografía computada (figs. 1 y 2) mostró espacios aéreos entre los planos musculares a lo largo del miembro inferior izquierdo. La causa probable fue la perforación espontánea a nivel de la anastomosis rectal, con fistulización retrocutánea a extremidad inferior. Se propuso revisión quirúrgica de urgencia, que se realizó con los siguientes hallazgos: colostomía en asa a nivel de fosa ilíaca izquierda, fasciotomía amplia de extremidad con lavado y drenaje de un gran absceso localizado a lo largo de todo el miembro inferior izquierdo (fig. 3).
Doce días después, ante la persistencia de íleo y del abundante drenaje purulento a través de la fasciotomía a pesar del control y de las curas diarias, se realizó una colostomía terminal definitiva en fosa ilíaca izquierda. Durante el postoperatorio, el paciente presentó cuadro de íleo paralítico, que se resolvió de manera conservadora, y episodio autolimitado de rectorragia acompañada de sangrado a través de la herida quirúrgica de extremidad inferior, que provocó repercusión hemodinámica y requirió transfusión de 4 concentrados de hematíes. Una vez estabilizado el paciente, habiendo cesado el cuadro hemorrágico y persistiendo un abundante drenaje purulento por heridas del miembro inferior, se decidió iniciar terapia Vacuum Assisted Closure™. Progresivamente se evidenció mejoría clínica con evolución favorable de las heridas practicadas que granularon por segunda intención y que permitieron dar al paciente de alta al mes de su ingreso hospitalario. Cuarenta y ocho horas más tarde reingresó por presentar un nuevo cuadro de rectorragia masiva por colostomía y sangrado abundante por heridas del muslo izquierdo, con importante repercusión hemodinámica que obligó a nueva transfusión de concentrados de hematíes. Durante las siguientes horas, a pesar de las medidas terapéuticas para su estabilización, persistió un sangrado incoercible que finalmente provocó su fallecimiento por choque hipovolémico tras una hemorragia catastrófica.
DiscusiónEl cáncer colorrectal es el tercer cáncer más frecuente diagnosticado en hombres y el segundo en mujeres. La tasa de mortalidad que se le atribuye ha decrecido progresivamente desde 1980, esto puede justificarse por una detección precoz de la enfermedad y por la aparición de nuevas terapias más efectivas e individualizadas de adyuvancia y neoadyuvancia. Sin embargo, en aquellos casos con metástasis al diagnóstico, que llegan a suponer el 20%, la supervivencia a los 5 años no supera el 7%3.
Dentro de las terapias dirigidas a este grupo de pacientes debemos señalar los anticuerpos monoclonales y, dentro de estos, el bevacizumab que, asociado a fluorouracilo, leucovorin, y oxaliplatin (FOLFOX), constituye en la actualidad la terapia de primera línea para estos pacientes. Su mecanismo de acción se basa en el control de la angiogénesis. Otros anticuerpos antiangiogénicos con otros mecanismos de acción como el bloqueador del factor de crecimiento endotelial vascular o anti-VEGF (aflibercept) y el inhibidor de la tirosincinasa (sorafenib, sunitinib, vandetanib, pazopanib, etc.) actúan inhibiendo la angiogénesis mediante el bloqueo de los factores de crecimiento endotelial vascular (VEGF) y han demostrado igualmente un claro beneficio clínico en el manejo de varios tumores sólidos4.
Dentro de estas nuevas terapias nos centraremos en el aflibercept, dado que es el fármaco con el que se trató al paciente del caso. Es una proteína humana recombinada con efecto antiangiogénico, que se comporta como un receptor señuelo para bloquear los VEGF A y B y los factores de crecimiento placentario. Según diferentes estudios, este ha presentado mayor eficacia en aquellos tumores cuyo crecimiento se basa en una angiogénesis patológica, por su mayor ubicuidad y eficacia5. Por ello, la recomendación vigente actual para su uso es como tratamiento de segunda línea en los pacientes con metástasis por carcinoma colorrectal en combinación con 5-fluorouracilo, leucovorina e irinotecan (FOLFIRI) y en pacientes resistentes o que han presentado progresión tras un tratamiento con oxiplatino5. Pero, si bien los estudios han demostrado que esta combinación mejora la supervivencia y el tiempo libre de enfermedad en este grupo de pacientes metastásicos, también existe evidencia suficiente como para afirmar que el uso de aflibercept en el tratamiento de pacientes con tumores sólidos se asocia a un riesgo más elevado de efectos adversos fatales6, mayor incidencia de eventos hemorrágicos graves4 y un mayor riesgo significativamente estadístico de desarrollar perforación gastrointestinal5. Los eventos hemorrágicos relacionados con el aflibercept tienen su origen en el mecanismo anti-VEGF.
El VEGF posee múltiples acciones sobre la pared vascular como regulador de la permeabilidad y proliferación, y de su inhibición; por lo tanto, ocasiona alteraciones en ella que predisponen a fenómenos hemorrágicos4.
Por otra parte, la patogénesis de las perforaciones en relación con los antiangiogénicos no es tan bien conocida. Se han propuesto diversos mecanismos como la existencia previa de daño en la pared intestinal por colitis posquimioterápica, diverticulitis, úlcera gástrica o necrosis tumoral o por fenómenos tromboembólicos que producen isquemia intestinal y la subsecuente perforación. En ratones de investigación se comprobó que los fármacos antiangiogénicos ocasionaban una regresión de los capilares de las vellosidades intestinales, lo cual podría contribuir al desarrollo de microperforaciones7. Otra importante complicación relacionada con el aflibercept es la aparición de infecciones, incluyendo las de alto grado que comprometan la supervivencia. En el paciente del caso presentado se manifestó mediante una importante infección de tejidos blandos en la extremidad inferior secundaria a una progresión retrorrectal de la perforación de la anastomosis. El mecanismo causal de las infecciones en relación con la administración del aflibercept es todavía desconocido. Entre las teorías propuestas las más aceptadas son el desarrollo de neutropenia asociado a aflibercept o el posible bloqueo del ciclo hematopoyético de las células madre provocado por la inhibición del receptor de VEGF8.
Por otro lado, también se conoce que la combinación de radioterapia esterotáxica y fármacos antiangiogénicos incrementa de manera significativa el daño intestinal severo, frente al empleo de ambas terapias de forma independiente9.
El paciente del caso reunía todos los factores descritos: tumor sólido metastásico que había recibido pautas previas de quimioterapia y había sido tratado con radioterapia pélvica a altas dosis antes de ser rescatado, por progresión de su enfermedad, con aflibercept. Como hemos descrito tras la revisión de diferentes metaanálisis, la mayor incidencia de hemorragias, infecciones y perforaciones asociada al uso de este fármaco, considerando el tipo de paciente, contribuyó a que estos efectos secundarios desencadenaran una cascada de procesos que acabaron siendo fatales, como hemos presentado. Sin embargo, y a pesar de esto, en el escenario clínico actual y tras la revisión bibliográfica realizada, su uso permanece claramente justificado siempre y cuando se sigan las indicaciones aprobadas7. Conociendo la efectividad del uso de aflibercept en un tipo específico de pacientes y su elevada toxicidad10, ya que presenta el 46% de infección, el 4.2% de hemorragia grave y el 1.9% de perforación gastrointestinal, es fundamental optimizar su uso, encaminando los estudios a descubrir biomarcadores predictivos y evitándolo en pacientes con riesgo de sangrado conocido con úlcera gastroduodenal, hemoptisis, etc., y manejando a tiempo las perforaciones intestinales con el fin de minimizar la morbimortalidad11.
ConclusionesEstudios futuros deberán encaminarse a descubrir biomarcadores predictivos que permitan optimizar su uso en pacientes con tumores sólidos para disminuir la incidencia de efectos adversos fatales como los descritos en el caso presentado.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.