Los quistes aracnoideos son divertículos de duramadre con contenido similar al líquido cefalorraquídeo. El 1% se presenta en la médula espinal; se localizan típicamente en la parte posterior de la médula espinal torácica y son una causa rara de compresión medular.
Caso clínicoSe presenta el caso de un paciente masculino de 15 años, previamente sano, quien acude a valoración por paraparesia espástica de 20 meses de evolución, la cual comienza después de un evento anestésico por osteosíntesis de tobillo. Presenta disminución de la sensibilidad y fuerza de miembros pélvicos, que se incrementa gradualmente hasta presentar anestesia a nivel de dermatomos T12 a L4, hipoestesia L5 y S1 bilateral y fuerza 4+/5 bilateral, en la raíz L2 y 2+/5 en L3, L4, L5, S1, hiperreflexia, Babinski y clonus, sin alteraciones en los reflejos sacros. Mediante resonancia magnética se diagnostica quiste aracnoideo extradural de T6 a T9. Se realizó laminotomía T6 a T10, resección del quiste, cierre del defecto dural y laminoplastia. En el seguimiento a 12 meses el paciente presenta recuperación de la sensibilidad, mejoría de la fuerza muscular hasta 4+/5 en L2 a S1 y normorreflexia.
ConclusionesDespués de la anestesia espinal se produjeron cambios en la presión del líquido cefalorraquídeo y expansión del quiste, lo que desencadenó el déficit neurológico, haciendo evidente su presencia. A pesar del tiempo que se mantuvo la compresión, el paciente presentó una adecuada evolución clínica.
Arachnoid cysts are dural diverticula with liquid content similar to cerebrospinal fluid, with 1% occurring in the spinal cord. They locate mainly in the dorsal region of the thoracic spine, and are unusual causes of spinal cord compression.
Clinical caseThe case is presented of a previously healthy 15-year-old boy, with a 20-month history of spastic paraparesis that started apparently after epidural block for ankle osteosynthesis. There was decreased sensitivity and strength of the pelvic limbs and gradually presented with anaesthesia from T12 to L4 dermatomes, L5 and S1 bilateral hypoaesthesia and 4+/5 bilateral strength, in the L2 root and 2+/5 in L3, L4, L5, S1, hyperreflexia, Babinski and clonus, but with no alteration in the sacral reflexes. In the magnetic resonance it was diagnosed as an extradural arachnoid cyst from T6 to T9. The patient underwent a T6 to T10 laminotomy, cyst resection, dural defect suture, and laminoplasty. One year after surgery, the patient had recovered sensitivity, improvement of muscle strength up to 4+/5 in L2 to S1, and normal reflexes.
ConclusionsAfter the anaesthetic procedure, increased pressure and volume changes within the cyst could cause compression of the spinal cord, leading to symptoms. Despite being a long-term compression, the patient showed noticeable improvement.
Los quistes aracnoideos corresponden al 1% de los tumores espinales y se definen como un divertículo de la duramadre, la aracnoides o de la vaina de una raíz nerviosa que resultan en la acumulación de líquido similar al cefalorraquídeo (LCR) en el espacio extradural o intradural1–5. Se encuentran dorsales a la médula espinal y existen reportes en posición posterolateral y anterior2,6,7. El conducto raquídeo a nivel torácico es relativamente pequeño en su diámetro, por lo que los quistes presentan sintomatología con mayor frecuencia7–9.
Se presenta el caso de un paciente adolescente, deportista, anteriormente asintomático, quien cursó con déficit neurológico progresivo en extremidades pélvicas, posterior a la administración de anestesia epidural para osteosíntesis de tobillo derecho.
Caso clínicoPaciente masculino de 15 años de edad que fue atendido para estudio de paraparesia espástica de 20 meses de evolución. En el interrogatorio refiere desarrollo psicomotriz normal, previamente sano. Hace 20 meses, el paciente presentó fractura de tobillo derecho posterior a un trauma directo, que ameritó manejo quirúrgico con anestesia epidural lumbar, en un hospital del norte del país. El paciente evolucionó con disminución de la fuerza y sensibilidad de las extremidades pélvicas, con alteración sensitiva en el tronco, atribuidas por los médicos tratantes a la lesión de tobillo. Es revalorado 40 días después de la cirugía por un médico, quien atribuye los síntomas a la poca cooperación del paciente, e indica rehabilitación. Durante estos meses, la limitación funcional lo alejó de las actividades diarias tanto escolares como deportivas. Niega alteraciones en su hábito miccional y de evacuaciones.
La fuerza disminuyó progresivamente, dificultando la marcha y la bipedestación, por lo que acude a valoración a nuestro instituto. En la exploración física realiza marcha independiente auxiliada de andadera con ruedas anteriores. Contacto inicial en antepié bilateral con apoyo en barra medial bilateral, fases de despegue e impulso deficientes, patrón en steppage, antepulsión de tronco, semiflexión de caderas, recurvatum de ambas piernas, amplia base de sustentación.
Presentaba hipoestesia exteroceptiva en todas sus modalidades en la raíz de T11, anestesia de T12 a L4 e hipoestesia L5 y S1 bilateral. La fuerza se encontró con afectación bilateral con 4+/5 en la escala de Lucille-Daniels en la raíz L2 y 2+/5 en L3, L4, L5 y S1. Se evocó hiperreflexia patelar con clonus Aquíleo no agotable y respuesta plantar de Babinski bilateral. Presenta contracción anal voluntaria débil, con reflejo anal cutáneo, anal externo, bulbocavernoso y bulboanal presentes.
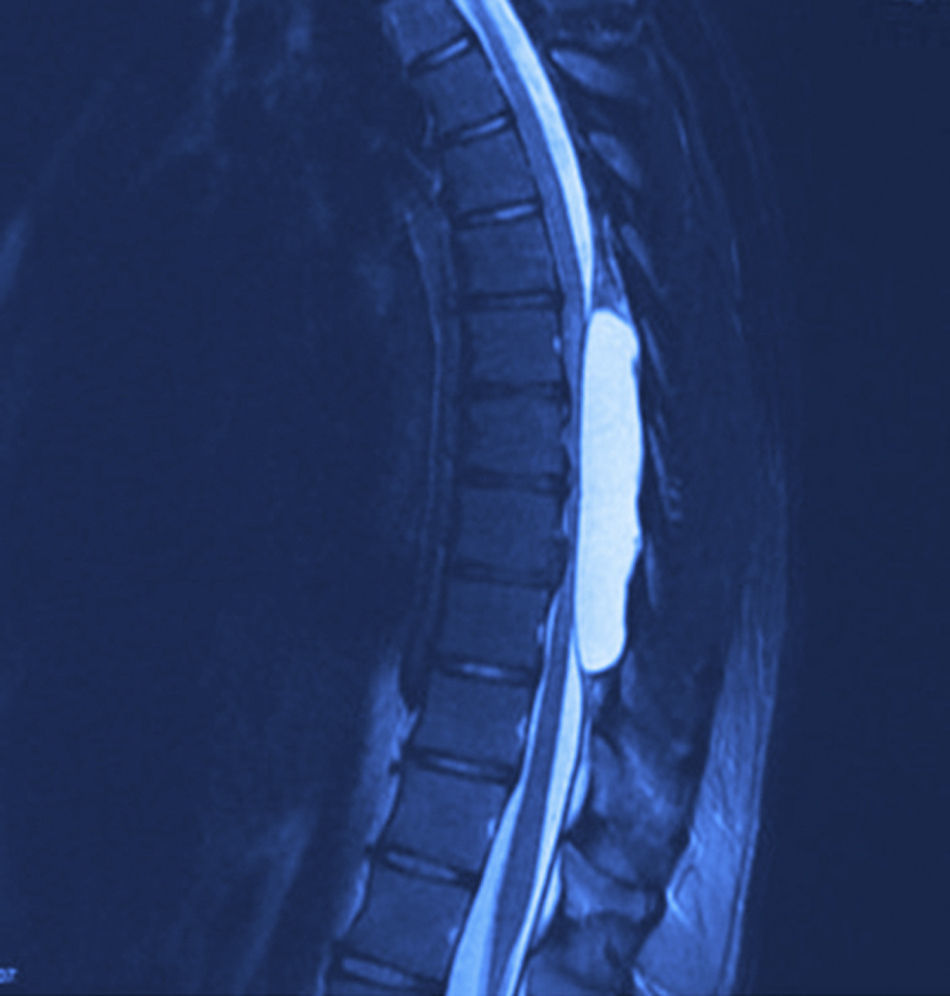
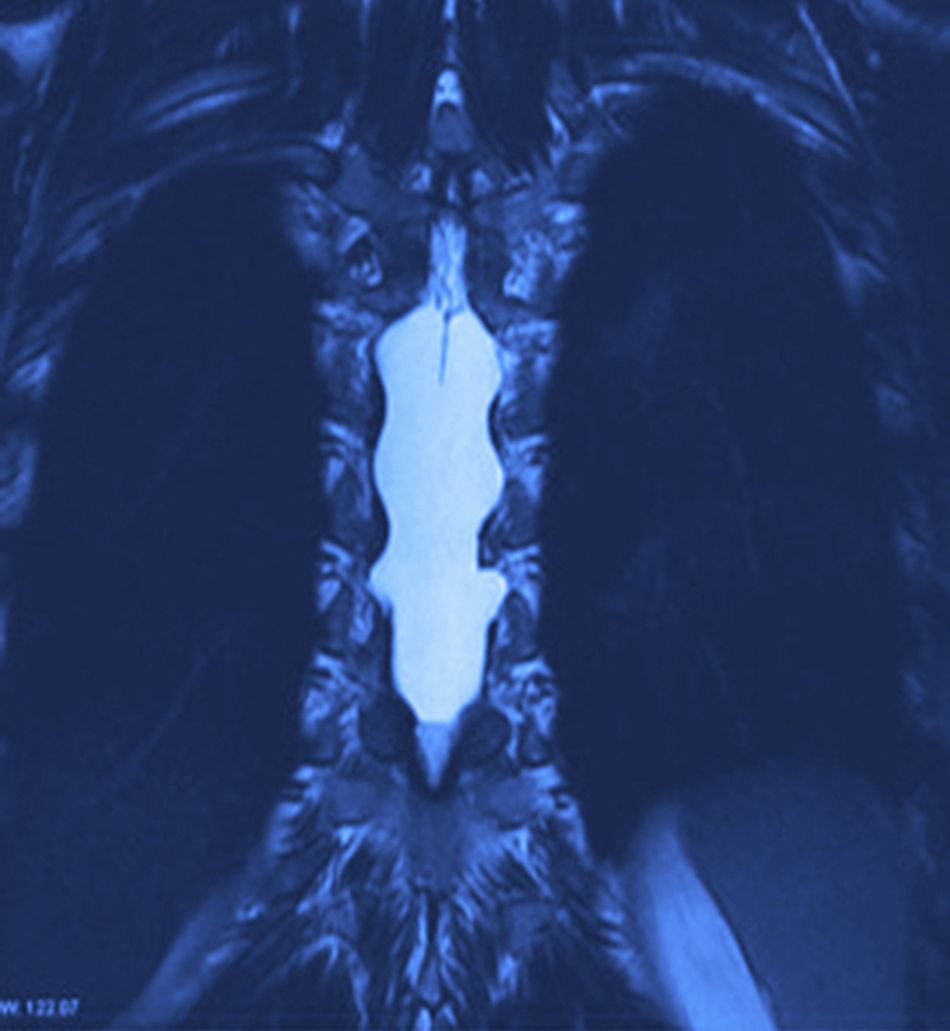
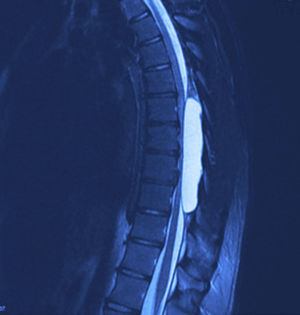
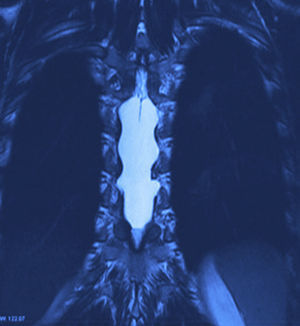
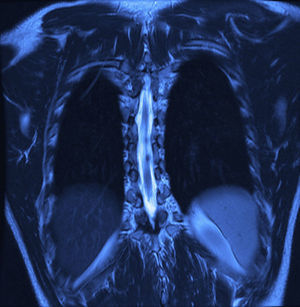
Se realizaron radiografías, donde se evidencia remodelación ósea en el conducto raquídeo torácico con hiperdensidad homogénea de T6 a T9. La resonancia magnética nuclear (figs. 1 y 2) mostró un conducto raquídeo amplio, con moldeamiento de la tabla interna de los arcos posteriores por proceso ocupativo extramedular, fuera del espacio subaracnoideo, con aparente disección de la dura y la aracnoides, en forma alargada, con diámetro de 95 mm que se extiende de T6 a T9; la intensidad de la señal en las diferentes secuencias corresponde a líquido, sin poder especificar qué tipo ya que la resonancia no puede detectarlo, sin componente sólido; la médula espinal se encuentra desplazada y comprimida en sentido dorsoventral, con ocupación completa del conducto raquídeo y aumento en la intensidad de la señal medular a estos niveles. Aumentan también las dimensiones de los neuroforámenes de forma discreta.
Se realizó laminotomía T6 a T10 y se exploró el conducto raquídeo, encontrando una lesión quística a tensión con pedículo en la raíz dorsal derecha de T8. Se realizó resección con cierre del defecto dural y laminoplastia fijando el colgajo óseo con sutura no absorbible. El líquido aspirado del quiste se observó de características similares al LCR. El estudio de la lesión reportó hallazgos consistentes con quiste aracnoideo de 4×2×1 cm, de color blanco grisáceo y superficie lisa.
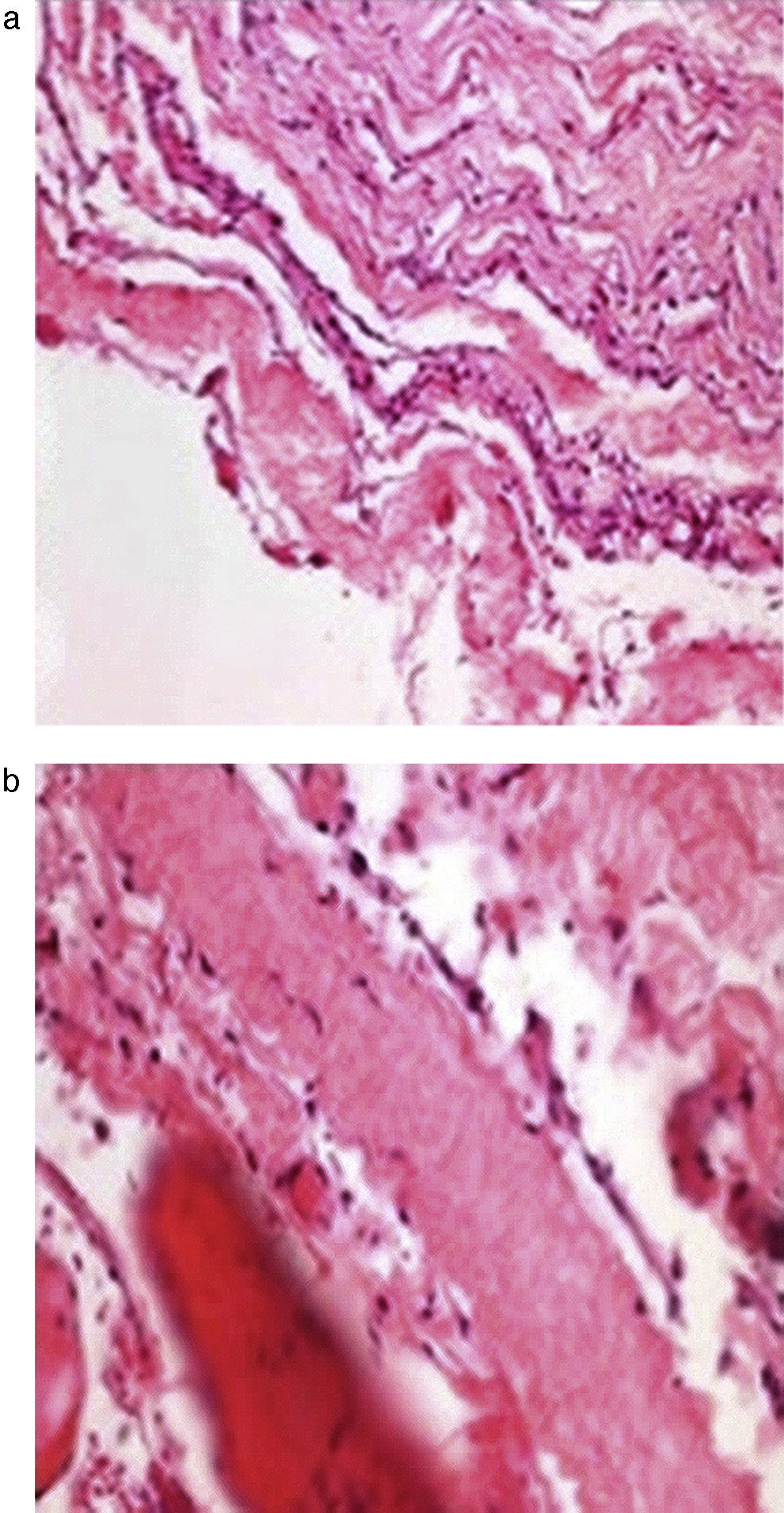
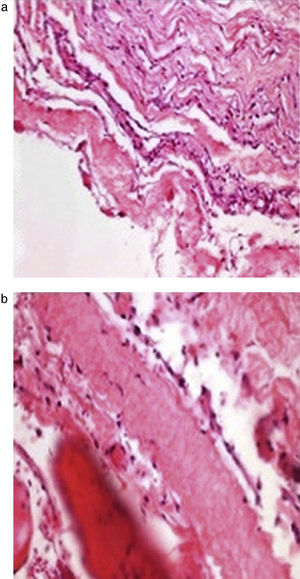
En el estudio histopatológico (fig. 3a y b) se aprecian las paredes del quiste compuestas de tejido fibroconjuntivo, con células de aspecto meningotelial, fibras de colágeno, tejido fibroadiposo y músculo estriado esquelético.
Un mes después se inició rehabilitación intensiva, estableciendo como objetivos primordiales el mejorar la fuerza muscular, disminuir las contracturas, mejorar el equilibrio y reeducar la marcha.
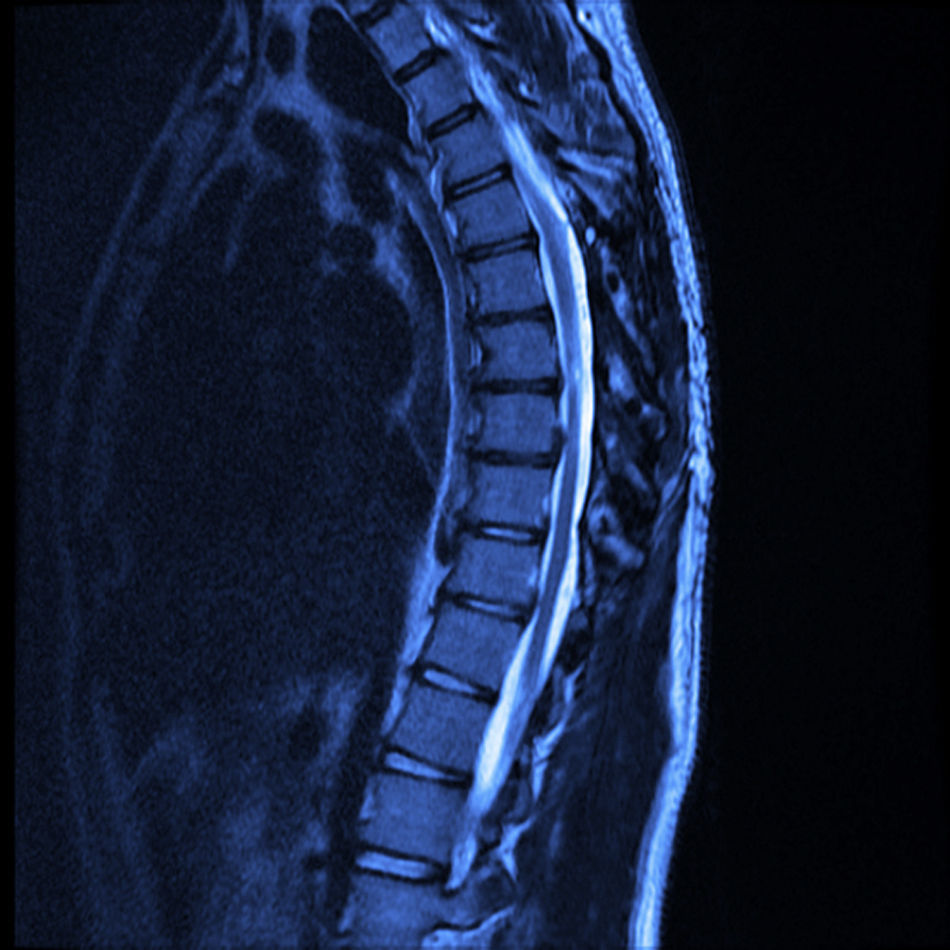
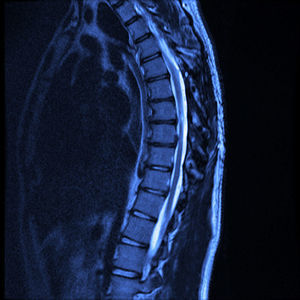
A 12 meses de la cirugía el paciente se encuentra con marcha independiente, marcha punta-talón sin dificultad, sensibilidad superficial y discriminación dolor-tacto romo conservada desde T6 hacia distal, fuerza muscular con 4+/5 en la escala de Lucille Daniels en la raíz L2 a S1, normorreflexia patelar e hiperreflexia Aquílea bilateral. Sin recurrencia de la lesión al año, según resonancia magnética (figs. 4 y 5).
El paciente aún presenta un déficit motor en ambos miembros pélvicos que le condiciona una limitación leve para los traslados; sin embargo, ha superado sus desventajas con respecto a sus congéneres de la misma edad para la realización de su rol social, familiar y escolar, quedando pendiente la reincorporación a sus actividades recreativas y deportivas.
DiscusiónLos quistes aracnoideos son tumores benignos que se desarrollan en el eje cerebroespinal de la membrana aracnoidea10. Históricamente el primer quiste aracnoideo fue detectado por Schlesinger en 1893, y el primer reporte fue de Spiller en 190311. Son más comunes en hombres, en la segunda década de la vida12,13. Se presentan frecuentemente en la región torácica media y baja (65%), en la columna lumbar y lumbosacra (13%), toracolumbar (12%), sacra (7%) y cervical (3%)13.
Los quistes extradurales resultan de una protrusión de la aracnoides que se comunica con el espacio subaracnoideo a través de un defecto de la duramadre10, son los menos frecuentes y pueden ser simples o múltiples14,15. Nabors et al.16 clasifican los quistes aracnoideos como: Tipo I, quiste meníngeo espinal extradural sin involucramiento de fibras de la raíz nerviosa; Tipo IA, quiste meníngeo extradural; Tipo IB, meningocele sacro; Tipo II, quiste meníngeo espinal extradural con involucramiento de fibras de la raíz nerviosa; Tipo III, quiste meníngeo intradural.
Se han propuesto 5 mecanismos de formación:
- 1.
De causas congénitas, asociadas a defectos del tubo neural y siringomielia. Lake et al.17 postularon que los quistes se originan de trabéculas aracnoideas que se disecan dorsalmente en el espacio subaracnoideo de la línea media a lo largo del canal espinal o cerca de la raíz nerviosa. Perret et al.18 evidenciaron que los quistes intradurales son resultado de la ampliación del septum posticum, y las pulsaciones de LCR que dilatan las áreas débiles de la aracnoides formando quistes dorsales; sin embargo, ninguna de estas teorías explica la formación de los quistes ventrales. Estudios en cadáveres confirman que los septos dorsolaterales son distintos a nivel torácico porque las raíces dorsales descienden más oblicuas, provocando que al fusionarse con los septos dorsolaterales en la línea media se forme una pared transversa de aracnoides en el espacio subaracnoideo, pudiendo ser este el origen de los quistes aracnoideos19. Otra teoría demuestra que durante el periodo embrionario se forma una herniación de la membrana aracnoidea a través de un defecto en la duramadre, secundario a disrafismo medular15.
- 2.
Secundarios a un proceso inflamatorio causado por virus, espiroquetas o bacterias.
- 3.
Aracnoiditis secundaria a una hemorragia subaracnoidea.
- 4.
Lesiones traumáticas a la columna, punciones lumbares. Lee et al.20 muestran que las fuerzas tensiles entre el saco tecal móvil y las raíces nerviosas fijas producen lesiones en la duramadre; si existe un problema estructural previo en el saco tecal, el movimiento o trauma hará que la lesión de la duramadre incremente el volumen y la presión, provocando la formación del quiste.
- 5.
De etiología idiopática.
También se han descrito 3 teorías sobre el llenado del quiste.
- 1.
Por secreción activa de líquido por células de la pared del quiste. Berle et al.21 postulan que el mecanismo de llenado es por un transporte selectivo o activo o por la secreción de las células de revestimiento del quiste. En su estudio, encontraron líquido isotónico con baja concentración de proteínas dentro del quiste en comparación con la del LCR, lo que podría implicar un transporte activo o selectivo del fluido sobre las membranas del quiste. El nivel de fosfato en el LCR es menor que en sangre periférica debido a la actividad de transportadores en el epitelio del plexo coroides. Cantidades mayores de fosfato en el líquido del quiste implican que el epitelio de este presenta mecanismos de transporte similares a los del plexo coroideo22. Esto es consistente con descubrimientos de estructuras enzimáticas ultracitoquímicas y morfológicas en la pared del quiste que son capaces de secretar fluido. Aarhus et al.23 publicaron que en el quiste, el cotransportador NKCC1 (una isoforma de la proteína transportadora de membrana que mueve conjuntamente un sodio, un potasio y 2 cloros) es regulado a la alta y se observa una reducción de complejos proteínicos. Se ha reportado también que los cotransportadores como GLUT1, MCT1 y NKCC1 tienen la habilidad de transportar agua a lo largo de sus respectivos sustratos, a pesar del gradiente osmótico21–23.
- 2.
Aumento de la presión oncótica. Esta teoría propone que durante el periodo embrionario existe una proliferación y distribución patológica de las células trabeculares de aracnoides, que posteriormente se degeneran e incrementan la presión oncótica dentro del quiste15.
- 3.
Mecanismo de válvula. Se postula que existe una comunicación anatómica por una válvula de un sentido entre el espacio subaracnoideo y el quiste18. Puede sellarse en una etapa posterior de su desarrollo, constituyendo el quiste aracnoideo no comunicante24. Las extensiones paravertebrales se producen por este mecanismo, causando expansión a través de los forámenes y áreas de menor resistencia del ligamento amarillo24.
En el examen histológico, las células de revestimiento presentan: tejido fibrocartilaginoso, células meningoepiteliales, células inflamatorias y, en algunas ocasiones tejido aracnoideo25.
Presentación clínica, diagnóstico y tratamientoLos síntomas que presentan son fluctuantes y son consecuencia de cambios en la presión hidrostática del LCR, que a su vez, originan cambios de presión dentro del quiste, por lo que se exacerban con cambios posturales, ejercicio físico y/o con maniobras de Valsalva15,25. Estos síntomas pueden ser: dolor de espalda, cambios sensoriales, disfunción urinaria y debilidad7,17,19. Pueden presentar mielopatía, compresión radicular, síntomas de cauda equina, parálisis flácida o espástica14,16,24.
En las radiografías se observan signos indirectos del efecto de masa, tal como: un canal espinal aumentado, erosiones óseas, adelgazamiento de los pedículos, forámenes ensanchados o aumento de la distancia interpedicular26.
La resonancia magnética es el estándar de oro para el diagnóstico. Los quistes se observan isointensos al LCR, hipointensos en T1 e hiperintensos en T2, y no refuerzan con contraste. Así mismo, se pueden observar los grados de atrofia y la extensión de la mielomalacia19,24.
Los pacientes con dolor y déficit neurológico son candidatos a cirugía27. Existen diversas técnicas; sin embargo, no existe un consenso de manejo quirúrgico14. La laminoplastia ofrece la exposición requerida y descompresión del canal espinal, mientras que mantiene la estabilidad de la columna y la integridad de los elementos posteriores28. La resección quirúrgica completa6, seguida de obliteración del pedículo comunicante y reparación del defecto dural, es en la mayoría de los casos, curativa y presenta mejoría de la función neurológica12. Lee et al.20 reportaron una menor recurrencia en quienes se reparó el defecto dural; otras técnicas de manejo quirúrgico son la marsupialización o fenestración y la reparación del defecto dural18,29. En reportes de laminoplastia, el 2% de los pacientes con reparación de la pared dural presentaron recurrencia, mientras que el 66.7% de aquellos en que no se reparó el defecto presentaron recurrencia20. Para los que se realizó resección total del quiste o fenestración fue del 8.3 y 3.6%, respectivamente29. Finalmente, el drenaje del contenido del quiste dentro del espacio subaracnoideo se ha descrito con buenos resultados temporales13,29.
La incidencia de deformidad después de laminectomía es de 33-100%, por lo que se prefiere la laminoplastia29. Algunos factores que conducen a la deformidad postoperatoria son: edad menor de 3 años, deformidad preexistente, descompresión que abarca la columna cervical o la región cervicotorácica, retirar 3 o más láminas y facectomía intensiva.
La cirugía presenta resultados desfavorables en pacientes de edad avanzada, con larga duración de paresias y adelgazamiento de la médula espinal por la presencia del quiste, que provoca una insuficiencia vascular permanente por la compresión prolongada6,25. La recuperación neurológica depende del tamaño del quiste y del grado y la duración de la compresión de la médula espinal, por lo que es de vital importancia un alto índice de sospecha y el tratamiento adecuado y a tiempo27.
Existe un reporte similar al nuestro, de una paciente femenina que cursó con lumbalgia y fiebre un día después de un bloqueo epidural a nivel L4-L5 que se le colocó para un procedimiento de cesárea. La paciente tenía antecedente de lumbalgia crónica y obesidad mórbida. Se diagnosticó un quiste aracnoideo torácico de 8 mm sin presencia de edema ni compresión, y tampoco presentó deterioro neurológico; se mantuvo en observación con manejo conservador30.
ConclusionesLos quistes aracnoideos son entidades poco comunes que se diagnostican incidentalmente. Su etiología es incierta, y aunque la mayoría cursan asintomáticos, en aquellos en quienes generan compresión medular y radicular, el impacto puede ser importante en términos biológicos, psicológicos, sociales y económicos.
En el caso de nuestro paciente podemos dilucidar que se trató de un quiste de origen congénito, puesto que no contaba con antecedente traumático, quirúrgico o infeccioso, ni con sintomatología previa de origen lumbar o torácico. Proponemos que después de la anestesia espinal se causaron cambios en la presión del LCR y expansión del quiste, lo que desencadenó el déficit neurológico, haciendo evidente su presencia. A pesar del tiempo que se mantuvo la compresión, el paciente presentó una adecuada evolución clínica, probablemente por tratarse de una persona joven previamente sana.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.