La técnica del cruce duodenal (CD) es considerada una cirugía compleja y con serias complicaciones metabólicas por su carácter malabsortivo, lo que hace que su uso no se haya extendido entre los cirujanos bariátricos. A pesar de ello la consideramos una técnica adecuada en superobesos.
Pacientes y métodosEstudio prospectivo de 110 pacientes con obesidad mórbida intervenidos consecutivamente con la técnica del CD y seguidos durante un período mínimo de cuatro años tras la cirugía. Hemos evaluado la pérdida de peso, evolución de las comorbilidades y las complicaciones metabólicas.
ResultadosLa pérdida del exceso de peso fue superior al 50% en el 75% de los pacientes después de 12 meses de seguimiento. Un total de 68 pacientes (75,5%) experimentaron completa corrección de las comorbilidades que presentaban. Las alteraciones metabólicas más frecuentes fueron el déficit de hierro y la elevación de la PTH.
ConclusionesEl CD es una técnica segura y eficaz para el tratamiento de la obesidad mórbida, con buenos resultados ponderales, elevado porcentaje de remisión de las comorbilidades, morbimortalidad similar a otras técnicas y con alteraciones nutricionales corregibles y por tanto asumibles.
The duodenal switch (DS) technique is considered to be complex surgery with a series of metabolic complications due to its malabsorptive character. For these reasons, it has not been extensively used by bariatric surgeons. Despite this, we consider it to be a suitable technique for the grossly obese.
Patients and methodsA retrospective study was performed on 110 patients with morbid obesity operated on using the DS technique and who were followed up for a minimum period of four years after surgery. We evaluated the weight loss, the outcomes of the comorbidities, and the metabolic complications.
ResultsThe loss of excess weight was greater than 50% in 75% of the patients after 12 months follow up. The comorbidities suffered by 68 patients (75.5%) were completely resolved. The most frequent metabolic complications were iron (Fe) deficiency and an increased parathyroid hormone (PTH).
ConclusionsDS is a safe and effective technique for the treatment of morbid obesity, with good weight loss results, a high percentage of remission of the comorbidities, a similar morbidity and mortality to other techniques, and with correctable nutritional changes, and thus acceptable.
El cruce duodenal (CD) está aceptado por algunos autores1–3 como técnica de elección en pacientes superobesos, aunque mantiene escasa implantación entre los cirujanos bariátricos por su dificultad técnica y temor a graves complicaciones nutricionales, sin embargo, la estricta vigilancia de las mismas4 permite su control sin excesivo riesgo para el paciente.
Presentamos los resultados a largo plazo de un estudio prospectivo en 110 pacientes intervenidos mediante esta técnica.
Pacientes y métodoDe enero de 2001 a diciembre de 2006, hemos intervenido quirúrgicamente de manera consecutiva a 118 obesos mórbidos con la técnica del CD abierto.
Medimos la longitud de todo el intestino delgado y lo seccionamos a 250cm de la válvula ileocecal (AA=50%), ascendiendo la porción distal transmesocólicamente para anastomosarla con el duodeno a 2cm del píloro. A 80cm de la válvula ileocecal efectuamos la anastomosis término-lateral del asa biliopancreática (ABP=50%) con el asa alimentaria formando el asa común (AC=16%).
Seccionamos el estómago con endograpadora, reforzando la línea de grapado con sutura sero-serosa. Calibramos el remanente gástrico mediante una sonda de Faucher de 40 frenchs, quedando un estómago residual de 150ml. Realizamos colecistectomía sistemáticamente.
A los pacientes se les informó de que deberían seguir controles y tratamiento de por vida para algún posible déficit y/o complicación metabólica.
Tras excluir a ocho pacientes (tres perdidos, cuatro por no seguir los controles y un éxitus) la serie la componen 110 (94 mujeres y 16 hombres), de los que 16 se intervinieron en el año 2001, 17 en el 2002, 13 en el 2003, 25 en el 2004, 17 en el 2005 y 22 en el 2006, por lo que 16 han sido seguidos durante 9 años, 33 durante 8, 46 durante 7, 71 durante 6, 88 durante 5 y todos durante 4.
La media de edad fue 42,6 años (22-69) y la del IMC 49,7kg/m2 (38-69). Presentaron comorbilidades mayores 90 pacientes (82%). La mayoría (n=98) fueron ASA 3.
Los controles postoperatorios se han realizado a los 3, 6, 12, 18 meses y posteriormente anuales.
Realizamos profilaxis del déficit de hierro y Ca durante el primer año postoperatorio con sulfato ferroso y carbonato cálcico más vitamina D. Posteriormente se administran según hallazgos en los controles. Valoramos la administración de otros suplementos (complejos vitamínicos) para el resto de déficits según los presenten a lo largo del seguimiento.
Prospectivamente se ha evaluado la pérdida de peso, evolución de las comorbilidades mayores (diabetes mellitus tipo II, HTA, dislipemia, SAOS y artropatía) tipificándolas como «agravada», «mejorada» y «corregida» siguiendo la subescala BAROS5 y los déficits malabsortivo-nutricionales, mediante la valoración de distintos parámetros sanguíneos.
Presentamos un estudio descriptivo de los parámetros ponderales y analíticos más influenciados por este tipo de cirugía, comparado los resultados pre- y postoperatorios. Hemos considerado que existe significación estadística a un valor de p<0,01.
ResultadosFalleció una paciente con síndrome de Kartagener por insuficiencia respiratoria, hubo 9 infecciones de herida, un neumotórax iatrogénico, un derrame pleural y una crisis hipertensiva. No hemos tenido ninguna fuga de la línea de grapado.
A lo largo del estudio 21 pacientes se han intervenido por hernia incisional, el 3,6% en el primer año. Cambiamos de realizar incisión media supraumbilical a subcostal bilateral, pasando de un 42% de eventraciones a un 19%, que aparecen con el tiempo y la pérdida de peso.
La mayoría de pacientes presentaron un ritmo defecatorio normal y 9 presentaron diarrea (media de 7 deposiciones/día). Persisten dos casos con media de 4 deposiciones/día.
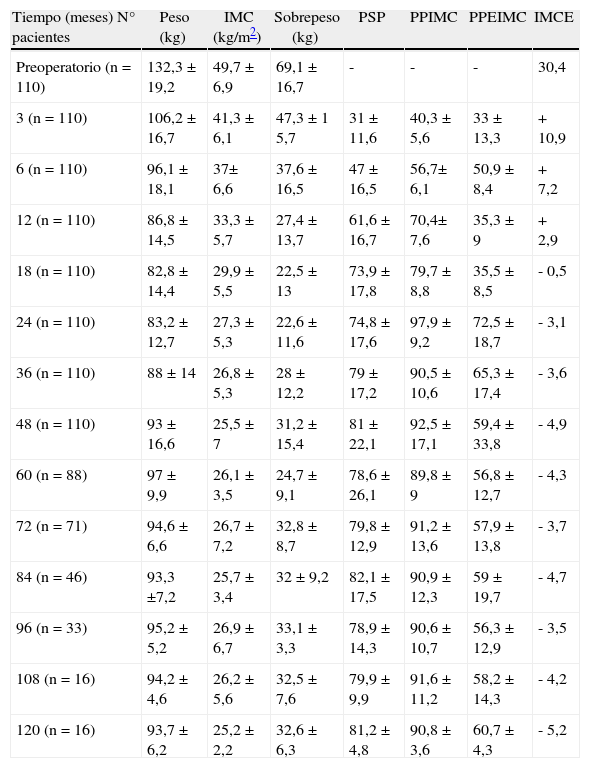
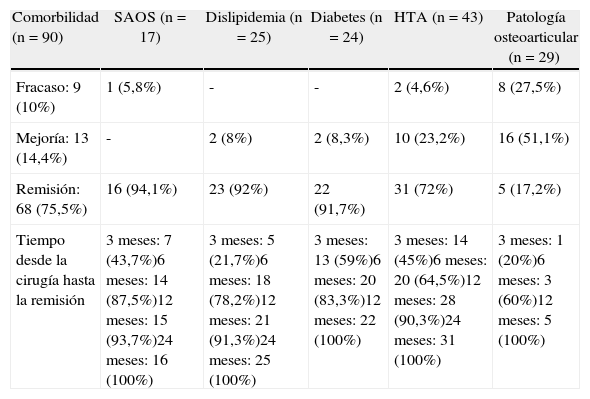
En la tabla 1 se muestra la reducción evidente y progresiva del peso en el seguimiento y en la tabla 2 la evolución de las comorbilidades.
Evolución ponderal de los pacientes de la serie a lo largo del periodo estudiado
| Tiempo (meses) N° pacientes | Peso (kg) | IMC (kg/m2) | Sobrepeso (kg) | PSP | PPIMC | PPEIMC | IMCE |
| Preoperatorio (n=110) | 132,3±19,2 | 49,7±6,9 | 69,1±16,7 | - | - | - | 30,4 |
| 3 (n=110) | 106,2±16,7 | 41,3±6,1 | 47,3±1 5,7 | 31±11,6 | 40,3±5,6 | 33±13,3 | + 10,9 |
| 6 (n=110) | 96,1±18,1 | 37± 6,6 | 37,6±16,5 | 47±16,5 | 56,7± 6,1 | 50,9±8,4 | + 7,2 |
| 12 (n=110) | 86,8±14,5 | 33,3±5,7 | 27,4±13,7 | 61,6±16,7 | 70,4± 7,6 | 35,3±9 | + 2,9 |
| 18 (n=110) | 82,8±14,4 | 29,9±5,5 | 22,5±13 | 73,9±17,8 | 79,7±8,8 | 35,5±8,5 | - 0,5 |
| 24 (n=110) | 83,2±12,7 | 27,3±5,3 | 22,6±11,6 | 74,8±17,6 | 97,9±9,2 | 72,5±18,7 | - 3,1 |
| 36 (n=110) | 88±14 | 26,8±5,3 | 28±12,2 | 79±17,2 | 90,5±10,6 | 65,3±17,4 | - 3,6 |
| 48 (n=110) | 93±16,6 | 25,5±7 | 31,2±15,4 | 81±22,1 | 92,5±17,1 | 59,4±33,8 | - 4,9 |
| 60 (n=88) | 97±9,9 | 26,1±3,5 | 24,7±9,1 | 78,6±26,1 | 89,8±9 | 56,8±12,7 | - 4,3 |
| 72 (n=71) | 94,6±6,6 | 26,7±7,2 | 32,8±8,7 | 79,8±12,9 | 91,2±13,6 | 57,9±13,8 | - 3,7 |
| 84 (n=46) | 93,3 ±7,2 | 25,7±3,4 | 32±9,2 | 82,1±17,5 | 90,9±12,3 | 59±19,7 | - 4,7 |
| 96 (n=33) | 95,2±5,2 | 26,9±6,7 | 33,1±3,3 | 78,9±14,3 | 90,6±10,7 | 56,3±12,9 | - 3,5 |
| 108 (n=16) | 94,2±4,6 | 26,2±5,6 | 32,5±7,6 | 79,9±9,9 | 91,6±11,2 | 58,2±14,3 | - 4,2 |
| 120 (n=16) | 93,7±6,2 | 25,2±2,2 | 32,6±6,3 | 81,2±4,8 | 90,8±3,6 | 60,7±4,3 | - 5,2 |
IMC: índice de masa corporal; IMCE: índice de masa corporal esperado; PPEIMC: porcentaje perdido de exceso de IMC; PPIMC: porcentaje perdido de IMC; PSP: porcentaje de sobrepeso perdido.
Comorbilidades mayores asociadas a la obesidad mórbida en los pacientes de la serie y evolución de las mismas
| Comorbilidad (n=90) | SAOS (n=17) | Dislipidemia (n=25) | Diabetes (n=24) | HTA (n=43) | Patología osteoarticular (n=29) |
| Fracaso: 9 (10%) | 1 (5,8%) | - | - | 2 (4,6%) | 8 (27,5%) |
| Mejoría: 13 (14,4%) | - | 2 (8%) | 2 (8,3%) | 10 (23,2%) | 16 (51,1%) |
| Remisión: 68 (75,5%) | 16 (94,1%) | 23 (92%) | 22 (91,7%) | 31 (72%) | 5 (17,2%) |
| Tiempo desde la cirugía hasta la remisión | 3 meses: 7 (43,7%)6 meses: 14 (87,5%)12 meses: 15 (93,7%)24 meses: 16 (100%) | 3 meses: 5 (21,7%)6 meses: 18 (78,2%)12 meses: 21 (91,3%)24 meses: 25 (100%) | 3 meses: 13 (59%)6 meses: 20 (83,3%)12 meses: 22 (100%) | 3 meses: 14 (45%)6 meses: 20 (64,5%)12 meses: 28 (90,3%)24 meses: 31 (100%) | 3 meses: 1 (20%)6 meses: 3 (60%)12 meses: 5 (100%) |
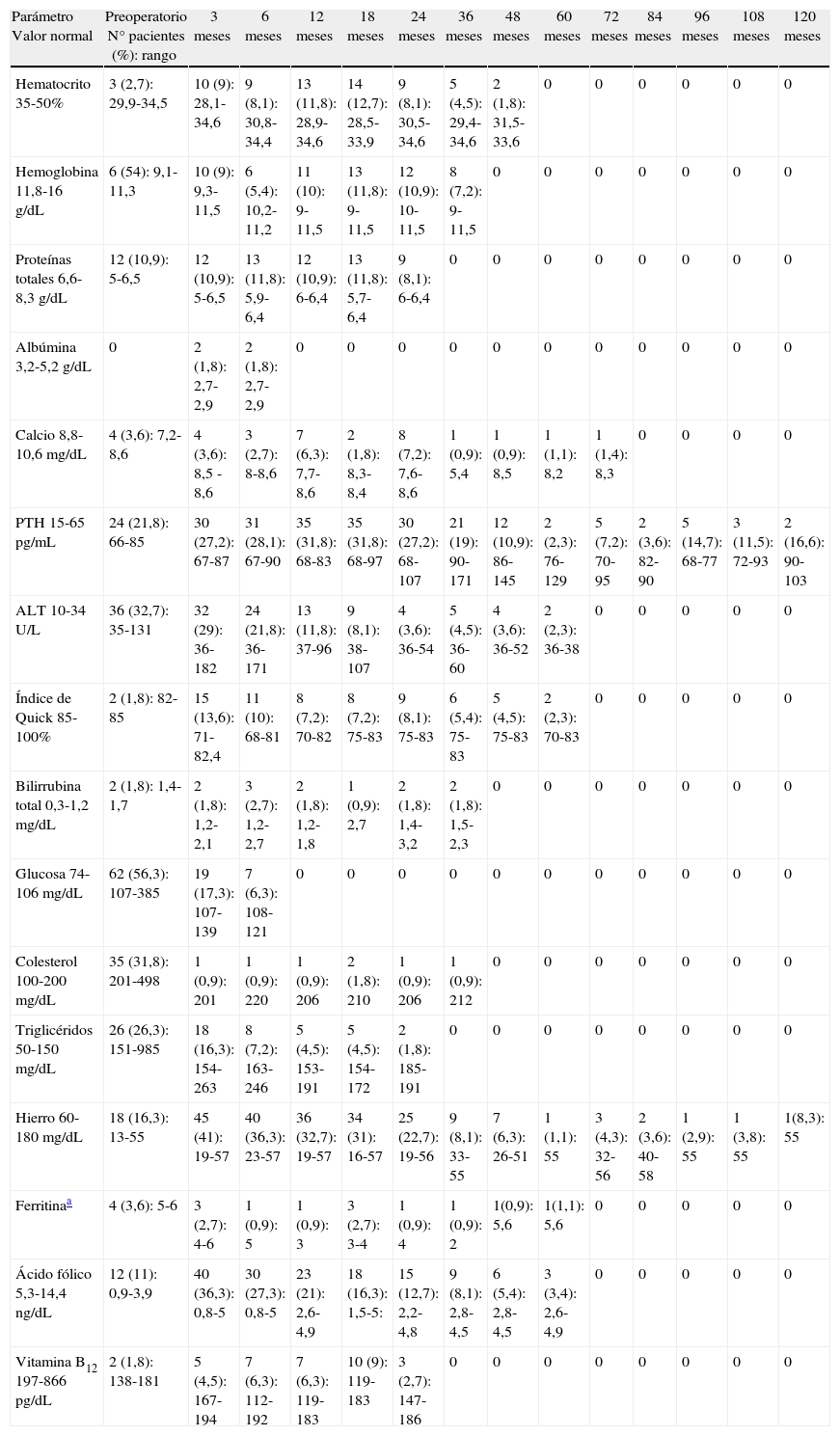
- Hematocrito y hemoglobina: el número de pacientes con hematocrito inferior al normal osciló entre catorce a los 18 meses y dos al cuarto año. A los cinco años no hay ningún paciente con valores inferiores al 35%.
Evolución de los parámetros sanguíneos
| Parámetro Valor normal | Preoperatorio N° pacientes (%): rango | 3 meses | 6 meses | 12 meses | 18 meses | 24 meses | 36 meses | 48 meses | 60 meses | 72 meses | 84 meses | 96 meses | 108 meses | 120 meses |
| Hematocrito 35-50% | 3 (2,7): 29,9-34,5 | 10 (9): 28,1-34,6 | 9 (8,1): 30,8-34,4 | 13 (11,8): 28,9-34,6 | 14 (12,7): 28,5-33,9 | 9 (8,1): 30,5-34,6 | 5 (4,5): 29,4-34,6 | 2 (1,8): 31,5-33,6 | 0 | 0 | 0 | 0 | 0 | 0 |
| Hemoglobina 11,8-16g/dL | 6 (54): 9,1-11,3 | 10 (9): 9,3-11,5 | 6 (5,4): 10,2-11,2 | 11 (10): 9-11,5 | 13 (11,8): 9-11,5 | 12 (10,9): 10-11,5 | 8 (7,2): 9-11,5 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Proteínas totales 6,6-8,3g/dL | 12 (10,9): 5-6,5 | 12 (10,9): 5-6,5 | 13 (11,8): 5,9-6,4 | 12 (10,9): 6-6,4 | 13 (11,8): 5,7-6,4 | 9 (8,1): 6-6,4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Albúmina 3,2-5,2g/dL | 0 | 2 (1,8): 2,7-2,9 | 2 (1,8): 2,7-2,9 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Calcio 8,8-10,6mg/dL | 4 (3,6): 7,2-8,6 | 4 (3,6): 8,5 -8,6 | 3 (2,7): 8-8,6 | 7 (6,3): 7,7-8,6 | 2 (1,8): 8,3-8,4 | 8 (7,2): 7,6-8,6 | 1 (0,9): 5,4 | 1 (0,9): 8,5 | 1 (1,1): 8,2 | 1 (1,4): 8,3 | 0 | 0 | 0 | 0 |
| PTH 15-65pg/mL | 24 (21,8): 66-85 | 30 (27,2): 67-87 | 31 (28,1): 67-90 | 35 (31,8): 68-83 | 35 (31,8): 68-97 | 30 (27,2): 68-107 | 21 (19): 90-171 | 12 (10,9): 86-145 | 2 (2,3): 76-129 | 5 (7,2): 70-95 | 2 (3,6): 82-90 | 5 (14,7): 68-77 | 3 (11,5): 72-93 | 2 (16,6): 90-103 |
| ALT 10-34 U/L | 36 (32,7): 35-131 | 32 (29): 36-182 | 24 (21,8): 36-171 | 13 (11,8): 37-96 | 9 (8,1): 38-107 | 4 (3,6): 36-54 | 5 (4,5): 36-60 | 4 (3,6): 36-52 | 2 (2,3): 36-38 | 0 | 0 | 0 | 0 | 0 |
| Índice de Quick 85-100% | 2 (1,8): 82-85 | 15 (13,6): 71-82,4 | 11 (10): 68-81 | 8 (7,2): 70-82 | 8 (7,2): 75-83 | 9 (8,1): 75-83 | 6 (5,4): 75-83 | 5 (4,5): 75-83 | 2 (2,3): 70-83 | 0 | 0 | 0 | 0 | 0 |
| Bilirrubina total 0,3-1,2mg/dL | 2 (1,8): 1,4-1,7 | 2 (1,8): 1,2-2,1 | 3 (2,7): 1,2-2,7 | 2 (1,8): 1,2-1,8 | 1 (0,9): 2,7 | 2 (1,8): 1,4-3,2 | 2 (1,8): 1,5-2,3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Glucosa 74-106mg/dL | 62 (56,3): 107-385 | 19 (17,3): 107-139 | 7 (6,3): 108-121 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Colesterol 100-200mg/dL | 35 (31,8): 201-498 | 1 (0,9): 201 | 1 (0,9): 220 | 1 (0,9): 206 | 2 (1,8): 210 | 1 (0,9): 206 | 1 (0,9): 212 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Triglicéridos 50-150mg/dL | 26 (26,3): 151-985 | 18 (16,3): 154-263 | 8 (7,2): 163-246 | 5 (4,5): 153-191 | 5 (4,5): 154-172 | 2 (1,8): 185-191 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Hierro 60-180mg/dL | 18 (16,3): 13-55 | 45 (41): 19-57 | 40 (36,3): 23-57 | 36 (32,7): 19-57 | 34 (31): 16-57 | 25 (22,7): 19-56 | 9 (8,1): 33-55 | 7 (6,3): 26-51 | 1 (1,1): 55 | 3 (4,3): 32-56 | 2 (3,6): 40-58 | 1 (2,9): 55 | 1 (3,8): 55 | 1(8,3): 55 |
| Ferritinaa | 4 (3,6): 5-6 | 3 (2,7): 4-6 | 1 (0,9): 5 | 1 (0,9): 3 | 3 (2,7): 3-4 | 1 (0,9): 4 | 1 (0,9): 2 | 1(0,9): 5,6 | 1(1,1): 5,6 | 0 | 0 | 0 | 0 | 0 |
| Ácido fólico 5,3-14,4ng/dL | 12 (11): 0,9-3,9 | 40 (36,3): 0,8-5 | 30 (27,3): 0,8-5 | 23 (21): 2,6-4,9 | 18 (16,3): 1,5-5: | 15 (12,7): 2,2-4,8 | 9 (8,1): 2,8-4,5 | 6 (5,4): 2,8-4,5 | 3 (3,4): 2,6-4,9 | 0 | 0 | 0 | 0 | 0 |
| Vitamina B12 197-866pg/dL | 2 (1,8): 138-181 | 5 (4,5): 167-194 | 7 (6,3): 112-192 | 7 (6,3): 119-183 | 10 (9): 119-183 | 3 (2,7): 147-186 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
Se muestra el número y porcentaje de pacientes con valores anormales así como los límites de los mismos, en cada unos de los periodos estudiados.
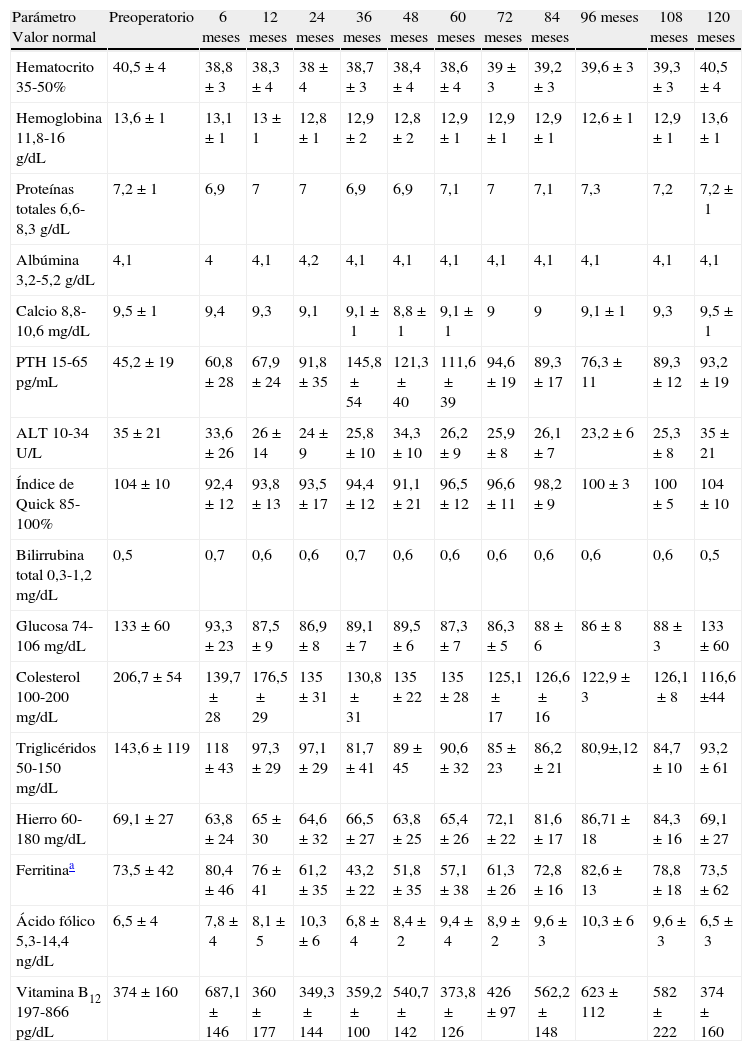
Evolución de los parámetros sanguíneos
| Parámetro Valor normal | Preoperatorio | 6 meses | 12 meses | 24 meses | 36 meses | 48 meses | 60 meses | 72 meses | 84 meses | 96 meses | 108 meses | 120 meses |
| Hematocrito 35-50% | 40,5±4 | 38,8±3 | 38,3±4 | 38±4 | 38,7±3 | 38,4±4 | 38,6±4 | 39±3 | 39,2±3 | 39,6±3 | 39,3±3 | 40,5±4 |
| Hemoglobina 11,8-16g/dL | 13,6±1 | 13,1±1 | 13±1 | 12,8±1 | 12,9±2 | 12,8±2 | 12,9±1 | 12,9±1 | 12,9±1 | 12,6±1 | 12,9±1 | 13,6±1 |
| Proteínas totales 6,6-8,3g/dL | 7,2±1 | 6,9 | 7 | 7 | 6,9 | 6,9 | 7,1 | 7 | 7,1 | 7,3 | 7,2 | 7,2±1 |
| Albúmina 3,2-5,2g/dL | 4,1 | 4 | 4,1 | 4,2 | 4,1 | 4,1 | 4,1 | 4,1 | 4,1 | 4,1 | 4,1 | 4,1 |
| Calcio 8,8-10,6mg/dL | 9,5±1 | 9,4 | 9,3 | 9,1 | 9,1±1 | 8,8±1 | 9,1±1 | 9 | 9 | 9,1±1 | 9,3 | 9,5±1 |
| PTH 15-65pg/mL | 45,2±19 | 60,8±28 | 67,9±24 | 91,8±35 | 145,8±54 | 121,3±40 | 111,6±39 | 94,6±19 | 89,3±17 | 76,3±11 | 89,3±12 | 93,2±19 |
| ALT 10-34 U/L | 35±21 | 33,6±26 | 26±14 | 24±9 | 25,8±10 | 34,3±10 | 26,2±9 | 25,9±8 | 26,1±7 | 23,2±6 | 25,3±8 | 35±21 |
| Índice de Quick 85-100% | 104±10 | 92,4±12 | 93,8±13 | 93,5±17 | 94,4±12 | 91,1±21 | 96,5±12 | 96,6±11 | 98,2±9 | 100±3 | 100±5 | 104±10 |
| Bilirrubina total 0,3-1,2mg/dL | 0,5 | 0,7 | 0,6 | 0,6 | 0,7 | 0,6 | 0,6 | 0,6 | 0,6 | 0,6 | 0,6 | 0,5 |
| Glucosa 74-106mg/dL | 133±60 | 93,3±23 | 87,5±9 | 86,9±8 | 89,1±7 | 89,5±6 | 87,3±7 | 86,3±5 | 88±6 | 86±8 | 88±3 | 133±60 |
| Colesterol 100-200mg/dL | 206,7±54 | 139,7±28 | 176,5±29 | 135±31 | 130,8±31 | 135±22 | 135±28 | 125,1±17 | 126,6±16 | 122,9±3 | 126,1±8 | 116,6 ±44 |
| Triglicéridos 50-150mg/dL | 143,6±119 | 118±43 | 97,3±29 | 97,1±29 | 81,7±41 | 89±45 | 90,6±32 | 85±23 | 86,2±21 | 80,9±,12 | 84,7±10 | 93,2±61 |
| Hierro 60-180mg/dL | 69,1±27 | 63,8±24 | 65±30 | 64,6±32 | 66,5±27 | 63,8±25 | 65,4±26 | 72,1±22 | 81,6±17 | 86,71±18 | 84,3±16 | 69,1±27 |
| Ferritinaa | 73,5±42 | 80,4±46 | 76±41 | 61,2±35 | 43,2±22 | 51,8±35 | 57,1±38 | 61,3±26 | 72,8±16 | 82,6±13 | 78,8±18 | 73,5±62 |
| Ácido fólico 5,3-14,4ng/dL | 6,5±4 | 7,8±4 | 8,1±5 | 10,3±6 | 6,8±4 | 8,4±2 | 9,4±4 | 8,9±2 | 9,6±3 | 10,3±6 | 9,6±3 | 6,5±3 |
| Vitamina B12 197-866 pg/dL | 374±160 | 687,1±146 | 360±177 | 349,3±144 | 359,2±100 | 540,7±142 | 373,8±126 | 426±97 | 562,2±148 | 623±112 | 582±222 | 374±160 |
Se muestra el valor medio de los diferentes parámetros sanguíneos estudiados en cada unos de los periodos de seguimiento postoperatorio.
Un número de pacientes que osciló entre seis (6.° mes) y trece (18.° mes) presentaron cifras de hemoglobina inferiores a los normales. A partir del cuarto año no hay ningún paciente con valores inferiores a los normales.
- Proteínas totales (PT) y albúmina: los valores medios estuvieron siempre entre los normales. A los tres meses 12 pacientes presentaban cifras de PT inferiores a las normales (entre 5 y 6,5g/dL) y ninguno a partir del segundo año.
Al tercer y sexto mes ha habido dos pacientes con cifras de albúmina de 2,7 y 2,9g/dL no habiendo ninguno con cifras inferiores a las normales en el resto del estudio.
- Calcio y PTH: el mayor número de pacientes con déficit de calcio se dio a los 2 años (n=8). A partir del tercer año solo hay un paciente con valor inferior al normal.
Postoperatoriamente, los valores medios de PTH se incrementan progresivamente, alcanzando el máximo a los tres años para descender al cuarto año (n=2) sin alcanzar valores normales. El mayor número de pacientes con valores elevados se dio a los 12 y 18 meses y el mayor porcentaje a los dos años.
- Hierro, ferritina, vitamina B12 y ácido fólico: a los tres meses el 41% de pacientes tenían valores de hierro inferiores a los normales, porcentaje que disminuye de manera evidente a partir del segundo año. Los valores medios de ferritina han estado siempre dentro de los límites normales.
El mayor número de pacientes con cifras de vitamina B12 menores de las normales se dio a los 18 meses (n=10). No hay pacientes deficitarios a partir de los 24 meses.
A los tres meses un 36% de pacientes presentaba cifras de ácido fólico inferiores a las normales. Este porcentaje va disminuyendo y a partir del quinto año no hay ningún paciente con valores inferiores a los normales.
- Glucemia, colesterol y triglicéridos: en el preoperatorio 62 pacientes (56%) tenían hiperglucemia, mientras que al tercer mes era el 17% y a los 18 todos tenían cifras normales. En este periodo había dos pacientes con valores de colesterol superiores a los normales. En el resto de periodos solo hubo uno y ninguno a partir de los 48 meses.
Los valores medios de triglicéridos estuvieron siempre dentro de los normales y a los 36 meses no hay ningún paciente con valores mayores de los normales.
- Función hepática (ALT, bilirrubina e índice de Quick): en el preoperatorio, 36 pacientes (33%) tenían valores de ALT superiores a los normales. A los tres meses, era un 29%. A partir de los cinco años no hay pacientes con valores anormales.
La bilirrubina mantuvo siempre los valores medios dentro de los normales. A partir de los 48 meses todos los pacientes tienen valores normales.
En el preoperatorio, dos pacientes tenían el índice de Quick inferior al normal. Al tercer mes eran 15. Estas cifras disminuyen con el tiempo, y a partir de los cinco años no hay pacientes con valores por debajo del normal.
El estudio estadístico muestra diferencias significativas entre los valores ponderales pre- y postoperatorios. Lo mismo ocurre con los valores de glucemia, colesterol, triglicéridos, PTH e índice de Quick y entre los valores de hematocrito y hemoglobina preoperatorios y los postoperatorios hasta los 3 años aunque posteriormente desaparecen. Lo mismo ocurre con el Ca y la ALT entre los valores preoperatorios y los obtenidos a los 12, 18 y 24 meses, pero no con el resto de los periodos estudiados.
No ha habido diferencias entre los valores preoperatorios de Fe, ferritina, vitamina B12, ácido fólico, bilirrubina, PT y albúmina.
DiscusiónHoy día el CD está aceptado como técnica quirúrgica para el tratamiento de la obesidad mórbida, ya que obtiene hasta un 70% de reducción del sobrepeso, con un mejor y más estable resultado en el tiempo que otras técnicas6. Marceau7, en un trabajo de 15 años de experiencia con esta técnica y un seguimiento medio de 7,3 años, informa que el 92% de pacientes con IMC inicial ≤50kg/m2 obtienen un IMC<35.
En nuestra serie, a partir del año, el valor medio del IMC fue siempre <35, con un PSP del 31% al tercer mes y del 62% al año, momento en que 87 pacientes (79%) ya habían perdido el 50% del sobrepeso, pérdida similar a la obtenida por Anthone8, quien en un trabajo con 701 pacientes intervenidos con el CD y 10 años de seguimiento, informa de un PSP al año del 69%.
Baltasar9, en una serie de 125 pacientes con un IMC medio de 50, obtiene un PSP>70% al año y un 81,4% a los cinco años, similar al obtenido por nosotros.
El valor medio del IMCE para la serie es de 30,4, sin embargo, a partir del año ya es inferior, siendo el IMCE medio superior al 100% a partir de los 12-18 meses, con límites del 101,6% a los 18 meses y 117,1% a los 120 meses. Esto supone un correcto control ponderal, mantenido en el tiempo, similar a los datos existentes en la bibliografía10.
Los pacientes obesos suelen presentar comorbilidades que deben valorarse antes de la cirugía, a fin de comprobar su eficacia. En nuestra serie, la mayoría (40%) presentaban dos de ellas. Tras la cirugía se obtuvo un 75,5% de corrección y un 14% de mejoría de las mismas, ocurriendo en más del 50% de pacientes a partir del sexto mes, siendo el SAOS la que presentó mayor porcentaje de corrección, seguido de la dislipidemia, diabetes e HTA.
La enfermedad osteoarticular fue la que obtuvo peor resultado, si bien en nuestra serie había un 42% de pacientes mayores de 45 años, con obesidad de larga evolución. Parece lógico que los pacientes de más edad y años de evolución de sus lesiones, resulten más difíciles de solucionar, llegando a ser en ocasiones irreversibles.
La alteración en la absorción de nutrientes y vitaminas ocasionada por la variación anatómica que supone la cirugía es mayor en las técnicas malabsortivas que en las restrictivas, sobre todo en lo que respecta al Fe, calcio y vitaminas liposolubles, por lo que se debe controlar sus alteraciones y suplementar su déficit11. Aunque estas carencias nutricionales son conocidas y esperadas, su control y suplementación no está homogeneizado, de hecho, el 5% de los cirujanos bariátricos no realizan ninguna determinación analítica en el seguimiento11.
Malnutrición calórico-proteicaEs una complicación grave aunque poco frecuente, con una incidencia de entre el 0 y el 30%12. En nuestra serie, el mayor número de pacientes con valores de proteínas inferiores a las normales se dio a los 18 meses (n=13), pero manteniendo cifras de albúmina normales, corrigiéndose progresivamente hasta normalizarse a los tres años de seguimiento. La hipoalbuminemia solamente se observó en dos pacientes al tercer mes, hecho que concuerda con los valores referidos por Anthone8 en su serie.
La malnutrición es proporcional entre otras, a la longitud del área absortiva6. Un asa común entre 50 y 200cm evita graves problemas de hipoalbuminemia y desnutrición, con una pérdida de peso aceptable13. Nosotros, con asa común de 80cm y asa alimentaria hasta 250cm, no hemos observado casos de hipoproteinemia sintomática o que requiriesen tratamiento, habiéndola objetivado solo en el control analítico, por ello no realizamos prevención de la hipoproteinemia excepto con consejos dietéticos.
Se ha evidenciado, al igual que ha ocurrido con nuestros pacientes, que a medida que transcurre el tiempo tras la cirugía, el intestino se adapta y aumenta su capacidad absortiva disminuyendo la malnutrición proteica14.
La hipoalbuminemia y otros defectos nutricionales pueden ser debidos más a la restricción gástrica que al componente malabsortivo. En el CD ocurre con menor frecuencia pues permite una ingesta casi similar a la preoperatoria, por lo que el 98% de pacientes conservan la albúmina sérica en los límites normales15 como ocurre en nuestra serie.
Anemia (hemoglobina, hematocrito, hierro, vitamina B12 y ácido fólico)La carencia de hierro es una alteración frecuente y puede estar presente en el 50% de pacientes en algún momento de su evolución16. En nuestra serie existe una tendencia a la corrección del déficit con el tiempo y el tratamiento, pasando de un 40,9% de pacientes con déficit a los 3 meses a un 10% a los 5 años. Esta mejoría se traduce en una recuperación del hematocrito y hemoglobina, disminuyendo progresivamente el número de pacientes con anemia microcítica, no habiendo ninguno a los cinco años.
Según las series estudiadas, el porcentaje de anemia varía del 33 al 40%, estando ocasionada por un déficit de hierro, ácido fólico y/o vitamina B1217. Nosotros no hemos tenido un porcentaje de pacientes con valores de hematocrito deficitarios superior al 14%, oscilando entre 14% a los 18 y 36 meses y 7% a los 48 meses. Lo mismo ha ocurrido con la hemoglobina, oscilado su déficit entre un 5% al 6° mes y un 15% a los dos años.
La tendencia debe ser suplementar a estos pacientes con hierro oral, consiguiéndose replecionar los depósitos de hierro. Sin embargo hasta un 14% presentan anemia microcítica con valores de hierro normales18. Nosotros hemos observado este efecto, ya que la administración de hierro mantuvo en casi todos los pacientes deficitarios, cifras de ferritina normales a pesar de presentar algunos anemia microcítica.
Anthone15 opina que la frecuencia de la anemia en el CD es similar a la del by-pass gástrico, que suele ser leve y solamente un pequeño porcentaje de pacientes necesita suplementación con hierro por vía parenteral. También comunica que no hay deficiencias de vitamina B12 por la conservación de una mayor cantidad de mucosa gástrica.
Las recomendaciones en la suplementación de hierro varían entre 40-65mg/día14 y 320mg dos veces/día19. En nuestro caso la hemos realizado con sulfato ferroso en ayunas acompañado de vitamina C, ya que aumenta los niveles de ferritina más que administrándolo solo20. En caso de intolerancia se puede recurrir a la administración de hierro-sacarosa intravenoso21.
Similar al déficit de hierro es el comportamiento de la vitamina B12, con una incidencia de déficit entre el 26 y el 70%22. En nuestra serie ha oscilado entre el 4 y el 10%, desapareciendo a partir del 2.° año. Esto parece debido a que la exclusión gástrica en el CD es menor que en otras técnicas restrictivas22, de hecho, los valores medios de B12 y ácido fólico de la serie estuvieron siempre dentro de los límites normales a partir del tercer mes.
Prácticamente la totalidad de los casos son asintomáticos y no existen pacientes deficitarios a partir del cuarto año, por lo que la necesidad de aporte de por vida no parece ser estrictamente necesario, aunque sí un control de los mismos.
La suplementación de vitamina B12 puede ser oral o parenteral y repetida, a partir del sexto mes, con periodicidad anual. La administración de altas dosis por vía oral (350μg/día) constituye la primera opción terapéutica. En caso necesario, la administración intramuscular (1.000μg/mes), suele ser suficiente para mantener niveles normales23.
Calcio y PTHLa absorción del calcio está disminuida por exclusión del duodeno y yeyuno proximal y por malabsorción de la vitamina D24. Esto hace necesario suplementar la dieta desde el postoperatorio inmediato, pues aunque las alteraciones en el metabolismo del Ca y vitamina D se originan pronto, las evidencias clínicas y bioquímicas del trastorno óseo pueden no observarse hasta años después25.
En nuestra serie, los valores medios del calcio estuvieron siempre dentro de los límites normales, sin embargo esto no representa la realidad, ya que los niveles se mantienen elevados debido a la acción de la PTH.
El porcentaje más elevado de pacientes con valores de Ca por debajo del normal fue a los dos años (7,2%). A partir de los 7 años no hay ninguno, aunque persiste un 11,6% que mantiene la PTH elevada.
Un 25,8% de pacientes presentaban valores preoperatorios de PTH discretamente superiores a los normales, aumentando este porcentaje progresivamente desde el postoperatorio inmediato y comenzando a disminuir a los dos años de seguimiento. Sin embargo, aunque los pacientes con valores elevados disminuyen, los que a pesar del tratamiento no normalizan sus cifras, mantienen un hiperparatiroidismo secundario, por lo que administramos calcio de manera profiláctica durante el primer año y posteriormente según controles analíticos. Slater26 informa que a los dos años tras la cirugía, el 27% de sus enfermos presentaban hipocalcemia y un 48% de ellos hiperparatiroidismo secundario.
El objetivo es mantener los niveles de PTH por debajo de 100pg/mL27. En nuestra serie, los valores medios de PTH>100pg/mL se observaron entre los 3 y 5 años y aunque posteriormente disminuyen, no llegan a normalizarse en la totalidad de pacientes. Al igual que en otros estudios28, no hemos observado signos clínicos de hipocalcemia ni de pérdida ósea.
Glucemia, colesterol y triglicéridosEs evidente que la pérdida de peso se relaciona con la mejora de estos parámetros: 100% la glucemia y 88% la dislipidemia en caso de derivación biliopancreática29.
En nuestra serie, el 56% de los pacientes tenían valores de glucemia elevados preoperatoriamente. Al año de la cirugía, todos ellos tenían valores normales. Lo mismo ocurre con el colesterol y los triglicéridos, aunque la total normalidad ocurre un poco más tarde.
Función hepática (ALT, bilirrubina, índice de Quick)Las alteraciones hepáticas no son frecuentes y en la mayoría de casos, de aparecer, no son clínicamente significativas, aunque se han publicado casos graves esporádicos e incluso mortalidad por fallo hepático agudo30.
Los casos de insuficiencia hepática tras el CD no son diferentes a los encontrados en otras intervenciones de derivación gástrica y, probablemente, son el resultado de una hepatopatía preexistente (en nuestra serie un 33% de los pacientes ya presentaban elevación de ALT preoperatoriamente), que explicaría estas alteraciones durante los primeros meses del postoperatorio. Esta elevación de transaminasas de forma «fisiológica» tras el CD se normaliza con el tiempo sin requerir un tratamiento específico31. Nuestros pacientes se comportan de manera similar, de forma que aquellos con valores elevados, a partir del tercer mes tienden a la normalización, probablemente por una mejoría significativa de la esteatohepatitis no alcohólica, resultados que coinciden con la bibliografía31. Esta mejora en la función hepática no es únicamente analítica o funcional30 sino también histológica32, consiguiendo un 60% de casos una reducción en el grado de hepatitis e infiltración grasa a los tres años del seguimiento31.
DiarreaAunque la mayoría de los pacientes presentan un ritmo defecatorio normal, la diarrea no es infrecuente, siendo en ocasiones invalidante. Con dieta y tratamiento (metronidazol, neomicina y loperamida) va cediendo, normalizándose a partir de los 6 meses en algunos casos y la mayoría a partir del año.
El mal olor de las deposiciones es de difícil control. Indicamos cambios de hábitos alimentarios y administramos enzimas pancreáticos, silicona antiespumante y suplementos de Zn, aunque con resultados pocos satisfactorios.
ConclusionesLas alteraciones de los parámetros clínico-biológicos indicadores de complicaciones nutricionales en el postoperatorio de la cirugía de la obesidad mórbida realizada con la técnica del CD son frecuentes, sobre todo del hierro y Ca, corrigiéndose con el tiempo y tratamiento suplementario y por tanto asumibles, dado el beneficio obtenido en las comorbilidades y el control a largo plazo del IMC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.