La anemia representa una entidad o comorbilidad extremadamente frecuente dentro de la población de pacientes quirúrgicos. Su manejo implica un abordaje multidisciplinar con el fin de optimizar los recursos terapéuticos disponibles de forma individualizada en cada situación clínica. El uso racional por parte del clínico de transfusiones sanguíneas, ferroterapia (oral y endovenosa), agentes estimuladores de la eritropoyesis y otras alternativas terapéuticas ha de proporcionar el máximo beneficio a nuestros pacientes con las mínimas complicaciones posibles. El presente artículo de revisión resume las principales características de la anemia, metabolismo férrico, eritropoyesis y alternativas terapéuticas desde una perspectiva quirúrgica, a la luz de los conocimientos actuales.
Anemia is very common entity or comorbidity in surgical patients. Its management involves a multidisciplinary approach with the aim of optimizing the available therapeutic resources with individualized care for each clinical situation. Rational use of blood transfusions, iron therapy (oral and intravenous), erythropoiesis stimulating agents and other therapeutic alternatives by physicians must achieve maximal benefit with minimal complications for our patients. This review article summarizes the main characteristics of anemia, iron metabolism, erythropoiesis and therapeutic alternatives from a surgical perspective in the light of present knowledge.
La anemia representa una de las patologías más prevalentes, especialmente en población de edad avanzada (17–63%), y constituye una entidad extremadamente frecuente (prevalencia 40%) en pacientes médicos y quirúrgicos1–6. La anemia, definida por la OMS (1968) como valores de hemoglobina <13g/dl en varones y <12g/dl en mujeres no gestantes, altera la eficacia del aporte tisular de oxígeno y constituye una de las principales causas de complicaciones y mortalidad, necesidad de ingreso e incremento de estancia hospitalarios y deterioro de la calidad de vida2–5,7–11. Representa un síntoma o comorbilidad asociada a multitud de patologías, y en muchas ocasiones posee un origen multifactorial7,12. Analizando todas las causas de anemia en pacientes de más de 65 años, un tercio es de origen ferropénico, un tercio responde a anemias por procesos inflamatorios crónicos y el tercio restante presenta una etiología desconocida1,4,5,13–16. La anemia por enfermedad crónica (AEC) constituye la forma más frecuente de anemia en pacientes hospitalizados y críticos17. La anemia del paciente oncológico, extremadamente frecuente (hasta un 44–77%), combina características de la AEC y de otros tipos de anemia (ferropénica, megaloblástica, mielosupresiva, hemolítica, etc.)12,18–22. Los pacientes ingresados en unidades de críticos presentan, asimismo, una elevada prevalencia de anemia y requerimientos transfusionales (40–60%)23–29.
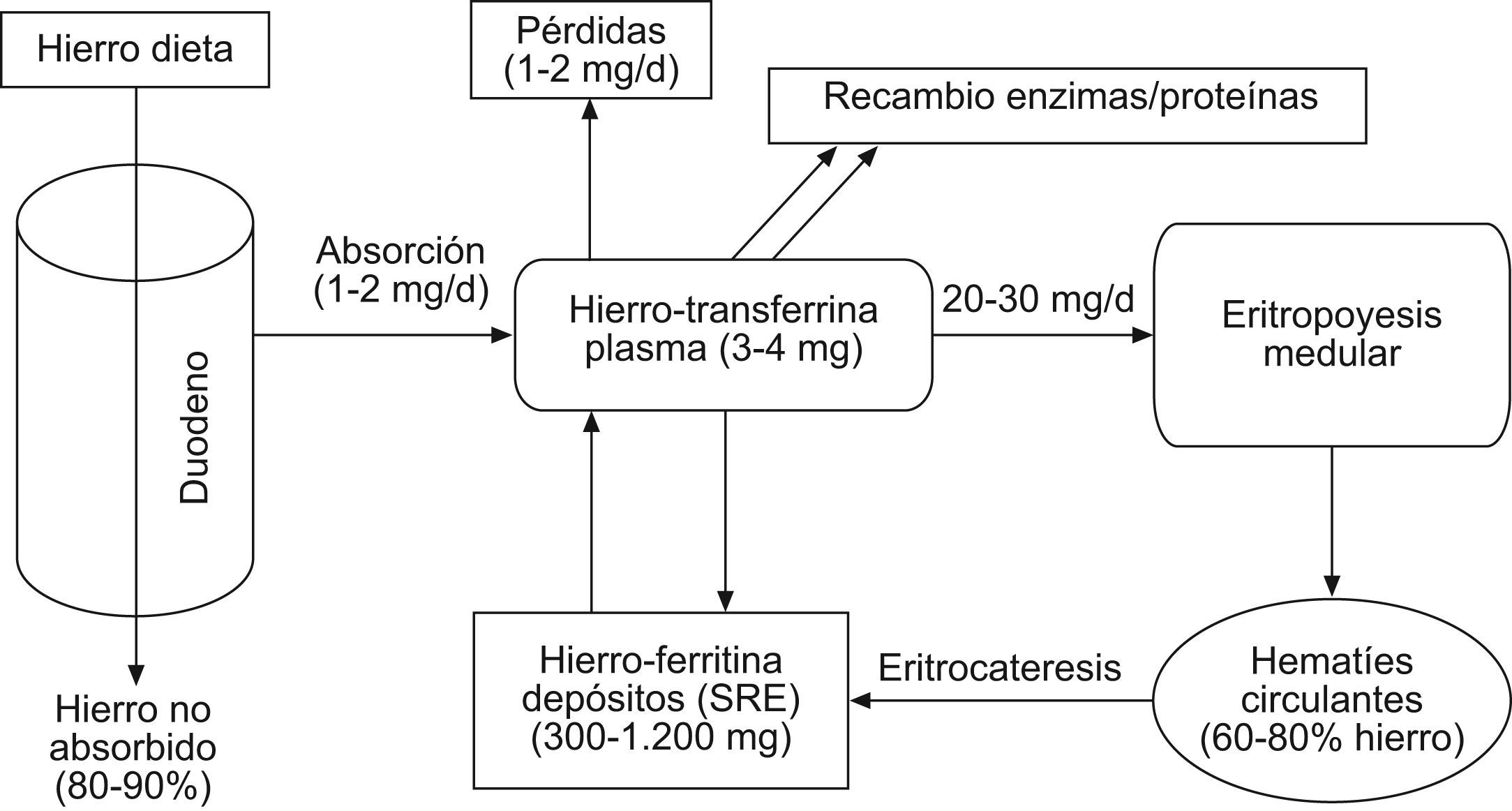
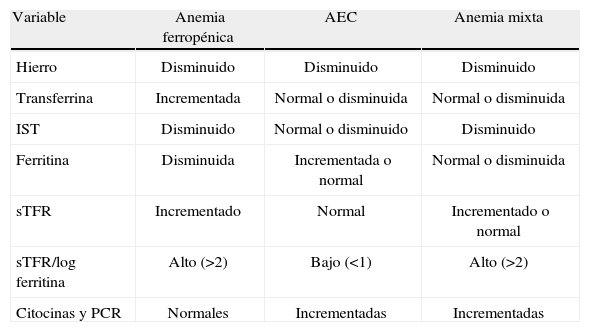
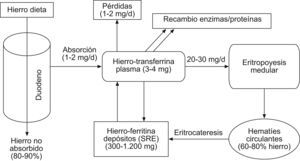
Metabolismo del hierro, eritropoyesis y alteracionesDebido a su capacidad para aceptar y donar electrones, el hierro representa un elemento esencial para multitud de funciones biológicas, como el transporte de oxígeno (grupo heme de la hemoglobina), producción de energía, funciones enzimáticas, síntesis de ADN y hematopoyesis, respuesta inmune y otros procesos30–34. Su capacidad para producir radicales libres de oxígeno tóxicos obliga al organismo a regular con precisión sus niveles31,35. El contenido total de hierro del organismo se estima en 35–50mg/kg (3–4g en total), y el requerimiento diario es 1mg/d (2–3mg/d en mujeres en edad reproductiva)36–38. El metabolismo del hierro representa un ciclo muy complejo y altamente regulado (fig. 1)37. La dieta habitual en nuestro medio supone una ingesta diaria de 10–30mg de hierro26,38. El hierro no heme procedente de la dieta (85–95% del total) se absorbe en la porción proximal del duodeno a través de un transportador transmembrana (DMT-1) del borde apical del enterocito14,30,31,34,39. El hierro heme de la dieta (derivado de la hemoglobina y mioglobina de alimentos de origen animal) se incorpora al organismo a través de mecanismos aún no esclarecidos30,40. Dentro del enterocito, una pequeña fracción del hierro absorbido es almacenada (unida a ferritina) y el resto atraviesa la membrana basolateral a través del transportador ferroportina 1, para alcanzar así la circulación y unirse a la transferrina7,14,30,31,34,41. La transferrina es una β1-globulina sintetizada por los hepatocitos cuya principal función consiste en unirse al hierro trivalente, mantenerlo en forma soluble y distribuirlo a los tejidos14,38,42,43. El hierro unido a la transferrina (3–4mg) es reemplazado o recambiado 10–15 veces al día, constituyendo el pool dinámico más importante para la eritropoyesis. Los precursores eritroides de la médula ósea precisan 20–30mg de hierro/día para la síntesis mitocondrial del grupo heme de la hemoglobina y formar nuevos eritrocitos37,43. Lo obtienen mediante endocitosis de los complejos hierro-transferrina plasmáticos a través de receptores celulares (TFR1) para transferrina34,36,37,42. La eritropoyesis precisa asimismo del estímulo de la eritropoyetina (EPO) renal y otras citocinas y cofactores7,14,37,38. La velocidad a la que el hierro puede ser movilizado constituye uno de los principales factores limitantes de la eritropoyesis medular. A los 120 días de su incorporación a la circulación, los eritrocitos senescentes son fagocitados por los macrófagos del bazo, hígado y médula ósea (sistema retículo-endotelial, SRE)38. En el citoplasma macrofágico se hidroliza la hemoglobina, se cataboliza el heme y se libera el hierro, que es almacenado unido a la ferritina y, en menor proporción, en forma de hemosiderina38,44. La ferritina, principal proteína de almacenamiento intracelular de hierro, representa una reserva para la síntesis de compuestos que precisan hierro, un sistema de recubrimiento del hierro en una forma soluble no tóxica y un conocido reactante de fase aguda37,45–48. Las células liberan una pequeña cantidad de ferritina a la circulación sistémica, proporcional al contenido de los depósitos biológicos14. Desde estos depósitos biológicos el hierro puede incorporarse a la transferrina plasmática, que lo transportará nuevamente a la médula ósea y a otros tejidos7,38,43. Este circuito de recirculación constituye la principal fuente de hierro para la eritropoyesis (99%), puesto que el hierro absorbido por el intestino habitualmente solo compensa las pequeñas pérdidas diarias (1–2mg/d) secundarias a hemorragias menores, descamación celular y pérdidas por sudor, orina y heces43,45. En condiciones fisiológicas, el hierro plasmático (unido a transferrina) y los depósitos biológicos (hierro unido a ferritina) se mantienen en un estado de equilibrio dinámico7. Los procesos inflamatorios (agudos o crónicos) y otras situaciones patológicas alteran este balance, jugando un papel central en el desarrollo de la anemia49. Según las últimas investigaciones, la hepcidina, una hormona de síntesis hepática, desempeña un papel regulador clave en el metabolismo del hierro14,31,39,43,44,46,50. Su síntesis responde a la demanda eritropoyética, la concentración de transferrina, los depósitos de hierro, la hipoxia y los estados inflamatorios infecciosos (niveles de IL-6, lipopolisacárido, etc.), y ejerce un control sistémico y coordinado de la absorción intestinal, el reciclaje y el almacenamiento de hierro14,31,39,43,51–53. La hepcidina parece ejercer un doble efecto inhibitorio, a nivel de la ferroportina-1 macrofágica (inhibición de la liberación de hierro) y de la DMT-1 del enterocito (inhibiendo la absorción intestinal de hierro)50,54,55. El resultado neto de dichas acciones es la disminución de la absorción intestinal de hierro y la inhibición de su liberación plasmática desde los depósitos biológicos, disminuyendo así el hierro disponible para la eritropoyesis14,39,41,43,49,55,56. De esta forma, la interacción hepcidina-ferroportina mantiene la concentración extracelular de hierro en niveles estables (6–27μmol/l en plasma)43. La síntesis de hepcidina se incrementa en los estados de sobrecarga férrica y disminuye con la anemia, hipoxia y déficit de hierro, manteniendo así la homeostasis38. La anemia por déficit de hierro (ADH) o anemia ferropénica se desarrolla en aquellas situaciones en que el organismo no dispone de suficiente hierro para ser incorporado a los precursores eritroides, debido a una depleción de los depósitos secundaria a hemorragia (aguda o crónica), malnutrición-malabsorción o incremento de la demanda (gestación, infancia). Se caracteriza por una hemoglobina <13g/dl (en varones), índice de saturación de transferrina (IST) <16–20%, ferritina <30–100μg/l, incremento del receptor soluble de transferrina (sTFR) y ratio sTFR/log ferritina alta (>2), en pacientes sin evidencia clínica o bioquímica de inflamación, y suele ser de tipo microcítica e hipocrómica (tabla 1)2,13,14,46,57. La AEC representa la forma más frecuente de anemia en pacientes hospitalizados y críticos, y puede definirse como aquella anemia asociada a un proceso inflamatorio (con evidencia clínica o biológica, como PCR >1–5mg/l), con cifras de ferritina >100μg/l, IST <16–20%, concentración normal del sTFR y ratio sTFR/log ferritina baja (<1), habitualmente normocítica y normocrómica (tabla 1)57–59. En la AEC, el déficit de hierro «disponible» o déficit funcional de hierro (DFH) es consecuencia de la retención del mismo en los depósitos biológicos (mediante downregulation del transportador ferroportina-1 y upregulation de TFR1 y ferritina) y la inhibición de la absorción intestinal de hierro37,46,59,60. Asimismo, se produce una inhibición de la proliferación y diferenciación de los precursores eritroides, reducción de la semivida eritrocitaria, inhibición de la unión hierro-transferrina, disminución de la síntesis y respuesta medular a eritropoyetina endógena e incremento de la eritrofagocitosis18,26,58,59. Las moléculas responsables del DFH, especialmente la hepcidina y una gran variedad de citocinas y moléculas proinflamatorias (IL-1, IL-6, TNFα, IFNγ, etc.), son activamente sintetizadas durante procesos inflamatorios e infecciosos (agudos o crónicos), respuesta inflamatoria sistémica (sepsis, trauma, fracaso multiorgánico o agresión quirúrgica), enfermedades autoinmunes y enfermedades neoplásicas2,13,14,27,28,36,49,51,56,60–63.
Características de la anemia ferropénica y AEC
| Variable | Anemia ferropénica | AEC | Anemia mixta |
| Hierro | Disminuido | Disminuido | Disminuido |
| Transferrina | Incrementada | Normal o disminuida | Normal o disminuida |
| IST | Disminuido | Normal o disminuido | Disminuido |
| Ferritina | Disminuida | Incrementada o normal | Normal o disminuida |
| sTFR | Incrementado | Normal | Incrementado o normal |
| sTFR/log ferritina | Alto (>2) | Bajo (<1) | Alto (>2) |
| Citocinas y PCR | Normales | Incrementadas | Incrementadas |
La anemia representa una entidad o comorbilidad extremadamente frecuente dentro de la población de pacientes quirúrgicos, y habitualmente posee un origen multifactorial. Globalmente, el 5–80% de los pacientes quirúrgicos presentan anemia preoperatoria, uno de los principales factores causales de transfusión sanguínea alogénica (TSA)1,7,8,13,27,63–67. Progresivamente se intervienen a pacientes más mayores y en condiciones más extremas, de forma que la anemia perioperatoria representa una entidad muy frecuente, bien por pérdidas digestivas o procesos inflamatorios crónicos, la patología basal del enfermo (especialmente neoplasias), la técnica quirúrgica empleada (gastrectomía, bypass gástrico, etc.), malnutrición y déficits vitamínicos, el efecto mielosupresivo de la quimioterapia, pérdidas sanguíneas perioperatorias o por la respuesta inflamatoria sistémica desencadenada por la propia agresión quirúrgica2,61,62,68,69. Al margen de la hemorragia perioperatoria, durante el periodo postoperatorio es frecuente la hiposideremia y una disminución de los valores de transferrina e IST, con incremento de la ferritina51,70,71. Este escenario implica un marcado descenso en la disponibilidad y absorción de hierro durante las primeras 2–6 semanas postoperatorias que dificulta la eritropoyesis y frecuentemente conduce a anemia postoperatoria70–74. Dicha situación a menudo no logra subsanarse con la administración de ferroterapia oral pero sí con hierro parenteral, lo cual evidencia una alteración de la liberación de hierro por parte del SRE similar a la AEC70,71. Así pues, la anemia postoperatoria (al igual que la anemia de los pacientes críticos o sépticos) puede considerarse una variante aguda y transitoria de la AEC70. Múltiples estudios corroboran la asociación entre anemia perioperatoria e incrementos en la incidencia de complicaciones, mortalidad postoperatoria, estancia hospitalaria y empeoramiento de varios parámetros de calidad de vida27,66,75–85. Por último, la anemia postoperatoria representa, según algunos estudios en pacientes neoplásicos, un factor pronóstico negativo en términos de intervalo libre de enfermedad y supervivencia86. La presencia de un proceso inflamatorio crónico y la ferropenia representan los principales factores etiológicos de anemia en pacientes quirúrgicos (64% y 23–33% de todas las anemias preoperatorias, respectivamente)27,87. El DFH, mecanismo subyacente a la AEC, está presente en muchos pacientes quirúrgicos y graves, y conduce no solo a una eritropoyesis ineficaz, sino también a una inadecuada respuesta inmunitaria, incrementando la estancia y mortalidad7,17,28,62,88. Dunne et al confirmaron la presencia de anemia pre y postoperatoria en el 33,9 y 84,1% de los casos, respectivamente, en una serie prospectiva de 6301 pacientes sometidos a cirugía no cardiaca electiva; ambas circunstancias (y la TSA) se asociaron a un incremento de mortalidad, neumonía postoperatoria y estancia hospitalaria75. Aproximadamente el 15–23% de los pacientes afectos de tumores sólidos precisan TSA en algún momento de la evolución de su enfermedad89–91. Como dato representativo, la incidencia de anemia susceptible de transfusión perioperatoria en pacientes afectos de cáncer colorrectal (CCR) se sitúa entre el 20–85%13,92,93. La anemia postoperatoria constituye, asimismo, una de las principales complicaciones en pacientes sometidos a gastrectomía (20–62%), con un origen multifactorial: déficit de absorción de vitamina B12 por ausencia de factor intrínseco y disbacteriosis, déficit de ácido fólico, déficit en la ingesta y absorción de hierro por aclorhidria, etc64,69,94–101. La cirugía bariátrica representa otra disciplina íntimamente relacionada con el desarrollo de anemia postoperatoria a medio y largo plazo, con una prevalencia al año del 16–36%102–106. Los déficits vitamínicos de estos pacientes (vitamina B12 y folatos) suelen ser fácilmente subsanables mediante la administración de suplementos104,106–108; por el contrario, el déficit de hierro (multifactorial) no suele responder a ferroterapia oral, precisando en ocasiones un aporte de hierro por vía parenteral e, incluso, TSA103,104,107,108.
Anemia en cirugía: posibilidades terapéuticasTanto por su frecuencia como por su repercusión clínica, la anemia representa un importante problema en el manejo del paciente quirúrgico, por lo que muchas veces hemos de recurrir a la TSA, una forma rápida y eficaz de restaurar los valores de hemoglobina y evitar los efectos deletéreos de la anemia grave27,59. Por otra parte, la TSA representa un recurso caro y escaso, asociado a conocidas complicaciones y efectos adversos que hemos de sopesar a la hora de indicarla, tomando en consideración la etiología de la enfermedad, la intensidad de los síntomas, la comorbilidad asociada y las posibles alternativas terapéuticas109,110. En el caso específico de las neoplasias digestivas, la TSA se ha asociado a incrementos significativos de la tasa de infección postoperatoria, estancia y gastos hospitalarios, recurrencia neoplásica y mortalidad28,64,65,109–117. El estudio de Sitges-Serra et al (N=2809 resecciones colorrectales) confirmó la TSA como el factor de riesgo más relevante en el desarrollo de infección postoperatoria109. Asimismo, Rovera et al confirman (N=110) la TSA perioperatoria como variable independiente para el desarrollo de infección de herida quirúrgica tras esofaguectomía por neoplasia111. Varios estudios realizados en unidades de cuidados intensivos han confirmado la asociación entre TSA y estancia y mortalidad7. Estos importantes efectos adversos propiciaron la búsqueda de alternativas a la TSA, como la administración de hierro (oral o parenteral), agentes estimuladores de la eritropoyesis o ESA [eritropoyetina recombinante humana (EPOrh) y otros], transfusión autóloga, antifibrinolíticos, normotermia intraoperatoria e hipotensión controlada, transportadores artificiales de oxígeno y, obviamente, un adecuado estudio preoperatorio y una técnica quirúrgica depurada y rápida28,118–125. Asimismo, a raíz del estudio de Hébert et al (que demostró la efectividad de una estrategia transfusional restrictiva frente a otra más liberal), se están generalizando criterios transfusionales más restrictivos en pacientes quirúrgicos y críticos (con umbrales transfusionales en torno a 7g/dl y mantenimiento de cifras de hemoglobina de 7–9g/dl, en ausencia de disfunción orgánica), relegando la TSA a situaciones agudas con compromiso hemodinámico1,7,58,88,118,121,122,126–131.
Agentes estimuladores de la eritropoyesis en cirugíaLa administración de EPOrh constituye un tratamiento eficaz y seguro para disminuir las necesidades de TSA durante cirugía electiva en pacientes con anemia preoperatoria y candidatos a intervenciones con pérdidas hemorrágicas importantes89,92,119,132–134. Se han empleado diferentes regímenes preoperatorios de ESA subcutáneos, desde 300–600UI/kg/semana (3–4 semanas antes de la intervención) a 300UI/kg/d (durante 7–10 días antes y 4–7 días postoperatorios)125,131,135,136. Varios estudios han demostrado un incremento significativo de los valores de hemoglobina y reducción de las necesidades de TSA en pacientes sometidos a cirugía por neoplasia gastrointestinal bajo tratamiento preoperatorio con dosis bajas de EPOrh y hierro (incluyendo programas de transfusión autóloga)92,135,137–139. Levine et al demostraron que la administración de EPOrh (250UI/kg 3 veces/semana, asociada a hierro oral) durante la neoadyuvancia por neoplasia de recto mejoraba de forma significativa los valores de hemoglobina y disminuía las necesidades transfusionales (0,4 vs 3,7 concentrados/paciente)140. Qvist et al demostraron un incremento de los valores pre y postoperatorios de hemoglobina y una reducción en las necesidades de TSA perioperatoria en pacientes anémicos afectos de CCR mediante la administración perioperatoria de EPOrh (300UI/kg 4 días antes de la intervención y 150UI/kg la siguiente semana) y ferroterapia oral preoperatoria (200mg/d durante 4 días)139. El grupo de Christodoulakis et al demostró la eficacia en términos de incrementos de los valores de hemoglobina y hematocrito y reducción de las necesidades transfusionales en un ensayo clínico randomizado (ECR) con 223 pacientes anémicos afectos de CCR mediante la administración preoperatoria de EPOrh, ferroterapia oral y ácido fólico92. La administración preoperatoria de EPOrh ha demostrado su eficacia en cirugía electiva oncológica urológica y neoplasias de cabeza y cuello141,142. Por último, la administración postoperatoria de EPOrh ha demostrado una reducción de las necesidades de TSA en pacientes afectos de neoplasia gástrica143. En 1994 se aprobó el uso de EPOrh en la UE como coadyuvante en los programas de donación autóloga preoperatoria, cuya eficacia ha sido confirmada en pacientes de traumatología, cirugía cardiovascular y enfermos afectos de neoplasias gastrointestinales (gástrica, hepática y colorrectal), ginecológicas y sacras137,144–150.
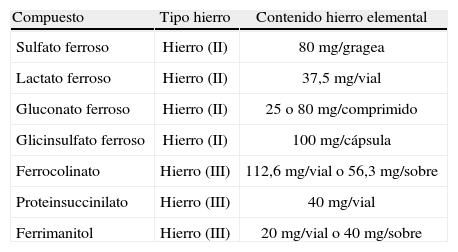
Ferroterapia oral en cirugíaLa ferroterapia oral ha demostrado su eficacia en la corrección de la anemia y reducción de las necesidades transfusionales en cirugía digestiva programada. La tabla 2 recoge las distintas formulaciones de hierro oral disponibles, con mínimas diferencias entre ellas respecto a su eficacia. Habitualmente, la recuperación de las cifras de hemoglobina se inicia 7–10 días después de iniciar el tratamiento. Okuyama et al demostraron que los pacientes afectos de CCR y anemia que recibían ferroterapia oral preoperatoria (200mg/d durante 2 semanas) precisaban menos transfusiones intraoperatorias (9,4 vs 27,4%)151. Un ECR reciente (N=49 casos) en pacientes pendientes de cirugía colorrectal programada confirmó una reducción significativa de las necesidades transfusionales (26 vs 59%) con la administración preoperatoria de hierro oral, constituyendo un método simple y barato para evitar la TSA13.
Preparados de hierro oral disponibles en España
| Compuesto | Tipo hierro | Contenido hierro elemental |
| Sulfato ferroso | Hierro (II) | 80mg/gragea |
| Lactato ferroso | Hierro (II) | 37,5mg/vial |
| Gluconato ferroso | Hierro (II) | 25 o 80mg/comprimido |
| Glicinsulfato ferroso | Hierro (II) | 100mg/cápsula |
| Ferrocolinato | Hierro (III) | 112,6mg/vial o 56,3mg/sobre |
| Proteinsuccinilato | Hierro (III) | 40mg/vial |
| Ferrimanitol | Hierro (III) | 20mg/vial o 40mg/sobre |
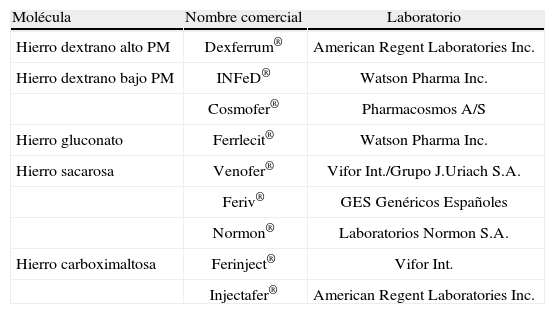
La administración de hierro endovenoso representa una medida eficaz y segura para mejorar los valores de hemoglobina en pacientes quirúrgicos (tabla 3). Múltiples estudios han corroborado la eficacia del hierro endovenoso para acelerar la recuperación de las cifras de hemoglobina y reducir las necesidades de TSA perioperatoria en cirugía general, traumatología y ortopedia, ginecología y obstetricia y gastroenterología, con mejorías significativas en las tasas de infección y complicaciones postoperatorias, estancia hospitalaria y mortalidad a corto plazo1,8,27,28,61,62,88,152–157. Algunos centros de nuestro país emplean protocolos estandarizados para la administración preoperatoria de hierro endovenoso en pacientes afectos de neoplasias digestivas28. El uso de hierro endovenoso (asociado o no a ESA) tiene especial interés en el tratamiento de la anemia en pacientes candidatos a cirugía programada en un periodo corto de tiempo1,7,62,135,138,158. El hierro endovenoso consigue corregir el DFH y los parámetros hematológicos, reducir la tasa de TSA y mejorar la situación inmunológica del paciente quirúrgico, por lo que su uso debería contemplarse en la preparación preoperatoria y la corrección postoperatoria de la anemia28.
Preparados de hierro parenteral
| Molécula | Nombre comercial | Laboratorio |
| Hierro dextrano alto PM | Dexferrum® | American Regent Laboratories Inc. |
| Hierro dextrano bajo PM | INFeD® | Watson Pharma Inc. |
| Cosmofer® | Pharmacosmos A/S | |
| Hierro gluconato | Ferrlecit® | Watson Pharma Inc. |
| Hierro sacarosa | Venofer® | Vifor Int./Grupo J.Uriach S.A. |
| Feriv® | GES Genéricos Españoles | |
| Normon® | Laboratorios Normon S.A. | |
| Hierro carboximaltosa | Ferinject® | Vifor Int. |
| Injectafer® | American Regent Laboratories Inc. |
Las técnicas de transfusión autóloga programada consisten en la recolección, almacenamiento y posterior reinfusión al paciente de su propia sangre. Globalmente, podemos distinguir 5 modalidades: transfusión/donación autóloga de sangre total con predepósito; eritroaféresis autóloga preoperatoria; hemodilución normovolémica aguda; recuperación de sangre intraoperatoria (mediante recuperadores celulares o cell savers); recuperación de sangre postoperatoria (procedente de los drenajes postoperatorios)119,124,125,131,137,159. La donación autóloga ha demostrado una reducción significativa (31–63%) del número de pacientes transfundidos en cirugía electiva ortopédica, cardíaca, vascular y oncológica (neoplasia esofágica, gástrica, colon, etc.)131,160–165.
Sustancias antifibrinolíticas en cirugíaAprotinina, desmopresina, ácido ε-aminocaproico, ácido tranexámico y factor VII activado constituyen las principales sustancias antifibrinolíticas disponibles en el mercado166–169. El efecto antifibrinolítico de la aprotinina se basa en la inhibición de enzimas clave de la fibrinolisis y de la cascada inflamatoria119. Múltiples ECR y metaanálisis han demostrado su eficacia en cirugía cardíaca en términos de reducción de la hemorragia perioperatoria y ahorro de hemoderivados, y varios estudios confirman su utilidad en cirugía ortopédica mayor y cirugía hepática electiva89,170–172. Su comercialización ha sido recientemente suspendida a raíz de un ECR multicéntrico (ensayo BART) que evidenció un aumento de la mortalidad en pacientes sometidos a cirugía cardíaca que recibieron aprotinina173,174. La desmopresina es un análogo sintético de la hormona antidiurética con propiedades hemostáticas, con eficacia demostrada en la profilaxis de la hemorragia perioperatoria en pacientes con hemofilia, algunas formas de enfermedad de von Willebrand, defectos plaquetarios, hepatopatía y uremia119,169. El ácido ε-aminocaproico posee acción antifibrinolítica al inhibir tanto la plasmina como la activación del plasminógeno. El ácido tranexámico posee una actividad antifibrinolítica similar, pero con una acción más prolongada y 6–10 veces más potente. Ambos agentes han demostrado su eficacia en la reducción de pérdidas sanguíneas, necesidades transfusionales, complicaciones de la herida y número de reintervenciones por sangrado en cirugía general y digestiva, cardíaca, ginecológica, ortopédica y neurocirugía89,119,169,171,175–177. El factor VII activado recombinante induce la producción de grandes cantidades de trombina y fibrina, resultando especialmente indicado en episodios hemorrágicos en pacientes hemofílicos, déficit congénito de factor VII, tromboastenia de Glanzmann, alteraciones adquiridas de la coagulación, politraumáticos graves, hemorragia intracraneal y profilaxis en cirugías de alto riesgo hemorrágico119,167,169,171.
Materiales prohemostáticos y otras medidas en cirugíaRespecto a los materiales prohemostáticos de aplicación tópica, existen multitud de productos disponibles en el mercado: esponjas o películas de gelatina absorbible, celulosa oxidada, colágeno microfibrilar, trombina tópica, selladores de fibrina y geles de plaquetas178. La hipotermia intraoperatoria es responsable de importantes alteraciones de la coagulación y disfunción plaquetaria, por lo que el mantenimiento de la normotermia durante la intervención quirúrgica resulta crucial. Finalmente, los transportadores artificiales de oxígeno, soluciones de reemplazamiento del volumen intravascular con capacidad para fijación de oxígeno, representan uno de los campos más innovadores en terapia de sustitución sanguínea119,123,179. Las emulsiones de fluorocarbonados y las soluciones de hemoglobina artificial constituyen los 2 grandes grupos de sustancias estudiadas en la práctica clínica hasta el momento120,180. El perflubron líquido endovenoso (Oxygent™, Alliance Pharmaceutical Corp.) constituye un fluorocarbonado desarrollado para aumentar temporalmente el aporte de oxígeno en pacientes con riesgo de desarrollar hipoxia tisular secundaria a anemia aguda (trauma o cirugía mayor)119. Ha demostrado su eficacia mediante una reducción significativa de las necesidades de TSA en pacientes programados para cirugías mayores181. Las soluciones de hemoglobina artificial (HBOC-201 Hemopure®, MP4 Hemospam® y otras) han demostrado en algunos trabajos una buena capacidad de transporte de O2 y reducción de las necesidades transfusionales. Han sido empleadas con éxito en ensayos clínicos fase I-III de cirugía cardíaca, vascular, cirugía mayor ortopédica y en pacientes con crisis isquémicas por anemia hemolítica, aunque estudios recientes suscitan dudas sobre su seguridad y efectos adversos120,180,182–184. Las líneas de investigación generadas por estas novedosas sustancias podrían, sin llegar a sustituir totalmente a las transfusiones sanguíneas, conseguir una reducción significativa de la demanda de transfusiones y contribuir a un uso más racional y eficiente de la TSA185.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.