El incremento de los implantes de biomateriales en la pared abdominal, con la finalidad de reparar procesos herniarios, ha permitido disminuir significativamente el porcentaje de recidivas y mejorar la calidad de vida de los pacientes. Sin embargo, la aparición de complicaciones como la infección conduce a retirar el material protésico en un importante número de casos. Ello implica, casi siempre, la recidiva del proceso herniario. Un posible tratamiento en territorios afectados por la infección es la colocación de un material protésico compatible, que genere o induzca un tejido de soporte que permita, en una siguiente fase, realizar la reparación definitiva del defecto parietal. Ésta es la misión esencial que deben cumplir las bioprótesis. Estos materiales son derivados de colágeno de origen animal (generalmente porcino) o humano. Deben ser acelulares y totalmente biocompatibles, para que generen una mínima reacción a cuerpo extraño y nula respuesta inmunitaria.
The increased use of biomaterials for the repair of abdominal wall hernias has achieved a significant reduction in recurrences and consequently improved the quality of life of patients. However, the appearance of complications such as infection may require the implanted prosthetic material to be removed in a considerable number of patients. A possible treatment option in areas compromised by infection is the implant a biocompatible prosthetic material to generate, or induce the formation of a support tissue so that, in a second stage, the definitive repair of the parietal defect may be undertaken. This is the main goal of bioprostheses. These implants are composed of collagen of animal (usually porcine) or human origin. They should be acellular and fully biocompatible so that they induce a minimal foreign body reaction and immune response.
Una de las alternativas en las reparaciones de la pared abdominal afectadas por la infección es el empleo de materiales que den “soporte tisular”, ya sea temporal o incluso, a veces, definitivo. Estos materiales son las denominadas bioprótesis, elaboradas con colágenos desnaturalizados y acelulares, procedentes de animales (xenoinjertos) o de bancos de tejidos humanos (aloinjertos).
La misión de estos biomateriales, en la ingeniería tisular, es conseguir, además de la reparación, la regeneración del tejido. De tal manera que, una vez implantados, estimulen elementos de la matriz extracelular del receptor, favorezcan la angiogénesis e incluso impliquen a los factores de crecimiento en la creación de un nuevo tejido, en el caso particular que nos ocupa, una neopared abdominal.
Para la fabricación de estas bioprótesis de colágeno, es necesario obtenerlo y tratarlo (liofilización) suprimiendo el contingente celular y dejando solamente los componentes matriciales: colágenos I, III, IV y elastina. Después del proceso de purificación, es necesario que en el huésped no se produzca respuesta inmunitaria alguna y que la reacción inflamatoria del receptor al implante sea mínima.
Respecto a este tema, se han publicado pocos trabajos, tanto experimentales como clínicos. Por lo general, suelen tener un buen comportamiento en la interfaz peritoneal y generan un buen mesotelio. Hasta el momento no hay publicaciones que refieran la aparición de complicaciones como fístula intestinal. Por este motivo y según nuestra experiencia previa, se comportan como prótesis de tipo laminar1.
Deben mostrar buena resistencia mecánica, puesto que a menudo son utilizadas en la reparación de zonas anatómicas sometidas a un movimiento activo, como es el caso de las paredes abdominal y torácica o los diafragmas.
La resistencia mecánica de estas bioprótesis depende de su estructura y de las uniones de la triple hélice de colágeno. En condiciones in vivo, los colágenos son degradados por enzimas como las metaloproteinasas e incluso por gérmenes cuando hay contaminación. Por ello, los implantes en los que las fibras de colágeno no posean buenos enlaces tienden a sufrir reabsorción rápida2 y, además, no proporcionan un óptimo soporte tisular. En una palabra, fracasan en su función final. Lo ideal funcionalmente es que estas bioprótesis no sufran una degradación rápida y se mantengan estables hasta ir consiguiendo paulatinamente su incorporación total al tejido receptor. Para conseguir esto, es necesario que los enlaces de la triple hélice que constituye la molécula de colágeno sean eficaces; de lo contrario, la firmeza mecánica se verá comprometida.
Estudios experimentales y clínicos que han empleado bioprótesis en la pared abdominalHasta el momento, la experiencia clínica en el empleo de prótesis biológicas es escasa, debido a varias causas. En primer lugar, la existencia de otros materiales inertes (polipropileno, poliéster, politetrafluoroetileno expandido) que han aportado excelentes resultados tras su implante. En segundo lugar, las indicaciones precisas que tienen estas prótesis biológicas, que se destinan fundamentalmente a zonas de reparación afectadas por infección. En tercer lugar, esencialmente, el coste de estos materiales.
Los trabajos publicados, en los que se menciona el uso de bioprótesis, carecen de un seguimiento a medio/largo plazo suficiente como para obtener resultados y conclusiones en cuanto al beneficio en su uso. Muchos trabajos recogen experiencias de un solo caso, y otras series cortas aportan experiencias iniciales que no son concluyentes en cuanto a la utilidad real en el empleo de estos materiales protésicos.
Los primeros implantes de colágeno en hernia ventral y hernia inguinal, fueron comunicados por Sarmah et al3 en 1984.
En clínica humana, las bioprótesis naturales de colágeno más empleadas en la actualidad son Surgisis®, Permacol® y Alloderm®. A continuación se revisa cada una de ellas.
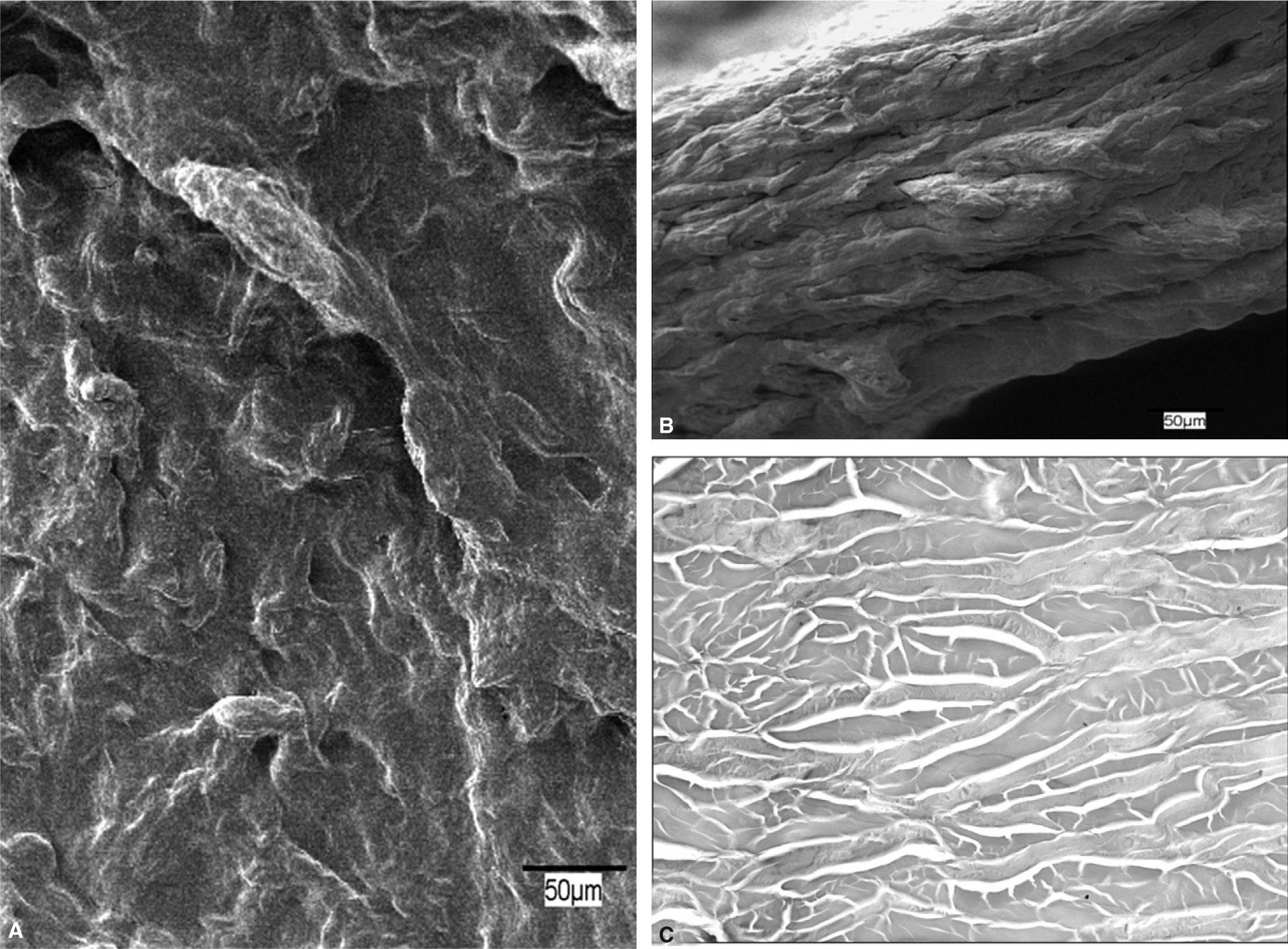
Surgisis® (SIS) (fig. 1)Es un biomaterial de origen natural, obtenido de la submucosa de intestino delgado del cerdo, después de eliminar su componente celular y dejar la matriz extracelular intacta. Está constituido principalmente por proteínas y, en menor cantidad, hidratos de carbono y lípidos. La matriz extracelular conserva su composición natural de colágeno (fundamentalmente de los tipos I, III y VI, lo que constituye un 40% de su peso seco) y glucosaminoglucanos, como ácido hialurónico, condroitinsulfatos A y B, dermatansulfato y heparansulfato4. Contiene también proteoglucanos y glucoproteínas, conocidas por su importante papel en la reparación y remodelación tisular.
Surgisis®. A: imagen al microscopio electrónico de barrido de la superficie protésica (×20). B: sección transversal en la que puede apreciarse el espesor del biomaterial y las capas laminares que lo conforman (×200). C: detalle al microscopio óptico (HE, ×200) de un corte transversal, en el que son claramente visibles núcleos celulares (flechas) entre las fibras de colágeno y vasos sanguíneos contenido hemático (asterisco). Recuadro inferior derecho: tricrómico de Masson(×630).
Los glucosaminoglucanos son componentes esenciales de la matriz extracelular que tienen un importante papel funcional y estructural. Modulan la cicatrización interviniendo en la organización y el depósito de las fibras de colágeno, estimulando la angiogénesis e iniciando la proliferación y diferenciación celular. Intervienen también en la remodelación durante las fases más adelantadas de la cicatrización, mediante el control del tamaño, la orientación y la disposición de las fibras de colágeno.
Las prótesis de SIS, una vez implantadas, actúan como soporte o andamiaje (scaffolds en inglés) en la reparación del tejido dañado, induciendo una invasión de la matriz por células del tejido adyacente y un crecimiento rápido de capilares. SIS no tiene enlaces entre las moléculas de colágeno que la componen; por eso, una vez implantada, es reabsorbida gradualmente en un período de 60–90 días5–7, y la reemplaza un tejido nuevo, bien vascularizado y derivado del huésped, que llega a organizarse y diferenciarse de forma similar a la estructura tisular original, manteniendo la adecuada tensión.
Se ha utilizado SIS para la reparación de tejidos en una gran variedad de localizaciones clínicas, como los injertos vasculares periféricos8, la reparación de estructuras tendinosas9,10, hernias paraesofágicas11, heridas dérmicas crónicas12 y en el tracto urinario para la construcción de neovejigas13–15.
En su aplicación en la pared abdominal, Prevel et al12, en un trabajo experimental, publicaron los resultados de la utilización de SIS como material protésico en la reparación de un defecto de 2 × 2 cm, que incluía músculo y fascia de la pared abdominal de roedores. Los tiempos de estudio fueron de 1 semana y 3 meses. No observaron la aparición de hernias abdominales. El examen histológico mostró una respuesta inflamatoria aguda 1 semana después, que fue disminuyendo paulatinamente hasta los 3 meses de estudio, cuando la incorporación del SIS fue manifiesta, con reducción de las zonas de inflamación.
En posteriores estudios, se intentó comprobar si esta bioprótesis sería adecuada para la reparación de grandes defectos de la pared abdominal, ya que la utilidad clínica de los biomateriales reabsorbibles como SIS depende del equilibrio entre su degradación y la adecuada remodelación tisular. Tanto en su forma unilaminar como en la multilaminar, a los 60–90 días del implante, el SIS utilizado para reparar tejidos mostró una rápida reabsorción, con reemplazo por células procedentes del huésped y de una nueva matriz5,6,16, manteniendo una adecuada fuerza mecánica. En este sentido, Clarke et al17 publicaron en 1996 los resultados de un estudio realizado en perros, utilizando una doble lámina de SIS de 0,1 mm de grosor, en el que se la comparó con prótesis de polipropileno en la reparación de defectos completos y parciales de la pared abdominal; se evaluaron los resultados a las 4 semanas y a los 2 y los 4 meses del implante. Los exámenes histológicos mostraron que la lámina de SIS se reemplazó gradualmente por tejido conectivo organizado igual al del huésped, con células fusiformes y fibras alineadas en dirección paralela a la fascia adyacente, de forma que a los 4 meses los estudios inmunohistoquímicos demostraron que el implante de SIS se había reemplazado completamente por tejido del receptor. El resultado de la reparación fue un tejido conectivo bien organizado e incorporado a la fascia y las fibras musculares adyacentes.
Este tejido contrastaba con el tejido conectivo que apareció en los casos en que se utilizaron prótesis de polipropileno, en los cuales las fibras de colágeno aparecieron alrededor de los filamentos de la prótesis sin una clara organización. La reparación mesotelial sobre SIS fue correcta en los casos de reparación completa de la pared. La ausencia de deformidad del contorno de la pared abdominal durante el período de estudio y el grosor final del tejido reparado y su estructura indican que SIS proporciona la suficiente tensión durante el período de remodelación para utilizarlo como método de cierre temporal18.
En 2001, Badylak et al19 estudiaron, en un modelo experimental en perros, los cambios de tensión en un diseño multilaminar de SIS multiperforado en la pared abdominal. Para ello, crearon un defecto de 8 × 12 cm que comprendía todo el grosor de la pared abdominal. Realizaron un estudio de la resistencia mecánica a la tensión que es capaz de soportar la pared antes y después del implante, transcurridos 1, 4, 7 y 10 días y 1, 3, 6 y 24 meses. Los autores concluyeron que la disminución temprana en la tensión que es capaz de soportar el biomaterial tiene relación con la rápida degradación de SIS, relacionada con una infiltración celular inmediata, una rápida angiogénesis y la aparición de una neomatriz, que culminan con la formación de un neotejido en el lugar del implante, que con el tiempo muestra una resistencia superior a la del tejido nativo.
Se puede utilizar SIS en casos de infección, pues presenta buena tolerabilidad. Franklin et al20, 21 utilizaron SIS para la reparación de hernias inguinales e incisionales potencialmente contaminadas o con infección establecida (hernias incarceradas y estranguladas con necrosis intestinal, reparación herniaria coincidiendo con colectomía, etc.). A los 15 meses, en las 25 reparaciones realizadas sólo hubo un caso de infección de la herida, complicada con la aparición de una fístula enterocutánea en un paciente inicialmente intervenido por isquemia intestinal, si bien la fístula presentaba una localización independiente de la prótesis de SIS. En una revisión posterior sobre 53 pacientes y 58 reparaciones herniarias, con un seguimiento medio de 19 meses, no observaron más complicaciones ni recidivas que las encontradas en las 25 reparaciones efectuadas previamente. Los resultados indican que SIS podría ser una alternativa viable en el tratamiento de los defectos de la pared abdominal en presencia de infección.
Ueno et al22, empleando esta bioprótesis en 20 pacientes intervenidos de defectos herniarios, todos ellos con contaminación bacteriana activa o cirugía sucia, después de un seguimiento medio de 15,7 meses, observaron una tasa de recidivas de un 30%, además de otras complicaciones como, seroma, íleo e infección residual de la pared en 8 casos.
Eid et al23 emplearon SIS en 12 de 85 pacientes con hernia incisional. Después de un seguimiento de 13 meses, no encontraron recidivas tras la utilización de este material.
En un estudio experimental de reparación de defectos de pared abdominal en ratas, Soiderer et al24 compararon SIS con otras bioprótesis de colágeno. El tiempo de estudio fue de 4 y 8 semanas. No encontraron diferencias en el comportamiento entre los diferentes colágenos, pero sí respecto al polipropileno.
Zheng et al25, en un estudio histológico, empleando además PCR, demostraron la presencia de células y ADN porcino en la bioprótesis. Esos autores ensayaron en animales (ratón y conejo) la biocompatibilidad de SIS y observaron una fuerte reacción inflamatoria en la zona de los implantes, con importante tasa de linfocitos. Creemos que ese trabajo, no citado por los diferentes autores que han ensayado SIS, es de especial relevancia, ya que nosotros hemos podido corroborar los mismos hallazgos, al realizar el estudio de caracterización de la prótesis.
Puccio et al26 realizaron un estudio comparativo entre polipropileno, poliglactina y SIS en reparaciones de hernia inguinal. El seguimiento medio fue de 12 meses. No hubo recidiva herniaria en ese tiempo. El bienestar, la recuperación y el dolor del paciente fueron mejor en los pacientes en los que se empleó SIS.
Nuestro grupo18 llevó a cabo un estudio experimental comparando una prótesis compuesta, formada por polipropileno y poliuretano (PL-PU99) y SIS, en un modelo de cierre temporal en conejo. A las 2 semanas de los implantes, se consiguió un comportamiento similar en la interfaz peritoneal. La reacción macrofágica a los implantes fue similar, y solamente hubo diferencias en el espesor del neoperitoneo formado. Esto tuvo repercusión en la formación adhesiva, que fue mayor con los implantes de SIS.
Quizá uno de los trabajos clínicos más importantes realizados con esta bioprótesis, aunque retrospectivo, sea el de Helton et al27, que intervinieron por vía laparoscópica (13 pacientes) o abierta (40) a 53 pacientes con hernias incisionales. Dependiendo de las afecciones, hubo 22 casos de cirugía limpia, 12 de limpia-contaminada, 1 de contaminada y 18 de sucia. El seguimiento medio de los pacientes fue de 14 meses. A pesar del corto seguimiento, hubo recidiva herniaria en un 17% de los casos de cirugía contaminada. En los implantes realizados en cirugía limpia no se observaron complicaciones.
Permacol® (fig. 2)Es un colágeno porcino tratado con hexametilendilsocianato (HMDI) que mantiene los enlaces en la molécula de colágeno, lo que ayuda a la estabilidad y lo hace resistente al efecto de la degradación enzimática mediado por colagenasas o metaloproteinasas28.
Permacol® permite al tejido receptor la infiltración celular y la angiogénesis, y se integra a él. En estudios experimentales, Zheng et al29 han demostrado que esta bioprótesis tiene valores de resistencia a la rotura similares a los del polipropileno a los 90 días del implante.
Escasos y aislados estudios clínicos han sido publicados empleando Permacol®. Adedeji et al30 realizaron un implante con esta prótesis en un defecto de la pared abdominal, con buenos resultados. Cobb et al31, en un estudio clínico retrospectivo, tras efectuar reparaciones por laparoscopia, compararon dos biomateriales: una prótesis compuesta de polipropileno y politetrafluoroetileno y otra de Permacol®. De un total de 60 pacientes, registraron 4 recidivas herniarias tras el implante de Permacol®, frente a 1 (1,2%) de un total de 84 implantes con el biomaterial compuesto. Hubo infección en el 3,3% tras el implante de Permacol® y el 2,4% en la prótesis compuesta. Como complicaciones graves encontraron una fístula intestinal tras el implante de la prótesis compuesta.
Parker et al32 implantaron Permacol® en 9 pacientes con historia de infección previa de pared, con buenos resultados tras una revisión media de 18 meses. Solamente observaron una recurrencia herniaria. Liyanage et al33 repararon un defecto masivo en la pared anterior del abdomen utilizando este biomaterial, además en un paciente portador de una colostomía. Saettele et al34 trataron con éxito un caso de infección protésica sustituyendo con Permacol® el material infectado.
Catena et al35, en un estudio prospectivo en 7 pacientes, todos ellos con contaminación de prótesis, realizaron la reparación herniaria con Permacol®. Tras un seguimiento medio de 11 meses, no observaron recidiva alguna ni infección.
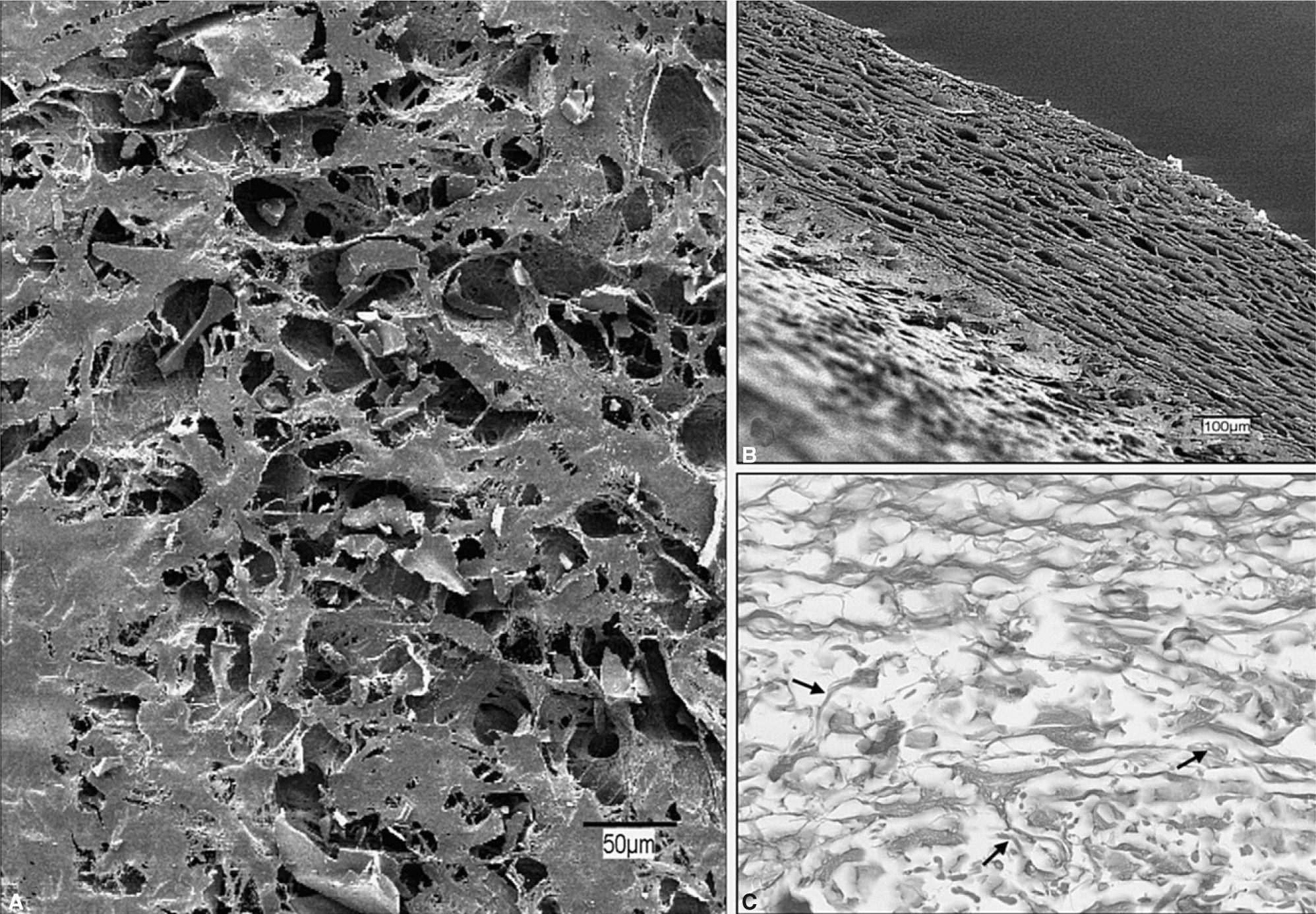
AlloDerm® (fig. 3)Es una prótesis de colágeno acelular de procedencia humana. Fue usada por primera vez en 1992 para reemplazar piel en quemados36. Después se ha destinado a múltiples usos, como la reparación de defectos en cirugía plástica37 y otorrinolaringología38, y también en el trata miento de defectos herniarios de la pared abdominal39–41.
AlloDerm®. A: aspecto general de la superficie protésica (×200). B: espesor del biomaterial (×100). C: el estudio al microscopio óptico mostró una disposición irregular de los haces de colágeno, entre los que aparecían pequeñas fibras de elastina (flechas) (tricrómico de Masson, ×200)
En los últimos años, y debido a la aparición de complicaciones de infección tras el implante de otros biomateriales, han ido surgiendo estudios experimentales y clínicos que emplean esta bioprótesis.
Así, Menon et al42 realizaron un trabajo experimental en conejos en el que repararon defectos totales en la pared anterior del abdomen, de 7 x 3 cm, utilizando AlloDerm® o MicroMesh®. A los 30 días no encontraron formación herniaria en ninguno de los grupos de estudio. No hubo adherencias en los implantes de AlloDerm®, pero sí en el MicroMesh®. La resistencia a la tracción no ofreció diferencias estadísticamente significativas entre los dos materiales.
Silverman et al43 implantaron AlloDerm® en 13 pacientes con infección y contraindicación formal de utilizar otro tipo de material. No encontraron hernias recurrentes.
En un trabajo experimental en rata, Carbonell et al44 compararon varios materiales, entre los que se incluían DualMesh® pretratado con plata y clorhexidrina y Allo-Derm®. A los 5 días obtuvieron mejores resultados con el PTFEe pretratado (no mencionan el comportamiento en particular del AlloDerm®).
Butler et al45, en 13 pacientes oncológicos, realizaron reparaciones de defectos parietales localizados en el tórax y el abdomen. El seguimiento medio de los pacientes fue de 6,4 meses. Las complicaciones consistieron en seroma, hematoma, fístula intestinal y dehiscencia aguda de la reparación, con exposición al exterior del material protésico.
Kim et al46, en un trabajo retrospectivo, intervinieron a 29 pacientes con problemas críticos de la pared abdominal empleando prótesis de AlloDerm®. La media de seguimiento fue de 182 días. Un paciente falleció por neumonía y, de los demás, presentaron recidiva 3 pacientes que tenían importante obesidad; uno de ellos, además, era portador de un estoma.
Schuster et al47 realizaron su estudio sobre 18 pacientes con pared abdominal contaminada. Tuvieron 9 recurrencias (50%) en un período de seguimiento medio de 9,1 meses. Para esos autores, los resultados no justificaban el coste del producto frente a otras alternativas como las prótesis reabsorbibles tipo Vicryl®.
Tras el implante de la bioprótesis en 11 pacientes con hernia inguinal y contaminación bacteriana, Albo et al48 no observaron recidivas tras un seguimiento medio de 9 meses. Tuvieron 2 infecciones en las que no fue necesario retirar la prótesis.
Patton et al49, en un trabajo retrospectivo, revisaron a 67 pacientes con complicaciones en la pared abdominal por infección, fístula e incluso evisceración. Encontraron 16 casos de infección residual (la mayoría superficiales), aunque 5 requirieron reintervención y 2, retirar la prótesis; 12 pacientes presentaron recidiva herniaria. El seguimiento de los pacientes fue de 10,6 meses.
De las tres bioprótesis revisadas, Surgisis® y AlloDerm® son las más empleadas y las que más aportaciones a la literatura han dado, y Permacol®, probablemente por ser la de más reciente aparición, es la menos ensayada clínica y experimentalmente.
ConclusionesLas bioprótesis están emergiendo como formas de tratamiento de los trastornos de la pared abdominal afectada por infección secundaria a la colocación previa de un biomaterial que ha sufrido contaminación bacteriana, que en muchos casos requiere el recambio de la prótesis. También podrían ser utilizadas como soportes temporales de la pared, en casos de “pared abdominal catastrófica” (postraumáticos, sépticos, etc.). De esta forma, se podría iniciar un proceso reparativo, al que seguiría un tratamiento definitivo, en función del defecto o la afección existente en la pared abdominal. La experiencia clínica es todavía muy escasa, y es necesario realizar estudios prospectivos con seguimientos a medio-largo plazo (mínimo 5 años) que evalúen el rendimiento real y la relación coste-beneficio de estos materiales protésicos.