La mayoría de los ensayos clínicos realizados sobre pacientes con cáncer escamoso anal (CEA) excluyen pacientes inmunodeprimidos. El objetivo del presente estudio es comparar las características y los resultados oncológicos entre pacientes con CEA inmunocomprometidos e inmunocompetentes.
MétodosEstudio multicéntrico comparativo retrospectivo que incluye 2 cohortes consecutivas de pacientes, inmunocomprometidos e inmunocompetentes, diagnosticados de carcinoma escamoso anal. Se han investigado las características de los pacientes, los tratamientos realizados, la respuesta clínica al tratamiento con quimiorradioterapia (QRT), la recidiva local o a distancia, la supervivencia global (SG) y la supervivencia libre de enfermedad (SLE).
ResultadosDe enero 2012 a diciembre 2017 hemos estudiado a 84 pacientes, 47 (55,6%) mujeres, afectos de CEA, de los cuales 22 (26%) han sido pacientes inmunocomprometidos y 62 (74%) inmunocompetentes. Los pacientes inmunocomprometidos fueron más jóvenes (53 vs. 61 años; p=0,001), con un menor tamaño tumoral (p=0,044), y presentaban un mayor consumo de tabaco (p=0,034) y de drogas de uso parenteral (p=0,001). No se objetivaron diferencias significativas en los tratamientos administrados (p=0,301), tampoco difirió la respuesta clínica a la QRT (83 vs. 100%). Tampoco se observaron diferencias significativas en la supervivencia global (60 vs. 64%; p=0,756) o en la supervivencia libre de enfermedad a 5 años (SLE) (65 vs. 68%; p=0,338).
ConclusionesEn el presente estudio no se observaron diferencias significativas en relación con los resultados oncológicos a largo plazo entre pacientes inmunocompetentes e inmunocomprometidos diagnosticados de CEA, con un grado de cumplimiento del tratamiento similar. Esta evidencia podría deberse al estrecho seguimiento y buen control terapéutico de pacientes infectados por HIV.
Most evidence, including recent randomized controlled trials, analysing anal squamous cell carcinoma (SCC) do not consider immunocompromise patient population. The aim of this study was to compare clinical and oncological outcomes among immunocompetent and immunocompromised patients with anal squamous cell carcinoma.
MethodMulticentric retrospective comparative study including 2 cohorts of consecutive patients, immunocompetent and immunocompromised, diagnosed with anal SCC. This study evaluated clinical characteristics, clinical response to radical chemoradiotherapy (CRT) and long-term oncological results including both local and distant recurrence, overall survival (OS) and disease-free survival (DFS).
ResultsA total of 84 patients, 47 (55.6%) female, diagnosed with anal SCC from January 2012 to December 2017 were included, 22 (26%) and 62 (74%) patients in immunocompromised and immunocompetent groups respectively. Patients in immunocompromised group were significantly younger (53 vs. 61 years; P=0.001), with smaller tumoral size (P=0.044) and reported higher rates of substance abuse.
including tobacco use (P=0.034) and parenteral drug consumption (P=0.001). No differences were found in administered therapies (P=301) neither in clinical response to chemoradiotherapy (83 vs. 100%). Moreover, similar 5-year OS (60 vs. 64%; P=0.756) and DFS (65 vs. 68%; P=0.338) were observed.
ConclusionThe present study shows no significant differences in long-term oncological results among immunocompetent and immunocompromised patients diagnosed with anal SCC, with a similar oncologic treatment. This evidence might be explained due to the close monitoring and adequate therapeutic control of HIV positive patients.
La epidemiologia del cáncer escamoso anal (CEA) ha cambiado sustancialmente a lo largo de la segunda mitad del siglo XX. A pesar de ser una enfermedad poco frecuente, su incidencia y mortalidad se han incrementado a lo largo de las últimas décadas. En 2016, el CEA registró una incidencia de 1,8 por 100.000 habitantes de EE. UU., siendo la 26.ª enfermedad maligna más frecuente en aquel país1. En los últimos 10 años, el porcentaje de casos de CEA se ha incrementado en un 2-3% por año, así como los casos de fallecimiento debido a este tumor (3% por año)2.
Se conocen varios factores asociados al riesgo de desarrollar un CEA, como son la edad avanzada, el consumo de tabaco, el aumento del número de parejas sexuales, el sexo anal receptivo, los antecedentes de cáncer cervical, vulvar o vaginal, la infección anogenital por virus del papiloma humano (HPV) y la supresión del sistema inmunitario, bien por afecciones, como la infección por el virus de la inmunodeficiencia humana (HIV), o bien inducida por fármacos inmunosupresores (IMS), como los utilizados en el trasplante de órganos3.
El HPV es causa necesaria, aunque no suficiente, para la producción del cáncer anal. Se han identificado más de 150 tipos diferentes de HPV; unos tienen afinidad por la piel, y son causantes de lesiones cutáneas y otros por las mucosas, con capacidad de infectar el tracto anogenital. De ellos, unos son de alto riesgo u oncogénicos y otros de bajo riesgo, causantes de condilomas anogenitales.
La prevalencia media en Europa de infección por HPV en mujeres (con citología vaginal normal) es del 8-13%, siendo más alta entre las mujeres jóvenes, y del 25-30% y del 40-60% entre los varones heterosexuales y hombres que mantienen sexo con hombres (MSM), respectivamente4,5. El serotipo 16 del HPV es el que mayoritariamente (85%) está relacionado con el CEA, seguido en menor grado por el serotipo 18 (7%). Las alteraciones citológicas provocadas por este virus en el margen y canal anal son bien conocidas, sin embargo, los mecanismos de progresión hacia el cáncer escamoso o por el contrario los de regresión de las lesiones, no lo son tanto6.
En aquellas situaciones en que el sistema inmune está deteriorado, por infección por HIV o por tratamiento con IMS, la probabilidad de lavado del virus disminuye ostensiblemente, pudiendo favorecer la progresión de lesiones citológicas displásicas hasta neoplasias infiltrativas. Por tanto, podría suponerse que los pacientes inmunosuprimidos presentarían neoplasias anales más agresivas o avanzadas y con peores resultados oncológicos que los pacientes con cáncer anal e inmunocompetentes. En este sentido, los pacientes infectados por HIV constituirían un grupo de alto riesgo. Sin embargo, en estos pacientes con un mayor control clínico y con la implementación de terapias antirretrovirales más agresivas, se han obtenido resultados en el tratamiento de las lesiones anales asociadas al HPV similares a la población no infectada por HIV7, sugiriendo que aquellos pacientes HIV bien controlados, con cifras de CD4 normales, podrían comportarse como inmunocompetentes7–10.
El objetivo del presente trabajo ha sido caracterizar el curso de esta enfermedad, tanto en pacientes inmunocompetentes (IC) como inmunodeprimidos (ID), comparando los datos relativos a las características de los pacientes y resultados del tratamiento, en términos de recidiva, progresión y supervivencia.
MétodoSelección de pacientesEstudio retrospectivo que incluye una serie consecutiva de pacientes tratados por carcinoma escamoso de margen y canal anal en la Comunidad Autónoma del País Vasco durante el periodo comprendido desde enero 2012 hasta diciembre 2017. Para el estudio se obtuvo la Autorización del Comité de ética de la Investigación de Euskadi (CEIm-E) con fecha 10 de noviembre 2017.
Se han extraído los datos de la base clínico-administrativa conjunto mínimo básico de datos básicos (CMBD) del Sistema Nacional de Salud y de datos del Osabide Global (historia clínica sociosanitaria integrada del Servicio Vasco de Salud, Osakidetza), recogidos desde la herramienta Oracle Bussiness Inteligence Enterprise Edition (OBIEE). Se realizó una preselección con códigos internacionales (CIE) para datos topográficos (ano y región perianal) y morfológicos (carcinoma escamoso, carcinoma de células escamosas, carcinoma de células basales, carcinoma cloacogénico y carcinoma verrucoso), recogiéndose todos los pacientes confirmados y tratados con informe anatomopatológico de carcinoma anal escamoso.
La clasificación para la estadificación clínico tumoral utilizado fue el del TNM 2009 (AJCC, 7th edition).
Variables a estudioSe recogieron los datos relativos a edad, sexo, ASA, antecedentes de alcoholismo, tabaquismo, adicción a drogas intravenosas, presencia de diabetes mellitus, presencia o antecedentes de enfermedad de cuello uterino o vagina asociado al virus HPV (CIN o VIN), infección por HIV y su estadio (Clasificación CDC 1993), tratamientos efectuados, tamaño y estadificación tumoral, tiempo, tipo y tratamiento de la persistencia y/o recurrencia tumoral.
Fueron considerados como pacientes ID aquellos con historia de trasplante de órganos sólidos, enfermedades malignas de médula ósea, infectados por HIV con CD4 inferiores a 200 y/o en estadio C de sida (C1, C2, C3, A3 y B3), con malnutrición severa (pérdida rápida de peso superior al 10%, albumina <2 y colesterol <100) y en tratamiento esteroideo (más de 30mg) durante un periodo superior al año en el momento del diagnóstico del CEA. La diabetes y el alcoholismo fueron tenidas en cuenta como comorbilidad.
De los pacientes infectados por el HIV se recogieron además, el año de diagnóstico de la infección, el estadio de la infección por HIV, el nadir de CD4 (número más bajo de CD4), el tratamiento antirretroviral (TAR), el tratamiento iniciado con 3 fármacos (TARGA), el tratamiento subóptimo previo (inicio del TAR con mono o doble terapia), la proporción de tiempo de diagnóstico de HIV en TAR (tiempo en TAR dividido entre tiempo total conocido HIV), el lapso de tiempo (en meses) desde el diagnóstico de HIV a diagnóstico del CEA, los CD4 en el momento de inicio de TAR, los CD4 en el momento de diagnóstico de cáncer anal, la carga viral (CV) en el momento del diagnóstico de cáncer anal (indetectable vs. detectable), proporción de tiempo con CV indetectable (tiempo con CV indetectable dividido entre el tiempo desde que se conoce la infección por HIV) y la proporción de tiempo con CV indetectable en TAR (tiempo con CV indetectable dividido entre tiempo en TAR triple-adherencia).
En el esquema de tratamiento quimio-radioterápico se consideró tratamiento subóptimo cuando la dosis de radioterapia fuera inferior a 50Gy o que tuviera dosis reducidas de quimioterapia. Los pacientes fueron examinados a los 6 meses tras completar el tratamiento con intención curativa tras la quimiorradioterapia (QRT) mediante exploración física y pruebas de imagen.
El seguimiento finalizó el día 31 de diciembre 2019.
Estudio estadísticoLas variables cuantitativas se presentan con números absolutos y su distribución mediante medidas de tendencia central adecuadas: media o mediana y su rango intercuartílico. El análisis univariante cualitativo se realizó con el test de Chi-cuadrado o el exacto de Fisher cuando fue preciso. Se realizó un estudio de la normalidad con el test de Kolmogorov-Smirnov, y según sus resultados se analizaron las variables cuantitativas con el test de la t de Student o Mann-Whitney. El estudio de supervivencia global (SG) y libre de enfermedad (SLE) y la aparición de recidivas se analizaron con el método de Kaplan-Meier, expresados como medianas y su IC al 95%. La prueba de log-rank fue utilizada para el análisis univariado de curvas de supervivencia. Para comprobar la heterogeneidad de las muestras se utilizó el test de la U de Mann-Whitney. Todas las pruebas estadísticas se realizaron con el software SPSS v. 26.0 (SPSS®, Chicago, EE. UU.).
Se han seguido las directrices STROBE.
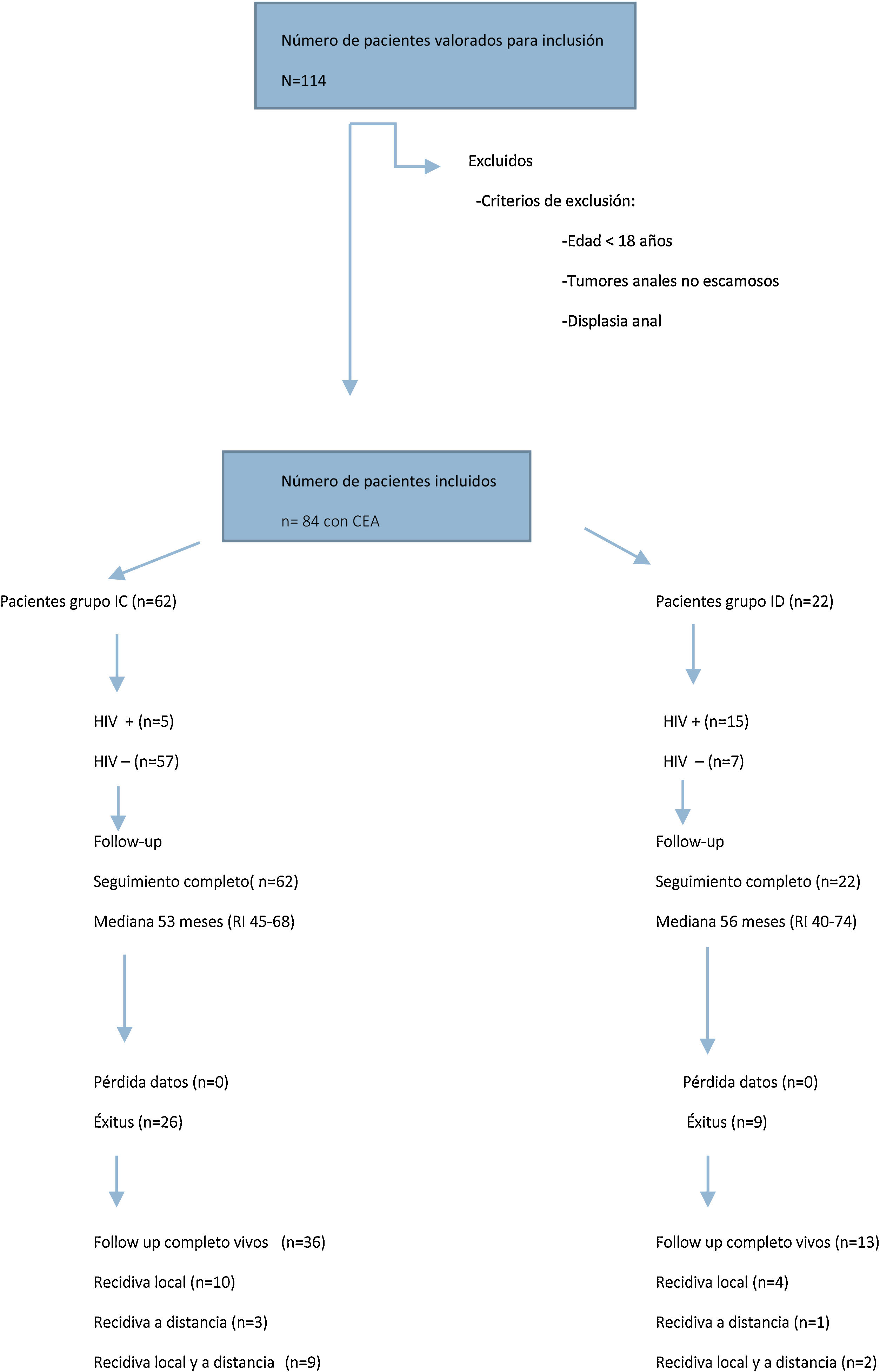
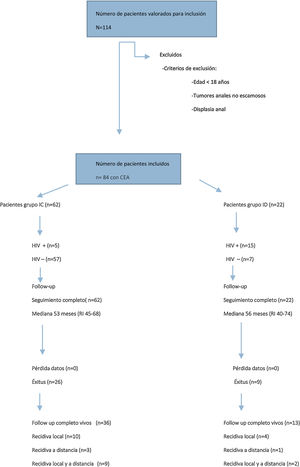
ResultadosCaracterísticas de los pacientes y estadificación tumoralDe enero de 2012 a diciembre de 2017, se registraron 84 pacientes tratados consecutivamente por CEA, de los cuales 22 (26%) fueron pacientes ID y 62 (74%) pacientes IC (fig. 1).
En la tabla 1 se presentan los datos clínico-epidemiológicos y de estadificación tumoral de ambos grupos. En el grupo de pacientes ID se incluyeron 15 pacientes con enfermedad de sida (13 en estadio C y 2 en estadio B3), un paciente con linfoma B, un paciente con mieloma múltiple, un paciente con trasplante renal, 2 pacientes con anorexia y malnutrición severa y 2 pacientes con tratamiento prolongado de corticoides. Dentro del grupo de pacientes IC, 5 pacientes se encontraban infectados por HIV (3 en estadio A2 y 2 en estadio B1).
Características de pacientes inmunocompetentes e inmunodeprimidos
| Pacientes 84 | ICn=62 | IDn=22 | Valor de p |
|---|---|---|---|
| Mujer | 36 (58,1%) | 11(50%) | 0,513* |
| Edad (mediana) | 61 (RI: 52-76) años | 53 (RI: 47-55) años | 0,001** |
| ASA I/II | 36 (58%) | 7 (31,8%) | 0,054* |
| ASA III/IV | 26 (41,9%) | 15 (68,2%) | |
| Fumadores | 35 (56,5%) | 18 (81,8%) | 0,034* |
| Diabetes mellitus | 9 (14,5%) | 2 (9,1%) | 0,517* |
| Drogas endovenosas | 5 (8,1%) | 10 (45,5%) | 0,001* |
| Enfermedad CIN | 8 (22%) | 6 (54%) | 0,147* |
| HIV | 5 (5,9%) | 15 (17,8%) | 0 |
| Estadio cTNM | |||
| T1 | 7 (11,3%) | 8 (36,4%) | 0,044* |
| T2 | 30 (48,4%) | 7 (31,8%)) | |
| T3 | 16 (25,8%) | 6 (27,3%) | |
| T4 | 9 (14,5%) | 1 (4,5%) | |
| N− | 39 (62,9%) | 18 (81,8%) | 0,103* |
| N+ | 23 (37,2%) | 4 (18,1%) | 0,956* |
| M1 | 3 (4,8%) | 1 (4,5%) | 0,144* |
| Estadio | |||
| I | 6 (9,7%) | 7 (1,8%) | |
| II | 31 (50%) | 10 (45,4%) | |
| IIIa | 4 (6,5%) | 1 (4,5%) | |
| IIIb | 18 (29%) | 3 (13,6%) | |
| IV | 3(4,8%) | 1 (4,5%) | |
| Tamaño tumoral medio (cm) | 6 | 3 | 0,133** (DE: 2,87-3,56) |
ASA: American Society of Anesthesiologists Physical Status Classification; DE: desviación estándar; HIV: virus de la inmunodeficiencia humana: IC: inmunocompetente; ID: inmunodeprimido; CIN: cervical intraephitelial neoplasia.
Al comparar ambos grupos no existieron diferencias significativas en cuanto a sexo, ASA preoperatorio, enfermedad de cuello uterino asociado al virus HPV o presencia de diabetes. En cambio, sí observamos diferencias entre ambos grupos relativas a la edad media de aparición del CEA, la tasa de fumadores y de adicción a drogas intravenosas.
Con respecto a la estadificación clínico tumoral hubo diferencias significativas en la clasificación T, con un mayor número de pacientes del grupo ID con estadios iniciales; sin embargo, el número de pacientes con metástasis, ganglionares o a distancia, fue similar en ambos grupos. La media del tamaño tumoral fue de 4,6 (0,7-14; DE: 2,87) cm y de 3,5 (0,5-15; DE: 3,56), en el grupo IC e ID, respectivamente, sin diferencia significativa.
En la tabla 2 se presentan los datos clínico-analíticos de los pacientes infectados por HIV de ambos grupos y sus correspondientes tratamientos antirretrovirales; como puede observarse en el momento del diagnóstico del CEA, no existían diferencias entre ambos grupos.
Pacientes infectados por HIV
| IC (n=5) | ID (n=15) | Valor de p | |
|---|---|---|---|
| Nadir CD4 | 181 | 114 | 0,142* |
| Linfocitos CD4 en el momento del diagnóstico tumoral | 450 | 491 | 0,735* |
| Estadio | |||
| A | 3 (60%) | 0 | 0,001** |
| B | 2 | 2 | |
| C | 0 | 13 (86%) | |
| TARGA | 4 (80%) | 10 (66,6%) | 0,517*** |
| Tratamiento subóptimo previo | 3 (60%) | 7 (46,5%) | 0,500*** |
| Proporción de tiempo de diagnóstico de VIH en TAR | 66,6% | 64,7% | 0,933* |
| Tiempo de diagnóstico de VIH a cáncer anal | 121,8 | 160 | 0,395* |
| CV detectable en diagnóstico de cáncer anal | 1 (20%) | 4 (26,6%) | 0,634*** |
| Proporción de tiempo con CV indetectable | 40,2% | 41,40% | 0,735* |
| Proporción de tiempo con CV indetectable en TAR | 47,3% | 38,6% | 0,553* |
CV: carga viral; IC: inmunocompetente; ID: inmunodeprimido; Nadir CD4: punto bajo de CD4; TAR: tratamiento antirretroviral; TARGA: tratamiento antirretroviral intensificado.
Setenta y cinco pacientes (89%) fueron tratados con intención curativa a dosis plenas, y 9 con tratamiento subóptimo (8 IC). Recibieron dosis subóptimas de RT 6 pacientes con propósito hemostático o control clínico local, todos ellos mayores de 80 años, 4 pacientes ASA IV y 2 pacientes alcohólicos (uno de ellos tratado de adenocarcinoma de próstata). Se administró QT a dosis subóptimas a 2 pacientes con antecedentes de alcoholismo (uno ASA IV y el segundo tratado con RT por adenocarcinoma de próstata). El paciente ID fue un varón HIV+, T1N0M1 con dosis subóptima de QT por toxicidad (CD4 131 en el momento del diagnóstico). Los tratamientos realizados pueden observarse en la tabla 3. En el total de la serie, el 51% recibió QRT o QT/RT solas (por radiación pélvica previa o contraindicación para la QT), al 26% se le realizó una resección local aislada y en un 22% se les administró QRT o RT tras una resección local por presentar bordes positivos o insuficientes. No hubo diferencias entre los diferentes tratamientos utilizados en ambos grupos. Únicamente en una paciente se realizó una amputación abdomino-perineal como primera intención (paciente ID, ASA IV, estadio C por enfermedad de sida con radioterapia previa por cáncer de vulva).
Tratamiento inicial
| Pacientes 84 | IC (n=62) | ID (n=22) | Valor de p |
|---|---|---|---|
| QTRT | 24 (38,7%) | 7 (31,9%) | 0,301* |
| RTao QTb | 9 (14,5%) | 3 (13,6%) | |
| Quirúrgico | |||
| RL | 14 (22%) | 8 (36%) | |
| RL+QRT/RT | 14 (22%) | 3 (13,5%) | |
| AAP | 1 (4,5%) | ||
| Tratamiento sintomático | 1 (1,6%) |
AAP: amputación abdominoperineal; IC: inmunocompetente; ID: inmunodeprimido; QT: quimioterapia; QTRT: quimiorradioterapia; RL: resección local; RT: radioterapia.
Del total de los 43 pacientes que recibieron quimioterapia, el esquema más utilizado fue mitomicina C con 5-Fu (34 pacientes, 80%). Las dosis de radioterapia fueron óptimas en 46 pacientes (92%) con una media de 55,5Gy (50-63). De los 57 pacientes que recibieron radioterapia, 4 recibieron dosis subóptimas (3 IC y 1 ID). De estos 4 pacientes, 2 presentaron recidiva loco-regional y un paciente una recidiva a distancia.
De los pacientes tratados con QRT con intención radical, 4 (13%), todos ellos del grupo IC, presentaron persistencia y/o progresión tumoral, precisando en 3 de ellos una amputación abdomino perineal y una colostomía paliativa. El 100% de los pacientes ID presentaron respuesta clínica completa al tratamiento
Recidiva y tratamientoLa mediana de tiempo hasta la recidiva entre los pacientes IC fue de 28 meses (RI: 7-53) frente a 40 meses (RI: 15-68) en ID (p=0,133, test de la U de Mann-Whitney). Como podemos ver en la tabla 4, la tasa de recidiva global fue similar en ambos grupos, 35,5 y 31,8% en IC e ID, respectivamente. La forma más frecuente de recidiva fue la recidiva loco-regional (30% IC vs. 27% ID); y los lugares donde más frecuentemente diseminaron los tumores fue en pulmón, hígado y hueso.
Recidiva pacientes inmunocompetentes e inmunodeprimidos
| Recidiva | Locorregional | Locorregional+distancia | Distancia | p=0,861* |
|---|---|---|---|---|
| IC | 10 (16,1%) | 9 (14,5%) | 3 (4,8%) | |
| ID | 4 (18,2%) | 2 (9,1%) | 1 (4,5%) |
IC: inmunocompetente; ID: inmunodeprimido.
Con relación al tratamiento de las recurrencias, no encontramos diferencias entre ambos grupos, como se señala en la tabla 5. De los 16 pacientes que precisaron cirugía, a 11 se les realizó una amputación abdomino perineal, a 3 sendas resecciones locales y en 2 casos, colostomías.
Tratamiento de la recidiva
| Pacientes 29 | IC (n=22) | ID (n=7) | Valor de p |
|---|---|---|---|
| QTRT | 1 (4,5%) | 1 (14,2%) | 0,123* |
| RT o QT | 5 (22,7%) | 4 (57,4%) | |
| Qco.±(QRT/RT/QT) | 14 (63,6%) | 2 (28,4%) | |
| Paliativo | 2 (9%) |
IC: inmunocompetente; ID: inmunodeprimido; Qco.: quirúrgico; QT: quimioterapia; QTRT: quimiorradioterapia; RT: radioterapia.
Al finalizar el estudio comprobamos que la tasa global de colostomía fue superior en el grupo de pacientes IC (30 vs. 2%; p=0,045).
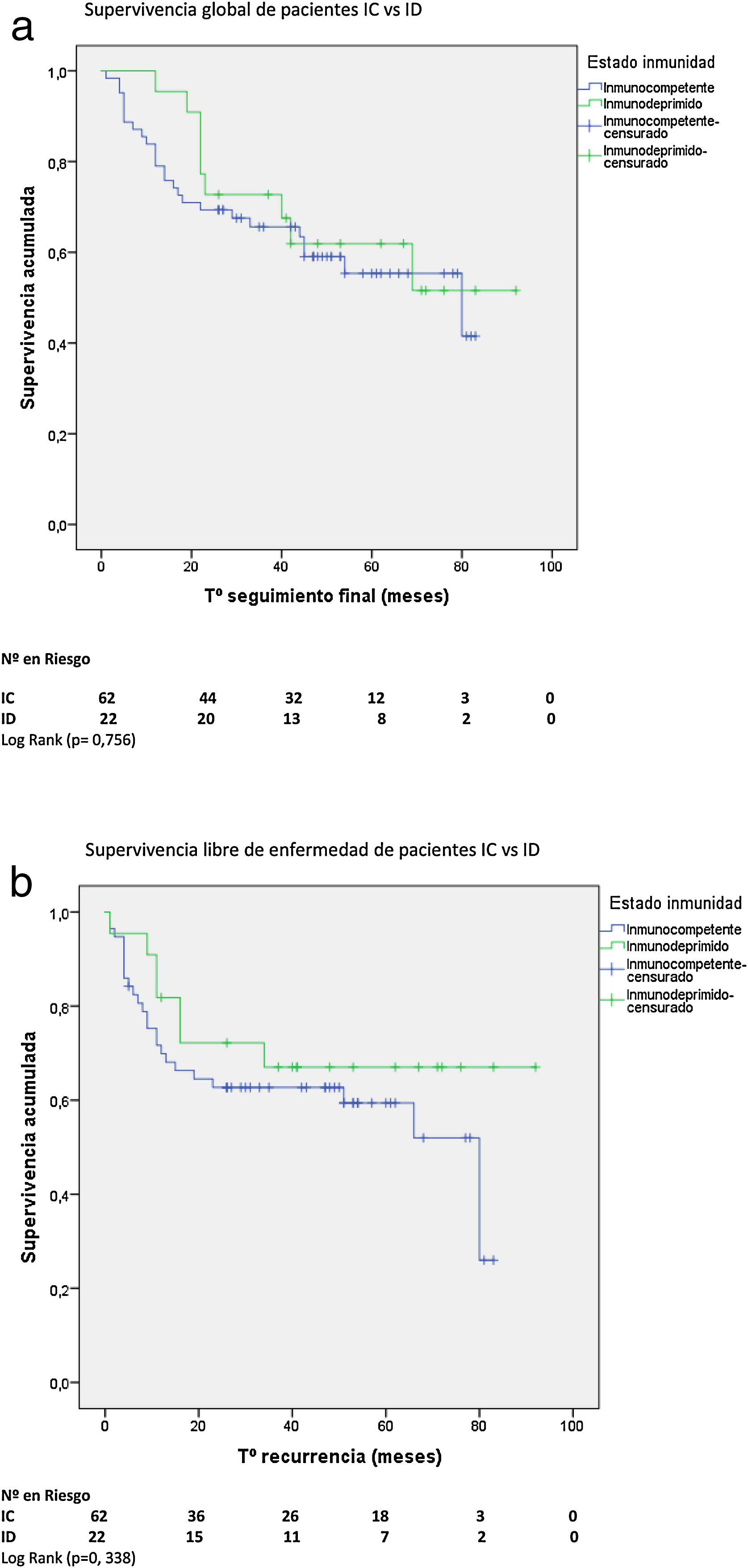
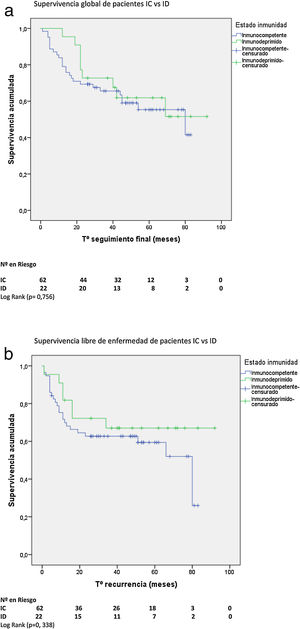
Supervivencia global y libre de enfermedadCon una mediana de supervivencia de 62 meses (IC 95%: 53-72) para pacientes IC y de 71 meses (IC 95%: 59-83) para pacientes ID, no hubo diferencia significativa en la supervivencia global (SG) a 5 años. Tampoco hubo diferencia en la supervivencia libre de enfermedad (SLE) a 5 años entre ambos grupos con una mediana de SLE para pacientes IC de 80 meses (IC 95%: 38-121) vs. 82 meses para ID (IC 95%: 59-103) (figs. 2A y B).
No hubo diferencias en la SG ni en la SLE entre pacientes HIV+ y HIV−. Con una mediana de SG de 76 meses (IC 95%: 58-94) para pacientes HIV+ y de 62 meses (IC 95%: 50-74) para HIV−, y una mediana de SLE para pacientes HIV+ de 80 meses (IC 95%: 14-146) vs. 82 meses (IC 95%: 58-105) para HIV−.
DiscusiónEl principal objetivo en este estudio comparativo ha sido observar las diferencias en las características clínicas y resultados oncológicos entre los pacientes IC e ID con CEA. En nuestro estudio no hemos encontrado diferencias significativas en cuanto a la SG, SLE, tipo de tratamiento, tolerancia al mismo, regresión tumoral tras QRT y recidiva tumoral entre ambos grupos. Sí encontramos diferencias en algunas características de los pacientes y las formas de presentación del tumor.
Los pacientes del grupo ID de nuestro estudio resultaron ser más jóvenes y presentaron tumores de menor tamaño en el momento del diagnóstico del CEA. El hecho de que los tumores fueran más pequeños hizo que la tasa de resección local fuera mayor entre los pacientes ID. Estos hallazgos son similares a los observados por autores como Oehler-Jänne et al.11 donde en un estudio multicéntrico recogen una larga cohorte de pacientes HIV positivos y negativos observando que los pacientes infectados por el HIV presentaban estadios clínicos y patológicos T más precoces y con similares resultados en términos de supervivencia. En nuestra serie tampoco hemos encontrado diferencias en la SG ni SLE entre los pacientes IC e ID, y pensamos, al igual que estos autores, que tanto el diagnóstico más temprano como el control del tratamiento de los pacientes infectados por HIV que se realiza en las unidades de enfermedades infecciosas, son posibles motivos por los que los resultados oncológicos sean similares al grupo de pacientes no HIV.
La inmunodeficiencia incrementa la actividad del HPV, por lo que sería de esperar que los pacientes infectados por HIV tuvieran lesiones neoplásicas asociadas al HPV más avanzadas y de peor pronóstico. Sin embargo, entre los pacientes infectados por el HIV, el tratamiento antirretroviral intensificado ha cambiado la historia natural de la enfermedad, viéndose una disminución de la incidencia de sarcoma de Kaposi, de linfomas no Hodgkin o de otros tumores asociados a la inmunodeficiencia por HIV9. No obstante, los cambios que estos tratamientos más activos puedan tener sobre el desarrollo y progresión del CEA, así como de la tolerancia y de la respuesta a su tratamiento en este grupo de pacientes, son menos conocidos10. En nuestro estudio, aquellos pacientes HIV positivos con más de 200 CD4/mm3 y/o en estadio A1-2 y B1-2 de la CDC de la enfermedad asociada al HIV, fueron incluidos como pacientes IC, entendiendo que, con un estado inmunitario controlado, su inmunocompetencia pudiera ser similar a la de los pacientes no infectados por el HIV
En la época previa a la utilización del tratamiento intensificado antirretroviral, los pacientes HIV positivos además de un peor pronóstico también experimentaban mayor toxicidad a la QRT en comparación con pacientes IC8,12. Con la entrada del TARGA, la supervivencia de pacientes HIV ha aumentado sustancialmente y los resultados en este grupo de pacientes con CEA y tratados con QRT también han mejorado13–17; probablemente este hecho esté relacionado con que los pacientes HIV positivos que presentan un estado inmunológico óptimo pueden tolerar tratamientos con esquemas de RT a dosis plenas y con fármacos más activos18.
La QRT constituye el tratamiento estándar del CEA en pacientes HIV-negativos, con el que se consiguen excelentes resultados, con control local de la enfermedad superior al 80%19,20. En un reciente estudio publicado por Camandaroba et al.21 observan que los pacientes HIV positivos en tratamiento antirretroviral intensificado tratados con QTRT necesitan más tiempo para lograr respuestas completas, y por tanto recomiendan esperar más para obtener la toma de decisión terapéutica con el propósito de disminuir las AAP. Uno de los factores fundamentales para la mejora en la tasa de recidiva local de los CEA es la tolerancia y el cumplimiento de la dosis planificada e intensificada de RQT11,13,22. En nuestro estudio el grado de toxicidad no fue un objetivo en sí mismo, sin embargo, sí lo fue el grado de cumplimentación del tratamiento, la necesidad de cambio del esquema, la necesidad de disminuir la dosis o la suspensión del mismo. Los pacientes ID que precisaron tratamiento con QRT con fines curativos consiguieron realizarlo sin necesidad de suspender el mismo, con dosis de radioterapia óptimas en todos ellos y con una respuesta clínica completa del 100 y 84% de los pacientes ID e IC, respectivamente. Ninguno de los 10 pacientes HIV positivos tratados con QTRT precisó una AAP. Pensamos que el hecho de haber alcanzado en la mayoría de los pacientes unas dosis óptimas de tratamiento con la RT, con esquemas de QT más eficaces, como la mitomicina C, y junto a un buen control y manejo de los pacientes infectados por HIV, hizo que se obtuviera una buena respuesta oncológica locorregional.
Los mecanismos por los que los retrovirales favorecen la tolerancia y la respuesta a la QRT en los CEA son aún discutidos. Los inhibidores de la proteasa para el HIV han demostrado que radiosensibilizan las células infectadas in vitro23, si bien no se conocen su efecto in vivo. En nuestra serie de pacientes HIV, la media de CD4 en el momento del diagnóstico del CEA fue muy superior a 200/mm3 y el 70% de ellos se encontraban con tratamiento antirretroviral intensificado. De este hecho puede explicar que la tasa de recidiva sea similar entre los pacientes IC e ID.
La inmunosupresión que produce el virus HIV en los pacientes infectados, pero con tratamiento antiviral intensificado, es probablemente diferente e inferior a la que se produce por el tratamiento inmunosupresor del paciente trasplantado o por otras causas de inmunosupresión. Hay pocos trabajos publicados en la literatura donde se estudian a pacientes IC frente a ID independientemente del estadio del HIV o de causa diferente a la infección por este. En el reciente estudio de Bingmer et al.24, que incluye fundamentalmente pacientes con trasplante de órganos sólidos, sí muestra una peor tolerancia a la QT y peor respuesta a la QRT, con un incremento en la tasa de recidiva. En cambio, con resultados similares a los encontrados en nuestro estudio, Fraunholz et al.22, en un estudio retrospectivo observa resultados similares entre pacientes HIV positivos y negativos.
El presente estudio tiene limitaciones inherentes a su diseño retrospectivo: muestras heterogéneas, con datos incompletos como la ausencia de los serotipados de todas las lesiones, ligeras variaciones en los protocolos de QT o distintas fuentes de emisión de RT, al reunir casuística de 4 centros diferentes. No obstante, se compone de una serie larga de pacientes con CEA con y sin HIV, sin pérdidas de pacientes, con acceso a datos de manejo, tratamiento, seguimiento y control estrecho de pacientes con HIV por parte de unidades de enfermedades infecciosas, con protocolos institucionales comunes y una historia clínica informatizada y compartida con asistencia primaria y especializada, lo que facilita el seguimiento completo de los pacientes.
ConclusiónEn nuestro estudio los resultados oncológicos para el CEA entre pacientes IC e ID ha sido similar, si bien los pacientes ID fueron más jóvenes y con tumores de menor tamaño que los pacientes IC. La tolerancia y el grado de cumplimiento del tratamiento fue similar en ambos grupos, lo que pensamos puede deberse al estrecho seguimiento y buen control de los pacientes infectados por HIV, tratados con medicación moderna por las unidades de enfermedades infecciosas, en colaboración con la unidad de coloproctología.
Se necesitan más estudios para confirmar estas conclusiones.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores no declaran conflicto de interés alguno.
Nuestro agradecimiento por su ayuda al Dr. Iribarren, Jefe de Servicio de la Unidad de Enfermedades Infecciosas del Hospital Universitario Donostia, al Dr. Montejo, Jefe de Servicio de la Unidad de Enfermedades Infecciosas del Hospital de Cruces y al Dr. Portu, responsable de la Unidad de Enfermedades Infecciosas del Hospital Universitario de Araba.