El tratamiento quirúrgico de la patología mamaria (PM) ha evolucionado aumentando su manejo como cirugía mayor ambulatoria (CMA). El objetivo de este estudio es analizar una serie de pacientes intervenidas de PM en régimen de CMA durante el año 2017 para evaluar su calidad y seguridad.
MétodosSe realiza análisis retrospectivo de las pacientes intervenidas de PM en el Consorcio Hospital General Universitario de Valencia desde enero hasta diciembre del 2017 incluidos en programa de CMA, estudiando el número de pacientes, los motivos de exclusión, el tipo de procedimientos quirúrgicos realizados, el índice de sustitución (IS), la tasa de ingreso (TI) y las causas de conversión al ingreso, complicaciones postoperatorias y el índice de satisfacción. Se compara con un grupo control del año 2013.
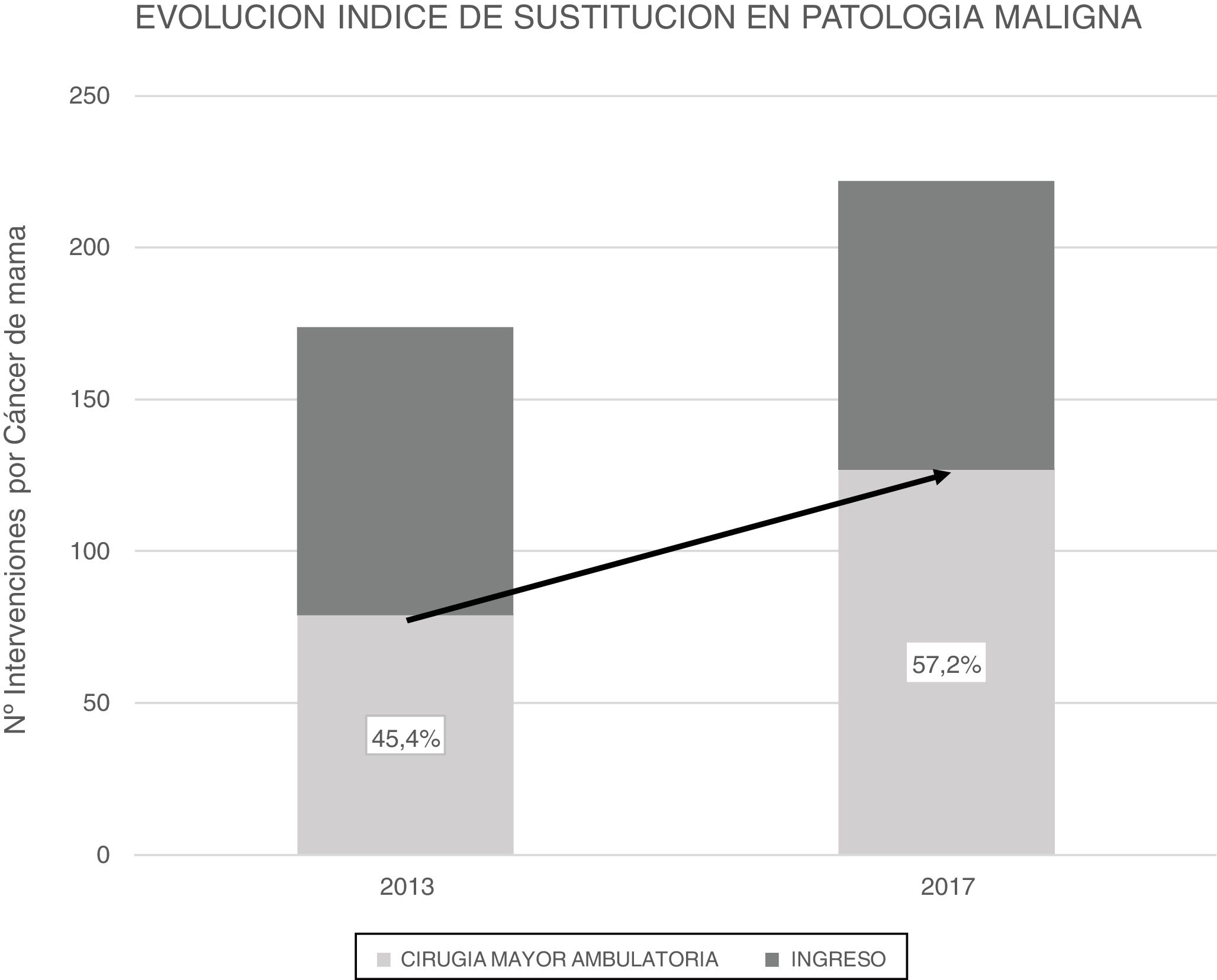
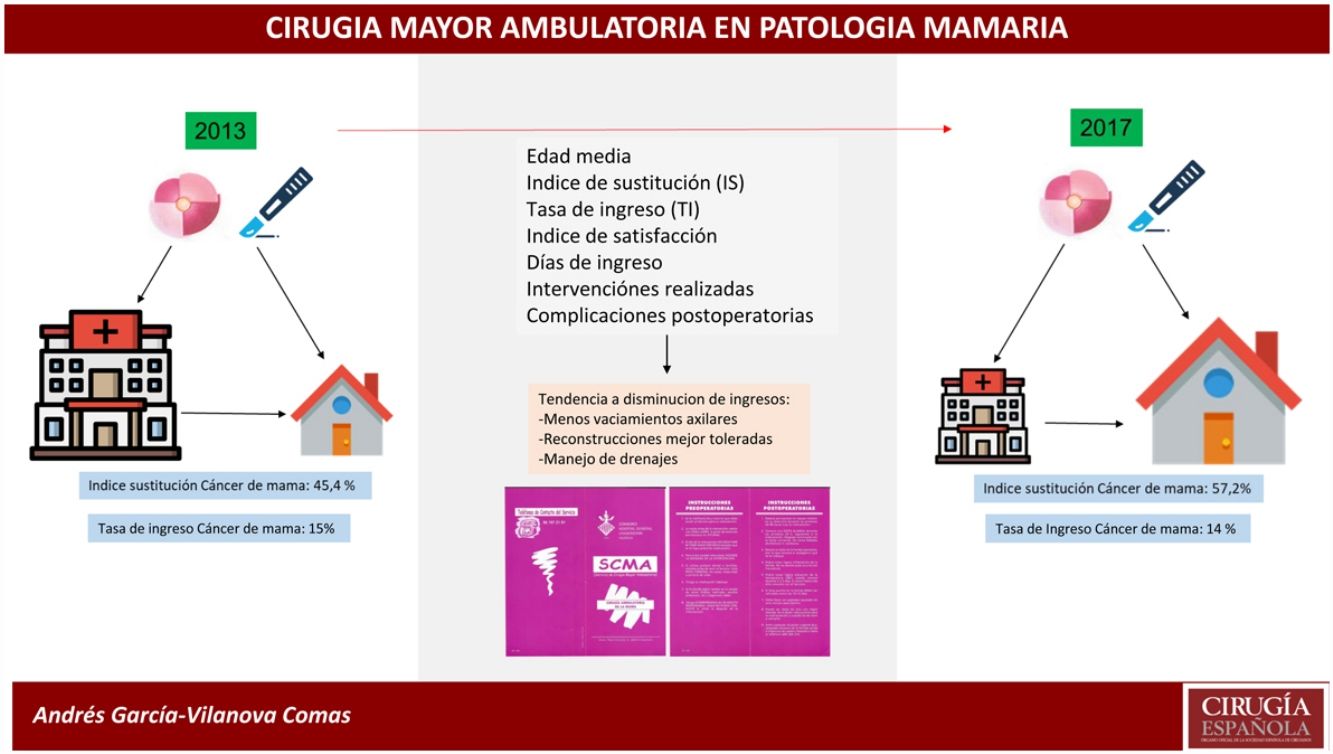
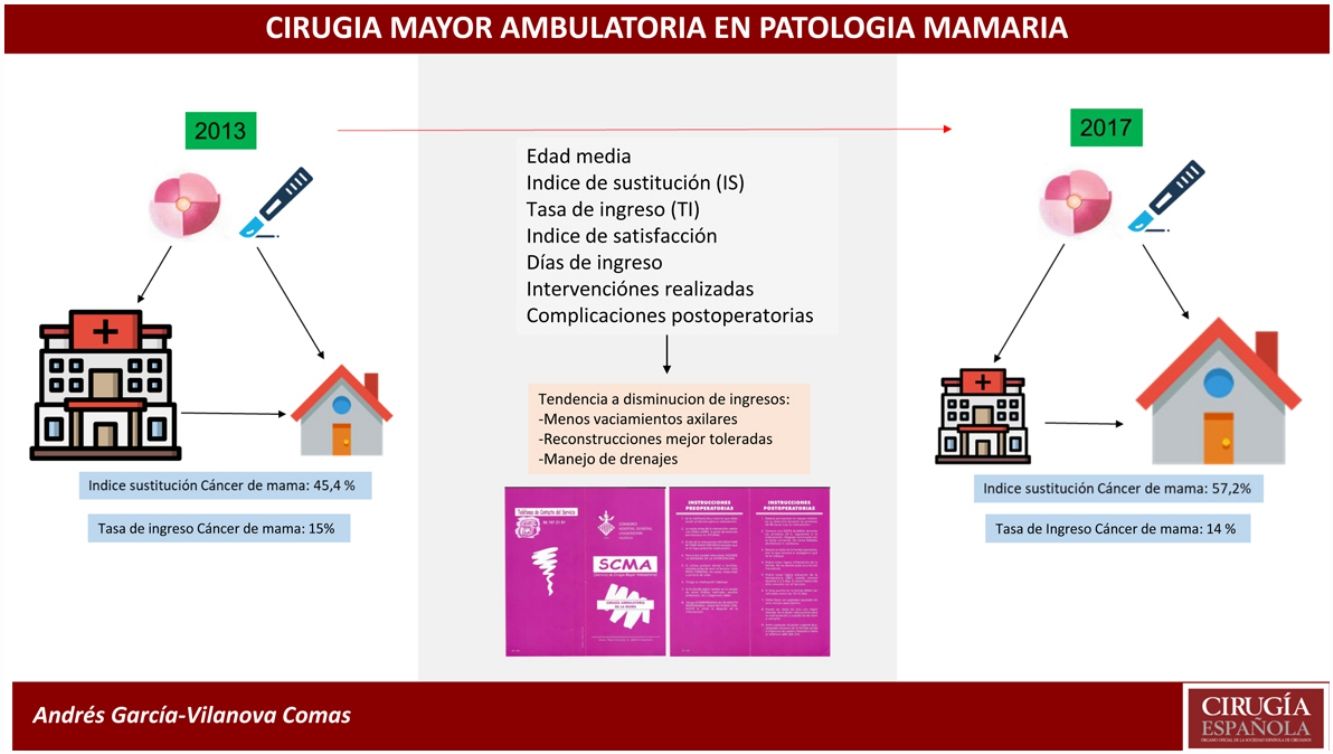
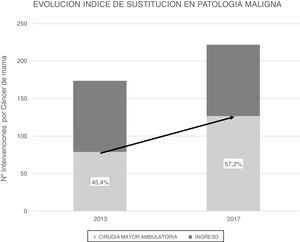
ResultadosEn 2017 se realizaron 396 intervenciones por PM, siendo de PM benigna (PMB) 170 intervenciones y de PM maligna (PMM) 226 intervenciones. El IS para la PM global es del 72,8% y para PMB fue 93,4%. El IS para PMM fue 57,2%, que ha progresado en los últimos años desde el 45,4% en 2013. La TI inesperado de la PMM fue del 14,1%, mientras que en la PMB fue del 0,6%. La PMM con ingreso presentó más morbilidad (17%) que la PMM sin ingreso (8,5%) y la PMB (6,5%).
ConclusionesEn PMM del Consorcio Hospital General Universitario de Valencia el IS ha aumentado y la TI depende de la linfadenectomía tras biopsia peroperatoria del ganglio centinela. La CMA para el tratamiento de la PM es segura y eficiente.
The use of ambulatory surgery (AS) for breast pathology (BP) has increased. The objective of this study is to analyse a group of patients treated surgically for breast pathology in order to evaluate its quality and security in a MAS setting in 2017.
MethodsA retrospective review of all patients undergoing breast surgery was conducted within an AS programme from January to December 2017 in Consorcio Hospital General Universitario of Valencia (CHGUV). The study analysed the number of patients, exclusion reasons, type of surgical procedures, evolution of substitution rate (SR), rate and causes of conversion to admission, postoperative complications, motives for not being included in the ambulatory programme and the satisfaction rate of the patients treated with ambulatory surgery. This has been compared with a 2013 group.
ResultsIn 2017, 396 procedures for BP were performed: 170 for benign and 226 for malignant disease. The SR for the global mammary pathology was 72.8%. The SR for benign pathology was 93.4% and the SR for malignant pathology was 57.2%, which has increased in recent years from 45.4% in 2013. The unexpected hospitalization rate (HR) of malignant pathologies was 14.1%, while the HR in benign pathologies was 0.6%. Patients hospitalized for malignant pathologies presented higher complications (17%) than ambulatory patients (8.5%) and benign pathologies (6.5%).
ConclusionsAt the CHGUV, the SR has steadily increased in malignant pathologies. The unexpected hospitalization rate is determined by perioperative sentinel lymph node biopsy results. AS for the treatment of mammary pathology is efficient and safe.
La evolución de la cirugia mayor ambulatoria (CMA) ha sido importante sobre todo durante las 2 últimas décadas, mejorando la calidad asistencial y la seguridad del paciente, requiriendo el desarrollo de nuevos indicadores para medir su calidad1.
La calidad y la eficiencia en CMA se valoran principalmente mediante 2 parámetros: el índice de sustitución (IS) que es el porcentaje de intervenciones realizadas en regimen ambulatorio respecto al total de intervenciones realizadas y la tasa de ingreso inesperado o no programado (TI) que es el porcentaje de pacientes inicialmente programados para CMA que ingresan por cualquier motivo. Interesa que el IS sea lo mayor posible y la TI lo menor posible.
Esta forma de organización de la asistencia quirúrgica, ya no tan nueva, conlleva niveles de aceptación de los pacientes de entre el 80% y el 90%2. Se considera como uno de los mejores sistemas para disminuir las listas de espera y conseguir mejorar la eficiencia quirúrgica. Reduce los costes en referencia a la cirugía con ingreso alrededor del 25-30%, llegando al 50% para algunas enfermedades quirúrgicas2,3.
Los avances tecnológicos, los nuevos procederes con vías de acceso quirúrgicas mínimamente invasivas y los agentes anestésicos de corta duración favorecen una rápida recuperación postoperatoria del paciente con efectos secundarios mínimos, y la paulatina inclusión de pacientes y entidades nosológicas quirúrgicas más complejas en la cartera de servicios de CMA4.
La inclusión en el circuito quirúrgico ambulatorio de pacientes afectas de patología mamaria benigna (PMB) está más establecida que las de patología mamaria maligna (PMM), que habitualmente requieren de intervenciones quirúrgicas más complejas, mamarias y axilares5–7.
El objetivo de este estudio es analizar una serie de pacientes intervenidas quirúrgicamente de PMB y PMM, en régimen de CMA durante el año 2017, para evaluar su eficiencia y seguridad utilizando indicadores de calidad de CMA: el IS, TI, complicaciones e índice de satisfacción de los pacientes intervenidos.
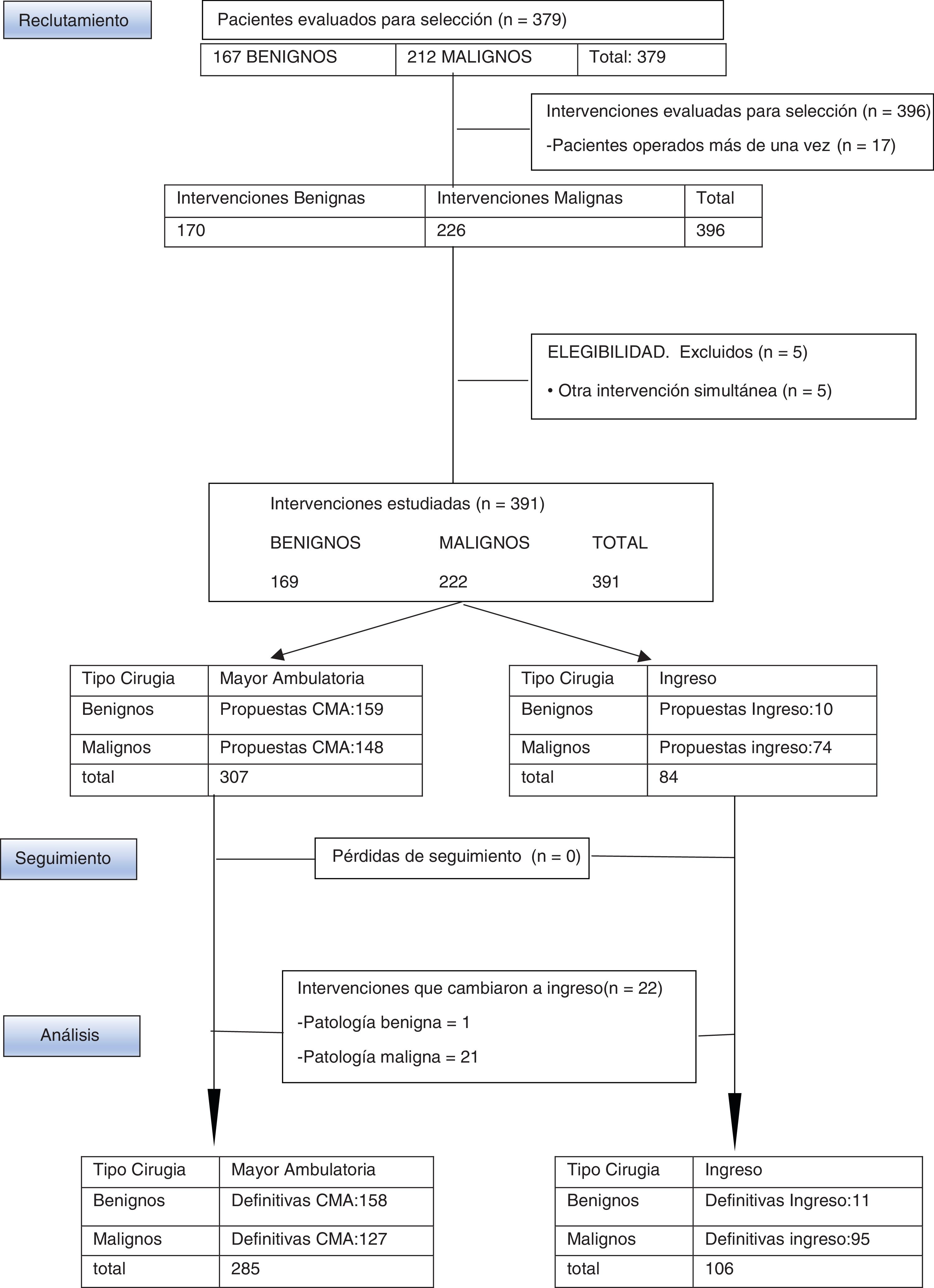
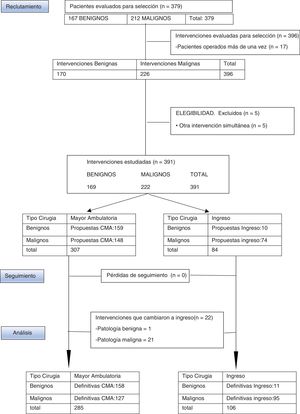
MétodosSe presenta un estudio observacional, descriptivo, retrospectivo y formado por una serie de 378 pacientes afectas de PMB y PMM, intervenidas en el Consorcio Hospital General Universitario de Valencia (CHGUV) durante el año 2017, estudiándose la CMA realizada (fig. 1) y se compara la PMM con un grupo control del año 2013, primer año en que se integra toda la cirugía mamaria en el circuito de CMA, aplicando los mismos criterios de inclusión y exclusión, la misma metodología y realizada por el mismo grupo de cirujanos.
Todas las pacientes fueron evaluadas por el Comité de Mama, y posteriormente en consultas externas por miembros del Servicio de Cirugía General y del Aparato Digestivo del CHGUV integrados en la Unidad Funcional de Mama (UFM), siendo valoradas para su posible inclusión en el programa de CMA tras comprobar que cumplían los criterios de selección establecidos1 (tabla 1), ofreciéndoseles la información necesaria sobre el proceso asistencial de forma verbal y escrita en un folleto específico de CMA adaptado a PM, así como los consentimientos informados quirúrgico, de CMA y anestésico.
Criterios de selección de pacientes con Patologia mamaria para CMA
| Criterios de inclusión | ASA I y II |
| ASA III estables durante los últimos 3 meses y/o no alterables por la intervención propuesta | |
| Domicilio a menos de 60min del hospital | |
| Teléfono en domicilio o vecindario | |
| Adulto responsable acompañante con vehículo a disposición durante 24-48h del postoperatorio | |
| Criterios para la valoración individualizada | Edad avanzada |
| Alteraciones psiquiátricas que dificulten el adecuado cuidado postoperatorio en domicilio | |
| Obesidad o sobrepeso superior al 30% | |
| Diabetes | |
| Anticoaguladas | |
| Alergia al látex | |
| Déficit físico (sordera, sordomudez, ceguera) | |
| Retraso mental no muy profundo | |
| Criterios de exclusión | ASA III descompensados, ASA IV y V |
| EPOC grave | |
| Incapacidad de comprensión o aceptación del proceso ambulatorio y los cuidados postoperatorios | |
| Ausencia de adulto responsable durante 24-48h del postoperatorio | |
| Distancia superior a 60min del hospital | |
| Obesidad mórbida | |
| Drogodependencia | |
| Antecedentes de hipertermia maligna |
Se incluyeron las intervenciones de nivel ii y algunas de iii en la Clasificación de Davis8. Se consideró criterio de exclusión en nuestro programa de CMA las intervenciones mamarias más agresivas y que requieren mayores cuidados postoperatorios, como son, en PMM, la linfadenectomía axilar completa (LA) o vaciamiento axilar (VA) y la mastectomía, con o sin reconstrucción con prótesis y en PMB las mamoplastias de aumento. También se excluyeron las pacientes en que se realizó cualquier otro procedimiento quirúrgico simultáneo que pudiera modificar el momento del alta. Todas las intervenciones quirúrgicas de los grupos de 2013 y 2017 fueron realizadas por el mismo equipo quirúrgico, formado por 3 cirujanos generales y un cirujano plástico, integrados en la UFM.
En la técnica de la biopsia del ganglio centinela se siguió un protocolo definido9, siguiendo indicaciones de consenso10 y valorando mediante técnica one step nucleic acid amplification (OSNA) la carga tumoral total. La detección de más de 15.000 copias peroperatoria llevó a ampliar la cirugía con LA y posterior ingreso hospitalario de pacientes inicialmente programados como cirugía sin ingreso (reconversión a ingreso)11. En el grupo de 2013 utilizando la técnica de OSNA la decisión de ampliar la cirugía con LA incluyó la micrometástasis y la macrometástasis, mientras que en 2017 se utiliza la carga tumoral total de 15.000 copias.
Se utilizó anestesia general, preferentemente mediante mascarilla laríngea, con opiáceos de acción corta, induciendo con propofol y midazolam12 y se mantuvo con propofol y perfusión de remifentanilo13. Se infiltraron los bordes de la herida con un anestésico local de larga duración (levobupivacaína) al finalizar la intervención14.
Se valoró a los pacientes con una escala de recuperación de Aldrete modificada, recogido en el manual de la unidad de cirugía mayor ambulatoria. Estándares y recomendaciones del Ministerio de Sanidad y Consumo1,2 para decidir su traslado progresivo a la unidad de recuperación posquirúrgica i y ii del servicio de CMA o al hospital de día. Posteriormente se les dio de alta al comprobar parámetros de recuperación1:
- -
Conscientes y orientadas.
- -
Deambulación autónoma sin sensación de inestabilidad durante la última hora.
- -
Constantes vitales estables.
- -
Tolerancia de líquidos.
- -
Buen control del dolor.
- -
Diuresis conservada.
- -
Ausencia de sangrado, náuseas y vómitos.
- -
Presencia de adulto responsable con vehículo para traslado a domicilio.
El equipo de enfermería del servicio de CMA realizó al día siguiente de la intervención3 una llamada telefónica a todas y cada una de las pacientes para control domiciliario, donde se valoró la intervención realizada, el estado general, la ingesta de medicación prescrita, la necesidad de acudir a urgencias, la presencia de fiebre, náuseas o vómitos, sangrado de herida, dificultad de micción o defecación, estado cognitivo y presencia e intensidad del dolor.
En las posteriores visitas en consultas externas, a las 4 semanas, se entregaron encuestas de satisfacción con preguntas específicas que se responden en una escala tipo Likert (tabla 2), y a partir de ellas se midió el índice de satisfacción de las pacientes intervenidas dentro del programa15.
Encuesta de satisfacción
| Estimado paciente: con el objetivo de mejorar nuestra asistencia, el Servicio de Cirugía Mayor Ambulatoria (SCMA) le ruega conteste esta encuesta. |
| Edad: …………….; Sexo: ………………; Profesión: …………………………………; Edad: ………….. |
| Fecha de la intervención quirúrgica: …………de………………..de............................................ |
| ¿De qué le operaron?:………………………………………………………………………………………………….. |
| Puntúe las siguientes preguntas con un 0, 1, 2, 3, 4 y 5 | |
|---|---|
| Señale con una X la puntuación elegida. (Un 0 para considerar como muy mal y un 5 para muy bien) | |
| ¿Cómo valora la información ofrecida antes de su operación? | : 0 – 1 – 2 – 3 – 4 - 5 |
| ¿Cómo ha sido atendido por el personal administrativo? | : 0 – 1 – 2 – 3 – 4 –5 |
| ¿Cómo ha sido atendido por los celadores/as? | : 0 – 1 – 2 – 3 – 4 –5 |
| ¿Cómo ha sido atendido por el personal de enfermería? | : 0 – 1 – 2 – 3 – 4 - 5 |
| ¿Cómo ha sido atendido por el personal médico? | : 0 – 1 – 2 – 3 – 4 - 5 |
| ¿Cuál es su valoración sobre nuestras instalaciones? | : 0 – 1 – 2 – 3 – 4 –5 |
| ¿Cómo valora el ambiente y la comodidad del SCMA? | : 0 – 1 – 2 – 3 – 4 – 5 |
| ¿Cómo valora la información ofrecida después de la operación? | : 0 – 1 – 2 – 3 – 4 – 5 |
| ¿Cómo puntuaría su asistencia en general? | : 0 – 1 – 2 – 3 – 4 – 5 |
| ¿Cuál es su valoración general sobre el SCMA? | : 0 – 1 – 2 – 3 – 4 –5 |
| ¿Cómo se encontró en su casa tras la intervención? | : 0 – 1 – 2 – 3 – 4 –5 |
| ¿Cómo valora nuestra llamada al día siguiente de la operación? | : 0 – 1 – 2 – 3 – 4 –5 |
| Conteste, por favor, las siguientes preguntas con un sí o un no: | |
|---|---|
| ¿Se le entregó un informe clínico de alta? | Sí No |
| ¿Se le entregaron las recetas de medicación postoperatoria? | Sí No |
| ¿Entendió todas las indicaciones al ser dado de alta? | Sí No |
| ¿Precisó asistencia de urgencias tras la operación? | Sí No |
| ¿Volvería a operarse en caso necesario en nuestro SCMA? | Sí No |
| ¿Recomendaría Vd. nuestro SCMA a otras personas? | Sí No |
| ¿Desea hacer alguna observación más? | |
Las variables estudiadas fueron la edad media, los días de ingreso, los tipos de PM y la intervención realizada, complicaciones postoperatorias y como indicadores de calidad de CMA el IS, la TI e índice de satisfacción de los pacientes intervenidos16. Se compara el IS y la TI del grupo de pacientes con cáncer de mama del año 2017 con el grupo control del año 2013.
Análisis estadísticoLos datos fueron incluidos en el paquete informático Excel 2013 y su ampliación estadística para su análisis, realizando un estudio descriptivo de la muestra, que incluye edad y tipo de cirugía realizada en muestras de pacientes de 2017 y 2013. Se ha utilizado el test de Kolmogorov-Smirnov para verificar la distribución normal de variables y se ha comprobado que resultaron homogéneas en cuanto a edad y tipo de intervención realizada. Las variables cualitativas fueron expresadas como valor absoluto y porcentaje. Para la comparación de las variables cualitativas se empleó la prueba de Chi cuadrado. Se consideró un nivel de significación del 95%: p<0,05.
Se realizó cálculo de test Chi cuadrado de análisis de proporciones para analizar la relación entre cuadrantectomías, mastectomías, vaciamientos axilares y la realización de CMA en PMM del año 2017 respecto a 2013.
ResultadosEntre enero y diciembre de 2017 la UPM del CHGUV practicó 396 intervenciones por PM a 379 pacientes (167 afectas de PMB, a las que se les realizaron 170 intervenciones, y 212 de PMM a las que se les practicaron 226). Se consideró criterio de exclusión la realización simultánea de otra cirugía que no fuera la mamaria para evitar confusión derivada de posibles complicaciones relacionadas con la otra cirugía. Por ello 5 pacientes fueron excluidas del estudio (4 con PMM y una con PMB). Tras esta exclusión se valoran finalmente a 374 pacientes a las que se les practicó 391 intervenciones, de las que el 72,8% se realizaron mediante CMA (285 intervenciones: 158 por PMB [55,4%] y 127 por PMM [44,7%]) y el 27,11% mediante cirugía con ingreso (106 intervenciones: 11 por PMB [10,3%] y 95 por PMM [89,6%]) (fig. 1).
La edad media de las pacientes fue de 61,06±2 años en las afectas de lesión maligna (PMM) y de 42,74±2 años en las operadas por lesiones benignas (PMB).
De las 169 intervenciones realizadas por PMB en 2017 se seleccionaron para CMA 156 pacientes a las que se les realizaron 159 intervenciones, de las que 158 intervenciones (155 pacientes) pudieron cumplimentarse como CMA y una debió ingresar por persistencia de dolor postoperatorio. Las intervenciones benignas programadas para ingreso estuvieron relacionadas con la necesidad de cirugía plástica: recambio de prótesis, retirada de prótesis y mamoplastia de aumento. Se propusieron inicialmente para ingreso 10 pacientes a los que se les realizó un total de 10 intervenciones. Por tanto, la TI es de 0,6% y su IS es de 93,4%.
En las afectas de PMM en el año 2013 se realizaron 174 intervenciones y en 2017 se incrementó esta cifra a 222, de las que se seleccionaron para CMA: la cuadrantectomía con o sin biopsia selectiva de ganglio centinela (BSGC), la BSGC, la retumorectomía, la exéresis de recidiva locorregional, la exéresis de cutánides y la resección de escara necrótica. Se utilizaron técnicas oncoplásticas básicas en las cuadrantectomías incluyendo movilización local glandular mamaria, patrón circular (round-block), mamoplastia vertical de pedículo superior de eje único y mamoplastias de rotación inferior. No se realizó «simetrización» de la mama contralateral. El resto de las intervenciones fueron subsidiarias de cirugía con ingreso (tabla 3). Se comparó el año 2013 con el 2017 en la proporción de intervenciones inicialmente asignadas a CMA, las que realmente se realizaron como CMA y el porcentaje de cuadrantectomías mediante test Chi cuadrado encontrando una diferencia estadísticamente significativa. En cambio, cuando se comparó la proporción de mastectomías y VA, aunque fueron superiores en 2013 frente a 2017, la diferencia no fue estadísticamente significativa (tabla 3).
Comparación de intervenciones por patología mamaria maligna entre los años 2013 y 2017
| Tipo de intervención | 2013 | 2017 |
|---|---|---|
| Intervenciones con CMA | ||
| Cuadrantectomía simple | 9 | 24 |
| Cuadrantectomía+BSGC | 62 | 96 |
| BSGC | 3 | 6 |
| Retumoretomía | 0 | 6 |
| Exéresis de recidiva locorregional | 3 | 0 |
| Exéresis de cutánides | 2 | 1 |
| Resección escara necrótica | 0 | 1 |
| Intervenciones sin CMA | ||
| Cuadrantectomía+vaciamiento axilar | 14 | 14 |
| Cuadrantectomía con linfadenectomía axilar selectiva y linfadenectomía axilar completa | 14 | 16 |
| Vaciamiento axilar | 3 | 5 |
| Mastectomía simple | 4 | 2 |
| Mastectomía con linfadenectomía axilar selectiva | 19 | 7 |
| Mastectomía radical modificada (con linfadenectomía axilar completa) | 23 | 21 |
| Mastectomía ahorradora de piel con linfadenectomía axilar selectiva y reconstrucción inmediata | 5 | 9 |
| Mastectomía ahorradora de piel con linfadenectomía axilar selectiva y linfadenectomía axilar completa y reconstrucción inmediata | 3 | 2 |
| Mastectomía ahorradora de piel con linfadenectomía axilar completa y reconstrucción inmediata | 0 | 5 |
| Mastectomía con linfadenectomía axilar selectiva y linfadenectomía axilar completa | 0 | 2 |
| Mastectomía profiláctica (+reconstrucción inmediata) | 0 | 3 |
| Mastectomía radical de Halsted | 0 | 1 |
| Mastectomía radical+exéresis ganglio mamaria interna+retirada prótesis | 0 | 1 |
| Total | 174 | 222 |
| Año | 2013 | 2017 | Chi cuadrado | p |
|---|---|---|---|---|
| Cuadrantectomías totales | 107 (61%) | 164 (73%) | 6,92 | <0,01 |
| Mastectomías totales | 54 (31%) | 53 (24%) | 2,54 | >0,05 |
| Vaciamientos axilares totales | 60 (34%) | 65 (29%) | 1,22 | >0,05 |
| Indicación inicial de CMA | 93(53%) | 148 (66%) | 7,15 | <0,01 |
| CMA realizada | 79 (45%) | 127 (57%) | 5,45 | <0,05 |
Durante 2017 fueron seleccionadas para CMA 144 pacientes afectas de PMM a las que se les realizaron 148 actos quirúrgicos, de las que 123 pacientes (127 intervenciones) pudieron cumplimentarse como CMA, mientras que 21 debieron ingresar: 16 porque inicialmente se les realizó una cuadrantectomía con BSGC extemporánea, mediante técnica OSNA, que resultó compatible con macrometástasis, completando la intervención con LA; 4 porque fueron intervenidas en el mes de agosto, en que se cerró el hospital de día, y una paciente ingresó al padecer síndrome de Wolff-Parkinson-White concomitante. El IS para PMM fue 57,2%.
Durante 2013 se realizó 174 actos quirúrgicos a pacientes afectas de PMM, de las que 93 fueron seleccionadas para CMA. Finalmente 79 intervenciones pudieron cumplimentarse como CMA, mientras que 14 debieron ingresar: 12 porque inicialmente se les realizó una cuadrantectomía con BSGC extemporánea, mediante técnica OSNA, que resultó compatible con micrometástasis o macrometástasis, completando la intervención con LA; otra por no detección de ganglio centinela también completando la intervención con LA y una paciente de 89 años ingresó por comorbilidades. El IS para PMM en 2013 fue 45,4%.
En el transcurso de 4 años (2013-2017) el IS en PMM en CMA ha sufrido un incremento del 11,8%, pues en 2013 este índice era del 45,4% y en 2017 del 57,2% (fig. 2). Se comparó la CMA realizada de ambos años mediante test Chi cuadrado encontrando una asociación estadísticamente significativa (tabla 3).
El IS para la PM global, benigna y maligna, fue del 72,8% en 2017.
Para tratamiento de la PMM en 2017 se propuso para ingreso de inicio a 64 pacientes a las que se les realizó un total de 74 intervenciones. Se les ha sumado las pacientes propuestas para CMA que fueron reconvertidas a ingreso, en este caso 21 pacientes a las que se les realizó en total 21 intervenciones. Así, finalmente en 2017 se realizaron mediante ingreso 95 intervenciones a 85 pacientes de las 222 intervenciones por PMM (44,81%). En 2013 se realizaron mediante ingreso 95 intervenciones de las 174 intervenciones por PMM (54,59%).
En la PMM de 2017 han sido reconvertidos a cirugía con ingreso 21 pacientes, lo que supone el 14% de tasa de ingreso inesperado (TI), frente a 14 pacientes en 2013 que supone el 15% de TI. En PMB solo una intervención seleccionada inicialmente para CMA fue reconvertida a cirugía con ingreso.
La media de días de ingreso de la PMM (1,33 días) es similar a la de la PMB (1,1 días).
En 169 intervenciones realizadas de PMB solo hemos detectado 11 complicaciones (6,51%), siendo la más frecuente el seroma seguido de infección de la herida quirúrgica (tabla 4).
Complicaciones por patología mamaria benigna y maligna en el año 2017
| Complicaciones por patología mamaria benigna 2017 | |||||
|---|---|---|---|---|---|
| CMA | 9 | Reconvertidos a ingreso | 0 | Ingresos programados | 2 |
| Dermatitis alérgica | 1 | Sangrado postoperatorio | 1 | ||
| Flebitis | 1 | Seroma | 1 | ||
| Seroma | 3 | ||||
| Edema postoperatorio | 1 | ||||
| Infección herida quirúrgica | 2 | ||||
| Desconexión del drenaje | 1 | ||||
| Total de complicaciones | 11 | 6,51% | |||
| Complicaciones por patología mamaria maligna 2017 | ||||||
|---|---|---|---|---|---|---|
| Durante el ingreso | N | Urgencias sin ingreso | N | Urgencias con ingreso | N | |
| Ingresos | •→Náuseas y vómitos•→EPOC grave enfisematosa•→Sangrado•→Dolor+disnea•→Síndrome anémico+transfusión•→Dolor•→Sangrado posquirúrgico+síndrome anémico•→Hipotensión+mareo•→Hematoma (no reintervención) | 211113111 | •→Drenaje sin vacío•→Taponamieno del drenaje | 11 | •→Escara necrótica:•→reintervención•→Necrosis cutánea y exposición material protésico: reintervención | 11 |
| CMA | No hay ingreso | 0 | No complicaciones | 0 | No complicaciones | 0 |
| CMA convertidas a ingreso | •→Hematoma (evacuación) | 1 | •→Hematoma•→Mal funcionamiento del drenaje | 11 | No complicaciones | 0 |
| Total | 8,56% | 19 | ||||
| Ingreso programado | 16 | |||||
| CMA | 0 | |||||
| CMA reconvertidas a ingreso | 3 | |||||
En PMM las intervenciones realizadas de manera ambulatoria no han generado complicaciones, pero en las reconvertidas a ingreso encontramos 3 complicaciones: 2 hematomas y otra relacionada con el drenaje.
Las intervenciones por PMM programadas para ingreso son las que más morbilidad presentaron: 16 complicaciones (17%), destacando el dolor, las náuseas y los vómitos. En este grupo encontramos los 2 únicos reingresos por problemas necróticos.
En CMA la PMM genera un mayor porcentaje de complicaciones (19 en 222 intervenciones: un 8,5%), mientras que la PMB solo genera 11 en 196 intervenciones: un 6,51%.
El índice de satisfacción determinado a través de encuestas muestra que el 94,29% de los pacientes valoró con la máxima puntuación (5 sobre 5) tanto la asistencia recibida como el servicio de CMA.
DiscusiónEl tratamiento quirúrgico ambulatorio de la PMM se ha incrementado paulatinamente y algunos autores lo consideran el nuevo estándar terapéutico en los tratamientos conservadores y la cirugía oncoplástica mamaria17–19. Las incidencias reportadas de complicaciones y reingresos son iguales o menores a las de la cirugía con ingreso17,20,21. Sin embargo, en determinados procedimientos quirúrgicos más complejos, que incluyen mastectomías, vaciamiento axilar completo o reconstrucciones mamarias, la propuesta de CMA es más discutible programándose como cirugía de 23horas (overnight stay) o con ingreso de corta estancia22,23.
Si bien en la selección de nuestras pacientes no hemos considerado como criterio de exclusión la edad, contando con una media de 61,06±2 años en PMM y 47,74±2 años en PMB, como en otros estudios21,24, ha de considerarse que las pacientes intervenidas por PMM tienden a ser más añosas y puede que en algunos casos la indicación de tratamiento quirúrgico en régimen de CMA sea más difícil por las comorbilidades que presentan.
En este estudio el IS de la PMM se ha incrementado un 11,8% en 4 años, indicativo de que la CMA del cáncer de mama ha aumentado en el CHGUV. Esto no se debe a que se hayan ampliado las indicaciones de CMA por incluir técnicas quirúrgicas más complejas o pacientes con más comorbilidad, sino que el motivo del cambio ha sido el aumento del número de pacientes que precisan de técnicas más sencillas (cuadrantectomías simples o con BSGC). Estos casos presentan una menor tasa de complicaciones y una recuperación más rápida que la cirugía radical o la reconstructora, con menos posibilidades de ingreso hospitalario tradicional. Posiblemente esté en relación con un aumento de pacientes remitidos de unidades de screening, tratamientos neoadyuvantes y cirugía oncoplástica.
Los IS obtenidos en nuestra serie son similares a los expuestos por otros autores nacionales24,25.
La TI en PMM de 2017 fue del 14%, cifra también semejante a las de otros estudios nacionales24,25 y revisiones sistemáticas20,26 en los que se encuentra entre el 10% y el 11,4%. La causa más frecuente de ingreso inesperado fue la ampliación del procedimiento operatorio con la realización de un VA completo, por positividad del ganglio centinela en el análisis anatomopatológico intraoperatorio, coincidiendo con otros autores24. En cambio, en el estudio de Medina12, con TI del 16,5%, las causas más frecuentes de ingreso fueron las náuseas, los vómitos, los hematomas, el dolor postoperatorio y las complicaciones de la herida.
La media de días de estancia de las pacientes operadas por PMB de forma programada y con ingreso fue de 1,1 días y la de las pacientes ingresadas intervenidas por PMM de 1,3 días, predominando el ingreso con overnight stay (menor a 24horas) en los casos de VA completos o mastectomías sin reconstrucción inmediata. Las pacientes sometidas a mastectomías con reconstrucción inmediata fueron las que más días de ingreso consumieron. La proporción de pacientes con cuadrantectomías reconvertidas a ingreso por positividad del ganglio centinela pasó del 18% en 2013 al 14% en 2017, y la TI en 2017 sería aún menor si no se hubiera cerrado en agosto de este año el hospital de día.
Las líneas de trabajo futuras para incrementar el IS y reducir la TI en la cirugía por PM en nuestro centro van dirigidas a disminuir el número de técnicas más complejas (mastectomías y VA), facilitar una adecuada educación de las pacientes en el cuidado postoperatorio de los drenajes y la inclusión en el programa de CMA de algunas pacientes seleccionadas que precisen intervenciones con VA y de mastectomías con y sin reconstrucción.
Disminuir el número de mastectomías de modo importante en los próximos años no parece muy probable27, pero la tendencia de la investigación actual es a disminuir las indicaciones de VA, porque la radioterapia axilar adyuvante puede igualar los beneficios de la cirugía axilar con menor morbilidad en los casos en que se realice un tratamiento conservador, tal y como sugieren los resultados de los ensayos clínicos ACOSOG-Z01128, AMAROS29 y OTOASOR30. Asimismo, los ensayos clínicos SOUND31 y BOOG 2013-1832 estudian evitar la realización de BSGC y realizar únicamente cuadrantectomía con radioterapia y observación. En las pacientes que actualmente se indica mastectomía con VA la tendencia también es disminuir estos vaciamientos32–34.
En los casos que han recibido neoadyuvancia y la axila previamente era clínicamente negativa está en investigación si siempre es necesario añadir VA en cualquier afectación de ganglio centinela. En los casos que han recibido neoadyuvancia y la axila era clínicamente positiva previa a la neoadyuvancia, si cumple ciertas condiciones, también se realiza BSGC y no se realiza VA si el ganglio ya no está afecto, según los estudios ACOSOG Z107135, SENTINA36 y SN FNAC37. Esta tendencia actual a una progresiva disminución del número de vaciamientos axilares debería seguir mejorando los indicadores de CMA.
En nuestra serie las intervenciones por PMM generaron un mayor porcentaje de complicaciones (8,56%) que las intervenciones por PMB (6,51%), aunque en estas también se incluyen reconstrucciones en pacientes que se consideraron libres de enfermedad neoplásica. En la CMA de PMM de este estudio hay una mayor tasa de complicaciones en las pacientes ingresadas que en las que recibieron el alta el mismo día de la intervención, tal como señalan otros autores38.
Nuestra tasa de complicaciones infecciosas en intervenciones por PMB es del 1,26%, cifra inferior a la del estudio del grupo de la Comunidad de Madrid, que fue del 3,89%, a la del grupo de Indicadores clínicos de mejora continua de la calidad (INCLIMECC) que fue del 2,28% y a la de la National Healthcare Safety Network (NHSN) cifrada en el 2,26%39–41.
Las encuestas de opinión y satisfacción que se realizan a las pacientes nos informan de sus opiniones y estimulan a planificar la CMA con ellos, aumentando su compromiso de participación en el tratamiento42. El índice de satisfacción de nuestros pacientes de 94,29% es similar al de otros autores, superior al 90%12.
La literatura sustenta que la CMA es factible, segura y beneficiosa para pacientes con cáncer de mama21,24,25,43,44 y mejora la eficiencia del sistema sanitario ahorrando en estancias hospitalarias45, por lo que se debería aumentar la progresiva incorporación de los servicios en este sistema.
En conclusión, en este estudio se observa en PMM en el periodo 2013 a 2017 un aumento del índice de sustitución, en relación con la disminución del uso de técnicas quirúrgicas más complejas; una disminución de la tasa de ingreso, en relación con la cantidad de linfadenectomías axilares inesperadas, una proporción de complicaciones menor en la CMA que en la cirugía con ingreso y un índice de satisfacción superior al 90%.
Se recomienda mejorar la calidad de los estudios, porque la mayoría no son uniformes, son series con pocos casos, y no existe un consenso claro sobre los criterios de preevaluación y los indicadores de calidad, dificultando hacer buenas comparaciones entre unidades/servicios de CMA de distintos hospitales (benchmarking)46.
Conflicto de interesesLos autores declaran la no existencia de conflicto de intereses.