Las complicaciones biliares postrasplante hepático han sido desde los incios de su historia tema de gran interés por su elevada incidencia, y su influencia en la morbi mortalidad. La fístula biliar es actualmente infrecuente, y su manejo sencillo. La estenosis anastomótica mantiene una incidencia del 10-15%. Si bien se considera que el tratamiento de elección actual es mediante CPRE, el tratamiento quirúrgico (hepaticoyeyunostomía) sigue teniendo un papel relevante. Las estenosis no-anastomóticas tienen una incidencia del 5-10%, se relacionan con factores isquémicos o inmunológicos y su tratamiento habitualmente es el retrasplante.La coledocolitiasis tiene una incidencia del 5-10%, siendo el tratamiento de elección la CPRE.Sin embargo, el tratamiento de las complicaciones biliares, deberá ser individualizado. Deberemos tener en cuenta el momento del diagnóstico, la función hepática, el estado general del paciente, y la disponibilidad y experiencia del equipo en las diferentes opciones terapéuticas.
There have been biliary complications since the beginning of liver transplants, and is a topic of great interest due to its high incidence, as well as their influence on morbidity and mortality. The biliary fistula is currently uncommon and its management is straightforward. Anastomotic stenosis continues to have an incidence of 10-15%. Although the current treatment of choice is endoscopic retrograde cholangiopancreatography (ERCP), surgical treatment (hepatico-jejunostomy) continues to have an important role. Non-anastomotic stenosis has an incidence of 5-10%, and is associated with ischaemic or immunological factors, and usually involves a re-transplant. Choledocholithiasis has an incidence of 5-10%, with the treatment of choice being ERCP. However the treatment of biliary complications should be individualised. We must take into account, liver function, the general health status of the patient, and the availability and experience of the team in the different therapeutic options.
Desde sus inicios en los años 60 el trasplante hepático (TH) ha pasado de ser un procedimiento experimental a un procedimiento estándar para el tratamiento de pacientes con enfermedad hepática terminal. El desarrollo de nuevos fármacos inmunosupresores, las mejoras en el manejo perioperatorio y la estandarización del procedimiento quirúrgico han permitido alcanzar los resultados actuales de calidad en el trasplante, con una mortalidad postoperatoria inferior al 10% y supervivencias a 5 años superiores al 75%1. Desde el punto de vista técnico, de las cuatro anastomosis que se realizan durante el implante del injerto: arteria hepática, vena porta, vena cava/suprahepáticas y vía biliar, esta última ha sido considerada desde los inicios «el talón de Aquiles» del trasplante2. A pesar de la estandarización de la técnica, la mejoría en los métodos de preservación y la mejoría global de los resultados del trasplante, la incidencia de complicaciones biliares sigue siendo un problema relevante dada su elevada incidencia y su influencia en la morbimortalidad3–6. Por otra parte su manejo sigue siendo objeto de controversia en la literatura.
La incidencia global de complicaciones biliares varía del 10 al 30% según las series3–6. La incidencia global en nuestra experiencia tras 1.000 TH es del 23%7. Las complicacions biliares tras el trasplante se pueden clasificar en 5 grandes grupos: 1) fístula biliar, 2) estenosis anastomótica (EA), 3) estenosis no anastomótica (ENA), 4) coledocolitiasis, 5) otras complicaciones. En esta revisión comentaremos cada una de ellas de forma independiente, dado que tienen diferente incidencia, factores de riesgo, diagnóstico, manejo y evolución. Nos centraremos en los puntos de mayor interés, o controversia, como es el manejo terapéutico. Por otra parte, en general nos referiremos a las complicaciones biliares postrasplante de donante cadáver. Otras opciones técnicas, como pueden ser el donante vivo, o la técnica de split podrían tener otras consideraciones, que por motivos de extensión, no comentaremos en esta revisión.
Antes de describir cada una de los tipos de CB revisaremos algunos aspectos generales.
Aspectos técnicosLa técnica de reconstrucción biliar ha variado desde los inicios del TH, siendo fruto de diversas modificaciones. Ello muestra una vez más la preocupación que ha existido siempre en los grupos de trasplante en disminuir la incidencia y gravedad de las CB. Ya desde los años 80, la hepático-hepaticostomía termino-terminal (H-H T-T) se ha estandarizado como la técnica más habitual8. Asimismo la reconstrucción con hepaticoyeyunostomía se considera de elección en los casos de desproporción de la vía biliar del donante y el receptor, trasplante por colangitis esclerosante, atresia de vía biliar, colangiocarcinoma de vía biliar y en algunos casos, de retrasplante. Otras opciones técnicas como la utilización de la vesícula en la recontrucción biliar están abandonadas. La hepático-hepaticostomía latero-lateral propuesta por el grupo de Neuhaus et al.9 no ha mostrado beneficios significativos en otras experiencias10. Finalmente, una vez aceptada la H-H T-T como la técnica estándar, quedaba por validar la utilidad real del uso del tubo de Kehr, preconizado en los inicios de la técnica11. Estudios aleatorizados han demostrado que el uso sistemático del tubo de Kehr no está justificado12,13. Igualmente diversos metaanálisis concluyen que no hay evidencia a favor del uso de tubo de Kehr14–16. Si bien su uso puede disminuir la incidencia de estenosis, las complicaciones globales no mejoran de forma global.
Vallera et al.17 publicaron una interesante revisión en los años 90, cuyas conclusiones son aún válidas. Así en primer lugar querríamos destacar desde el punto de vista técnico que para la realización de la anastomosis es importante evitar una disección excesiva de los ductos e intentar obtener una vía biliar del donante corta para asegurar la correcta vascularización. Se recomienda realizar la sutura mediante material reabsorbible, monofilamento de 5/0 o 6/0. Asimismo se acepta que la distancia entre los puntos debe ser de 2mm. No se han demostrado diferencias en la incidencia de CB, entre la realización de sutura continua o puntos sueltos18. Su indicación dependerá del diámetro de la vía biliar, aconsejándose la sutura con puntos sueltos en caso de diámetros pequeños.
Factores de riesgo generalesSi bien la etiopatogenia de los diferentes tipos de complicación biliar muestra sus pecularidades, en general los factores de riesgo de las CB pos-TH se pueden agrupar en tres grupos fundamentales19,20: 1) técnicos/vascularización, 2) inmunológicos, 3) daño postreperfusión.
Tal como hemos comentado en el apartado anterior, desde el punto de vista técnico el aspecto fundamental es conservar una correcta vascularización. Respecto a la vascularización nos referiremos tanto a nivel local, en evitar una disección excesiva al realizar la anastomosis, como también la correcta preservación de la vascularización arterial a través de la arteria hepática. Cualquier factor que afecte a la correcta irrigación arterial puede influir en el desarrollo de CB. Así la trombosis arterial es uno de los principales factores de riesgo de CB pos-TH. Asimismo la alteración del flujo arterial, por factores como fenómenos de robo o estenosis de tronco celíaco, pueden influir en el desarrollo de CB.
En la literatura se han descrito diversos factores de riesgo de CB pos-TH con un probable papel inmunológico como son la infección CMV, el mismatch grupo ABO, el mismatch Rh21, la indicación de TH por colangitis esclerosante o incluso la recidiva VHC.
Finalmente las alteraciones de la microcirculación ocasionadas por los fenómenos de isquemia-reperfusión parecen tener un papel fundamental en el desarrollo de CB pos-TH20,22. En este sentido diversos estudios han mostrado el tiempo de isquemia, especialmente en donantes añosos, como un factor de riesgo independiente23,24. Se consideraba que el daño era principalmente por la alteración en la microcirculación. En este sentido algún grupo propone maniobras como la perfusión arterial en banco25. Sin embargo en estudios recientes otros factores como la alteración en la composición de las sales biliares parecen tener gran relevancia26–28.
Una vez descritos estos aspectos generales, revisaremos el diagnóstico y manejo de cada una de las CB pos-TH de forma independiente.
Fístula biliarLa fístula biliar tras el TH se consideraba clásicamente una de las complicaciones más frecuentes, con una incidencia del 10-19%. Su incidencia ha disminuido de forma significativa en los últimos años.
El diagnóstico suele ser durante el postrasplante inmediato, siendo infrecuente el desarrollo de fístula tardía. Si el paciente es aún portador de un drenaje el diagnóstico se evidencia por salida de bilis por el drenaje. Si el paciente ya no es portador de drenaje o la fístula no está correctamente drenada puede presentar síntomas en forma de fiebre, dolor abdominal o incluso alteración de pruebas hepáticas. En caso de que el paciente sea portador de Kehr, la colangiografia transkehr permitirá confirmar el diagnóstico.
Para completar el estudio diagnóstico se realiza una ecografía abdominal y/o TAC que evalúa la posibilidad de biloma y permite en caso necesario la colocación de un drenaje percutáneo. Asimismo es fundamental para confirmar la correcta vascularización del injerto.
La fuga biliar se origina en la mayor parte de casos a nivel de la anastomosis biliar, a nivel de la inserción del tubo de Kehr, o a nivel del remanente cístico. Es mucho más infrecuente la necrosis masiva de la vía biliar, o la fuga a nivel de la zona de biopsia. En los casos de injertos parciales la superficie de transección es otro posible foco de fuga.
El tratamiento de la fuga biliar suele consistir simplemente en su correcto drenaje. En pacientes portadores de Kehr, la apertura del mismo puede resolver el problema. En casos de fuga persistente puede ser útil la realización de CPRE para papilotomía y/o colocación de stent29. En caso de imposibilidad de correcto drenaje y por tanto desarrollo de biloma será necesaria cirugía para drenaje de la fuga biliar y evitar complicaciones sépticas. La necesidad de reconstrucción de la anastomosis biliar por fuga y/o dehiscencia completa es infrecuente. En estos casos será recomendable la reconversión a hepaticoyeyunostomía, una vez resuelto el problema séptico.
Asi pues actualmente la fístula biliar tiene una baja incidencia, y poca influencia en la morbimortalidad postrasplante inmediato. Sin embargo, sí que hay que tener en cuenta su influencia en el desarrollo posterior de estenosis de la vía biliar.
Estenosis anastomóticaA pesar de las estandarización de la técnica quirúrgica, y las mejora en la presevación y selección de donantes, la incidencia de EA postrasplante se ha mantenido muy estable a lo largo de los últimos años siendo de aproximadamente el 10-15% en la mayor parte de centros, en el caso de trasplante con donante cadavérico7,30,31.
Las EA se clasifican según el momento de aparición en precoces (hasta 6 meses pos-TH) o tardías (> 6 meses pos-TH)31.
El primer signo de sospecha de EA suele ser la alteración analítica en los controles habituales, especialmente colostasis. En este sentido la elevación de fosfatasa alcalina es la determinación más sensible, mientras que la elevación de bilirrubina es más específica32,33. La primera prueba diagnóstica a realizar es la ecografia, que puede objetivar dilatación de vía biliar y por otra parte permite evaluar la permeabilidad vascular. Sin embargo hay que considerar que la ecografia tiene baja sensibilidad (40-60%)34,35 en el diagnóstico de CB, dado que la vía biliar del injerto hepático no se dilata de igual forma que un hígado no trasplantado35. La prueba diagnóstica con mayor sensibilidad y especificidad es la colangiorresonancia magnética (CRM)35–37, con la ventaja respecto la CPRE de que no es invasiva.En nuestra opinión la CRM es el gold standard en el diagnóstico de las CB36.
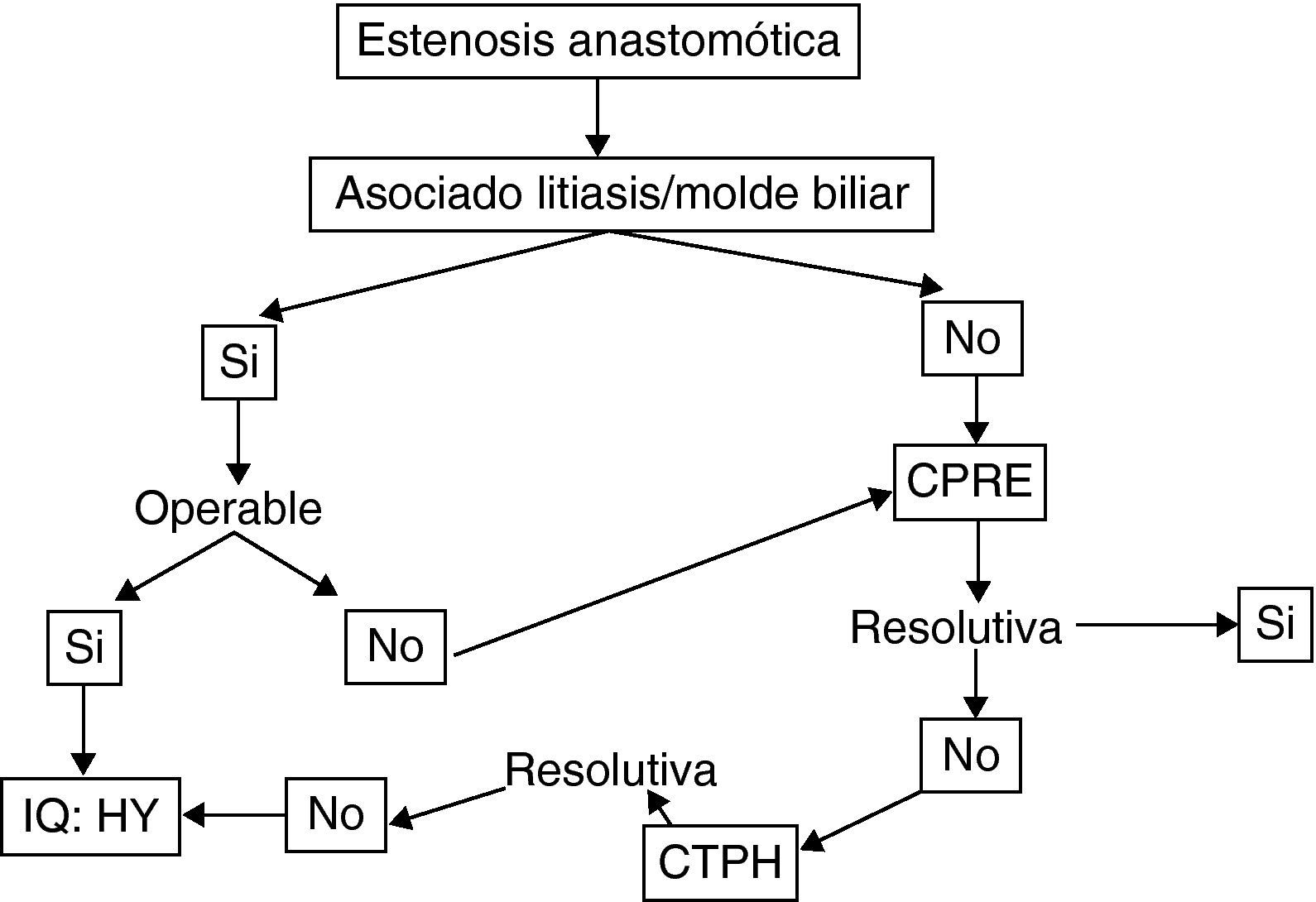
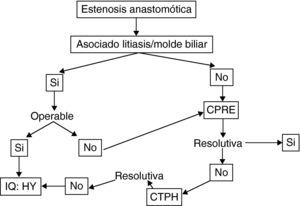
Cualquier EA clínicamente relevante, es decir con alteración analítica, debe ser tratada. Las opciones terapéuticas incluyen el tratamiento endoscópico (CPRE), el tratamiento radiológico percutáneo (CTPH), y el tratamiento quirúrgico (hepaticoyeyunotomía). Cada una de ellas tiene diferentes ventajas e inconvenientes.
El tratamiento endoscópico es considerado actualmente el tratamiento de elección en la mayor parte de centros4,38–42. Si bien inicialmente su eficacia era reducida (0-40%) por lo que era utilizada de elección en escasos centros41, en la actualidad su eficacia es del 60-75%. Aunque no está estandarizado, el manejo habitual más resolutivo consiste en la realización de varios procedimientos con dilatación, y colocación de stents que se retiran tras 3-6 meses42–44. Ello requiere una media de 3-4 sesiones, con una morbilidad del 30%. La recidiva se describe en el 20-30% de los casos. Así pues es un procedimiento complejo, no exento de morbilidad. Las estenosis tardías (> 6 meses) son las que responden peor, requieren más procedimientos y presentan más recidivas.
El tratamiento percutaneo mediante CTPH obtiene resultados similares, con un porcentaje de éxito del 60-70%, y morbilidad similar45. Así pues, la elección de uno u otro acceso depende fundamentalmente de la disponibilidad y experiencia de cada centro.
Finalmente el tratamiento quirúrgico más aceptado consiste en la realización de una hepaticoyeyunostomía en Y de Roux. No hay estudios aleatorizados que comparen sus resultados con los procedimientos radiológicos o percutáneos. Solo el trabajo de Kuo et al.46, comparó los diferentes procedimientos demostrando que el tratamiento quirúrgico tiene mejores resultados a largo plazo. Posteriormente, Davidson et al.47 publicaron la única serie referente a la HY postrasplante, mostrando una morbilidad del 26%, y una mortalidad del 6%.
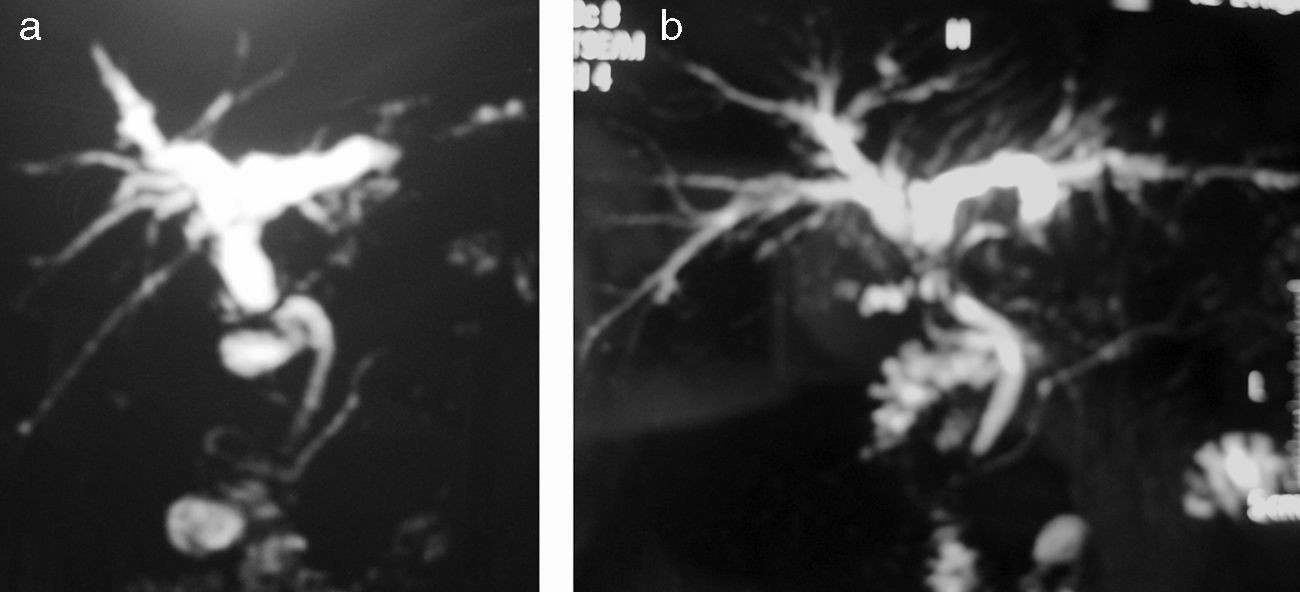
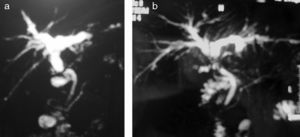
Así pues, el manejo de la EA postrasplante es complejo, y no exento de morbilidad. De forma global, se acepta el manejo endoscópico como de primera elección, si bien no hay que descartar el tratamiento percutáneo según la disponibilidad y experiencia del centro. Sin embargo, en nuestra experiencia7 nosotros añadiríamos que en caso de estenosis tardías, y/o especialmente estenosis asociadas a molde biliar supraestenótico (fig. 1), el tratamiento de primera elección es la cirugía (si no hay otra contraindicación quirúrgica). La fig. 2 muestra el algoritmo terapéutico de nuestro centro en el manejo de la EA.
Englobamos en este apartado todas aquellas estenosis no localizadas a nivel de la anastomosis, que son también denominadas en la literarura estenosis de tipo isquémico (ischemic-type strictures) estenosis intrahepáticas, o clásicamente colangitis isquémica postrasplante50,51. Su incidencia es del 5-15% según las series3,4,7,48–51.
Si bien inicialmente se consideraba que se debían a la trombosis de la arteria hepática, solo el 40-50% de las ENA se asocian a dicha trombosis.
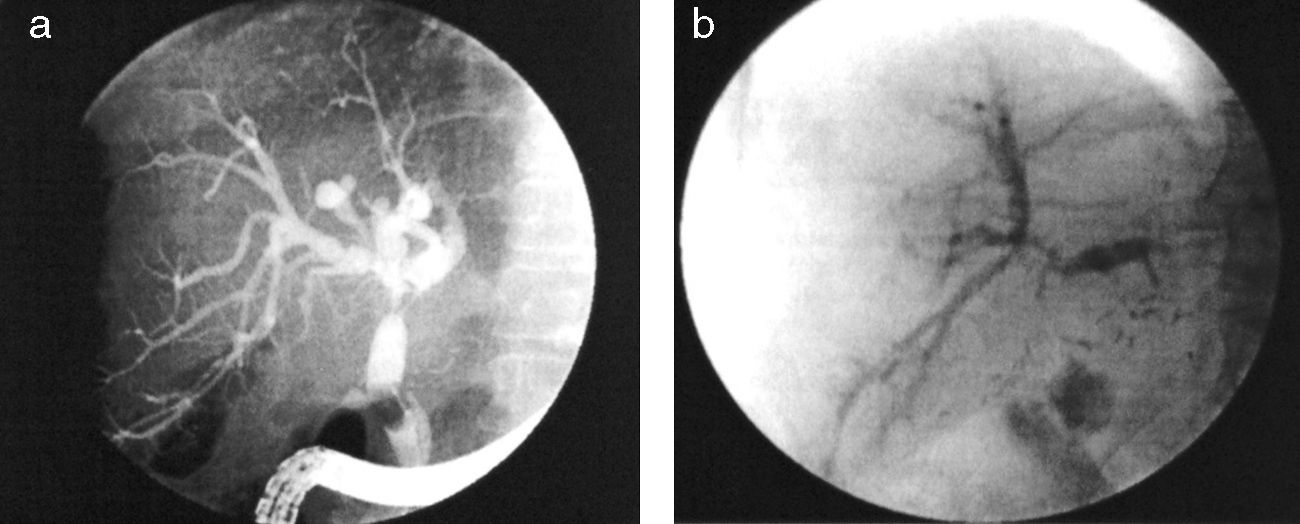
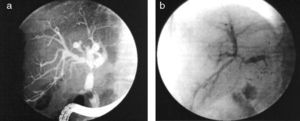
Algunos autores establecen una clasificación detallada según diferentes zonas de la vía biliar49, pero desde el punto de vista práctico la clasificación en «hiliar» o difusa36,50 (fig. 3) es a nuestro modo de ver la más útil, y por otra parte refleja la diferente fisiopatología de estos dos tipos de estenosis.
Por otra parte el momento de presentación también parece relacionarse con la etiopatogenia, y con el pronóstico. Así las ENA de inicio precoz, considerándose como tales las que se presentan antes de un año postrasplante, parecen estar más relacionadas con factores isquémicos50. Estos factores isquémicos pueden ser trombosis de la arteria hepática, o daño isquémico durante la preservación. Dentro de los factores de tipo isquémico cabe destacar el tiempo de isquemia, el tipo de solución de preservación (siendo preferible las de baja viscosidad) y el donante a corazón parado. Característicamente, las ENA de inicio precoz suelen ser del tipo «hiliar».
Las ENA tardías, es decir, las que se presentan más allá del primer año postrasplante, se relacionan más con factores inmunológicos como pueden ser componentes de autoinmunidad previos (trasplante por hepatitis autoinmune o colangitis esclerosante primaria, infección por citomegalovirus, rechazo...)51,52. Característicamente las ENA tardías suelen afectar de forma más difusa la vía biliar intrahepática, con el aspecto radiológico característico de estenosis y dilataciones intrahepáticas difusas.
El diagnóstico, al igual que en las EA, suele ser determinado por alteraciones analíticas en forma de colostasis. Durante la evolución, pueden presentarse colangitis de repetición, y finalmente la evolución puede ser a cirrosis biliar secundaria.
Una vez más la ecografía puede no ser diagnóstica, siendo la CRM la prueba diagnóstica de elección. Asimismo cabe destacar que algunos pacientes están inicialmente asintomáticos, sin repercusión analítica, siendo diagnosticados tras la realización de CRM rutinarias. Este aspecto es de gran relevancia, pues ha sido descrito que hasta un 25-30% de los pacientes con diagnóstico radiológico de ENA no presentarán progresión radiológica ni clínica51,52. Parece que en general la forma hiliar, sin afectación de ramas intrahepáticas periféricas, podría tener mejor pronóstico.
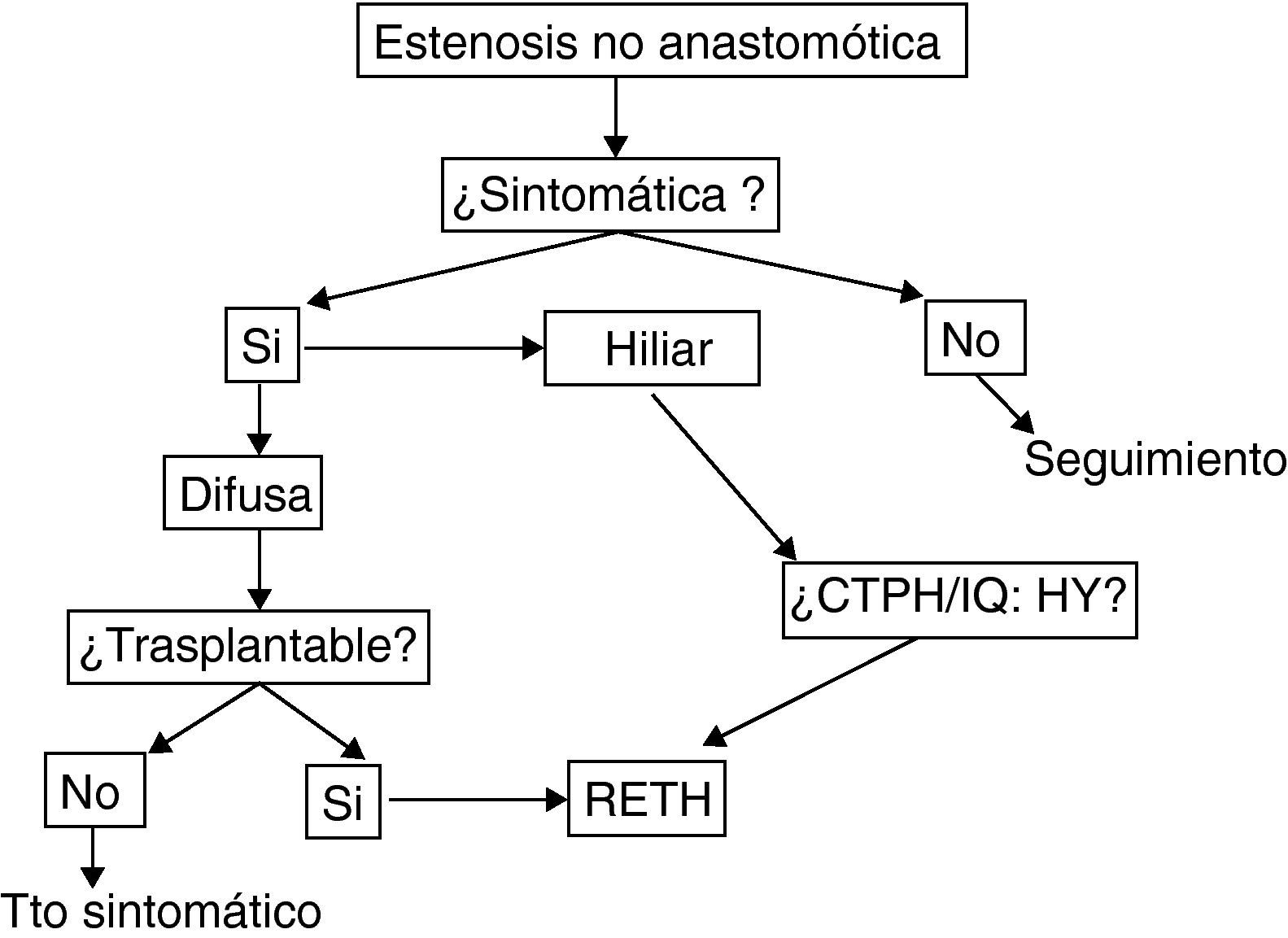
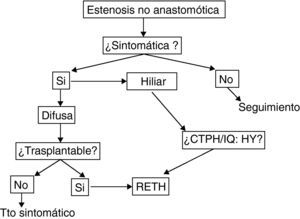
De forma general aquellos pacientes con diagnóstico radiológico de ENA, pero asintomáticos, pueden ser seguidos sin tratamiento. Es usual en la mayor parte de centros el tratamiento con ácido ursodeoxicólico, si bien no ha sido demostrada su eficacia en estudios controlados.
En caso de presentar ya alteración analítica, las opciones terapéuticas incluyen el tratamiento endoscópico, radiológico, quirúrgico (hepaticoyeyunostomía) o el retrasplante. Las opciones radiológicas o endoscópicas, solo tendrán papel en caso de estenosis focales, que son infrecuentes. Los casos de ENA de tipo hiliar pueden ser manejados mediante tratamiento endoscópico o radiológico, según la experiencia del centro, o mediante hepaticoyeyunostomía especialmente si ya se asocia a molde biliar.
Sin embargo, una gran parte de ENA son de tipo difuso. Si bien muchos grupos proponen el manejo radiológico/ensocópico inicial, en nuestra opinión es preferible el retrasplante de forma preferente, si es posible.La manipulación previa solo contribuye a incrementar las complicaciones sépticas, sin alterar la necesidad de retrasplante.
La fig. 4 muestra el algoritmo terapéutico de nuestro centro en el manejo de la ENA.
Las ENA son la complicación biliar más temida, dada la dificultad en prevenirla, el dificil manejo y el mal pronóstico. Así, si bien otro tipo de complicacions biliares no parece influir en la supervivencia del paciente, ni del injerto, las ENA se asocian a una necesidad de retrasplante del 60-70%, y a pesar de ello, con una mortalidad próxima al 50%.
Coledocolitiasis y otras complicacionesDentro del capítulo de otras complicaciones biliares, se describe habitualmente la disfunción del esfínter de Oddi. Este ha sido siempre un diagnóstico controvertido. Hipotéticamente se debería a la denervación de la vía biliar, y el tratamiento de elección consistiría en una papilotomía.
Otras complicaciones infrecuentes descritas en la literatura, especialmente en forma de casos, son el mucocele, hemobilia (secundaria a biopsias o colangiografia percutánea...), y el molde biliar (casts)3,4,6.
De forma global podríamos concluir que las complicaciones biliares siguen siendo un tema de gran interés en el manejo del TH. Su diagnóstico se basa en un seguimiento estricto, siendo la CRM la técnica diagnóstica de elección. Su tratamiento requiere un manejo individualizado. Se deberá tener en cuenta el momento del diagnóstico, la situación de la función hepática, el estado general del paciente y la disponibilidad y experiencia del equipo en las diferentes opciones terapéuticas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.