El trasplante hepático en adulto con órgano procedente de donante vivo es una alternativa válida y eficaz como tratamiento de la enfermedad terminal hepática. Sin embargo, en el contexto de tasas muy elevadas de órgano procedente de donante en muerte cerebral, como ocurre en los países occidentales (España), continúa manteniendo aspectos controvertidos que obligan a una evaluación continua para asegurar buenos resultados. La donación en vivo se encuentra estabilizada en la actualidad y representa alrededor del 5% de toda la actividad de trasplante hepático en Europa. La morbididad y la mortalidad están alrededor del 35 y el 0,1% respectivamente, cifras probablemente razonables, dadas las características de la intervención. En cuanto a los resultados de los receptores de un donante vivo, las supervivencias a 1 y 5 años actualmente son del 95 y el 75%, lo que los sitúa en cifras similares a los resultados procedentes de donante en muerte cerebral. Sin embargo, el índice de complicaciones biliares en este grupo de pacientes es mayor, con un 35–40% de incidencia, aunque hasta ahora ésta no influye en los resultados a largo plazo.
Adult liver transplants from a living donor are a valid and effective alternative as a treatment in terminal liver disease. However, in the context of a donation from a brain dead donor, as in western countries (Spain), it is very high, and there are still controversial aspects that should be continuously assessed in order to ensure good results. Live donations are currently stable and represent about 5% of the total liver transplants performed in Europe. Morbidity and mortality is around 35% and 0.1%, respectively, probably reasonable figures given the characteristics of the intervention. The 1 and 5 year survival rates of the recipients of a living donor are currently 95% and 75%, which are similar to those coming from brain dead donors. However the level of biliary complications in this patient group is higher, with an incidence of around 35–40%. However, this incidence has not had any effect on the long-term results up until now.
La obtención de un segmento de hígado para trasplante es una de las intervenciones más complejas en la actualidad. Se necesita una disección cuidadosa que no admite errores y necesita en todo momento de un tratamiento del parénquima que garantice su indemnidad durante todo el proceso de obtención1.
El injerto hepático parcial puede ser a partir del lóbulo izquierdo, que es el que se utiliza normalmente en el trasplante de hígado de donante vivo infantil, o del lóbulo derecho, que es el que habitualmente se utiliza en el trasplante de hígado de donante vivo en adulto. Cualquiera de las dos intervenciones obliga a un estudio exhaustivo antes y durante la intervención que permita el conocimiento anatómico exacto de todas las estructuras vasculares y biliares2.
A pesar de que como intervención se encuentra muy bien reglada, quizá la hepatectomía derecha para conseguir un lóbulo de tamaño suficiente, en el trasplante de donante vivo en adulto, es la que ha dado lugar al mayor número de aspectos controvertidos, que tienen que ver con el resto de tejido hepático que queda en el donante3, la superficie cruenta y la distribución vascular/biliar, etre otros. El aspecto que da lugar a mayor número de controversias es la morbilidad y la mortalidad que un proceso de este tipo puede conllevar4. De hecho, todos los esfuerzos se dedican a conseguir un procedimiento seguro, pero hay aspectos que son inherentes a intervenciones de gran magnitud, como el riesgo de tromboembolia, la aparición de complicaciones infecciosas, etc., que dan lugar a una morbilidad asociada cercana al 25% y una mortalidad que en la actualidad se cifra en un 0,3‰5.
A continuación se repasa todo el proceso de donación para obtener un injerto parcial, con especial hincapié en los aspectos más discutidos.
Evaluación anatómica del injerto potencialEn la actualidad disponemos de instrumental que permite la evaluación cuidadosa de todas las estructuras hepáticas, sean vasculares o biliares. Tanto la resonancia magnética (RM) como la tomografía computarizada (TC) multiplanar permiten conocer todas esas estructuras6. La RM tiene como ventajas que en una misma exploración se puede realizar todos los estudios tanto vasculares como biliares, aunque con el inconveniente de que consume significativamente más tiempo que la TC. El principal inconveniente de ésta se encuentra en que el estudio de la vía biliar requiere otra exploración independiente. Cualquiera de las dos permite de una forma muy poco agresiva conocer la distribución anatómica del hígado y plantear la intervención quirúrgica. Existen métodos para, a partir de las imágenes obtenidas, reconstruir el órgano en tres dimensiones para apreciar sin ningún tipo de dudas las relaciones de todas las estructuras vasculares (arteria y venas), entre ellas y con las vías biliares. Su realización encarece mucho la exploración, por lo que realizarla de forma sistemática, a nuestro juicio, no está justificado.
Estructuras vascularesEl estudio de las estructuras vasculares permite ver con detalle: a) las venas hepáticas, comprobando la presencia o no de una vena hepática derecha predominante, así como la existencia de venas hepáticas medias, que con frecuencia drenan los segmentos anteriores del lóbulo derecho; si tienen un tamaño alrededor de 1cm, sería aconsejable su reconstrucción durante el trasplante; b) la vena porta, en la que el dato más importante es la existencia de un tronco común derecho; en algunas ocasiones aparece una bifurcación muy temprana que precluye la existencia de una porta derecha única (actualmente este hallazgo no es motivo de contraindicación, ya que la bifurcación portal del receptor se puede utilizar, en el banco, para conseguir un tronco común7), y c) la arteria hepática derecha, que suele ser bastante uniforme en su distribución, con un trayecto derecho que permite un segmento suficiente para una reconstrucción arterial sin ningún tipo de injerto asociado.
La vía biliarEs importante conseguir buenas imágenes que permitan visualizar hasta los primeros radicales del lado derecho. Las anomalías anatómicas son frecuentes y la presencia de al menos dos conductos hepáticos representa un 60%8. Si no fuera posible, antes de iniciar el procedimiento durante el acto quirúrgico, es necesario realizar una colangiografía peroperatoria, lo que sirve para estudiar con detalle su anatomía, algo imprescindible a la hora de plantear la táctica quirúrgica.
Procedimiento quirúrgicoEl procedimiento quirúrgico está muy bien estandarizado y pocas dudas hay a la hora de plantear la técnica quirúrgica9. Ahora bien, es necesario ese estudio anatómico exhaustivo que permita controlar en todo momento y con seguridad el proceso de la hepatectomía.
Aislamiento de las estructuras vascularesEste primer aspecto consta de la disección de la arteria hepática derecha, la vena porta derecha y la identificación de la vía biliar derecha. De la misma forma, se libera todo el lóbulo derecho hepático, separándolo de la vena cava e identificando la vena hepática derecha. Todo ello permite separar el lóbulo derecho de la vena cava e identificar la línea de transección final mediante el paso de una cinta entre la venas suprahepáticas. El aislamiento de la arteria hepática y la vena porta derecha permite comprobar la línea de transección del parénquima mediante su pinzamiento10.
La vía biliarEn nuestra experiencia no hacemos ningún intento de disección, a pesar de que conozcamos la anatomía. La razón principal se basa en realizar todo ese procedimiento en la situación más favorable para el donante posible, por lo que consideramos que la vía biliar debe disecarse al final de proceso de transección del tejido hepático, cuando sólo las estructuras vasculares permanecen y, por lo tanto, se facilita muchísimo la sección de la vía biliar derecha.
Colangiografía peroperatoriaUna vez hecha la disección del hilio, se identifica aquello que creemos que es la vía biliar derecha y se marca con un par de clips. Se realiza la colecistectomía y la canulación del conducto cístico. La colangiografía nos mostrará la anatomía exacta, si no la conocíamos previamente. Motivo de controversia es la gran variabilidad de la vía biliar, lo cual podría ser motivo de contraindicación. Indudablemente, la aparición de más de un conducto derecho aumenta la dificultad de la reconstrucción biliar en el donante11. Si a esto se añade que el índice de complicaciones biliares es más elevado en este tipo de trasplante, se podría indicar no realizarlo cuando el número de conductos hepáticos derechos sea superior a dos. Sin embargo, no se ha podido demostrar que el número de conductos hepáticos condicione la aparición de complicaciones postoperatorias. Además, en la actualidad y a medida que aumenta la experiencia, las complicaciones de origen biliar se han reducido de forma sustancial y se producen en un 30% de los casos.
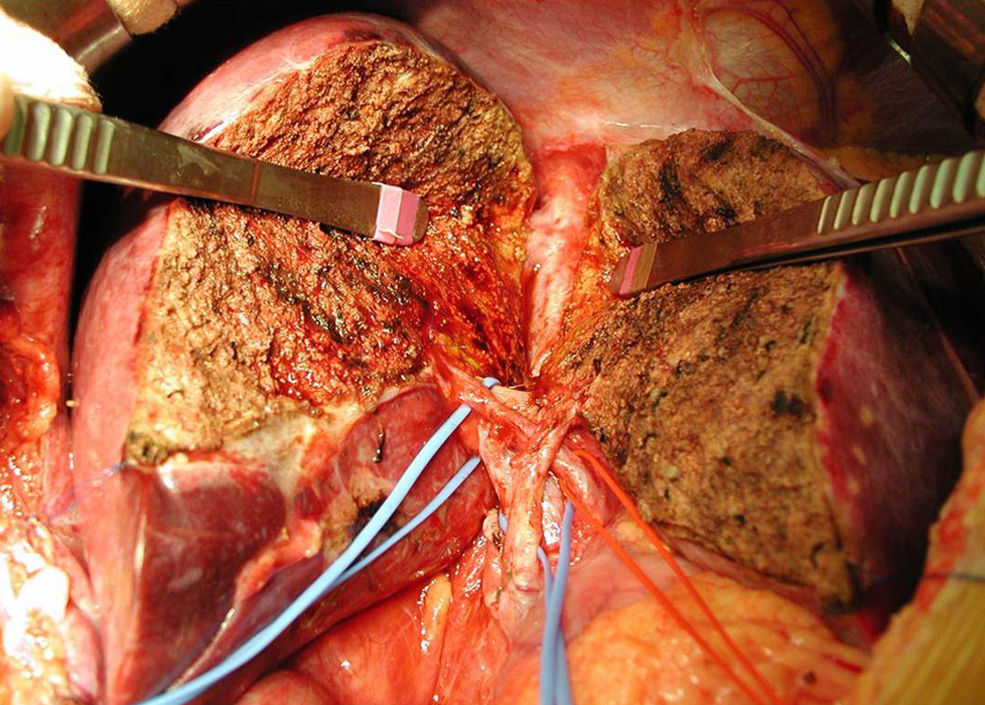
Transección del parénquimaLa transección hepática está muy bien estandarizada. En nuestra experiencia el empleo del bisturí ultrasónico Cusa® y un sistema de coagulación monopolar como es el tissuelink permite una hemostasia cuidadosa, junto con la identificación de las diferentes estructuras que se encuentran en el plano de sección, en su mayoría ramas de la vena hepática media y la propia vena en algunos casos (fig. 1). Dos aspectos permanecen todavía en la actualidad como motivo de controversia.
Sección de la vía biliarAlgunos autores prefieren la sección de la vía biliar al inicio de la intervención, pero en nuestra experiencia preferimos hacerlo cuando la transección hepática está casi terminada. La razón de ello es poder identificar muy bien las estructuras, la orientación de la vía biliar y las ramificaciones más o menos inmediatas. La sección se hace siempre con tijeras y facilitando la hemorragia como garantía de no comprometer la vascularización de este segmento de la vía biliar. La visualización de la vía biliar en un segmento más o menos largo permite, con la ayuda de una «herina», comprobar el camino exacto y la situación de la bifurcación biliar, evitando así lesionar el conducto hepático izquierdo.
Inclusión de la vena hepática media con el injertoLa vena hepática media ha sido motivo de discusión entre los diferentes grupos de trasplante hepático con experiencia en trasplante de donante vivo12,13. La base de la polémica es conseguir un drenaje del segmento hepático lo más adecuado posible, en condiciones distintas del estado fisiológico normal, es decir, suelen ser pacientes con hipertensión portal y flujos que pueden ascender a hasta 3 y 4 veces los valores normales. Ello coloca al injerto hepático parcial en una situación incómoda que puede llevar, si no se garantiza un drenaje venoso correcto, al síndrome que se conoce como «small for size» (pequeño para su tamaño)14,15. Las alternativas, desde el punto de vista técnico, son desde la conservación de la vena hepática media con el injerto16,17 —lo cual puede perjudicar al donante— a la realización de maniobras técnicas complejas en forma de plastias que intentan conseguir un drenaje venoso correcto18,19. Nuestra experiencia nos permite señalar los siguientes puntos: a) exhaustiva evaluación preoperatoria de la distribución de las venas hepáticas e identificar aquellas que, además de la vena hepática derecha, se necesitaría utilizar y anastomosar la vena cava (vena hepática derecha accesoria o vena hepática tributaria de la vena hepática media); b) tener en cuenta el proceso de transección por si la ligadura y la sección de un vaso comprometen el drenaje, cosa que se hace evidente en la superficie hepática; c) tras la sección completa, el lavado del injerto debe de ser uniforme; si no es así, alguna rama venosa compromete el buen drenaje, lo que aconseja soltar la ligadura correspondiente, y d) la disponibilidad de injertos criopreservados que permitan construir un puente a la cava desde la vena hepática identificada (normalmente tiene un diámetro > 5mm). Por último, controlamos en todo momento los flujos a través de la porta, al inicio de la intervención, tras la realización del shunt portocavo temporal, y en el momento de la reperfusión. El objetivo es no tener en ese momento un flujo > 2l. Para ello, si hace falta, se realiza la ligadura de la arteria esplénica. Nosotros, como muchos grupos20, no consideramos incluir la vena hepática media con el injerto hepático, puesto que nuestro criterio es realizar cualquier maniobra siempre a favor del donante; por lo tanto, la vena hepática media se queda en mayor o menor recorrido con el lóbulo izquierdo. La reconstrucción venosa en el receptor se plantea siempre con la posibilidad de utilizar injertos criopreservados para garantizar el mejor drenaje venoso posible.
Morbididad y mortalidadEs el motivo principal que pone en duda la justificación de este tipo de trasplante. La morbididad y la mortalidad relacionadas con la donación en vivo continúa planteando polémicas sobre su justificación21. Una evaluación exhaustiva preoperatoria no es suficiente para garantizar un curso postoperatorio sin problemas. La incidencia de complicaciones se cifra entre un 20 y más del 50%. Esta gran variabilidad se debe a la forma de considerar las diferentes complicaciones22. A menudo se consideran sólo las importantes, las que han requerido ingreso o reintervención. Sin embargo, una evaluación correcta indica que el número de complicaciones está más cerca del 50 que del 20%. La complicación más frecuente tiene que ver con la vía biliar23,24 y la aparición de fugas biliares que requieren de un tratamiento conservador y sólo en algunos casos implica la reintervención quirúrgica. Pero también son frecuentes la fiebre postoperatoria, el derrame pleural derecho, etc. Afortunadamente, en nuestra experiencia todos los donantes se han recuperado totalmente, y en un estudio inicial sobre su calidad de vida todos ellos la valoraban de forma satisfactoria.
Otro aspecto es la mortalidad entre los donantes. En la actualidad se calcula que la probabilidad de morir después de la donación está en un 0,3% (según el ELTR). Sin embargo, la mayoría de las críticas señalan que ese número está infravalorado. Hay que decir que los datos del Registro Europeo están auditados y, por lo tanto, es difícil que en Europa sea así (tabla 1). No obstante, en Estados Unidos y el resto del mundo no existe un registro común que incluya todos los trasplantes, y la publicación de un dato negativo como éste se hace complejo. Al margen de este hecho, es un dato objetivo que hay riesgo de morir, y eso condiciona muchísimo el establecimiento de este tipo de trasplantes. El objetivo es garantizar en todo momento una asistencia del máximo nivel; la evaluación preoperatoria y el seguimiento postoperatorio deben recoger todos los aspectos clínicos, no sólo la función hepática, sino también el estado funcional de todo el organismo. Es imposible garantizar una mortalidad nula, pero el programa en sí puede adquirir, como así es en todo el mundo, un compromiso de asistencia al más alto nivel, incluidos los fines de semana. En nuestra experiencia de los más de 60 trasplantes realizados, nuestro índice de complicaciones se encuentra alrededor del 35% y, afortunadamente, hasta ahora todos los donantes se encuentran en perfecto estado de salud.
Complicaciones del donante en el postoperatorio temprano (octubre de 1991 a junio de 2007)
| n (%) | |
| Sin complicaciones | 1.875 (80) |
| Complicaciones | 479 (20) |
| Fuga biliar | 95 (4) |
| Estenosis biliar | 16 (0,7) |
| Insuficiencia hepatica | 143 (6) |
| Pulmonares | (2) |
| Derrame pleural | 36 (1,5) |
| Embolia pulmonary | 19 (0,8) |
| Vascular | (2) |
| Hemorragia | 20 (0,8) |
| Trombosis portal | 11 (0,5) |
| Neumonía o neumotórax | 10 (0,5) |
| Trombosis arterial | 7 (0,3) |
| Flebitis | 1 (0,04) |
| Infección | (3,7) |
| Herida quirúrgica | 50 (2) |
| Distinta de herida quirúrgica | 37 (1,6) |
| Colección | (0,4) |
| Infectada | 2 (0,08) |
| No infectada | 6 (0,3) |
| Gastrointestinal | 16 (0,8) |
| General | 10 (0,5) |
Fuente: ELTR (European Liver Transplant Registry). Disponible en: http://www.eltr.org.
El trasplante en adulto procedente de donante vivo todavía es motivo de controversia, pero la mortalidad en la lista de espera justifica por sí sola este tipo de trasplante. Los resultados actuales indican una supervivencia similar a la del trasplante de cadáver, aunque se asocia a un mayor número de complicaciones biliares en cuanto a estenosis que aparecen a largo plazo (más allá de los 6 meses). El riesgo al que se somete al donante debe ser debidamente explicado. La actual ley española, que defiende explícitamente este tipo de trasplante, tiene desarrollados mecanismos que garantizan en lo posible la ausencia de presión25. La necesidad de unos informes positivos por parte de médicos que no forman parte del programa, la firma del consentimiento informado ante el juez, etc., hacen que el proceso se haga necesariamente largo, exhaustivo y, en su mayor parte, objetivo. Ante la ausencia de una garantía absoluta, se hace necesaria la evaluación continua del proceso para evitar la disminución en la intensidad del compromiso de todos los miembros del grupo. Solo así se conseguirán resultados objetivos que justifiquen con creces el riesgo al que se somete a una persona sana.