La cirugía robótica ha demostrado su eficacia en ciertos procedimientos quirúrgicos. Sin embargo, en cirugía hepática y pancreática (HBP) su uso es todavía poco frecuente. Se presenta la experiencia inicial en cirugía robótica HBP de una unidad especializada en un hospital de tercer nivel.
MétodoSe han estudiado en forma prospectiva los resultados de los pacientes intervenidos de cirugía HBP robótica entre abril de 2018 y octubre de 2020. Los datos analizados corresponden a datos demográficos, técnicas quirúrgicas realizadas y morbimortalidad asociada.
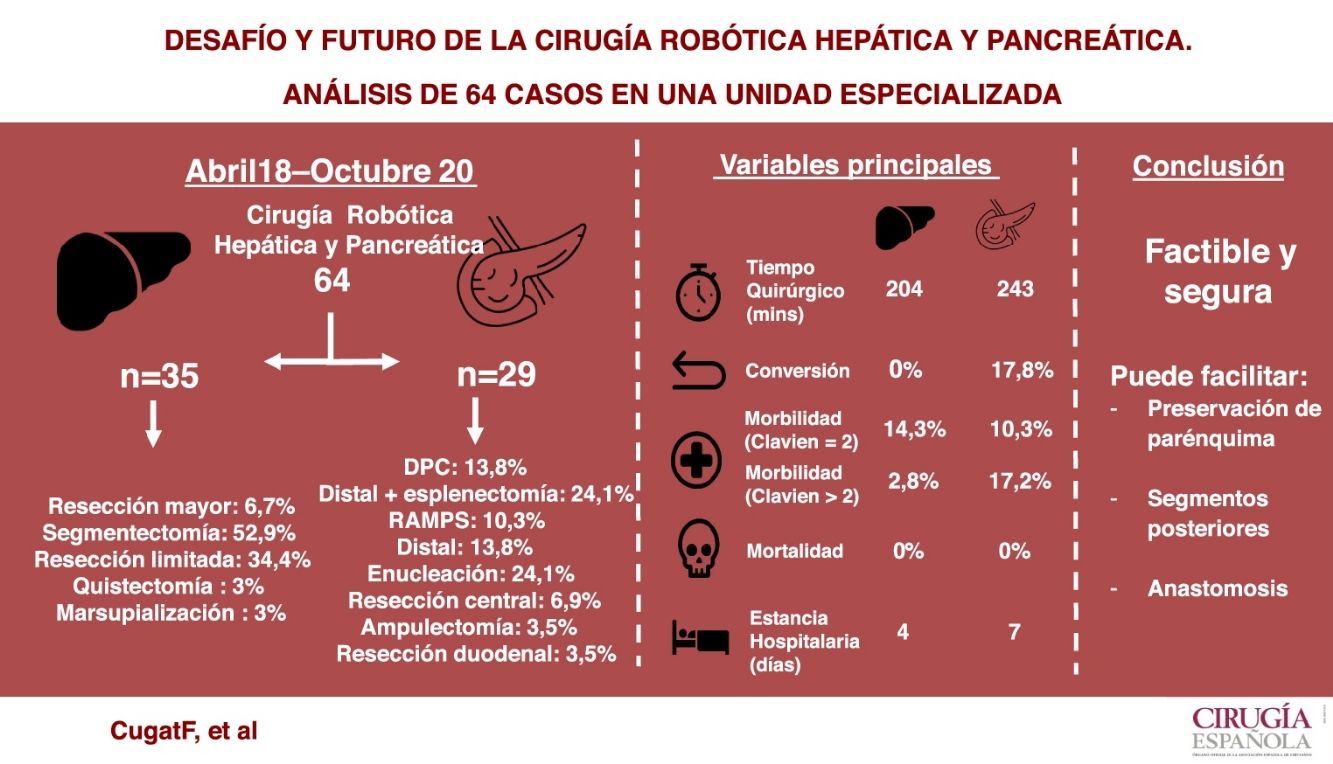
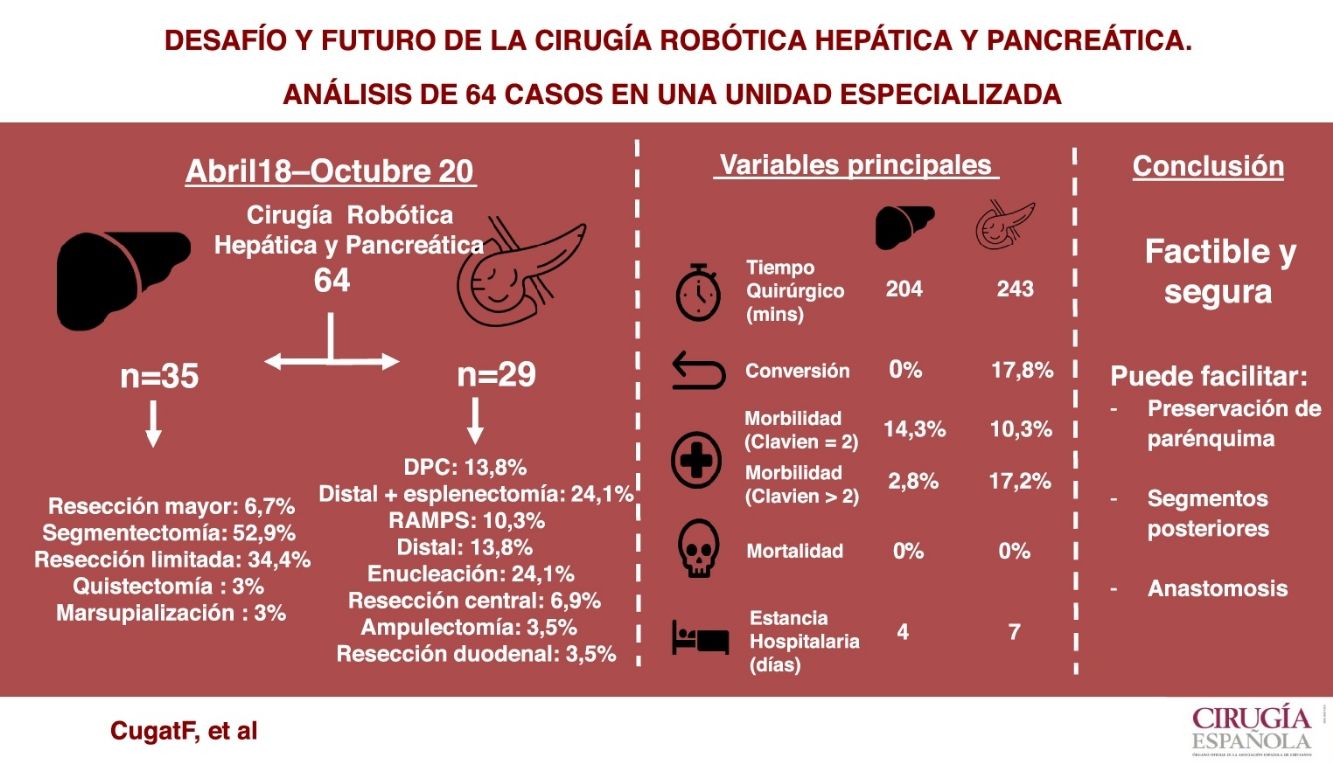
ResultadosSe intervinieron 64 pacientes, sometidos a 35 hepatectomías (mayores [6,7%], anatómicas [52,9%], limitadas [34,4%], quistectomías [3%] y marsupializaciones [3%]) y 29 pancreatectomías/resecciones duodenales (distales [48,2%], centrales [6,9%], cefálicas [13,8%], enucleaciones [24,1%], ampulectomías [3,5%] y resecciones duodenales [3,5%]).
En cirugía hepática el tiempo operatorio medio fue de 204,4 minutos (100-265 min), la mediana de complicaciones postoperatorias según la escala de Clavien-Dindo fue de uno (1-4), las pérdidas hemáticas medias de 166,7 mL (100-300 mL), no existió conversión y la estancia postoperatoria media de cuatro días (2-14 días).
En cirugía pancreática el tiempo operatorio medio fue de 243,8 minutos (125-460 min), la mediana de complicaciones postoperatorias de dos (1-4), las pérdidas hemáticas de 202,3 mL (100-500 mL) asociadas a una tasa de conversión del 17,8% y una estancia media de siete días (3-23 días).
ConclusionesLa cirugía robótica HBP es segura y factible. Se sugiere que su uso facilita la cirugía conservadora de parénquima, el acceso a segmentos posteriores hepáticos y la realización de anastomosis en la reconstrucción pancreática respecto a la cirugía laparoscópica.
Robotic surgery has proven effective in certain surgical procedures. However, in liver and pancreatic surgery (HBP) its use is still rare. The initial experience in HBP robotic surgery of a specialized unit of a tertiary hospital is presented.
MethodThe results of patients undergoing robotic HBP surgery between April 2018 and October 2020 have been prospectively studied. The data analyzed correspond to demographic data, surgical techniques performed, associated morbidity and mortality.
Results64 patients were operated, corresponding to 35 hepatectomies (major [6.7%], anatomic [52.9%], limited [34.4%], cystectomies [3%] and marsupialization [3%]), 29 pancreatectomies (distal [48.2%], central [6.9%], cephalic [13.8%], enucleations [24.1%], ampullectomies [3.5%] and duodenal resections [3.5%]).
In liver surgery the mean operative time was 204.4 minutes (100-265 min), the median postoperative complications according to the Clavien-Dindo scale was one (1-4), the mean blood losses 166.7 mL (100-300 mL), there was no conversion and the mean postoperative stay was four days (2-14 days).
In pancreatic surgery, the mean operative time was 243.8 minutes (125-460 min), the median of postoperative complications was two (1-4), blood loss of 202.3 mL (100-500 mL) associated to a conversion rate 17.8% and an average stay of seven days (3-23 days).
ConclusionsRobotic HBP surgery is safe and feasible. It is suggested that its use facilitates parenchymal sparing surgery, access to posterior liver segments and anastomosis in pancreatic reconstruction compared to laparoscopic surgery.
La cirugía robótica ha demostrado ya su eficacia en ciertos procedimientos quirúrgicos como en la prostatectomía radical1,2. La visión aumentada y la precisión de los movimientos permiten realizar en un espacio reducido técnicas que por laparoscopia pueden ser complejas. En esta área el robot ha simplificado y mejorado de forma importante la técnica quirúrgica3.
En el caso de la cirugía hepática y pancreática (HBP), la cirugía mínimamente invasiva se ha implementado mayoritariamente por vía laparoscópica, siendo poco frecuente el uso del robot.
La cirugía hepática por laparoscopia es una cirugía compleja que ha demostrado su eficacia, pero solo es reproducible por un número de cirujanos reducido con habilidades en laparoscopia avanzada4. La disposición del órgano, con zonas posteriores escondidas a la visión anterior dificulta el acceso a ciertas lesiones, por lo que se han descrito técnicas de acceso caudal y cambios de posición del paciente o colocación de trocares intercostales para soslayar estas circunstancias. La cirugía robótica, a priori, permitiría obviar estos problemas dada su capacidad de articulación de instrumentos y visión que facilita el acceso a las «zonas ocultas» a la visión laparoscópica5.
La cirugía pancreática laparoscopia ha demostrado su eficacia en la resección del cuerpo y cola siendo más controvertido la resección de la cabeza6-8. En este caso, la cirugía robótica podría tener, por un lado, un papel en la cirugía preservadora de parénquima pancreático, dada su visión microscópica y precisión, y por otro lado, en la fase reconstructiva del tracto digestivo después de una duodenopancreatectomía cefálica (DPC), al simplificar el procedimiento gracias a la facilidad de sus movimientos.
En caso de ser así, la incorporación de la cirugía robótica en el campo de la cirugía hepato-pancreática podría democratizar y facilitar el abordaje mínimamente invasivo respecto a la cirugía laparoscópica, que es altamente demandante y con una curva de aprendizaje larga y no siempre adecuada.
Sin embargo, estos supuestos beneficios todavía no se han demostrado en la cirugía HBP9.
En el presente estudio, se presenta la experiencia inicial en cirugía robótica hepática y pancreática en casos seleccionados de una unidad especializada en cirugía HBP de un hospital universitario de tercer nivel, con la finalidad de establecer las ventajas e inconvenientes de este abordaje.
MétodoEntre abril de 2018 y octubre de 2020, 64 pacientes fueron sometidos a una intervención HBP robótica con el Sistema Quirúrgico Da Vinci Xi® (Intuitive Surgical, Sunnyvale, CA, EE. UU.). Se realizaron 35 hepatectomías (mayores, anatómicas y limitadas), 28 pancreatectomías (distales, centrales, cefálicas y enucleaciones) y una resección duodenal. El desarrollo de las técnicas quirúrgicas fue simultáneo tanto para la cirugía hepática como la pancreática.
A todos los pacientes se les aplicó el protocolo hospitalario de prehabilitación quirúrgica10, con rehabilitación multimodal prequirúrgica y un protocolo de recuperación incentivada tras la cirugía (ERAS)11.
Descripción técnicaSe posicionó a los pacientes en decúbito supino sobre colchón de fijación Pink Pad®, en posición francesa, con piernas abiertas, el brazo derecho cerrado y se orientó la mesa en anti-Trendelenburg de 15°. Seguidamente, se realizó el neumoperitoneo (12-14 mmHg) con aguja de Veress en punto de Palmer. El posicionamiento de los trócares fue a lo largo de una línea recta bajo el ombligo, empezando por el trócar periumbilical para la cámara robótica estereoscópica de 30° y la determinación del objetivo (pointing target). Se utilizaron otros dos trócares robóticos de 8 mm y un tercero de 11 mm, para el uso de la endograpadora robótica, añadiendo un trócar accesorio para el ayudante según necesidad. La aproximación del brazo robotizado se realizó por la derecha del paciente para las resecciones hepáticas y duodenopancreáticas (con decúbito izquierdo variable), mientras que se realizó por la izquierda para las resecciones de cuerpo y cola pancreática y esplénicas (decúbito derecho). El acoplamiento de los puertos (Docking) se realizó, de derecha a izquierda, con pinza bipolar (T1), cámara robótica de 30° (T2), tijera monopolar/vessel sealer (T3) y pinza de agarre tip up grasper (T4).
Cirugía hepáticaSe realizó la movilización hepática para tener un adecuado acceso a la zona de transección. La transección parenquimatosa se realizó con pinzamiento hiliar de Pringle extracorpóreo mediante sistemática crush-clamp con pinza bipolar y tijera monopolar. Para la sección de radicales portales de segundo orden se utilizaron Hem-o-locks robóticos mientras que la transección de venas suprahepáticas o radicales portales de primer orden se realizaron con endostapler robótico, con carga blanca de 45 mm para las primeras y con carga azul de 60 mm para los segundos. Los especímenes fueron extraídos en endobag XL a través de una incisión accesoria de Pfannenstiel. Finalmente, se cerró la aponeurosis del trócar de 11 mm y de la incisión accesoria.
Cirugía pancreáticaPara las resecciones pancreáticas conservadoras de parénquima (enucleaciones), tras acceder a la transcavidad de los epiplones, se traccionó el estómago al cénit con dos cintas de Rummel, introducidas con aguja de Reverdain, para obtener una correcta exposición pancreática. Seguidamente, se identificó la lesión con ecografía peroperatoria. La disección y transección de la glándula se realizó con movimientos finos con pinza bipolar Maryland fenestrada y tijera monopolar.
Para la DPC, tras la transección del antro gástrico con endostapler 60 mm robótica, se accedió a la transcavidad de los epiplones. Se procedió a la disección del hilio hepático para seguir con una maniobra de Kocher amplia. Se disecó la vena porta retropancreática y se seccionó la glándula con tijera monopolar. Tras rechazar cranealmente el epiplón mayor, se identificó la primera asa yeyunal, que se seccionó con endograpadora 60 mm, para proceder al descruzamiento duodenal. Finalmente, se realizó la disección portal y la transección del mesopáncreas con la selladora robótica. Para la reconstrucción, la derivación entérica con anastomosis pancreático-yeyunal se realizó con sutura de PDS 4/0 discontínua para la ducto-mucosa y una doble capa continua con sutura barbada 3/0. En caso de una anastomosis pancreato-gástrica, se realizó una doble corona con sutura barbada 3/0 en la cara posterior gástrica. La hepatoyeyunostomía se realizó mediante doble sutura contínua barbada 3/0 y la gastroyeyunostomía, mediante anastomosis mecánica con endostapler robótica 60 mm, todo ello en asa única antecólica.
Análisis estadísticoEl análisis descriptivo se ha realizado y se expresa mediante medidas de frecuencia (porcentaje) para las variables cualitativas. Para las variables cuantitativas se utilizan medidas de valor central, media y mediana según si la variable sigue una distribución normal o no, y el rango, con el que expresamos también los valores máximo y mínimo de los resultados obtenidos.
ResultadosResecciones hepáticasSe intervinieron a 35 pacientes de cirugía hepática, con un total de 45 lesiones, predominando pacientes ASA 2, con un índice de Charlson (CCI) de mediana comorbilidad y una edad media de 57,7 años (tabla 1).
Datos demográficos de pacientes sometidos a cirugía hepática
| Datos demográficos | |
|---|---|
| Sexo masculino (%) | 20 (71,4) |
| Edad (rango) | 57,7 (20-82) |
| IMC (rango) | 26,7 (18,1-38,8) |
| ASA (rango) | 2 (1-3) |
| Índice de comorbilidad de Charlson (rango) | 6,9 (2-12) |
ASA: American Society of Anesthesiologists Classification; IMC: índice de masa corporal.
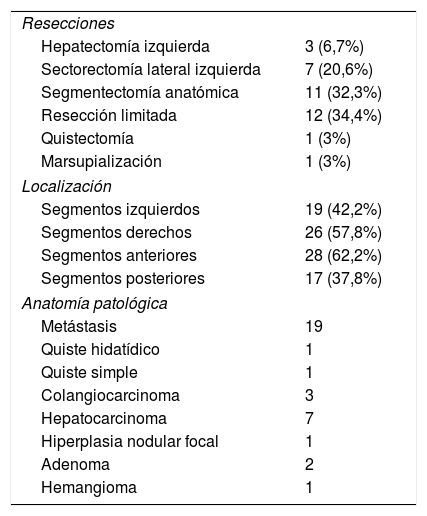
Se realizaron segmentectomías anatómicas (32,3%), resecciones limitadas (34,4%), sectorectomías laterales izquierdas (20,6%), hepatectomías izquierdas (6,7%), una quistectomía (3%) y una marsupialización (3%). En el 80% de los casos por lesiones únicas, un 37,8% localizadas en segmentos posteriores. El 80% de las intervenciones fueron por patología oncológica (tabla 2).
Resecciones, localización y anatomía patológica de las lesiones hepáticas
| Resecciones | |
| Hepatectomía izquierda | 3 (6,7%) |
| Sectorectomía lateral izquierda | 7 (20,6%) |
| Segmentectomía anatómica | 11 (32,3%) |
| Resección limitada | 12 (34,4%) |
| Quistectomía | 1 (3%) |
| Marsupialización | 1 (3%) |
| Localización | |
| Segmentos izquierdos | 19 (42,2%) |
| Segmentos derechos | 26 (57,8%) |
| Segmentos anteriores | 28 (62,2%) |
| Segmentos posteriores | 17 (37,8%) |
| Anatomía patológica | |
| Metástasis | 19 |
| Quiste hidatídico | 1 |
| Quiste simple | 1 |
| Colangiocarcinoma | 3 |
| Hepatocarcinoma | 7 |
| Hiperplasia nodular focal | 1 |
| Adenoma | 2 |
| Hemangioma | 1 |
El tiempo medio quirúgico fue de 204,4 min (rango 100-265 min). La pérdida hemática media fue de 167 mL (100-300 mL), no existiendo ningún caso de transfusión perioperatoria. El tiempo medio de pinzamiento hiliar fue de 41,5 minutos (0-76 minutos). No hubo conversiones. Se presentó un caso (2,8%) de complicación postoperatoria Clavien-Dindo > 2 por reoperación por lesión de asa, debida a un deserosamiento durante las maniobras de adhesiolisis laparoscópica previa, y cinco casos de complicaciones Clavien-Dindo 2 (14,3%). No hubo reingresos. No se registró ningún caso de mortalidad a 90 días. La estancia hospitalaria mediana fue de cuatro días (rango 2-14 días). El estudio anatomopatológico del margen oncológico de los pacientes con patología maligna (29) reveló un margen quirúrgico libre en 26 pacientes (89,6%), con una separación de 5,3 mm de media (0-30), y un margen parenquimatoso a menos de 1 mm en tres pacientes (10,4%). El tamaño medio de las lesiones fue de 41,8 mm (10-125 mm).
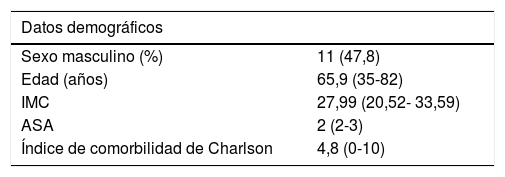
Resecciones pancreáticas y duodenalesSe intervinieron a 29 pacientes, predominando ASA 2, con un CCI de baja comorbilidad y una edad media de 65,9 años (tabla 3).
Datos demográficos de pacientes sometidos a cirugía pancreática
| Datos demográficos | |
|---|---|
| Sexo masculino (%) | 11 (47,8) |
| Edad (años) | 65,9 (35-82) |
| IMC | 27,99 (20,52- 33,59) |
| ASA | 2 (2-3) |
| Índice de comorbilidad de Charlson | 4,8 (0-10) |
ASA: American Society of Anesthesiologists Classification; IMC: índice de masa corporal.
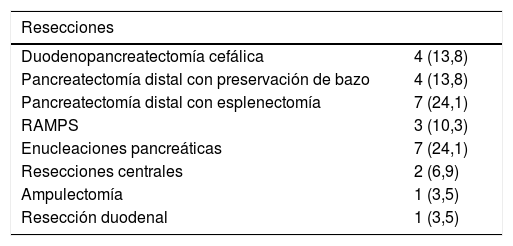
En 18 pacientes (62,1%) se realizaron resecciones mayores, incluyendo 14 pancreatectomías distales (48,3%) y cuatro DPC (13,8%). Once pacientes (37,9%) fueron sometidos a cirugías ahorradoras de parénquima, incluyendo siete enucleaciones (24,1%), dos resecciones centrales (6,9%), una ampulectomía (3,5%) y una resección de segunda porción duodenal (3,5%). El 65,5% de las intervenciones fueron por patología oncológica (tabla 4).
Resecciones y anatomía patológica de las lesiones pancreáticas
| Resecciones | |
|---|---|
| Duodenopancreatectomía cefálica | 4 (13,8) |
| Pancreatectomía distal con preservación de bazo | 4 (13,8) |
| Pancreatectomía distal con esplenectomía | 7 (24,1) |
| RAMPS | 3 (10,3) |
| Enucleaciones pancreáticas | 7 (24,1) |
| Resecciones centrales | 2 (6,9) |
| Ampulectomía | 1 (3,5) |
| Resección duodenal | 1 (3,5) |
| Anatomía patológica | |
|---|---|
| Malignas (%) | 19 (65,5) |
| Adenocarcinoma ductal | 8 |
| Tumor neuroendocrino | 6 |
| Metástasis no colorectal (2 renal, 1 ovario) | 3 |
| Carcinoma anillo de sello | 1 |
| Colangiocarcinoma | 1 |
| Benignas (%) | 10 (34,5) |
| Tumoración quística | 5 |
| Quiste mucinoso | 3 |
| Pseudoquiste | 1 |
| Ectopia estromal de ovario | 1 |
RAMPS: radical antegrade modular pancreatosplenectomy.
El tiempo medio operatorio fue de 243 min (rango 125-460 min) y la pérdida hemática media fue de 202 mL (100-500 mL), sin ningún caso de transfusión perioperatoria. El índice mediano de complicación postoperatoria de Clavien-Dindo fue de dos (10,3%), con cinco casos (17,2%) de complicaciones Clavien-Dindo > 2. Se incluyen tres casos de colección intraabdominal, un caso de fístula pancreática tipo ISGPS B que requirió drenaje percutáneo y una reintervención quirúrgica por perforación a nivel gástrico por lesión con pinza robótica. Otros dos casos presentaron fístulas bioquímicas, pudiendo retirar los drenajes en consultas externas sin otras medidas terapéuticas ni repercusión clínica. Se asocian cuatro reingresos (13,8%). Hubo un único caso de conversión por complicación intraoperatoria debido a un sangrado. Otros cuatro se convirtieron por mayor extensión de la enfermedad de lo inicialmente previsto, en tres de ellos debido a falta de progresión y en otro debido a un cambio de indicación quirúrgica, pasando de una ampulectomía a una DPC. La estancia mediana hospitalaria fue de siete días (rango 3-23 días). No hubo ningún caso de mortalidad perioperatoria a 90 días.
El estudio anatomopatológico reveló un margen oncológico de 8,4 mm de media (0-70 min) y un margen inferior a 1 mm en tres pacientes (15,8%), consiguiendo un margen R0 en 16 de los 19 pacientes (84,2%). El tamaño medio de las lesiones fue de 23,9 mm (8-90 mm).
DiscusiónLa cirugía laparoscópica ha demostrado reducir la morbilidad respecto a la cirugía abierta en la mayoría de procedimientos12 y, la cirugía robótica, reporta buenos resultados en cirugías de acceso complejo, como en cirugía prostática o rectal1.
La complejidad anatómica de la cirugía HPB, que exige la manipulación de estructuras profundas próximas a vasos principales, ha dado como resultado una adopción cautelosa y desigual del enfoque mínimamente invasivo, inicialmente laparoscópico y actualmente robótico. Esto hace que las series de cirugía HBP robótica publicadas sean muy escasas y poco comparables5,9.
Para iniciar un programa de cirugía robótica HBP es imprescindible, por un lado, tener experiencia en cirugía abierta y laparoscópica hepática y pancreática y, por otro lado, tener un conocimiento exhaustivo del funcionamiento de la plataforma robótica (DaVinci®).
Para ello debe realizarse un aprendizaje en tres fases. Un primer paso consiste en conocer el robot e incorporar los hábitos quirúrgicos propios del sistema.
Para ello, se inicia con cursos online y una instrucción presencial específica para consola y campo quirúrgico. Posteriormente, se establece un periodo de formación supervisada por parte de un tutor acreditado. También es de ayuda disponer de una plataforma de formación virtual en el sistema DaVinci, que permite realizar entrenamientos formativos y facilitan controlar el sistema.
El segundo paso es realizar una curva de aprendizaje con cirugía no compleja. En nuestro caso se incluyeron 25 colecistectomías y tres esplenectomías, con resultados análogos al abordaje laparoscópico. No hubo ningún caso de conversión ni de reintervención.
Finalmente, se inician las resecciones hepáticas y pancreáticas en casos seleccionados. En nuestra serie, para las resecciones hepáticas, seleccionamos casos con lesiones únicas o que requerían una sola resección localizados en ambos lóbulos, excluyendo hepatectomías mayores, a excepción de la hepatectomía izquierda. En cirugía pancreática, seleccionamos pacientes con resecciones limitadas con preservación de parénquima, páncreas distal y, finalmente, incluimos DPC. Todos eran pacientes candidatos a cirugía laparoscópica. La presencia de cirugía previa o cirrosis hepática no fue una contraindicación, aunque sí se descartaron los pacientes con obesidad mórbida.
Analizando nuestra serie, la cirugía robótica presenta algunas ventajas respecto a la cirugía laparoscópica o abierta aunque, a pesar de que la tecnología está en constante evolución, también presenta algunos inconvenientes.
En cirugía hepática, comparte los beneficios del acceso mínimamente invasivo que ofrece la cirugía laparoscópica13. Sin embargo, presenta algunas ventajas respecto a ésta. El 37,2% de las resecciones que realizamos se encontraron en segmentos posteriores, considerados ocultos y de difícil acceso. Estas resecciones por vía laparoscópica pueden resultar complejas debido a la limitación de movimientos que supone la rigidez y estructura de los instrumentos, requiriendo incluso el uso de trócares intercostales en determinadas ocasiones14. El acceso robótico, con instrumentos que ofrecen un gran rango de movimientos, gracias a la articulación de sus brazos, que además eliminan el esfuerzo físico asociado, facilita en gran medida estas cirugías. Otro aspecto interesante es la gran mejora en la visión que ofrece la plataforma robótica, basada en una óptica 3D de alta definición que resulta en una experiencia quirúrgica inmersiva que facilita la identificación de tejidos y estructuras. Unido a la eliminación del temblor fisiológico y la desmultiplicación de los movimientos de la mano del cirujano, permite realizar movimientos de gran precisión en espacios reducidos, disminuyendo el riesgo de lesionar estructuras adyacentes a la zona de intervención. A modo de ejemplo, en tres casos de cirugía por metástasis se había previsto realizar preoperatoriamente una resección mayor por proximidad a estructuras vasculares de las lesiones. Sin embargo, gracias a las ventajas descritas, fue posible liberarlas del vaso afecto, pudiendo ofrecer resecciones limitadas con margen R1 vascular, cuyos resultados oncológicos se han demostrado similares a los obtenidos con margen R015. Por tanto, es probable que la cirugía robótica pueda favorecer resecciones ahorradoras de parénquima en comparación con la cirugía abierta o laparoscópica. También es posible que estas mejoras nos permitan realizar cirugías más anatómicas, basadas en la aproximación extrahepática de los pedículos Glissonianos, a través del espacio que hay entre estos y la cápsula de Laennec. Esta técnica quirúrgica requiere, además de un extenso conocimiento de la anatomía hepática, una delicada manipulación de los tejidos, cualidad que el robot nos puede proporcionar.
Sin embargo, también existen algunos inconvenientes a tener en cuenta. Por un lado, la instrumentación existente para la cirugía robótica es todavía limitada, por lo que no se dispone del material específico utilizado en cirugía hepática. La falta de un disector de ultrasonidos (CUSA) obliga a realizar la transección hepática con coagulación mono y bipolar. Aunque resulta muy efectiva y, gracias al detalle de la visión y movimientos, segura, el proceso es laborioso y consume tiempo al inicio de la curva de aprendizaje. Una vez superada, nuestro tiempo operatorio medio fue de 204 minutos, con unas pérdidas hemáticas muy reducidas de 167 mL, ambos resultados similares o inferiores a los descritos en cirugía abierta e incluso en cirugía laparoscópica16,17. Otro aspecto que hay que tener en cuenta al iniciar este tipo de cirugía es que la falta de sensibilidad al manipular los tejidos, especialmente el tejido hepático, puede conllevar lesiones potencialmente graves. Por lo que hay que extremar las precauciones, sobre todo en el proceso de la movilización hepática. Finalmente, hay que destacar la imposibilidad de modificar la posición del paciente durante la cirugía, salvo que se disponga de la mesa sincronizada con la plataforma robótica, de elevado coste. Este inconveniente, que es compartido tanto para cirugía hepática como pancreática, dificulta la resección de lesiones bilaterales, especialmente si coexisten lesiones en segmentos izquierdos con lesiones en segmentos derechos posteriores. En caso de realizar cirugías que requieran cambios de posición, hay que desacoplar el robot y posteriormente volver a hacer el docking, hecho que conlleva tiempo. Por este motivo, seleccionamos pacientes preferentemente con lesiones únicas (82,3%).
Con relación a la cirugía pancreática, también existen ventajas evidentes respecto a la cirugía laparoscópica. El acceso robótico nos permitió realizar un número elevado de cirugías preservadoras de parénquima, como resecciones centrales, que son poco frecuentes debido a la dificultad técnica que conllevan. Globalmente supusieron el 37,9% de los procedimientos realizados, superando el rango habitual de estas cirugías en las series existentes que oscila entre el 13 y el 30%18. Estas resecciones presentan un alto riesgo de lesión de la glándula o Wirsung, con la posibilidad de que aparezca una fístula en el postoperatorio, o de los vasos esplénicos, que conlleva la necesidad de asociar una esplenectomía. La visión y el detalle de los movimientos descritos de la plataforma robótica facilitaron estos procedimientos, sin presentar un aumento en las complicaciones intra o postoperatorias. Otro beneficio, más evidente, se encuentra en la fase reconstructiva de la DPC19. Ésta incluye tres anastomosis y es física y técnicamente muy demandante si se realiza por laparoscopia, por tener que realizar suturas delicadas en campos de difícil acceso. La versatilidad de los instrumentos del robot junto con la ergonomía que ofrece facilita este procedimiento, con lo que se disminuye el tiempo quirúrgico y se acorta la curva de aprendizaje20,21. A pesar del tiempo dedicado al docking, nuestros tiempos quirúrgicos en las DPC (339 min de media) no difieran de los tiempos descritos en cirugía laparoscópica o abierta22,23. Sin embargo, la implementación de la cirugía robótica en estos procedimientos está relacionada con la dificultad que puede existir para resolver lesiones iatrogénicas de grandes vasos. En cirugía laparoscópica está establecido que debe intentar resolverse el problema de forma laparoscópica y, si no es posible, convertir a cirugía abierta. Esta secuencia resulta mucho más compleja en cirugía robótica por ser más laboriosa. Por tanto, hay que tener una buena preparación para desacoplar y retirar el robot en un corto espacio de tiempo.
Con todo ello, se consiguieron los buenos resultados descritos. No hubo diferencias significativas respecto a nuestros tiempos quirúrgicos por vía laparoscópica, a pesar del docking, que se ha descrito como un factor que lo incrementa24. Tampoco hubo mayores pérdidas hemáticas ni necesidad de transfusiones. Por otro lado, aspectos técnicos, clínicos y oncológicos, como el tiempo quirúrgico, porcentaje de R0, pérdidas hemáticas o las tasas de complicaciones se asemejan a la descrita en la literatura sobre cirugía robótica5,25-27.
Además, la cirugía robótica ofrece funcionalidades que facilitan los procedimientos quirúrgicos. En nuestro caso, hemos utilizado la ecografía intraoperatoria integrada o el verde de indocianina para localizar lesiones o áreas isquémicas, y modelos virtuales 3D para tener una referencia detallada de la anatomía del paciente. En un futuro es probable que se puedan añadir nuevas tecnologías, incorporando imágenes de realidad aumentada, navegación intraoperatoria o ayudas basadas en inteligencia artificial28.
Por todo ello, y a pesar de la complejidad que resulta el hecho de realizar cirugía mínimamente invasiva HBP, creemos que la cirugía robótica va a tener un papel importante, principalmente en aquella conservadora de parénquima, dado que permite realizar resecciones muy limitadas en localizaciones difíciles con campos reducidos, y puede ser de gran ayuda en fases de reconstrucción al facilitar suturas.
En condiciones adecuadas, la cirugía robótica HBP es segura y factible, con resultados clínicos a corto plazo comparables al abordaje por laparoscopia y mejores que en la cirugía abierta, en relación a los estándares oncológicos, frecuencia y gravedad de las complicaciones y mortalidad a los 90 días6,8,16,17.
Sin embargo, en este momento no se puede recomendar su aplicación a nivel generalizado, debido a la falta de evidencia científica de calidad que lo avale, quedando restringido a centros especializados de alto volumen. Además, se requieren estudios adicionales para explorar la rentabilidad económica29 y oncológica de la plataforma.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.