El bazo es uno de los órganos más frecuentemente dañado en el traumatismo abdominal cerrado. El manejo de la lesión esplénica ha evolucionado en los últimos años, con cada vez mayor tendencia al manejo conservador. El conocimiento de su función inmunológica ha sido el motor inicial para impulsar el desarrollo de técnicas de preservación del bazo. El mayor acceso a pruebas de imagen de alta resolución, así como a técnicas terapéuticas poco agresivas, como la angioembolización, ha permitido una mayor tasa de éxito en el manejo no quirúrgico de estos casos, con una disminución en la morbimortalidad global asociada a estos pacientes. El objetivo de esta revisión es dar a conocer el manejo actual de traumatismo esplénico basado en la bibliografía internacional de los últimos 30 años —se han identificado 63.205 pacientes— y, así, ofrecer al cirujano mejores herramientas a la hora de decidir el tratamiento recomendable en cada caso.
The spleen is one of the most frequently injured organs in blunt abdominal trauma. In the past decades, the treatment of patients with blunt splenic injury has shifted from operative to non-operative management. The knowledge of physiology and immunology of the spleen have been the main reasons to develop techniques for splenic salvage. The advances in high-resolution imaging techniques, as well as less invasive procedures, including angiography and angioembolization, have allowed a higher rate of success in the non-operative management. Non-operative management has showed a decrease in overall mortality and morbidity. The aim of this article is to analyze the current management of splenic injury based on a literature review of the last 30 years, from we have identified 63,205 patients. This would enable the surgeons to provide the best care possible in every case.
El bazo es el órgano más frecuentemente afectado en los traumatismos abdominales cerrados: ocurren hasta en un 60% de los casos, según la literatura1. Su manejo ha cambiado durante las últimas décadas. El primer caso de rotura traumática del bazo fue publicado por Eisendrath2 en 1902. A principios del siglo XIX el tratamiento quirúrgico consistía en esplenectomía, que se realizaba para evitar la muerte por sangrado, con una mortalidad posquirúrgica del 40% que se comparaba con aquella asociada a la no intervención, que podía llegar hasta el 90%1.
Con los años, el conocimiento de la función inmunológica esplénica y la importancia del sistema mononuclear-fagocítico para combatir infecciones por microorganismos encapsulados identificaron la alta mortalidad relacionada con la sepsis postesplenectomía, presente hasta en el 50% de los casos3.
Estudios en pacientes pediátricos iniciaron el desarrollo de técnicas de preservación del bazo. La esplenorrafia, el packing o el uso de hemostáticos4, así como el desarrollo de las pruebas de imagen y el uso de medidas no invasivas como la angioembolización, hicieron que se optara lentamente por el tratamiento conservador hasta convertirse hoy en día en el gold standard en este grupo de edad5.
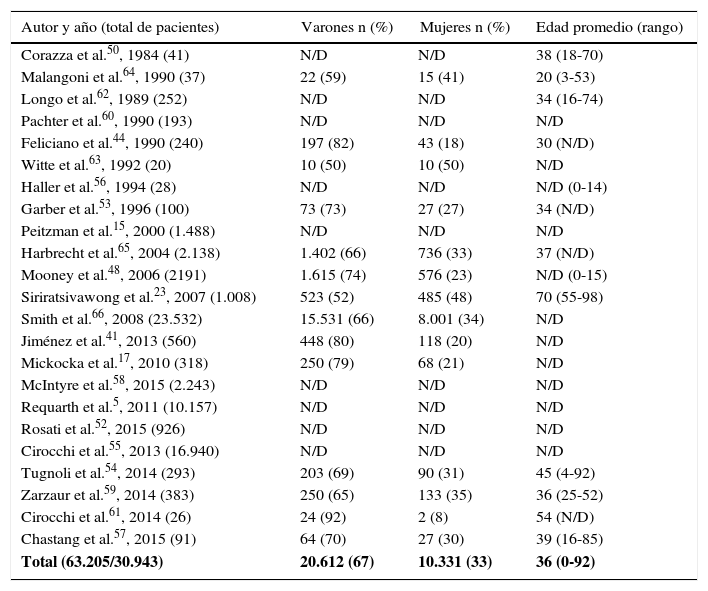
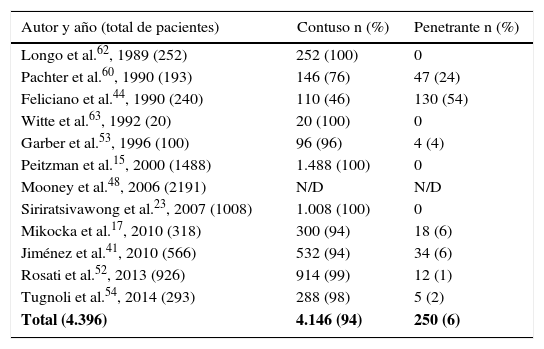
El objetivo de la presente revisión es investigar el manejo actual basado en la bibliografía internacional publicada en los últimos 30 años. Se ha realizado una búsqueda de la literatura a través de Pubmed, seleccionando artículos publicados en inglés y español entre 1987 y 2017, sin exclusión por edad. Se identificaron 23 series con un total de 63.205 pacientes (tabla 1), de los cuales el mecanismo de lesión predominante fue el contuso, que correspondió a más del 90% de los pacientes (tabla 2).
Incidencia por autor, sexo y edad
| Autor y año (total de pacientes) | Varones n (%) | Mujeres n (%) | Edad promedio (rango) |
|---|---|---|---|
| Corazza et al.50, 1984 (41) | N/D | N/D | 38 (18-70) |
| Malangoni et al.64, 1990 (37) | 22 (59) | 15 (41) | 20 (3-53) |
| Longo et al.62, 1989 (252) | N/D | N/D | 34 (16-74) |
| Pachter et al.60, 1990 (193) | N/D | N/D | N/D |
| Feliciano et al.44, 1990 (240) | 197 (82) | 43 (18) | 30 (N/D) |
| Witte et al.63, 1992 (20) | 10 (50) | 10 (50) | N/D |
| Haller et al.56, 1994 (28) | N/D | N/D | N/D (0-14) |
| Garber et al.53, 1996 (100) | 73 (73) | 27 (27) | 34 (N/D) |
| Peitzman et al.15, 2000 (1.488) | N/D | N/D | N/D |
| Harbrecht et al.65, 2004 (2.138) | 1.402 (66) | 736 (33) | 37 (N/D) |
| Mooney et al.48, 2006 (2191) | 1.615 (74) | 576 (23) | N/D (0-15) |
| Siriratsivawong et al.23, 2007 (1.008) | 523 (52) | 485 (48) | 70 (55-98) |
| Smith et al.66, 2008 (23.532) | 15.531 (66) | 8.001 (34) | N/D |
| Jiménez et al.41, 2013 (560) | 448 (80) | 118 (20) | N/D |
| Mickocka et al.17, 2010 (318) | 250 (79) | 68 (21) | N/D |
| McIntyre et al.58, 2015 (2.243) | N/D | N/D | N/D |
| Requarth et al.5, 2011 (10.157) | N/D | N/D | N/D |
| Rosati et al.52, 2015 (926) | N/D | N/D | N/D |
| Cirocchi et al.55, 2013 (16.940) | N/D | N/D | N/D |
| Tugnoli et al.54, 2014 (293) | 203 (69) | 90 (31) | 45 (4-92) |
| Zarzaur et al.59, 2014 (383) | 250 (65) | 133 (35) | 36 (25-52) |
| Cirocchi et al.61, 2014 (26) | 24 (92) | 2 (8) | 54 (N/D) |
| Chastang et al.57, 2015 (91) | 64 (70) | 27 (30) | 39 (16-85) |
| Total (63.205/30.943) | 20.612 (67) | 10.331 (33) | 36 (0-92) |
El total de pacientes hallados fue de 63.848; de ese total solo en 31.586 fue hallado el sexo.
N/D: no disponible.
Mecanismo de lesión esplénica
| Autor y año (total de pacientes) | Contuso n (%) | Penetrante n (%) |
|---|---|---|
| Longo et al.62, 1989 (252) | 252 (100) | 0 |
| Pachter et al.60, 1990 (193) | 146 (76) | 47 (24) |
| Feliciano et al.44, 1990 (240) | 110 (46) | 130 (54) |
| Witte et al.63, 1992 (20) | 20 (100) | 0 |
| Garber et al.53, 1996 (100) | 96 (96) | 4 (4) |
| Peitzman et al.15, 2000 (1488) | 1.488 (100) | 0 |
| Mooney et al.48, 2006 (2191) | N/D | N/D |
| Siriratsivawong et al.23, 2007 (1008) | 1.008 (100) | 0 |
| Mikocka et al.17, 2010 (318) | 300 (94) | 18 (6) |
| Jiménez et al.41, 2010 (566) | 532 (94) | 34 (6) |
| Rosati et al.52, 2013 (926) | 914 (99) | 12 (1) |
| Tugnoli et al.54, 2014 (293) | 288 (98) | 5 (2) |
| Total (4.396) | 4.146 (94) | 250 (6) |
Ante la sospecha de una posible lesión esplénica, el siguiente paso es valorar el grado de afectación del bazo. El método diagnóstico de elección es la tomografía axial computarizada (TAC), siempre y cuando el paciente se encuentre hemodinámicamente estable. El uso de la TAC ha contribuido al desarrollo del tratamiento no operatorio (TNO) del bazo: se ha descrito en algunas series un aumento del TNO del 11 al 71% para el mismo grado de lesión6,7. El uso dual de fase arterial y venosa tiene una sensibilidad del 90% para la identificación del pseudoaneurisma, del 97% para el sangrado activo y del 99% para el hematoma periesplénico8.
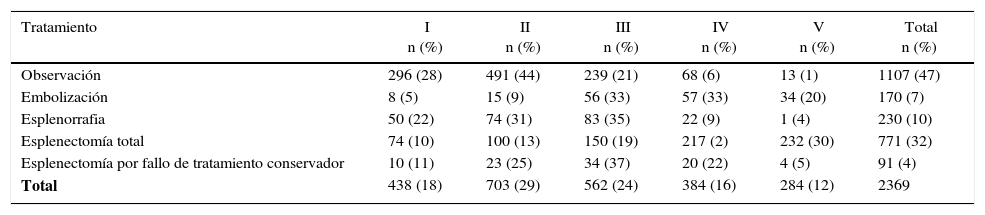
La escala más utilizada para determinar el grado de lesión esplénica es la establecida por la American Association for the Surgery of Trauma (AAST) (tabla 3)9,10. Según la bibliografía revisada, los grados de lesión más frecuentes son los II y III, seguidos de los grados I, IV y V (tabla 4).
Escala de grados de lesión esplénica de la Asociación Americana de Cirugía del Trauma (American Association for the Surgery of Trauma [AAST])10
| Gradoa | Descripción de la lesión | |
|---|---|---|
| I | Hematoma Laceración | Sucapsular,<10% superficie Desgarro capsular<1cm de profundidad |
| II | Hematoma Laceración | Subcapsular: 10-50% superficie; intraparenquimatoso:<5cm Desgarro capsular 1-3cm de profundidad sin afectar a los vasos trabeculares |
| III | Hematoma Laceración | Subcapuslar:>50% superficie o en expansión; subcapsular o intraparenquimatoso roto Intraparenquimatoso>5cm o en expansión 3cm de profundidad que afecta a los vasos trabeculares |
| IV | Laceración | Afectación de vasos segmentarios o hiliares con desvascularización>25% |
| V | Laceración Vascular | Avulsión completa Lesión hiliar que devasculariza el bazo |
Tratamiento por grado de lesión esplénica según la American Association for the Surgery of Trauma (Organ Injury Scale, Escala de lesión de órgano)
| Tratamiento | I n (%) | II n (%) | III n (%) | IV n (%) | V n (%) | Total n (%) |
|---|---|---|---|---|---|---|
| Observación | 296 (28) | 491 (44) | 239 (21) | 68 (6) | 13 (1) | 1107 (47) |
| Embolización | 8 (5) | 15 (9) | 56 (33) | 57 (33) | 34 (20) | 170 (7) |
| Esplenorrafia | 50 (22) | 74 (31) | 83 (35) | 22 (9) | 1 (4) | 230 (10) |
| Esplenectomía total | 74 (10) | 100 (13) | 150 (19) | 217 (2) | 232 (30) | 771 (32) |
| Esplenectomía por fallo de tratamiento conservador | 10 (11) | 23 (25) | 34 (37) | 20 (22) | 4 (5) | 91 (4) |
| Total | 438 (18) | 703 (29) | 562 (24) | 384 (16) | 284 (12) | 2369 |
Los porcentajes de cada grado se basan en el total de cada tipo de tratamiento.
Una vez establecido el grado de lesión esplénica, el manejo va a depender del estado hemodinámico del paciente, de la presencia de lesiones asociadas y de la disponibilidad de recursos de cada centro. Pacientes hemodinámicamente inestables con focused abdominal sonography for trauma positivo requerirán intervención quirúrgica con alta probabilidad de esplenectomía9.
Manejo no quirúrgicoEl objetivo del manejo no quirúrgico en el traumatismo esplénico es preservar su función y disminuir la morbimortalidad asociada a la cirugía. Se asocia a una menor tasa de laparotomías no terapéuticas, a menor tasa de transfusión sanguínea, a un descenso de la morbimortalidad global y a un menor gasto hospitalario9,11-13.
El manejo no quirúrgico debe incluir: ingreso en unidades de cuidados intermedios o intensivos con monitorización continua de constantes vitales, reposo relativo, control de niveles de hemoglobina y exploración abdominal de forma seriada. También debe existir en el centro posibilidad de transfusión sanguínea, accesibilidad a la TAC y la presencia continuada de cirujanos y de radiólogos intervencionistas14. Dependiendo de las series analizadas, la arteriografía y la embolización se pueden englobar en el tratamiento no quirúrgico. El tratamiento conservador debe ser valorado como opción terapéutica en un paciente que se encuentre hemodinámicamente estable, con independencia del grado de la lesión esplénica. No obstante, hay una correlación directa entre el grado de lesión y la tasa de fracaso del tratamiento no quirúrgico15-18.
La guía de la Eastern Association for the Surgery of Trauma (EAST) no contraindica el tratamiento conservador en pacientes con lesión severa de bazo diagnosticado por TAC, siempre y cuando se encuentren hemodinámicamente estables11,19,20.
Peitzman et al.15 describen una tasa del fracaso con dicho tratamiento del 4,8% para grado I y del 75% para el grado V. En un metaanálisis publicado por Requart et al.16 en 2011, con un total de 10.157 pacientes, la tasa de fallo de tratamiento no quirúrgico fue del 8,3%. Analizando el tratamiento no quirúrgico sin angioembolización, la tasa de fracaso variaba del 4,7 al 83,1% para los grados I y V, respectivamente.
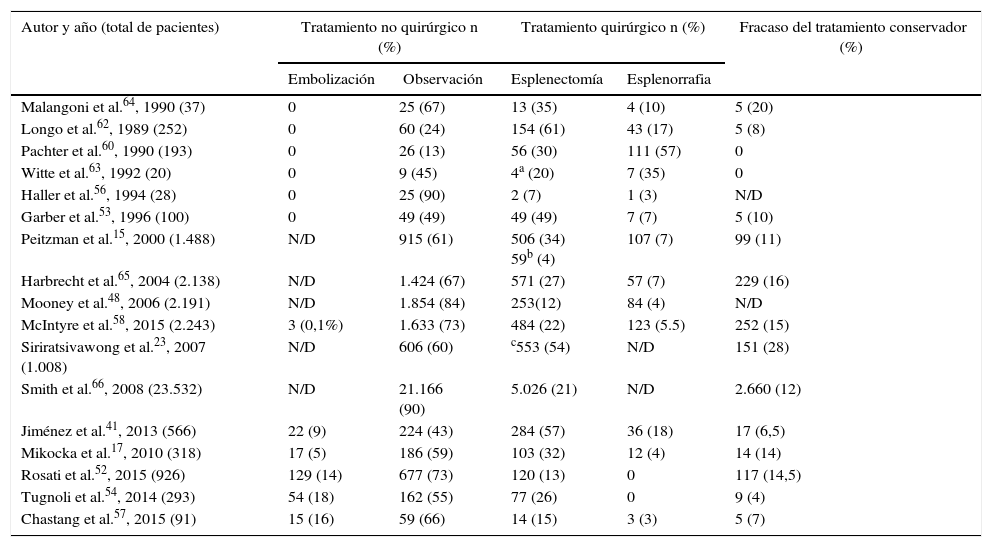
En los últimos años se observa cierta tendencia a la disminución del fracaso del TNO, debido a la introducción de la arteriografía y la embolización, sobre todo, para los grados IV y V. En la tabla 5 se pueden observar los resultados analizados; el número de esplenectomías recoge tanto aquellas realizadas en el manejo quirúrgico inicial como las realizadas debido al fracaso del tratamiento conservador.
Tratamiento del trauma esplénico
| Autor y año (total de pacientes) | Tratamiento no quirúrgico n (%) | Tratamiento quirúrgico n (%) | Fracaso del tratamiento conservador (%) | ||
|---|---|---|---|---|---|
| Embolización | Observación | Esplenectomía | Esplenorrafia | ||
| Malangoni et al.64, 1990 (37) | 0 | 25 (67) | 13 (35) | 4 (10) | 5 (20) |
| Longo et al.62, 1989 (252) | 0 | 60 (24) | 154 (61) | 43 (17) | 5 (8) |
| Pachter et al.60, 1990 (193) | 0 | 26 (13) | 56 (30) | 111 (57) | 0 |
| Witte et al.63, 1992 (20) | 0 | 9 (45) | 4a (20) | 7 (35) | 0 |
| Haller et al.56, 1994 (28) | 0 | 25 (90) | 2 (7) | 1 (3) | N/D |
| Garber et al.53, 1996 (100) | 0 | 49 (49) | 49 (49) | 7 (7) | 5 (10) |
| Peitzman et al.15, 2000 (1.488) | N/D | 915 (61) | 506 (34) 59b (4) | 107 (7) | 99 (11) |
| Harbrecht et al.65, 2004 (2.138) | N/D | 1.424 (67) | 571 (27) | 57 (7) | 229 (16) |
| Mooney et al.48, 2006 (2.191) | N/D | 1.854 (84) | 253(12) | 84 (4) | N/D |
| McIntyre et al.58, 2015 (2.243) | 3 (0,1%) | 1.633 (73) | 484 (22) | 123 (5.5) | 252 (15) |
| Siriratsivawong et al.23, 2007 (1.008) | N/D | 606 (60) | c553 (54) | N/D | 151 (28) |
| Smith et al.66, 2008 (23.532) | N/D | 21.166 (90) | 5.026 (21) | N/D | 2.660 (12) |
| Jiménez et al.41, 2013 (566) | 22 (9) | 224 (43) | 284 (57) | 36 (18) | 17 (6,5) |
| Mikocka et al.17, 2010 (318) | 17 (5) | 186 (59) | 103 (32) | 12 (4) | 14 (14) |
| Rosati et al.52, 2015 (926) | 129 (14) | 677 (73) | 120 (13) | 0 | 117 (14,5) |
| Tugnoli et al.54, 2014 (293) | 54 (18) | 162 (55) | 77 (26) | 0 | 9 (4) |
| Chastang et al.57, 2015 (91) | 15 (16) | 59 (66) | 14 (15) | 3 (3) | 5 (7) |
Actualmente se estima una tasa global de fracaso del 10% en el TNO. Se han descrito varios factores de riesgo asociados a dicho fracaso: grado de lesión, presencia de gran hemoperitoneo, extravasación de contraste en la prueba de imagen, hipotensión arterial a su llegada, lesión cerebral asociada y la necesidad de transfusión sanguínea14. Este último es considerado un factor de riesgo independiente de mortalidad en los pacientes politraumatizados11,21. Ninguno de estos factores se considera contraindicación absoluta para iniciar un tratamiento no quirúrgico, a excepción de que algunos autores recomiendan no indicar tratamiento conservador si se han transfundido más de 5unidades de hematíes en las primeras 24 h11,22. En pacientes con tratamiento anticoagulante preexistente se procede a su reversión: no es, por tanto, criterio de exclusión para el TNO11,22.
La edad tampoco se considera criterio de exclusión. En un estudio realizado con 1.008 pacientes mayores de 55 años y traumatismo esplénico contuso, se obtuvo una tasa de éxito del 75,3% en el TNO. La mortalidad fue más alta en el grupo de pacientes que requirieron cirugía (35 vs. 16,7%). El estudio concluyó que la mayoría de los pacientes mayores de 55 años pueden beneficiarse de un tratamiento conservador23.
A la hora de decidir sobre el manejo, debe tenerse en cuenta siempre el riesgo-beneficio, y valorar los factores de riesgo asociados a cada caso. Es imprescindible la presencia de cirujanos con experiencia y un equipo multidisciplinario para su correcto manejo6.
No existe un consenso unánime sobre cómo realizar las pautas de seguimiento. Algunos autores recomiendan la realización de TAC de control para el diagnóstico de lesiones vasculares no hemorrágicas, como puede ser el pseudoaneurisma. En cualquier caso, estaría indicado realizarlo ante la persistencia elevada de marcadores inflamatorios y del dolor abdominal, sospecha de lesión intestinal, descensos repentinos de hemoglobina y de hematocrito, o deterioro del estado general11,12,20,22.
En cuanto a la hematimetría, se recomienda control cada 6 h en las primeras 24, cada 12 h hasta el tercer día y cada 24 h hasta el alta11,24. No existe consenso sobre cuándo iniciar la profilaxis para la trombosis venosa profunda. En un estudio retrospectivo realizado con 328 pacientes, el inicio temprano con heparina de bajo peso molecular entre las 48 y 72 h desde el ingreso no se asoció a un aumento de sangrado ni a mayor fracaso del tratamiento no quirúrgico11,20.
En cuanto al alta hospitalaria, la mayoría de los expertos están de acuerdo en que los factores determinantes más importantes son la clínica y la estabilidad de los niveles de hemoglobina11,22. Los riesgos principales del manejo conservador son la hemorragia tardía, la necesidad de transfusión y las lesiones intraabdominales desapercibidas. Según la literatura revisada, el riesgo de desarrollar pseudoaneurismas, pseudoquistes y abscesos esplénicos es mayor en niños, en quienes llega hasta el 7,5%9,25,26.
Angiografía y angioembolizaciónEn el año 1975, Chuang et al.27 realizaron un estudio experimental en perros con sangrado del bazo que fue controlado inyectando material embólico en la arteria esplénica. Se concluyó que la embolización selectiva de la arteria era un método que podría ser utilizado en humanos que no fueran candidatos a esplenectomía.
Varios estudios fueron publicados con resultados esperanzadores en la década de los 70. Sclafani et al.28,29 introdujeron el concepto de la embolización proximal en pacientes con trauma esplénico contuso, con una tasa de éxito del 97%.
Los procedimientos angiográficos son tanto diagnósticos como terapéuticos y tienen como objetivo embolizar la arteria y detener el sangrado: forman parte del tratamiento conservador en el trauma esplénico30,31. Estos procedimientos son utilizados en pacientes hemodinámicamente estables, bajo supervisión quirúrgica estricta y con la posibilidad de realizar una esplenectomía de urgencia si fuese necesario. El porcentaje de intervenciones quirúrgicas urgentes con estos métodos ha disminuido del 33,3 al 11,9%32. Sin embargo, solo del 5 al 7% de los pacientes requieren una angioembolización19
La ventaja de esta técnica es que se pueden tratar concomitantemente otras lesiones vasculares asociadas. Las desventajas son la necesidad de un radiólogo intervencionista, el consumo de recursos económicos y la necesidad de utilizar grandes cantidades de contraste intravenoso19.
Los tipos de lesiones vasculares incluyen pseudoaneurisma, lesión vascular y fístula arteriovenosa. La identificación de una fístula está asociada hasta en un 60% al fallo del tratamiento conservador33. La angioembolización debe realizarse en cuanto haya evidencia de algún tipo de extravasación en la TAC y antes de llegar al deterioro hemodinámico34,35.
Las indicaciones36 de la angioembolización incluyen:
Absolutas:
- •
Grados IV y V en ausencia de otras lesiones en paciente estable.
- •
Extravasación de contraste periesplénico.
Relativas:
- •
Grados I, II y III en presencia de indicios de extravasación de contraste en TAC.
- •
Lesión intravascular esplénica asociada (pseudoaneurisma o fístula arteriovenosa).
- •
Hemoperitoneo moderado.
- •
Disminución de los niveles de hemoglobina durante el manejo conservador.
La angioembolización puede realizarse proximal o distal. Según la literatura consultada, el abordaje proximal es más rápido y sencillo, está asociado a menos fracaso del tratamiento conservador, además de tener menos complicaciones que el abordaje distal37.
A su vez presentan 2tipos de complicaciones, a saber:
Complicaciones mayores: sangrado hasta del 9%38 asociado a pseudoaneurismas no diagnosticados o resangrados, lesiones asociadas omitidas como pancreáticas o diafragmáticas, sepsis o abscesos esplénicos (4%), infarto o atrofia esplénica, pancreatitis aguda, sobre todo asociada a la angioembolización proximal39, lesión iatrogénica arterial (3%) más común en niños, nefropatía secundaria a medio de contraste y trombosis venosa profunda.
Complicaciones menores: infarto esplénico asociado a técnica proximal en un 20% y distal en un 27%, que suelen ser asintomáticos, migración del material embólico con una incidencia desconocida hasta el momento, disección vascular, daño vascular relacionado con el catéter, hematoma, íleo paralítico y trombocitosis40.
No está indicada la inmunización rutinaria en aquellos pacientes con manejo conservador. Incluso en aquellos casos de angioembolización y posterior infarto esplénico, la función fagocítica se mantiene en la mayoría de los casos11.
Manejo quirúrgicoSegún Jiménez et al.41, en un estudio de datos realizado en 6hospitales de España, publicado en 2013, con un total de 566 pacientes, el manejo quirúrgico representó un 56,6%. Debe indicarse tratamiento quirúrgico en todo paciente hemodinámicamente inestable, con sospecha de lesiones asociadas que requieran tratamiento quirúrgico o ante el fallo del tratamiento conservador9.
La elección del tratamiento quirúrgico no siempre conlleva esplenectomía. Existe la opción de cirugía con preservación del bazo, siempre y cuando el paciente se encuentre hemodinámicamente estable y se indique la laparotomía por otras lesiones asociadas6,9.
Existen diferentes opciones intraoperatorias para el control hemorrágico de la lesión esplénica: la clásica, y usualmente la más rápida, es la esplenectomía. Debido al conocimiento de la función inmunológica del bazo, se han ido desarrollando diferentes técnicas como la esplenorrafia, esplenectomía parcial y la utilización de agentes hemostáticos comerciales, así como mallas de ácido poliglicólico reabsorbibles para el control del sangrado42,43. Para las lesiones de grados IV y V la esplenectomía sigue siendo la primera opción. No obstante, ante la inestabilidad hemodinámica del paciente y la cirugía de control de daños, será indicación de esplenectomía independientemente del grado de lesión6,9,14. En la literatura revisada, de las 771 esplenectomías realizadas, el 58% corresponden a lesiones grados IV y V (tabla 4).
En un estudio publicado por Feliciano et al.44, con un total de 240 pacientes, el 86,2% de las esplenorrafias se realizaron en lesiones grados I y III. Se recomienda una correcta movilización y visualización del bazo durante la intervención quirúrgica para no pasar por alto lesiones potencialmente inadvertidas44.
La Society of American Gastrointestinal and Endoscopy Surgeons (SAGES) acepta la laparoscopia diagnóstica como método factible y seguro si se aplica en pacientes de trauma seleccionados. Incluye a aquellos pacientes hemodinámicamente estables, con lesiones en la región toracoabdominal izquierda y con sospecha de lesión intraabdominal no diagnosticada mediante técnicas de imagen6,45. Es de suma importancia contar con la experiencia necesaria en esta técnica para evitar pasar por alto lesiones. Es imprescindible la realización de más estudios para situar el papel de la laparoscopia en el tratamiento de los pacientes politraumatizados.
Existe el riesgo de desarrollar sepsis fulminante postesplenectomía. El periodo de máximo riesgo de infección grave se encuentra en los primeros 3a 5años tras la cirugía, y se mantiene durante el resto de la vida del paciente en un 5%46. En niños, se describen incidencias entre el 2,4 y el 11%9,47. El resto de las complicaciones asociadas a la cirugía están más relacionadas con la presencia de lesiones asociadas que por la esplenectomía per se. Para su prevención, se recomienda la vacunación frente al neumococo e influenza a las 2semanas de la esplenectomía, basados en un nivel de evidencia 2 y 3, así como también en aquellos pacientes que desarrollen hipoesplenismo tras tratamiento conservador. Estos pacientes deben saber que son más susceptibles a la malaria que el resto de la población, por lo que deben seguir estrictamente la profilaxis antimalárica correspondiente al área endémica a la que viajen46. No hay acuerdo sobre el uso generalizado de profilaxis antibiótica en todos los pacientes esplenectomizados. Dado el mayor riesgo de sepsis en niños y adolescentes, se recomienda la profilaxis en todo menor de 16 años, así como en pacientes mayores de 50 años y en aquellos con mala respuesta serológica a la vacuna6,9,46.
Seguimiento tras traumatismo esplénicoActualmente no existe evidencia científica sobre la necesidad de realización de pruebas de imagen de control tras el TNO. Del mismo modo, no hay consenso establecido respecto a las restricciones a la hora de retomar la actividad física6,19. En la literatura revisada, se recomienda evitar deportes de contacto y de alto riesgo durante los primeros 3meses tras el alta hospitalaria, aunque sin estudios clínicos que avalen dicha duración6,48.
En la revisión realizada por Carlotto et al.11, recomiendan el alta entre el 3.° y el 7.° día del ingreso ante buena evolución del TNO. Del mismo modo, establecen el tiempo de reposo dependiendo del grado de lesión y del tipo de actividad física: varía desde las 2semanas para la actividad rutinaria para los grados I a V, hasta los 12 meses en deportes de contacto con lesiones de grados IV y V.
Juyia y Kerr49 describen que el 84% de las lesiones, independientemente del grado de severidad, muestran una mejoría radiológica después de 10 semanas del traumatismo, con variaciones entre 3semanas para el grado I y 21 semanas para el grado IV.
Lesiones esplénicas en la edad pediátricaEl bazo es el órgano más frecuentemente lesionado en traumatismos abdominales en niños. Es más vulnerable debido a su disposición inferior a la parrilla costal y a la elasticidad de los ligamentos de sujeción50.
Como se mencionó anteriormente, este grupo de edad presenta mayor riesgo de desarrollar sepsis fulminante postesplenectomía, con un riesgo de muerte casi 600 veces mayor que la población general51. Debido a ello, fue en la población pediátrica donde se comenzó a plantear el TNO en el traumatismo esplénico, y hoy en día es el gold standard en este grupo de edad. Se han descrito tasas de éxito entre el 85 y el 90% según las series46,50,52.
Al igual que en el paciente adulto, el TNO es una opción, siempre y cuando el paciente se encuentre hemodinámicamente estable. La laparotomía está indicada si al ingreso necesita más de 40ml de sangre por kg de peso, lo que corresponde a la mitad de su volumen sanguíneo52.
ConclusiónEl manejo no quirúrgico requiere una serie de criterios para garantizar su éxito. Los pacientes deben ser bien seleccionados y siempre estar bajo supervisión de un equipo multidisciplinario, en un centro hospitalario que cumpla los requisitos que requiere dicho manejo conservador.
En la literatura revisada, la tasa de éxito ronda el 80-90%, con ciertos factores de riesgo descritos para el fallo de este. El uso de la angiografía y la angioembolización pueden ser una opción terapéutica poco invasiva en pacientes hemodinámicamente estables, en los que se evidencie extravasación de contraste y en aquellas lesiones de grados IV y V. Esta técnica puede ser una alternativa para la preservación esplénica, que asegura un mayor porcentaje de éxitos en el manejo conservador.
La esplenectomía sigue siendo la técnica de elección para aquellos pacientes que se encuentren hemodinámicamente inestables o con fallo del tratamiento conservador. La cirugía de preservación esplénica, como la esplenorrafia, la esplenectomía parcial o técnicas hemostáticas, pueden ser una alternativa en aquellos pacientes que requieran laparotomía por otras lesiones asociadas, hemodinámicamente estables, sin acidosis, coagulopatía ni hipotermia, y no tributarios de cirugía de control de daños, en los que la esplenectomía debe ser la norma.
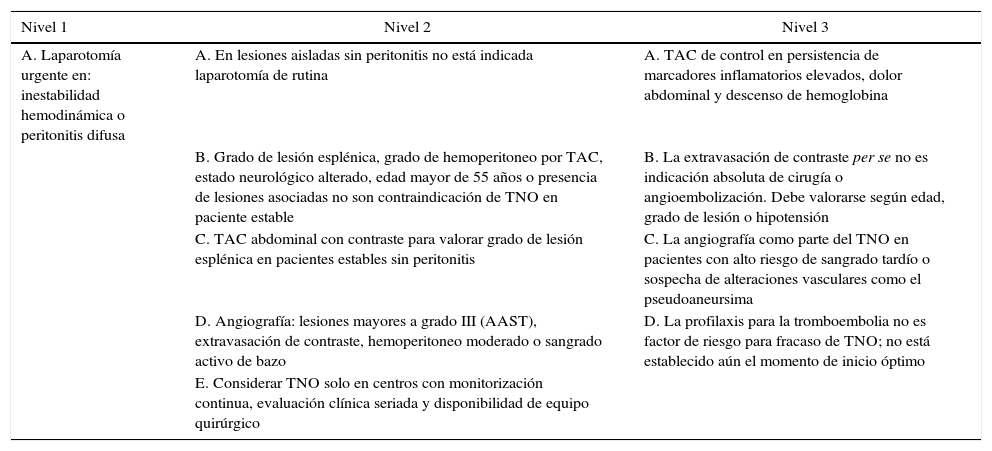
En la tabla 6 se postulan una serie de recomendaciones20 basadas en distintos niveles de evidencia. Se recomienda realizar estudios con mayor participación de distintos centros hospitalarios, para así unificar criterios basados en la evidencia científica para la toma de decisiones en el tratamiento de esta entidad traumática.
Niveles de recomendación tras traumatismo esplénico contuso según EAST.20
| Nivel 1 | Nivel 2 | Nivel 3 |
|---|---|---|
| A. Laparotomía urgente en: inestabilidad hemodinámica o peritonitis difusa | A. En lesiones aisladas sin peritonitis no está indicada laparotomía de rutina | A. TAC de control en persistencia de marcadores inflamatorios elevados, dolor abdominal y descenso de hemoglobina |
| B. Grado de lesión esplénica, grado de hemoperitoneo por TAC, estado neurológico alterado, edad mayor de 55 años o presencia de lesiones asociadas no son contraindicación de TNO en paciente estable | B. La extravasación de contraste per se no es indicación absoluta de cirugía o angioembolización. Debe valorarse según edad, grado de lesión o hipotensión | |
| C. TAC abdominal con contraste para valorar grado de lesión esplénica en pacientes estables sin peritonitis | C. La angiografía como parte del TNO en pacientes con alto riesgo de sangrado tardío o sospecha de alteraciones vasculares como el pseudoaneursima | |
| D. Angiografía: lesiones mayores a grado III (AAST), extravasación de contraste, hemoperitoneo moderado o sangrado activo de bazo | D. La profilaxis para la tromboembolia no es factor de riesgo para fracaso de TNO; no está establecido aún el momento de inicio óptimo | |
| E. Considerar TNO solo en centros con monitorización continua, evaluación clínica seriada y disponibilidad de equipo quirúrgico |
AAST: American Association for the Surgery of Trauma; TAC: tomografía axial computarizada; TNO: tratamiento no operatorio.
Los autores declaran no tener ningún conflicto de intereses