La carcinomatosis peritoneal se asocia a un mal pronóstico y las opciones terapéuticas son limitadas. El desarrollo de la quimioterapia intraperitoneal presurizada en aerosol (PIPAC) ofrece una alternativa de tratamiento paliativo para estos pacientes con una baja tasa de morbimortalidad. Nuestro objetivo es evaluar la implantación y la experiencia inicial de PIPAC para el tratamiento de la carcinomatosis peritoneal irresecable en nuestro centro.
Material y métodosRealizamos un estudio prospectivo incluyendo todos los pacientes a los que se les realizó PIPAC entre enero de 2019 y febrero de 2020 en nuestro hospital. Se recogieron: el origen del tumor primario, el volumen de ascitis, la extensión de la carcinomatosis peritoneal, el régimen de quimioterapia aplicada, el tiempo quirúrgico, las complicaciones postoperatorias, la estancia hospitalaria y la mortalidad.
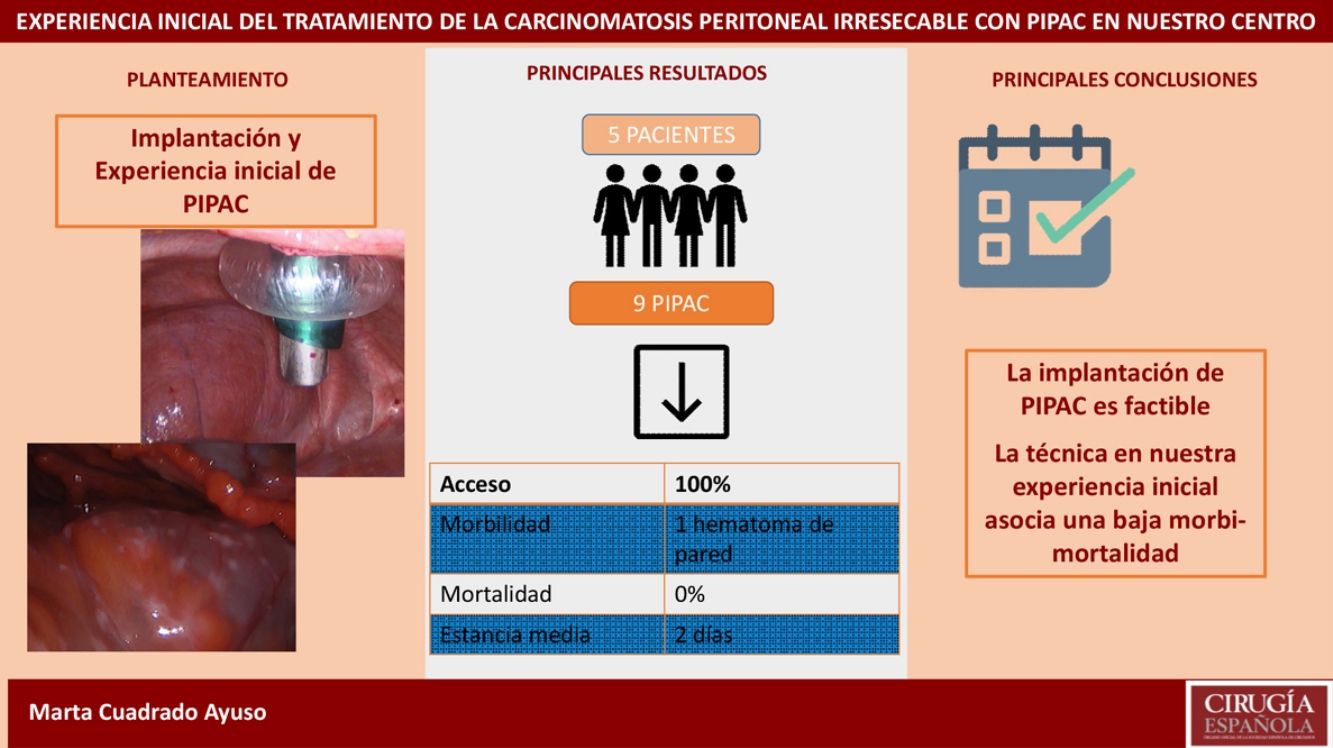
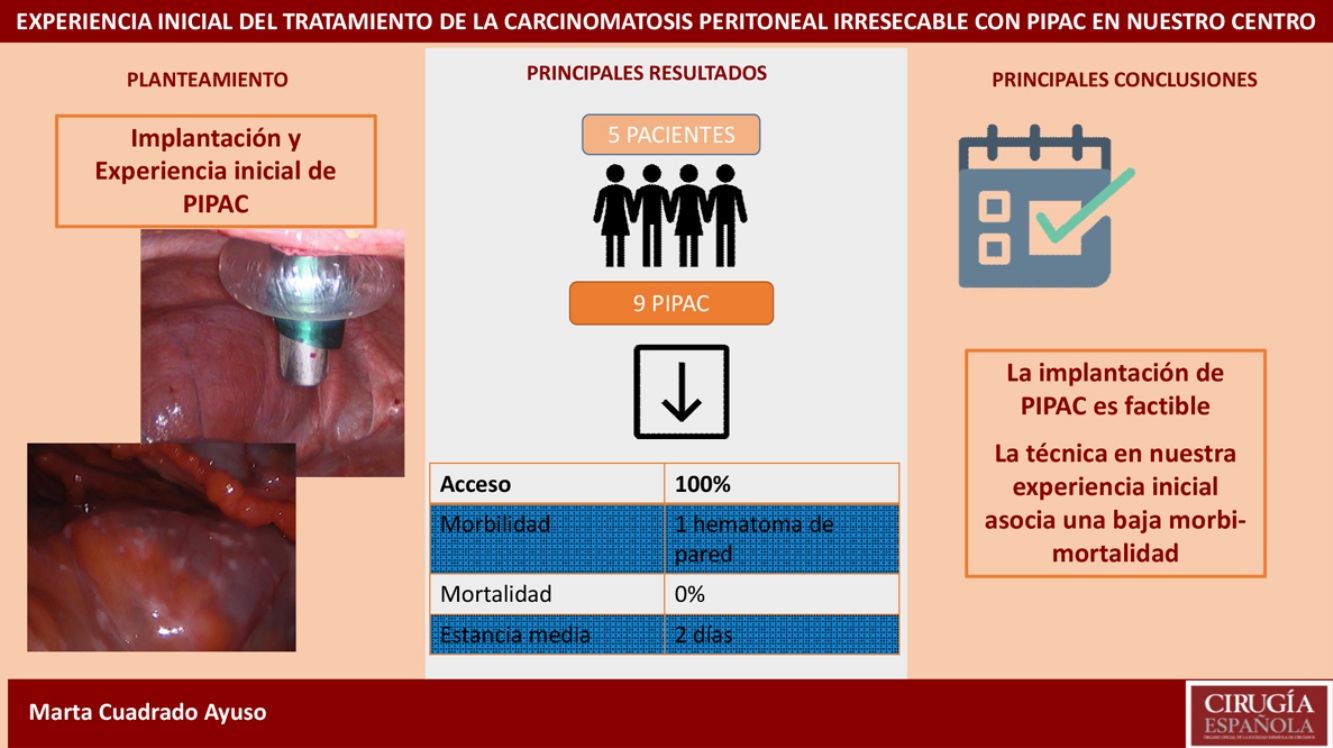
ResultadosAnalizamos 9 PIPAC realizadas en 5pacientes con carcinomatosis peritoneal de origen gástrico, ovárico y neoplasia mucinosa apendicular. La tasa de acceso a la cavidad peritoneal fue del 100%. El PCI medio fue 27,6 (24-35). El tiempo quirúrgico medio fue de 93min (70-125). En nuestra serie solo hubo una complicación Clavien-DindoII (1/9 procedimientos). La estancia hospitalaria media fue de 2días (1-4). La mortalidad fue del 0%.
ConclusiónLa implantación de PIPAC en nuestro centro se ha llevado a cabo con seguridad, pudiendo afirmar que es una técnica reproducible y con una baja tasa de morbimortalidad en nuestra experiencia inicial.
Peritoneal carcinomatosis remains a condition with poor prognosis and limited therapeutic options. Pressurized Intrapertioneal Aerosol Chemotherapy (PIPAC) has been developed as a new tool for delivering intraperitoneal chemotherapy with low morbidity. The aim of this study was to evaluate the initial experience of PIPAC in patients with peritoneal carcinomatosis at our hospital.
MethodsA prospective study between January 2019 and February 2020 was carried at a tertiary public hospital. Primary tumor, ascites volume, PCI, chemotherapy regimen, operative time, morbidity, length of hospital stay and mortality were recorded for analysis.
ResultsWe analyzed 9 PIPAC procedures performed in 5patients. Median PCI was 27.6 (24-35). Median surgical time was 93minutes (70-125). Only one adverse event occurred out of 9 procedures (Clavien-DindoII). Median length of hospital stay was 2days (1-4). Mortality was 0%.
ConclusionPIPAC seems to be a feasible and safe procedure to treat peritoneal carcinomatosis, with low morbidity and short hospital stay.
La carcinomatosis peritoneal, definida como la presencia de depósitos metastásicos en la cavidad peritoneal, es una manifestación frecuente de neoplasias de distinto origen: ginecológicas, digestivas y peritoneales. Está asociada a un mal pronóstico, así como a una mala calidad de vida por la aparición frecuente de ascitis, obstrucción intestinal y dolor abdominal1-2.
El tratamiento tradicional es la quimioterapia sistémica paliativa, si bien no está exenta de efectos secundarios y los resultados obtenidos son limitados, en parte por la existencia de la barrera peritoneo-plasmática, que dificulta el paso del quimioterápico a la cavidad peritoneal3-4.
Sugarbaker5 propuso un tratamiento multimodal combinando la cirugía citorreductora (CRS) asociada a quimioterapia intraperitoneal hipertérmica (HIPEC) con la intención de ofrecer un tratamiento intensivo a los pacientes con afectación de la cavidad peritoneal6. Este tratamiento está indicado en pacientes seleccionados, con histologías determinadas y extensión limitada de la enfermedad variando el límite de PCI establecido en función del origen del tumor primario, donde ha demostrado mejorar la supervivencia de forma significativa7-10.
En 2011 se desarrolló una nueva técnica para la administración de quimioterapia intraperitoneal, la Pressurized Intraperitoneal Aerosol Chemotherapy (PIPAC). Como ventajas aporta el abordaje mínimamente invasivo, una mejor distribución y penetración tisular del agente quimioterápico y la posibilidad de repetir el tratamiento cada 6-8semanas11-12.
Hasta la fecha, múltiples grupos han presentado buenos resultados, con bajas tasas de morbimortalidad asociadas al procedimiento, estableciéndose como una opción de tratamiento paliativo para los pacientes con carcinomatosis peritoneal que no son candidatos al tratamiento con CRS y HIPEC13-17.
Nuestro objetivo es analizar los resultados iniciales con la implantación de PIPAC para el tratamiento de la carcinomatosis peritoneal irresecable en un hospital de tercer nivel público de la Comunidad de Madrid.
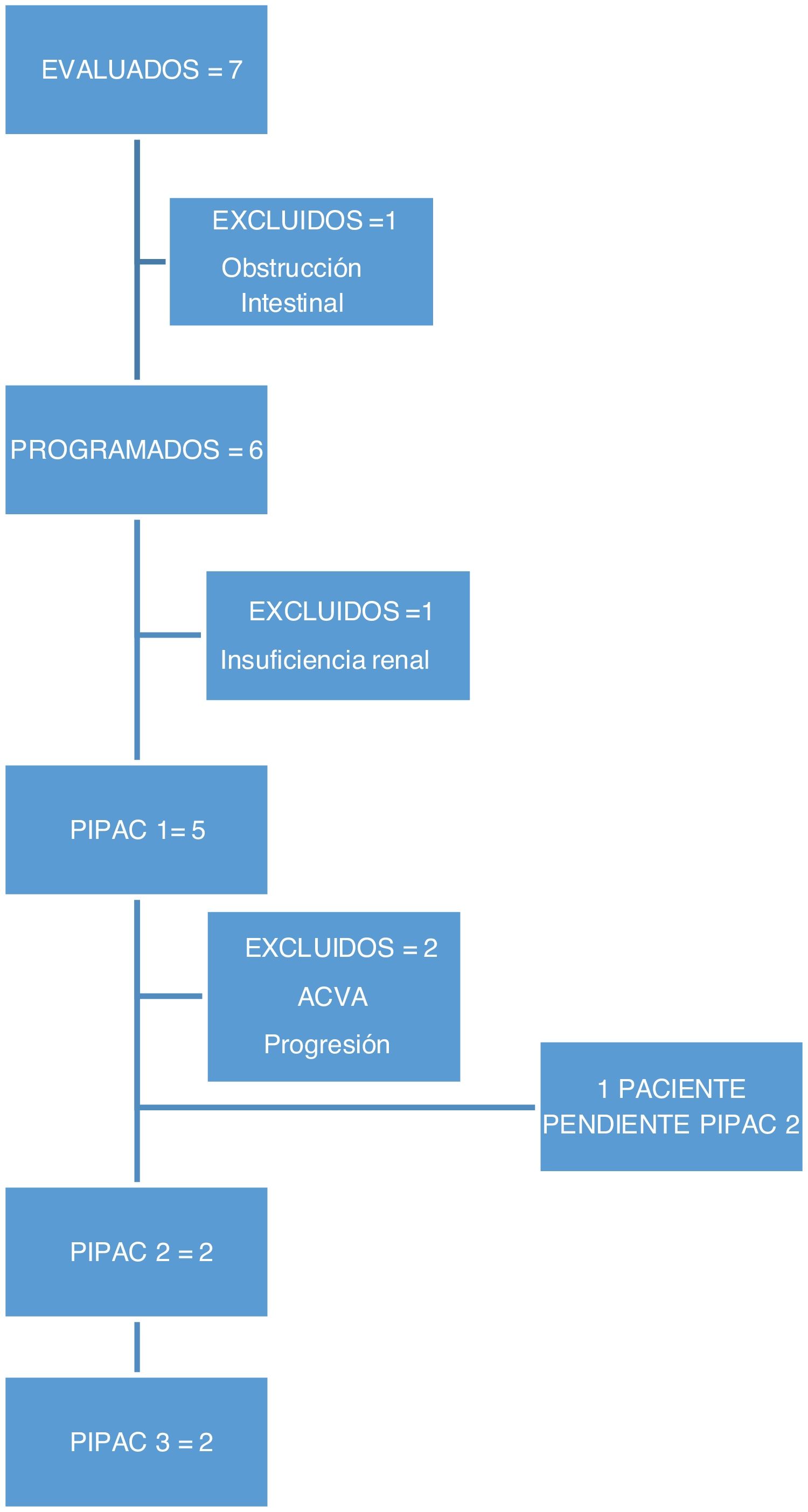
Material y métodosEntre enero de 2019 y febrero de 2020 se evaluaron 7 pacientes con diagnóstico de carcinomatosis peritoneal (1cáncer ovario, 5cáncer gástrico, 1neoplasia mucinosa apendicular) no subsidiarios de tratamiento con CRS y HIPEC, para PIPAC.
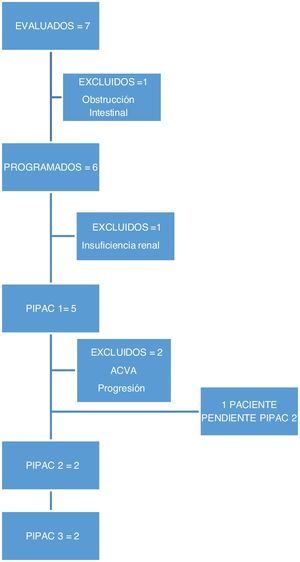
En este periodo realizamos 9 procedimientos en 5 pacientes. En dos pacientes no fue posible realizar el tratamiento por complicaciones previas al tratamiento: una paciente desarrolló una insuficiencia renal terminal diagnosticada en la analítica preoperatoria y otra paciente una obstrucción intestinal previo a la programación del primer ciclo de PIPAC, por lo que no recibieron tratamiento (fig. 1).
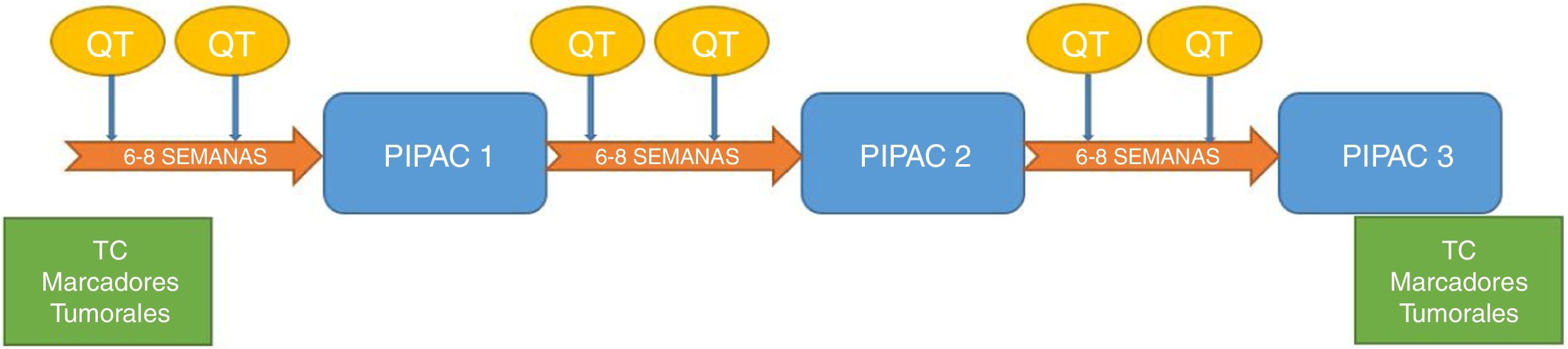
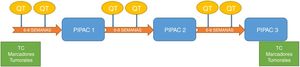
Los pacientes fueron evaluados en un comité multidisciplinar, posteriormente aprobados de forma individual en el comité del uso de medicamentos en situaciones especiales, y firmaron un consentimiento informado específico. Se programaron para 3 ciclos de PIPAC previstos cada 6-8semanas. A todos los pacientes se les administró en el intervalo quimioterapia sistémica según el esquema de tratamiento que se refleja en la figura 2.
En base a la experiencia de otros centros, y dada la ausencia de datos que determinen la eficacia del tratamiento con PIPAC, considerándolo un tratamiento paliativo dentro de las indicaciones, incluimos en nuestro protocolo las situaciones en las que no exista una alternativa terapéutica con eficacia demostrada, como son: pacientes con carcinomatosis peritoneal de origen colorrectal, apendicular, ovárico, gástrico o mesotelioma, en los que no esté indicada la cirugía con quimioterapia intraperitoneal hipertérmica por extensa afectación, en ausencia de metástasis a distancia y pacientes con carcinomatosis peritoneal de cualquier otro origen en los que no está indicada la cirugía de citorreducción con quimioterapia intraperitoneal hipertérmica, independientemente del grado de afectación peritoneal. Como contraindicaciones se establecen: presencia de metástasis extraperitoneales, obstrucción intestinal clínica o radiológica, y perforación de víscera hueca o sospecha de lesión durante el acceso laparoscópico.
Técnica quirúrgicaTodos los procedimientos fueron llevados a cabo por cirujanos acreditados para la realización de PIPAC. Se administró profilaxis tromboembólica 12h antes del procedimiento y profilaxis antibiótica con cefazolina 2g. Bajo anestesia general, se realizó el neumoperitoneo con aguja de Veress en hipocondrio izquierdo en pacientes con cirugías abdominales previas en los que el acceso a la cavidad abdominal puede estar comprometido por la existencia de adherencias; se empleó la ecografía para valorar la movilidad de las asas intestinales y seleccionar el punto de inserción de la aguja de Veress.
Cuando se alcanzó una presión de 14mmHg, se introdujo un trocar con balón de 5mm en el punto de inserción de la aguja de Veress, empleando durante el procedimiento una óptica de 5mm y 30°. Se evaluó en primer lugar la línea media para la colocación bajo visión directa del trocar con balón de 12mm. Tras la evacuación y cuantificación de la ascitis y la toma de citología, se realizó la exploración sistemática de la cavidad peritoneal y la determinación del PCI. Se tomaron biopsias, con una pinza de biopsia laparoscópica, de 4 cuadrantes siempre que fue posible, dejando marcados los puntos con clips para identificarlos en los ciclos de PIPAC sucesivos.
Con la óptica fija en el trocar de 5mm se introdujo el nebulizador (Capnopen®) de manera que quedase visible durante todo el procedimiento. Se conectó el inyector de alta presión al nebulizador, dejando cubierto el sistema con una funda de cámara para la prevención de vertidos accidentales. Se verificó la dosis de quimioterápico a administrar y la estanqueidad del sistema manteniendo el neumoperitoneo estable a una presión de 12mmHg con un flujo menor de 0,1ml/s (fig. 3).
El tipo de quimioterapia empleada fue doxorubicina 1,5mg/m2 y cisplatino 7,5mg/m2 en todos los pacientes, según el protocolo; el fármaco de elección depende del origen del tumor primario, estando indicado el oxaliplatino en la carcinomatosis de origen colorrectal, y la doxorubicina asociada a cisplatino en el resto de tumores. El inicio de la nebulización se realizó de forma remota, abandonando todo el personal el quirófano previo al comienzo de la infusión. Tras la nebulización se mantuvo el capnoperitoneo durante 30min y posteriormente se evacuó a través de un sistema cerrado conectado a 2filtros y al sistema de extracción de gases del hospital.
Utilizamos una lista de verificación específica previo al inicio de la infusión de quimioterápico con el objetivo de detectar y minimizar errores durante el procedimiento.
Análisis estadísticoLos datos de todos los pacientes fueron recogidos de forma prospectiva, incluyendo volumen de ascitis, PCI, toma de biopsias y la aparición de complicaciones en el postoperatorio según la clasificación de Clavien-Dindo, así como la estancia hospitalaria y la mortalidad.
Para el análisis estadístico empleamos el programa SPSS Statistics versión 23 (SPSS Inc, Chicago, IL); para las variables cuantitativas empleamos la media y el rango, y las variables cualitativas se expresan en valor absoluto y porcentaje (%).
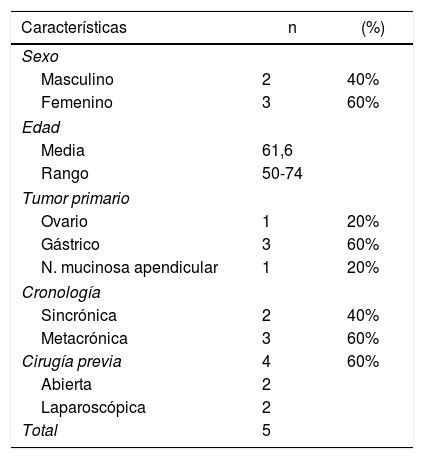
ResultadosAnalizamos 9 PIPAC realizados en 5 pacientes. El origen de la carcinomatosis peritoneal fue gástrico en 3pacientes (60%), ovárico en un paciente (20%) y neoplasia mucinosa apendicular de bajo grado en un paciente (20%). La carcinomatosis peritoneal fue sincrónica en 2 pacientes (40%) y metacrónica en 3 pacientes (60%). En 4 de los pacientes se había realizado cirugía del tumor primario previamente: gastrectomía total laparoscópica en un paciente, gastrectomía total abierta en un paciente, apendicectomía laparoscópica en un paciente y dos CRS en una paciente. Todos los pacientes habían recibido al menos una línea de quimioterapia previa a la indicación de PIPAC.
Las características de los pacientes se recogen en la tabla 1.
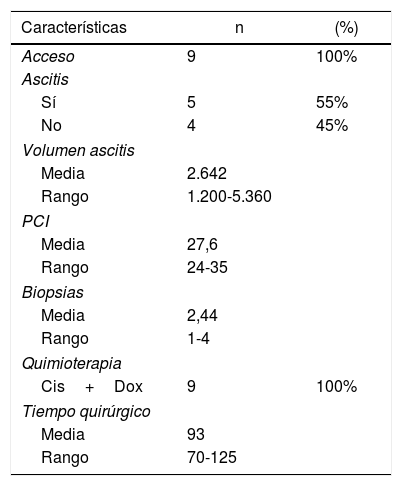
El acceso a la cavidad peritoneal fue posible en los 9 procedimientos; en los pacientes con cicatrices de cirugías previas empleamos la ecografía para guiar el acceso. Encontramos adherencias en los pacientes con cirugía abierta previa, más evidentes en la línea media, obligando a desplazar el punto de colocación del trocar de 12mm; no objetivamos adherencias en los pacientes con cirugía laparoscópica previa.
Los hallazgos intraoperatorios y la quimioterapia empleada se recogen en la tabla 2.
En nuestra serie registramos una única complicación en el postoperatorio en relación con la colocación del trocar: la paciente presentó anemización el primer día postoperatorio, sin repercusión hemodinámica, requiriendo transfusión de dos concentrados de hematíes y posteriormente la aparición de un hematoma en flanco izquierdo, que se resolvió sin incidencia. (Clavien-DindoII). La mortalidad postoperatoria (considerada hasta 30días) fue del 0% en nuestra serie. La estancia media fue de 2días (rango 1-4).
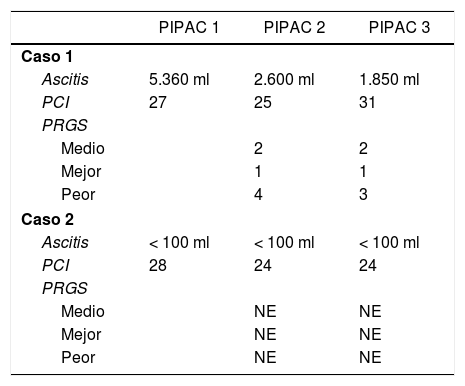
Tres pacientes recibieron un único ciclo de PIPAC. Un paciente presentó un ACVA y deterioro funcional, por lo que no se programó la segunda PIPAC. Una paciente presentó dolor lumbar, por lo que se realizó un TC en la que se objetivó aparición de metástasis óseas, por lo que se decidió no continuar el tratamiento por progresión de enfermedad extraperitoneal. Una paciente está pendiente de continuar tratamiento.
Dos pacientes completaron 3 ciclos de PIPAC, recibiendo quimioterapia sistémica en los intervalos de la cirugía. La respuesta de los pacientes que completaron los 3 ciclos de PIPAC se recoge en la tabla 3. Una paciente en la que se consiguió el control de la ascitis, sin mejoría de la afectación peritoneal entre PIPAC2 y PIPAC 3, se decidió no continuar y mantener con QT sistémica. A los 30días presentó ascitis refractaria y se realizó tratamiento con HIPEC sin ser efectivo, requiriendo colocación de drenaje para evacuación periódica de la ascitis. La supervivencia fue de 15meses. El segundo paciente, con una carcinomatosis de origen en una neoplasia mucinosa apendicular de bajo grado, se consideró inicialmente irresecable por afectación extensa de intestino delgado, presentó buena respuesta con disminución de los implantes sobre el intestino delgado, decidiéndose rescate con CRS y HIPEC, que se realizó a las 8semanas de PIPAC3.
DiscusiónPIPAC supone una nueva técnica para la administración de quimioterapia intraperitoneal en forma de aerosol por vía laparoscópica, y de esta manera se consigue una mejor distribución del agente quimioterápico y una mayor penetración tisular11,18. La posibilidad de administrar el tratamiento de forma repetida nos permite evaluar la respuesta del tumor macroscópicamente en las laparoscopias sucesivas así como histológicamente por la toma de biopsias; para ello se ha desarrollado el Peritoneal Regression Grade Score (PRGS), que nos permite establecer el grado de respuesta en las biopsias consecutivas19.
A falta de ensayos clínicos que demuestren la eficacia oncológica de PIPAC en el tratamiento de la carcinomatosis peritoneal17, y tras las experiencias en otros centros donde se ha puesto de manifiesto la seguridad de la combinación del tratamiento con PIPAC de forma alterna con quimioterapia sistémica, adoptamos el esquema de tratamiento propuesto en el que se administran dos ciclos de quimioterapia sistémica entre los ciclos de PIPAC20,21, si bien con la combinación de ambos tratamientos es difícil interpretar el efecto de cada uno de ellos individualmente. El potencial papel de PIPAC, como tratamiento paliativo, es controlar la progresión de los implantes peritoneales, con el teórico beneficio de controlar la sintomatología asociada, ascitis, obstrucción…, por lo que mejoraría la calidad de vida y, por otro lado, podría mejorar la supervivencia de estos pacientes. Dada la capacidad de inducir regresión de los implantes y, por tanto, la disminución del PCI en algunos casos, también se ha descrito la posibilidad de emplear PIPAC como tratamiento neoadyuvante para el rescate con CRS y HIPEC22.
Estudios recientes muestran que se trata de una técnica reproducible y segura23-25, donde uno de los factores limitantes es el acceso a la cavidad peritoneal. La mayoría de los pacientes candidatos a PIPAC han tenido cirugías abdominales previas, y en la literatura se describe un porcentaje de imposibilidad de acceso a la cavidad abdominal que varía entre el 0 y el 35%25. En nuestra experiencia el acceso fue posible en el 100% de los procedimientos, a pesar de incluir un alto porcentaje de pacientes con cirugías previas (80%).
La morbilidad en las distintas series publicadas varía entre el 0 y el 15,9%14,24-28. Algunos grupos distinguen entre complicaciones en el periodo intraoperatorio, donde lo más frecuente son las lesiones de intestino delgado, y en el periodo postoperatorio. En nuestro centro no tuvimos ninguna complicación en el intraoperatorio, y tan solo hubo una complicación postoperatoria (Clavien-DindoII): un hematoma en flanco izquierdo en relación con el punto de inserción del trocar de 5mm, lo que supone una morbilidad del 11% debido al pequeño tamaño de la muestra pero que concuerda con la literatura publicada.
El tiempo quirúrgico ha sido recogido por distintos grupos, con un tiempo medio entre 86 y 100min, similar al tiempo quirúrgico en nuestra experiencia, que fue de 93min; probablemente esta concordancia se debe a la estandarización de la técnica así como a la necesidad de acreditación previa al inicio del programa en los distintos hospitales13,15,16.
La estancia media postoperatoria en nuestra serie fue de 2días, un día menos que la publicada por otros grupos, donde la estancia fue de 3días, tanto en el estudio multicéntrico de Alyami et al.14 como en el análisis retrospectivo de Hübner et al.25, si bien en la mayoría de los artículos publicados no se menciona este dato. Debido a la buena experiencia inicial, se ha llegado a plantear la posibilidad de realizar el procedimiento de forma ambulatoria29, lo que en nuestra experiencia parece factible, dado que el 89% de los pacientes fueron dados de alta a las 24h de la intervención y la tasa de reingresos fue del 0%.
Respecto a la mortalidad, se recogen cifras en las distintas series que varían entre el 0 y el 6,85%14,23, si bien en estos estudios se discute la implicación de PIPAC como la causa directa de la muerte. En nuestra serie la mortalidad fue del 0% incluyendo el seguimiento hasta el 30 día postoperatorio.
Las limitaciones de este estudio son, por un lado, el pequeño número de pacientes incluidos: solo 7 pacientes fueron evaluados para recibir tratamiento con PIPAC, y en 2 de ellos la progresión de la enfermedad en el intervalo hasta la programación quirúrgica imposibilitó el tratamiento. Creemos que la falta de ensayos clínicos en los que se evalúe la eficacia oncológica de PIPAC dificulta que se incorpore dentro de la práctica clínica habitual. Por otro lado, la variabilidad del origen del tumor primario, la extensión y la cronología hacen imposible comparar o evaluar la respuesta al tratamiento en nuestra serie. Hasta la fecha solo se ha publicado la experiencia del primer procedimiento de PIPAC realizado en España30, por lo que nos parece interesante comunicar nuestros resultados tras un año de implantación de este tratamiento en el hospital.
Podemos concluir que la implantación de PIPAC en un hospital público de tercer nivel es factible. La experiencia inicial en nuestro centro ha puesto de manifiesto que se trata de una técnica segura asociada a una estancia hospitalaria corta, si bien es necesaria la realización de estudios controlados para llegar a establecer su eficacia y sus indicaciones.
Conflicto de interesesNinguno.