Se ha definido un grupo de resecabilidad borderline resectable (APBR) en el adenocarcinoma de páncreas. El objetivo del estudio es evaluar los resultados en el tratamiento quirúrgico tras neoadyuvancia del APBR.
MétodoEntre 2010 y 2014 incluimos pacientes afectos de APBR en un protocolo de neoadyuvancia y cirugía, estadificados mediante tomografía computarizada multidetector (TCMD). El tratamiento con quimioterapia se basó en gemcitabina y oxaliplatino (GEMOX). Posteriormente, se realizó TCMD para descartar progresión, y se administró 5-FU en infusión y radioterapia concomitante. Se practicó TCMD y resección en ausencia de progresión. Se realizó un estudio estadístico descriptivo, dividiendo la serie en grupo resección (grupo GR) y grupo progresión (grupo PROG). El seguimiento finalizó en febrero de 2016.
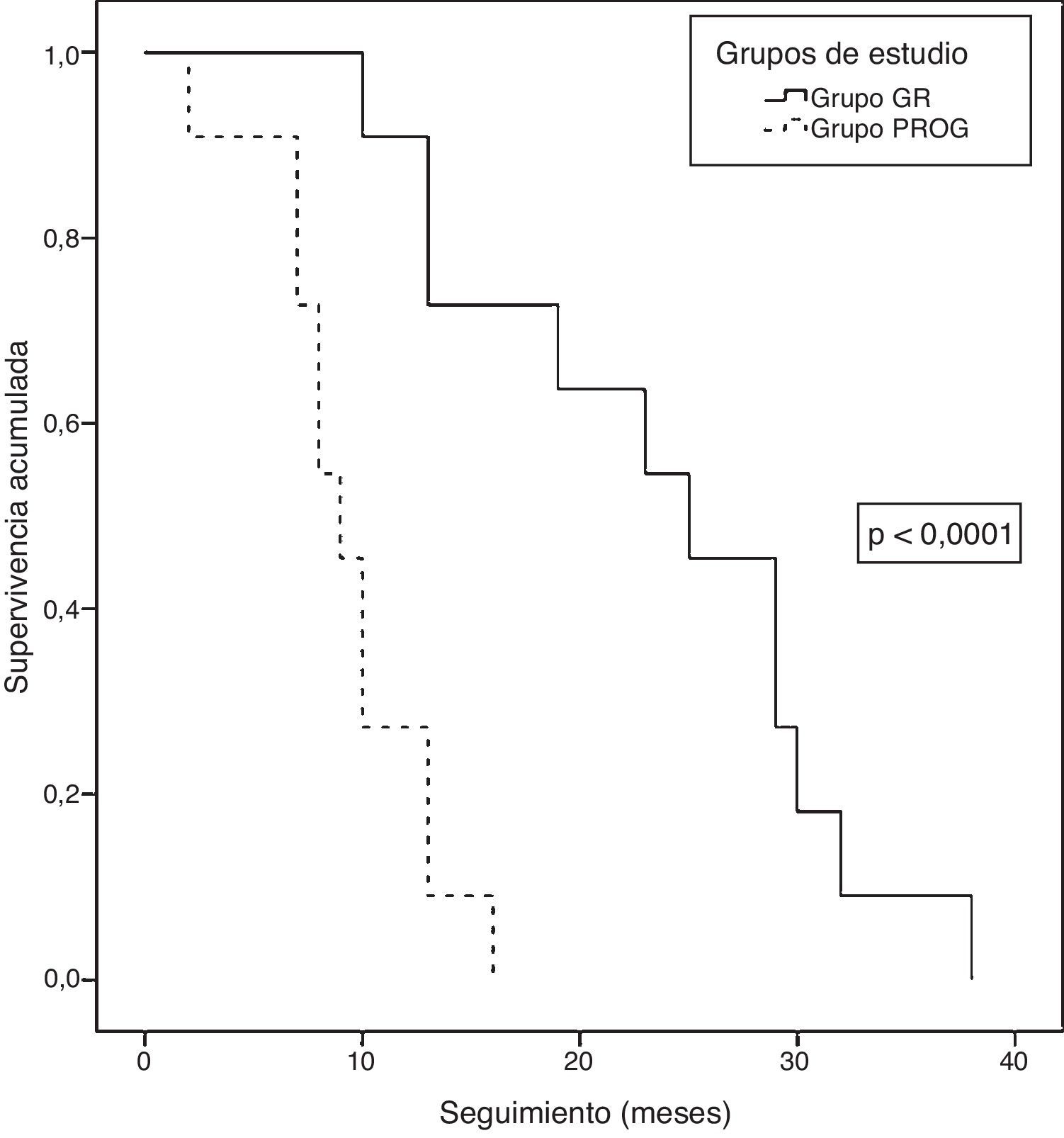
ResultadosIndicamos tratamiento neoadyuvante a 22 pacientes, 11 de ellos fueron finalmente intervenidos. Se realizaron 9 duodenopancreatectomías cefálicas, una duodenopancreatectomía total y una pancreatectomía corporocaudal. De los 11 pacientes, 7 requirieron algún tipo de resección vascular; 5 resecciones venosas, uno arterial y otro ambas. No hubo mortalidad postoperatoria, 7 (63%) tuvieron alguna complicación y 4 fueron reintervenidos. La estancia hospitalaria postoperatoria mediana fue 17 días (7-75). El estudio patológico evidenció márgenes microscópicos libres (R0) en el 63% de los pacientes y ausencia de afectación adenopática en 10 pacientes (ypN0). Al cierre del estudio, todos los pacientes habían fallecido, con una supervivencia actuarial mediana de 13 meses (9,6-16,3). La supervivencia actuarial mediana del grupo GR fue superior al grupo PROG (25 vs. 9 meses; p<0,0001).
ConclusiónEl tratamiento neoadyuvante del APBR permite seleccionar un grupo de pacientes en el que la resección consigue una supervivencia superior al grupo en el que se observa progresión. La resección pancreática posneoadyuvancia requiere resecciones vasculares en la mayoría de los casos.
A borderline resectable group (APBR) has recently been defined in adenocarcinoma of the pancreas. The objective of the study is to evaluate the results in the surgical treatment after neoadjuvancy of the APBR.
MethodBetween 2010 and 2014, we included patients with APBR in a neoadjuvant and surgery protocol, staged by multidetector computed tomography (MDCT). Treatment with chemotherapy was based on gemcitabine and oxaliplatin. Subsequently, MDCT was performed to rule out progression, and 5-FU infusion and concomitant radiotherapy were given. MDCT and resection were performed in absence of progression. A descriptive statistical study was performed, dividing the series into: surgery group (GR group) and progression group (PROG group).
ResultsWe indicated neoadjuvant treatment to 22 patients, 11 of them were operated, 9 pancreatoduodenectomies, and 2 distal pancreatectomies. Of the 11 patients, 7 required some type of vascular resection; 5 venous resections, one arterial and one both. No postoperative mortality was recorded, 7 (63%) had any complications, and 4 were reoperated. The median postoperative stay was 17 (7-75) days. The pathological study showed complete response (ypT0) in 27%, and free microscopic margins (R0) in 63%. At study clossure, all patients had died, with a median actuarial survival of 13 months (9,6-16,3). The median actuarial survival of the GR group was higher than the PROG group (25 vs. 9 months; p < 0.0001).
ConclusionThe neoadjuvant treatment of APBR allows us to select a group of patients in whom resection achieves a longer survival to the group in which progression is observed. Post-adjuvant pancreatic resection requires vascular resection in most cases.
El término adenocarcinoma de páncreas borderline resectable (APBR) describe un concepto de resecabilidad límite utilizado por primera vez por Maruer en 19991. Dicho concepto fue introducido para clasificar aquellos tumores que se hallan entre los tumores resecables y los irresecables2. La definición se basa en los hallazgos de la tomografía computarizada multidetector (TCMD). En el año 2006, el grupo del MD Anderson3 publicó una clasificación que incluía el APBR. Se definieron 3grupos según la afectación vascular: tumor resecable, tumor de resecabilidad límite o borderline resectable, y tumor irresecable. El grupo borderline resectable se definía como el de aquellos pacientes con resecabilidad límite y que podrían ser resecados tras neoadyuvancia. Dicho grupo ha publicado buenos resultados tras la resección en pacientes afectos de APBR tras neoadyuvancia, teniendo en cuenta que en el pasado eran considerados tumores irresecables. Recientemente, se ha adoptado dicha clasificación en un consenso internacional, con mínimos cambios4. El objetivo de este estudio es revisar los resultados a corto y medio plazo obtenidos en nuestro centro en el tratamiento quirúrgico del APBR tras tratamiento neoadyuvante, y analizar la morbimortalidad acaecida tras la cirugía posneoadyuvancia.
Material y métodosSe ha recogido la experiencia en el tratamiento quirúrgico del APBR tras neoadyuvancia desde julio de 2010 hasta noviembre de 2014 llevado a cabo en el Hospital Universitari de Bellvitge y en el Servei d’Oncologia Mèdica del Institut Català d’Oncologia de L’Hospitalet. Se han registrado de forma prospectiva los datos demográficos, el esquema neoadyuvante, la cirugía practicada, los datos anatomopatológicos y el seguimiento de todos los pacientes. El seguimiento de los pacientes finalizó en febrero de 2016.
Estudio de estadificaciónSe utilizó un TCMD de 64 coronas para el diagnóstico y estadificación. Los pacientes fueron clasificados de acuerdo con los criterios publicados por el grupo de MD Anderson3 en tumores resecables, borderline resecables e irresecables. Así, se definió APBR como aquellas lesiones de cabeza pancreática en contacto con la arteria mesentérica superior (AMS) menor de 180°, obliteración de la vena porta-vena mesentérica superior (VP-VMS) con posibilidad de reconstrucción, y/o contacto con la arteria hepática en su unión con la arteria gastroduodenal. Hemos incluido también lesiones de cuello-cuerpo pancreático que engloban al tronco celíaco (TC), siempre y cuando presenten una distancia libre de tumor desde la raíz de la aorta hasta el inicio del tumor5. Una vez incluidos en el protocolo de APBR, a los pacientes con ictericia, se procedió al drenaje biliar mediante prótesis metálica cubierta y confirmación citológica mediante punción guiada por ecoendoscopia6.
Tratamiento neoadyuvanteEl tratamiento neoadyuvante se basó en el esquema GEMOX (1.000mg/m2 de gemcitabina durante 100 min de infusión el día 1, seguido de 100mg/m2 de oxaliplatino en infusión durante 2 h el día 2, cada 2 semanas) por 6 ciclos. Durante el periodo analizado, 6 pacientes participaron en un ensayo clínico (esquema GEMOX+erlotinib 100mg/día) por 6 ciclos. Después de reestadificar a los pacientes con TCMD, los pacientes sin progresión de la enfermedad recibieron 5 semanas de quimioterapia (QT) con infusión de 5-FU a 250mg/m2/día concomitante a la radioterapia (50,4Gy). Los pacientes que fueron tratados dentro del citado ensayo clínico recibieron durante la radioterapia, 40mg/m2 de gemcitabina 2 veces a la semana y 100mg/día de erlotinib. Después de una nueva reestadificación con TCMD, entre las 4 y las 6 semanas posteriores al final del tratamiento concomitante de quimiorradioterapia (QRT), se indicó resección quirúrgica en caso de no presentar progresión. Se consideró progresión de la enfermedad en aquellos casos con mayor afectación tumoral local o enfermedad a distancia. Así, se indicó cirugía en los casos en los que el estudio radiológico no objetivó cambios en la estadificación previa al tratamiento o bien evidenció regresión tumoral.
Técnica quirúrgica y estudio anatomopatológicoSe realizó una duodenopancreatectomía cefálica (DPC), pancreatectomía corporocaudal con esplenectomía o duodenopancreatectomía total dependiendo de la localización del tumor, con una linfadenectomía regional7. Durante la cirugía se remitió el margen de resección para su análisis en fresco y se realizó ampliación de márgenes en caso de estar afectado. La resección vascular se planificó de forma individualizada. En cuanto al estudio anatomopatológico, se utilizó la clasificación pTNM de la International Union Against Cancer (UICC)8; el estudio de los márgenes de resección quirúrgicos se basó en el estudio de Royal College9. Por último, la presencia de cambios posneoadyuvancia fueron registrados de acuerdo con el grado de regresión tumoral (GRT) del College of American Pathologists (2009)10. En función de la respuesta patológica al tratamiento neoadyuvante, se considera GRT0 en los casos en los que no existen células tumorales viables (respuesta completa); GRT1, si se hallan células tumorales aisladas o en pequeños grupos; GRT2, si existe tumor residual pero el porcentaje de fibrosis es superior al tumoral y GRT3 si hay tumor residual extenso (respuesta mínima o sin respuesta).
Estudio estadísticoAnálisis descriptivo según medidas de tendencia central (media, mediana) y de dispersión (desviación estándar y rango intercuartílico) según criterios de normalidad (test de Kolmogorov-Smirnov). Posteriormente, se dividió la serie en el grupo resección (GR) y grupo progresión (PROG), dependiendo de la evolución registrada tras el tratamiento neoadyuvante. A continuación, se realizó un estudio comparativo entre variables cualitativas según chi-cuadrado o Fisher y entre variables cuantitativas según U de Mann-Whitney. La afectación radiológica se clasificó según existía contacto con la AMS, oclusión VP-VMS, contacto con TC y contacto con arteria hepática (AH). El período de tiempo transcurrido entre el diagnóstico y el inicio de la neoadyuvancia se denominó T1, entre el inicio y el final de la neoadyuvancia, T2 y entre el final de la neoadyuvancia y la cirugía, T3. Se analizó la supervivencia actuarial y el tiempo libre de enfermedad de la serie global mediante un análisis de Kaplan-Meier. Se consideró tiempo de supervivencia el tiempo transcurrido desde la fecha de inicio de la QT hasta la fecha de la muerte. Por último, se comparó la supervivencia actuarial entre los grupos GR y PROG mediante el test de log-rank (p<0,05). Se consideró tiempo libre de enfermedad de los pacientes del grupo GR el tiempo desde la cirugía hasta la aparición de la recidiva. En los pacientes del grupo PROG se definió tiempo hasta progresión el tiempo desde el inicio de la QT hasta la progresión. Se utilizó el paquete estadístico SPSS 18.0 ® y el valor estadísticamente significativo considerado fue de p<0,05 en todos los casos.
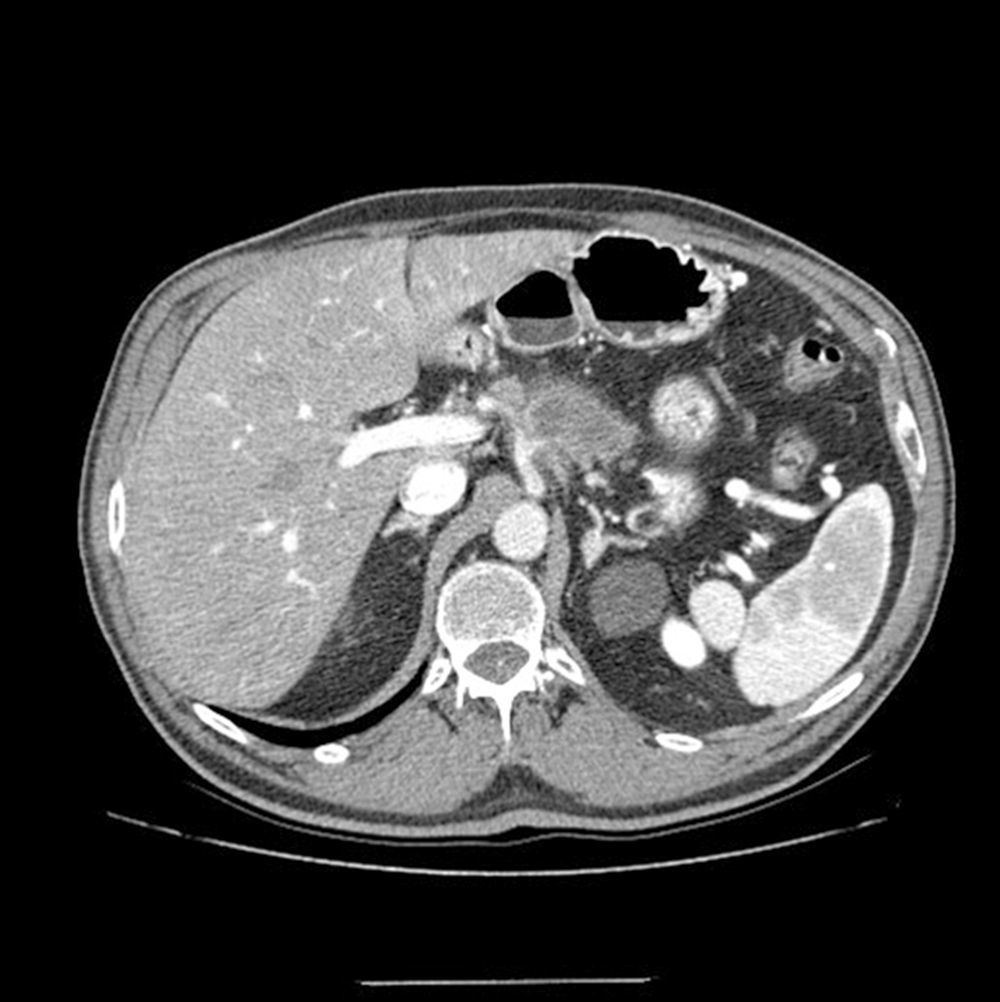
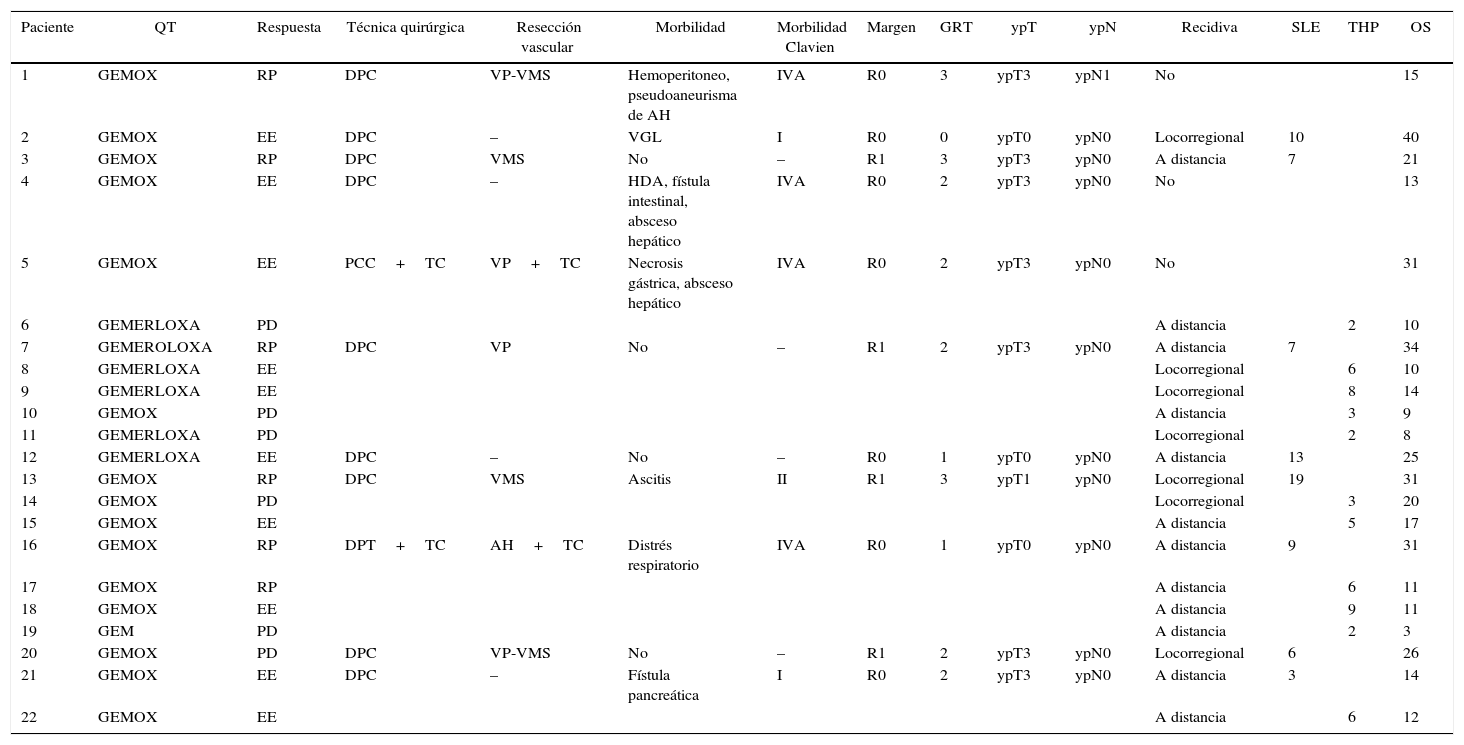
ResultadosValoración inicial y estadificaciónEntre 2010 y 2014, 22 pacientes se incluyeron en el protocolo de tratamiento con neoadyuvancia por APBR: 13 hombres y 9 mujeres, con una edad media de 62,7 años (±10,3) (rango: 41-78). El TCMD de estadificación demostró que los pacientes estudiados tenían lesiones en cabeza y cuello-cuerpo; 19 y 3 casos, respectivamente. Asimismo, se evidenció contacto del tumor con la arteria mesentérica superior (AMS) en 13, oclusión de VP-VMS en 9, el tumor englobaba el TC en 4 (fig. 1) y contacto del tumor con la AH en 5 (tabla 1).
Imagen de tomografía computarizada multidetector. Se evidencia lesión tumoral en el cuello-cuerpo pancreático que engloba la arteria esplénica y contacta focalmente con la arteria hepática y el tronco celíaco. En el momento del diagnóstico, a la paciente se le identificó una segunda lesión tumoral en cabeza pancreática, por lo que se planificó duodenopancreatectomía total, gastrectomía 4/5, esplenectomía, resección de tronco celíaco y anastomosis arterial terminoterminal tras embolización arterial en 2tiempos.
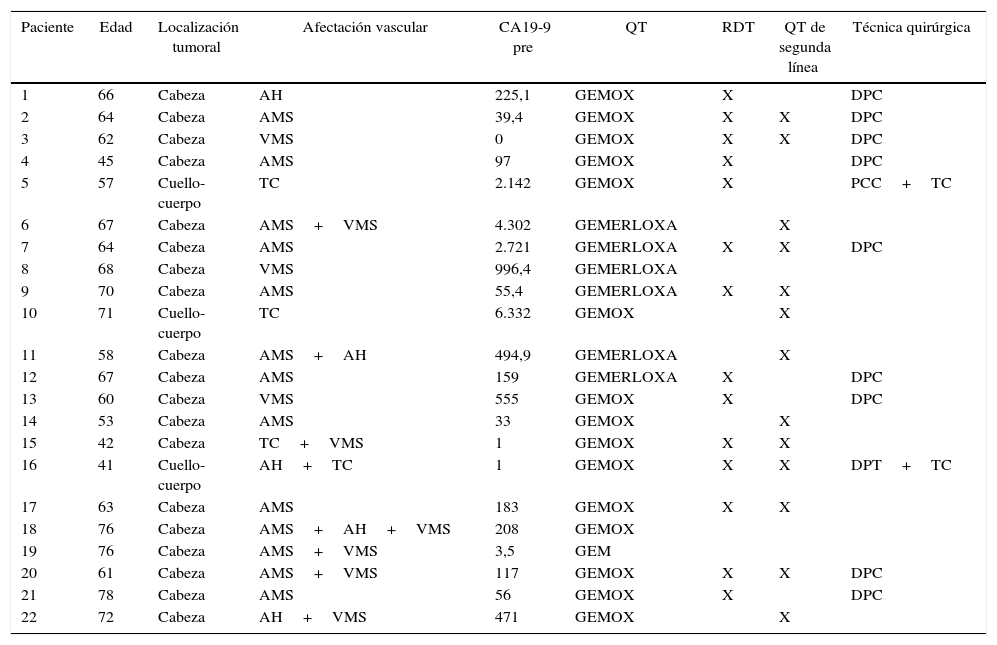
Afectación vascular y esquema terapéutico de los pacientes tratados mediante neoadyuvancia por adenocarcinoma de páncreas borderline resectable
| Paciente | Edad | Localización tumoral | Afectación vascular | CA19-9 pre | QT | RDT | QT de segunda línea | Técnica quirúrgica |
|---|---|---|---|---|---|---|---|---|
| 1 | 66 | Cabeza | AH | 225,1 | GEMOX | X | DPC | |
| 2 | 64 | Cabeza | AMS | 39,4 | GEMOX | X | X | DPC |
| 3 | 62 | Cabeza | VMS | 0 | GEMOX | X | X | DPC |
| 4 | 45 | Cabeza | AMS | 97 | GEMOX | X | DPC | |
| 5 | 57 | Cuello-cuerpo | TC | 2.142 | GEMOX | X | PCC+TC | |
| 6 | 67 | Cabeza | AMS+VMS | 4.302 | GEMERLOXA | X | ||
| 7 | 64 | Cabeza | AMS | 2.721 | GEMERLOXA | X | X | DPC |
| 8 | 68 | Cabeza | VMS | 996,4 | GEMERLOXA | |||
| 9 | 70 | Cabeza | AMS | 55,4 | GEMERLOXA | X | X | |
| 10 | 71 | Cuello-cuerpo | TC | 6.332 | GEMOX | X | ||
| 11 | 58 | Cabeza | AMS+AH | 494,9 | GEMERLOXA | X | ||
| 12 | 67 | Cabeza | AMS | 159 | GEMERLOXA | X | DPC | |
| 13 | 60 | Cabeza | VMS | 555 | GEMOX | X | DPC | |
| 14 | 53 | Cabeza | AMS | 33 | GEMOX | X | ||
| 15 | 42 | Cabeza | TC+VMS | 1 | GEMOX | X | X | |
| 16 | 41 | Cuello-cuerpo | AH+TC | 1 | GEMOX | X | X | DPT+TC |
| 17 | 63 | Cabeza | AMS | 183 | GEMOX | X | X | |
| 18 | 76 | Cabeza | AMS+AH+VMS | 208 | GEMOX | |||
| 19 | 76 | Cabeza | AMS+VMS | 3,5 | GEM | |||
| 20 | 61 | Cabeza | AMS+VMS | 117 | GEMOX | X | X | DPC |
| 21 | 78 | Cabeza | AMS | 56 | GEMOX | X | DPC | |
| 22 | 72 | Cabeza | AH+VMS | 471 | GEMOX | X |
AH: arteria hepática; AMS: arteria mesentérica superior; CA19-9PRE: CA19.9 antígeno carbohidratado 19.9 previo al inicio del tratamiento médico; DPC: duodenopancreatectomía cefálica; DPT: duodenopancreatectomía total con esplenectomía; GEM: gemcitabina: GEMERLOXA: gemcitabina oxaliplatino erlotinib; GEMOX: gemcitabina oxaliplatino; PCC: pancreatectomía corporocaudal con esplenectomía; QT: quimioterapia; RDT: radioterapia; TC: tronco celíaco; VMS: vena mesentérica superior.
Fuente: Hospital Universitari de Bellvitge (2010-2014).
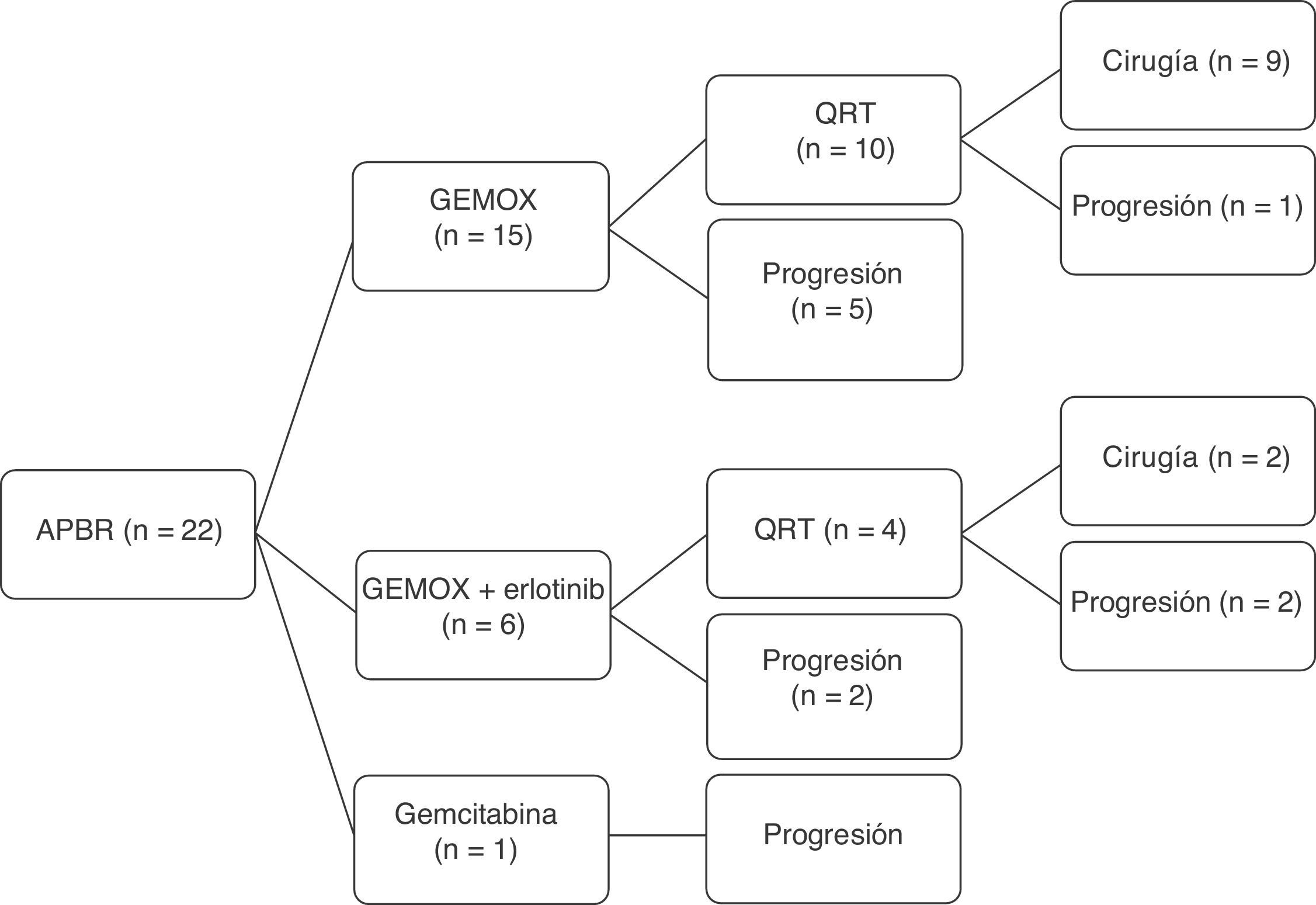
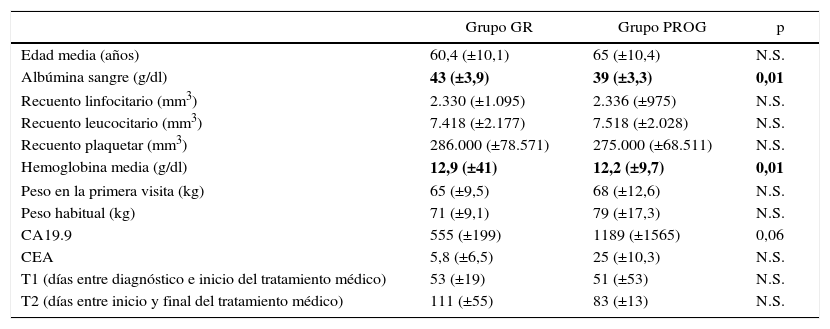
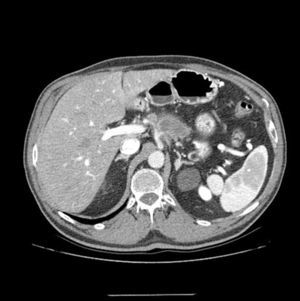
Un total de 22 pacientes fueron incluidos para tratamiento neoadyuvante, basado en QT de inducción durante 3 meses. Quince pacientes recibieron el esquema GEMOX por 6 ciclos, 6pacientes participaron en ensayo clínico (esquema GEMOX+erlotinib [100mg/día]) por 6 ciclos y un paciente recibió gemcitabina en monoterapia por 3 ciclos (fig. 2). En cuanto al perfil de toxicidad, 5 pacientes presentaron toxicidad hematológica grado 3 o 4 (neutropenia y trombocitopenia) y un paciente síndrome emético de grado 3. Las toxicidades de grado 1-2 más frecuentes fueron astenia y neurotoxicidad (tabla 2). Un total de 8 pacientes no recibieron tratamiento con QRT, debido a progresión de la enfermedad. Al finalizar el tratamiento neoadyuvante, 11 pacientes no presentaron evidencia de progresión tumoral y fueron intervenidos para realizar resección quirúrgica (grupo GR), y en 11 se evidenció progresión de la enfermedad (grupo PROG). La mediana de tiempo transcurrido entre diagnóstico e inicio del tratamiento (T1) fue de 58 días (rango: 40-66), el tiempo desde el inicio del tratamiento hasta el final (T2) fue de 83 días (rango: 45-204) y el tiempo desde final del tratamiento hasta la cirugía (en el grupo GR, T3) fue de 141 días (rango: 63-250). Al realizar el estudio comparativo entre los 2grupos, evidenciamos que el grupo PROG presentaba una cifra de CA19.9 previa al inicio del tratamiento neoadyuvante superior al grupo GR, sin llegar a la significación estadística (p=0,06, tabla 3).
Flujo de pacientes en protocolo de tratamiento neoadyuvante. Adenocarcinoma de páncreas borderline resectable.
APBR: adenocarcinoma de páncreas borderline resectable; GEMOX: gemcitabina oxaliplatino; QRT: quimiorradioterapia.
Fuente: Hospital Universitari de Bellvitge (2010-2014).
Perfil de toxicidad tras quimioterapia de inducción. Neoadyuvancia por adenocarcinoma de páncreas borderline resectable
| G1-G2 n (%) | G3-G4 n (%) | |
|---|---|---|
| Toxicidad hematológica | ||
| Neutropenia | 1 (4,5) | 1 (4,5) |
| Anemia | 3 (13,6) | – |
| Trombocitopenia | 5 (22,7) | 4 (18,2) |
| Toxicidad no hematológica | ||
| Astenia | 17 (77,2) | – |
| Diarrea | 4 (18,2) | – |
| Nauseas o vómitos | 7 (31,8) | 1 (4,5) |
| Alteración perfil hepático (elevación de transaminasas en sangre) | 3 (13,6) | – |
| Neurotoxicidad | 19 (86,3) | – |
Fuente: Hospital Universitari de Bellvitge (2010-2014).
Análisis comparativo entre el grupo GR (grupo resección) y grupo PROG (grupo progresión). Neoadyuvancia por adenocarcinoma de páncreas borderline resectable
| Grupo GR | Grupo PROG | p | |
|---|---|---|---|
| Edad media (años) | 60,4 (±10,1) | 65 (±10,4) | N.S. |
| Albúmina sangre (g/dl) | 43 (±3,9) | 39 (±3,3) | 0,01 |
| Recuento linfocitario (mm3) | 2.330 (±1.095) | 2.336 (±975) | N.S. |
| Recuento leucocitario (mm3) | 7.418 (±2.177) | 7.518 (±2.028) | N.S. |
| Recuento plaquetar (mm3) | 286.000 (±78.571) | 275.000 (±68.511) | N.S. |
| Hemoglobina media (g/dl) | 12,9 (±41) | 12,2 (±9,7) | 0,01 |
| Peso en la primera visita (kg) | 65 (±9,5) | 68 (±12,6) | N.S. |
| Peso habitual (kg) | 71 (±9,1) | 79 (±17,3) | N.S. |
| CA19.9 | 555 (±199) | 1189 (±1565) | 0,06 |
| CEA | 5,8 (±6,5) | 25 (±10,3) | N.S. |
| T1 (días entre diagnóstico e inicio del tratamiento médico) | 53 (±19) | 51 (±53) | N.S. |
| T2 (días entre inicio y final del tratamiento médico) | 111 (±55) | 83 (±13) | N.S. |
CA19.9: antígeno carbohidratado 19.9 previo al inicio del tratamiento médico; CEA: antígeno carcinoembrionario previo al inicio del tratamiento médico; Grupo IQ: intervención quirúrgica; Grupo PROG: progresión; N.S.: no significativo.
En negrita, resultados estadísticamente significativos.
Fuente: Hospital Universitari de Bellvitge (2010-2014).
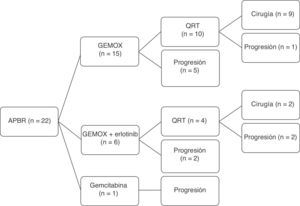
Entre los 11 pacientes intervenidos mediante resección quirúrgica, 6 presentaban contacto del tumor con la AMS, en 2 englobaba la TC, en 2 producía obliteración de VP-VMS y tenía contacto con la arteria hepática en uno. En 9 casos, se trataba de lesiones de cabeza pancreática: realizamos 9 DPC, 5 de ellas con resección venosa y anastomosis vascular terminoterminal (fig. 3). Registramos 2casos con lesiones de cuello-cuerpo pancreático. En un caso se realizó pancreatectomía corporocaudal con esplenectomía con resección venosa y del TC (intervención de Appleby)12. Dado que la lesión englobaba el TC, se realizó arteriografía y embolización preoperatoria de la AH común con la intención de aumentar el flujo sanguíneo hepático a través de la arteria gastroduodenal5. Por último, tratamos a una paciente con doble lesión neoplásica de cabeza y cuello-cuerpo pancreáticos, a la que se realizó una doble embolización preoperatoria. Inicialmente se embolizó la arteria gástrica derecha, arteria esplénica y arteria gástrica izquierda; y en un segundo tiempo se embolizó la arteria gastroepiploica, dejando la irrigación gástrica dependiente de las arterias frénicas con el fin de preservar el muñón gástrico bien irrigado. Finalmente, se realizó una duodenopancreatectomía total con gastrectomía 4/5, esplenectomía y resección de la TC y anastomosis arterial término-terminal (figs. 4-5).
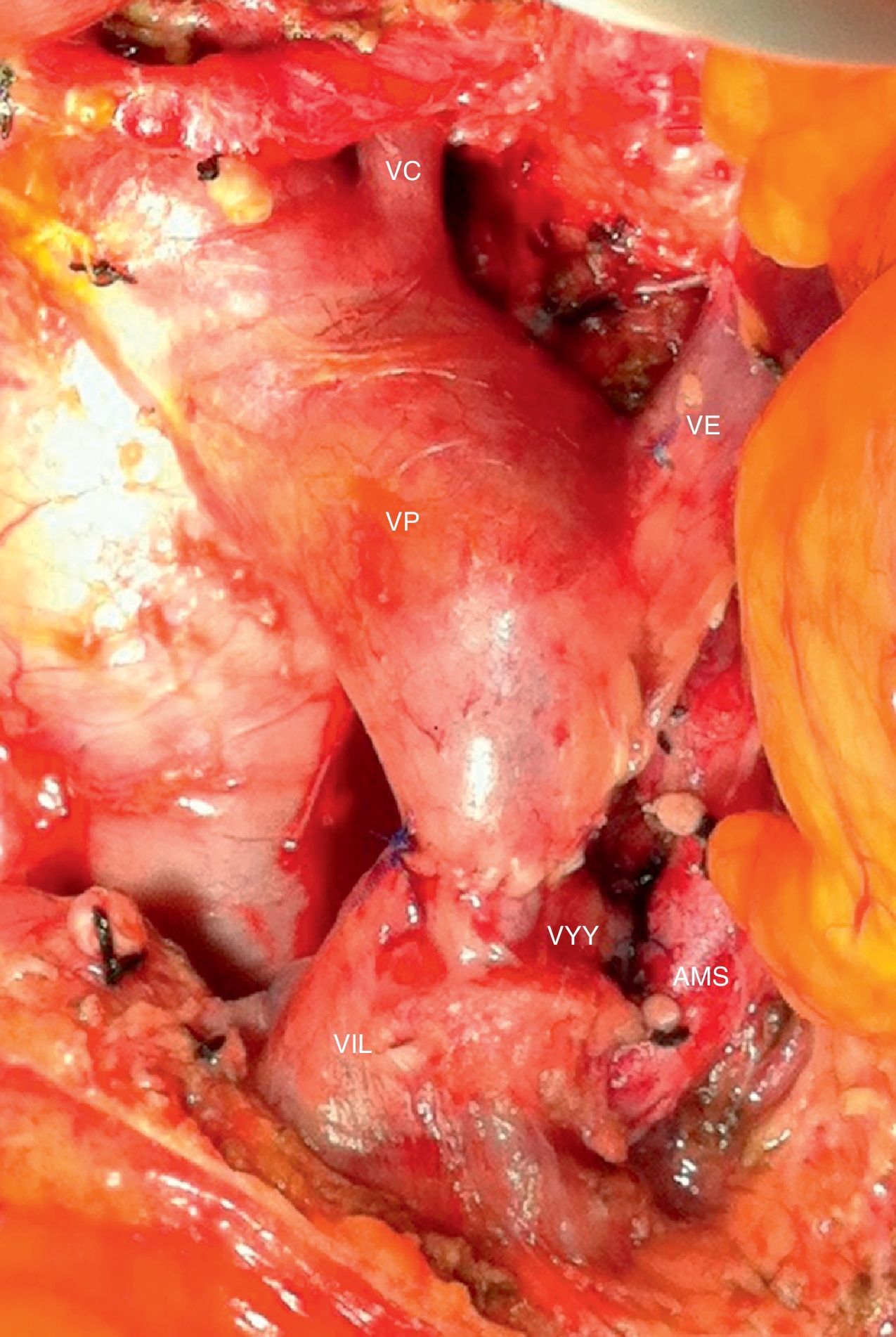
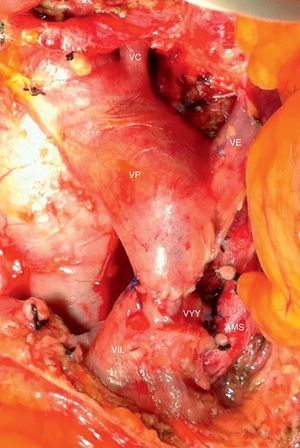
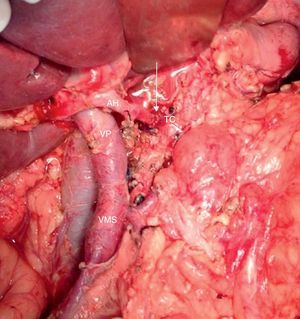
Imagen intraoperatoria tras la resección de adenocarcinoma de páncreas borderline resectable con obliteración de la vena mesentérica superior y VP. En la imagen se aprecia la anastomosis venosa terminoterminal entre la VMS y la confluencia de la vena ileocólica y la VYY.
AMS: arteria mesentérica superior; VC: vena coronaria; VE: vena esplénica; VP: vena porta; VYY: vena yeyunal.
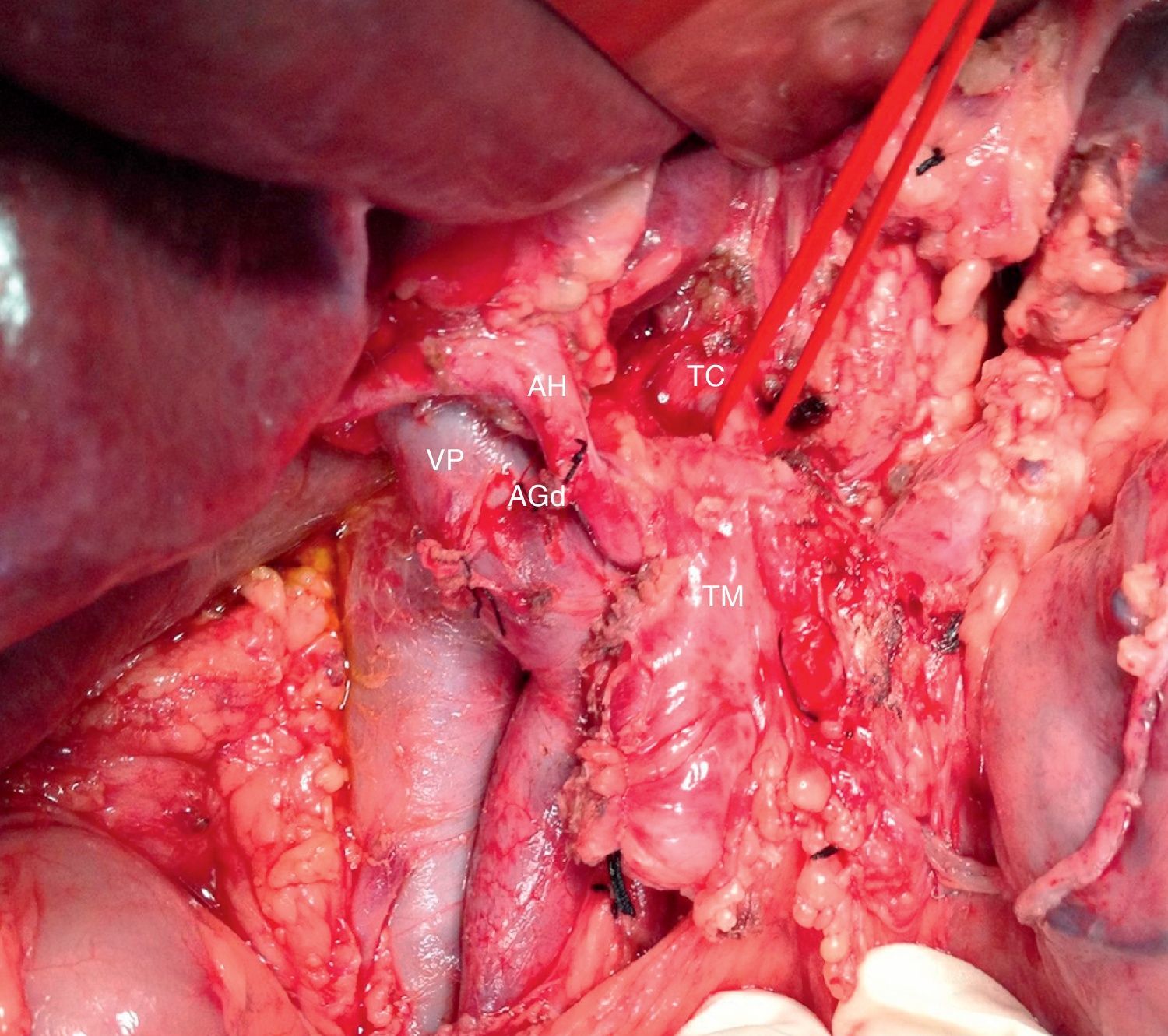
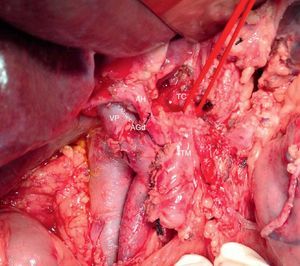
Imagen intraoperatoria (paciente comentado en fig. 1) tras la resección de la cabeza pancreática por neoplasia periampular y previamente a la resección del páncreas distal. Se evidencia adenocarcinoma de páncreas borderline resectable con afectación de AHC, arteria esplénica y TC.
AGDd: arteria gastroduodenal; AH: arteria hepática; AHC: arteria hepática común; TC: tronco celíaco; TM: tumor del cuerpo pancreático; VP: vena porta.
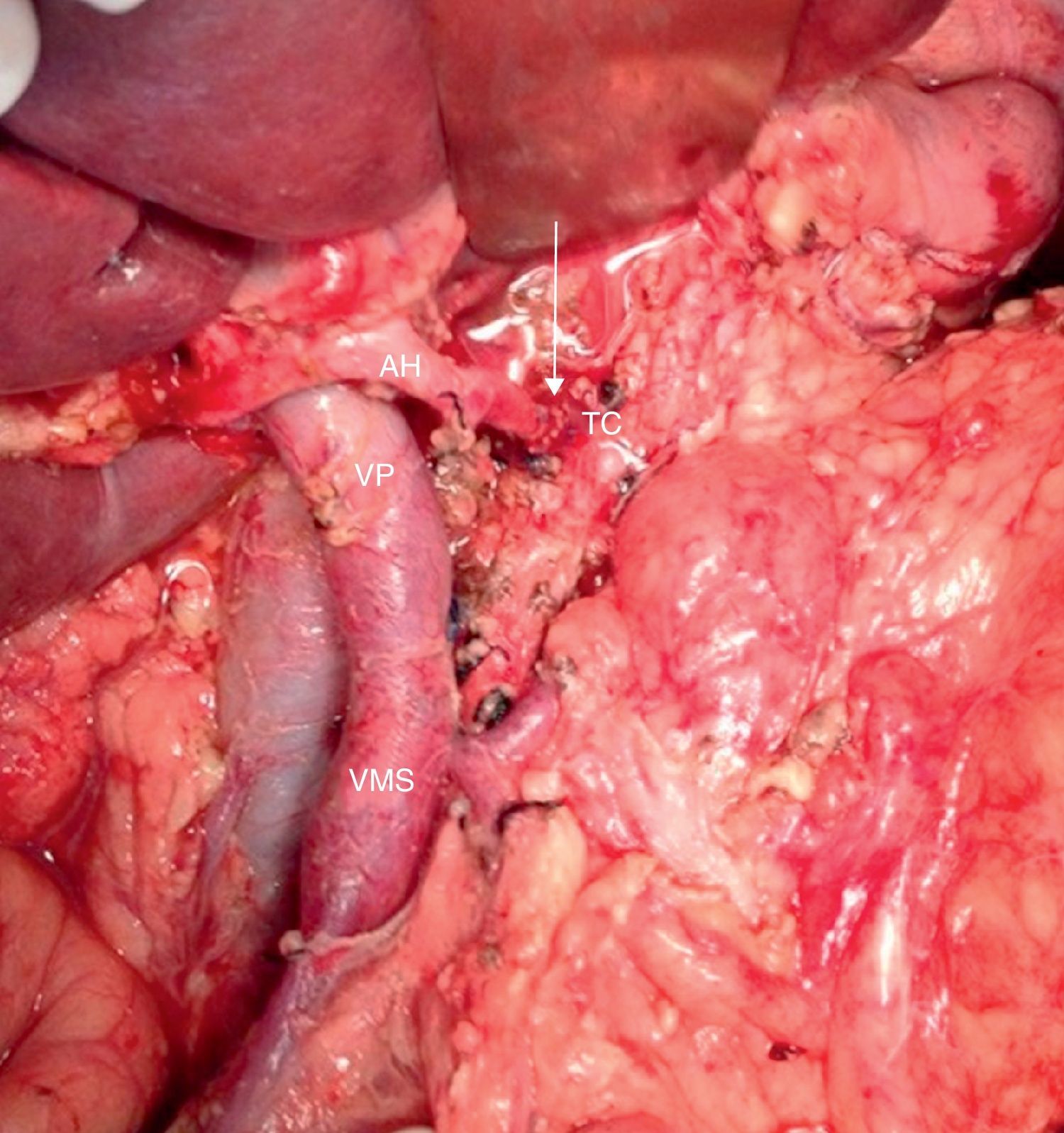
Imagen intraoperatoria (paciente comentado en figs. 1-3) tras embolización arterial en 2tiempos y ulterior duodenopancreatectomía total, gastrectomía 4/5, esplenectomía, resección del TC y anastomosis arterial terminoterminal. En la fotografía se aprecia la anastomosis arterial entre TC y la AH común marcada con una flecha.
AH: arteria hepática; TC: tronco celíaco; VMS: vena mesentérica superior; VP: vena porta.
El tiempo operatorio medio fue de 488 min (360-650) y fue necesaria la transfusión de hemoderivados en 4 casos (36%). La morbilidad postoperatoria se registró en 7 pacientes (63%). Al analizar todas las complicaciones, objetivamos 2 casos de vaciamiento gástrico lento (tipo A), 2 de fístula pancreática (tipo A y B), 2 de absceso hepático, 2 de fístula gastrointestinal, un caso de hemorragia digestiva alta, un hemoperitoneo por lesión arterial tardía, una isquemia gástrica, un distrés respiratorio, una infección de herida, una bacteriemia y una ascitis. Se tuvo que reintervenir a 4 pacientes: en 2 de ellos para conseguir hemostasia, un caso con lesión arterial tardía (aparecida el 12.° día postoperatorio) y un caso con hemorragia de la sutura gastroentérica. Un paciente fue reintervenido por isquemia gástrica, al que se le practicó gastrectomía total, y a otro paciente se le reintervino por distrés respiratorio y ascitis, con sospecha de isquemia gástrica, sin hallazgos patológicos en la reintervención. La estancia hospitalaria postoperatoria mediana fue de 17 días (rango: 7-75), con una mortalidad postoperatoria nula (tabla 4).
Afectación vascular y esquema terapéutico de los pacientes tratados mediante neoadyuvancia por adenocarcinoma de páncreas borderline resectable
| Paciente | QT | Respuesta | Técnica quirúrgica | Resección vascular | Morbilidad | Morbilidad Clavien | Margen | GRT | ypT | ypN | Recidiva | SLE | THP | OS |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | GEMOX | RP | DPC | VP-VMS | Hemoperitoneo, pseudoaneurisma de AH | IVA | R0 | 3 | ypT3 | ypN1 | No | 15 | ||
| 2 | GEMOX | EE | DPC | – | VGL | I | R0 | 0 | ypT0 | ypN0 | Locorregional | 10 | 40 | |
| 3 | GEMOX | RP | DPC | VMS | No | – | R1 | 3 | ypT3 | ypN0 | A distancia | 7 | 21 | |
| 4 | GEMOX | EE | DPC | – | HDA, fístula intestinal, absceso hepático | IVA | R0 | 2 | ypT3 | ypN0 | No | 13 | ||
| 5 | GEMOX | EE | PCC+TC | VP+TC | Necrosis gástrica, absceso hepático | IVA | R0 | 2 | ypT3 | ypN0 | No | 31 | ||
| 6 | GEMERLOXA | PD | A distancia | 2 | 10 | |||||||||
| 7 | GEMEROLOXA | RP | DPC | VP | No | – | R1 | 2 | ypT3 | ypN0 | A distancia | 7 | 34 | |
| 8 | GEMERLOXA | EE | Locorregional | 6 | 10 | |||||||||
| 9 | GEMERLOXA | EE | Locorregional | 8 | 14 | |||||||||
| 10 | GEMOX | PD | A distancia | 3 | 9 | |||||||||
| 11 | GEMERLOXA | PD | Locorregional | 2 | 8 | |||||||||
| 12 | GEMERLOXA | EE | DPC | – | No | – | R0 | 1 | ypT0 | ypN0 | A distancia | 13 | 25 | |
| 13 | GEMOX | RP | DPC | VMS | Ascitis | II | R1 | 3 | ypT1 | ypN0 | Locorregional | 19 | 31 | |
| 14 | GEMOX | PD | Locorregional | 3 | 20 | |||||||||
| 15 | GEMOX | EE | A distancia | 5 | 17 | |||||||||
| 16 | GEMOX | RP | DPT+TC | AH+TC | Distrés respiratorio | IVA | R0 | 1 | ypT0 | ypN0 | A distancia | 9 | 31 | |
| 17 | GEMOX | RP | A distancia | 6 | 11 | |||||||||
| 18 | GEMOX | EE | A distancia | 9 | 11 | |||||||||
| 19 | GEM | PD | A distancia | 2 | 3 | |||||||||
| 20 | GEMOX | PD | DPC | VP-VMS | No | – | R1 | 2 | ypT3 | ypN0 | Locorregional | 6 | 26 | |
| 21 | GEMOX | EE | DPC | – | Fístula pancreática | I | R0 | 2 | ypT3 | ypN0 | A distancia | 3 | 14 | |
| 22 | GEMOX | EE | A distancia | 6 | 12 |
AH: arteria hepática; DPC: duodenopancreatectomía cefálica; DPT: duodenopancreatectomía total con esplenectomía; EE: enfermedad estable; GEM: gemcitabina; GEMERLOXA: gemcitabina oxaliplatino erlotinib; GEMOX: gemcitabina oxaliplatino; GRT grado de regresión tumoral; Morbilidad Clavien: de acuerdo con los criterios de Clasificación Clavien-Dindo (Dindo: Ann Surg 2004); OS: tiempo de supervivencia (tiempo desde inicio de quimioterapia hasta la muerte: meses); PCC: pancreatectomía corporocaudal con esplenectomía; PD: progresión de la enfermedad; QT: esquema de quimioterapia; RP: respuesta parcial; SLE: supervivencia libre de enfermedad (tiempo desde cirugía hasta recidiva: meses); TC: tronco celíaco; THP: tiempo hasta progresión (tiempo desde inicio de quimioterapia hasta progresión: meses); VMS: vena mesentérica superior; VP: vena porta.
Fuente: Hospital Universitari de Bellvitge (2010-2014).
El estudio histológico de la pieza de resección evidenció un GRT de 0 en un caso, y de 1 en 2 casos; asimismo, fue clasificado como ypT1 en un caso y como ypT3 en 7. Por último, 10 pacientes no presentaban afectación adenopática. El estudio de los márgenes quirúrgicos evidenció que en 4 casos había afectación microscópica (R1), mientras que en 7 casos (63%) no había tumor (R0) (tabla 4).
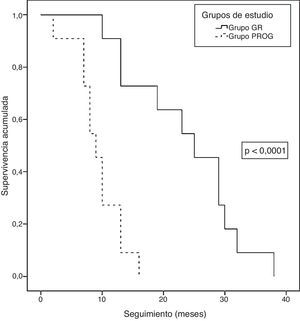
Seguimiento a largo plazoAl cierre del estudio, habían fallecido todos los pacientes (22 pacientes), con una supervivencia actuarial mediana de 13 meses (rango: 9,6-16,3). La supervivencia actuarial mediana del grupo GR fue estadísticamente superior a la del grupo PROG (25 [16,9-33] vs. 9 [7-10,9] meses; p<0,0001) (fig. 6). La mediana del tiempo libre de enfermedad fue de 8 meses (rango: 3-19) y la mediana del tiempo hasta progresión fue de 5 meses (rango: 2-8). En cuanto a la progresión o recidiva de la enfermedad, todos los pacientes del grupo PROG presentaban progresión y 8 de los pacientes del grupo GR presentaron recidiva. La progresión o recidiva de la enfermedad se diagnosticó localmente en 7 y a distancia en 12. Entre los pacientes que progresaron o recidivaron, 13 recibieron QT: 6 basada en fluoropirimidinas, 4 en gemcitabina y 3 recibieron nuevos tratamientos basados en ensayos clínicos.
Análisis de supervivencia actuarial tras el tratamiento neoadyuvante y posterior resección por adenocarcinoma de páncreas borderline resectable del Hospital Universitari de Bellvitge (2010-2014). Comparación de las curvas de supervivencia actuarial (curvas de Kaplan-Meier) de los grupos de estudio: grupo GR (grupo resección, 11 pacientes) y grupo PROG (grupo progresión, 11 pacientes), mediante el test de log-rank (p<0,0001).
El tratamiento adyuvante es el manejo estándar tras la cirugía por cáncer de páncreas. Sin embargo, este abordaje comporta algunos inconvenientes. En primer lugar, la elevada morbilidad de la cirugía pancreática implica que aproximadamente solo un 60% de los pacientes resecados recibirán tratamiento adyuvante tras la intervención13. En segundo lugar, la elevada tasa de recidiva durante el primer año postoperatorio haría sospechar que la selección de pacientes para la cirugía se debería mejorar. Por último, la resección quirúrgica con frecuencia se lleva a cabo con márgenes microscópicos afectos (R1)14, lo que justificaría algún tipo de tratamiento preoperatorio para disminuir dicho porcentaje y así mejorar la supervivencia. En contrapartida, el tratamiento neoadyuvante puede tratar a casi todos los pacientes estadificados desde el inicio y seleccionar a los pacientes con peor biología tumoral; además, podría mejorar la tasa de cirugía con margen microscópico libre (R0). Algunos grupos a nivel mundial han defendido su uso desde hace años, como el MD Anderson de Texas (Estados Unidos)15. Ahora bien, la neoadyuvancia también puede comportar problemas, como la morbilidad relacionada con el drenaje biliar, el retraso en la cirugía o la progresión durante el tratamiento. En los años 90, algunos estudios ya señalaban que la QRT neoadyuvante podría mejorar la resecabilidad y disminuir la recidiva tras la cirugía16,17. En 2001, Mehta18 publicó la primera serie con 15 pacientes con resecabilidad «marginal» en el estudio con TC preoperatorio, con una supervivencia mediana de 30 meses en los 9 pacientes resecados. Casi 10años después, en 2010, Landry19 publicó el primer estudio multicéntrico aleatorizado, de fase II, que comparaba diferentes regímenes de tratamiento en APBR basados en 2regímenes con gemcitabina. A pesar de ser un prometedor estudio, este debió clausurarse de forma temprana por la baja incorporación de pacientes. Finalmente, se incluyó a 23 pacientes, 5 de los cuales resecaron, con una supervivencia mediana de 26 meses, lo que evidenció una correcta tolerancia a los regímenes de tratamiento. En un reciente metaanálisis que incluye a 959 pacientes con APBR11, se evidencia que la resección tras neoayuvancia, en este escenario, es factible y que se puede llevar a cabo hasta en un 63% de ellos, con un porcentaje de resecciones sin afectación de los márgenes (R0) del 57,4%. Los esquemas terapéuticos utilizados por la mayoría de los grupos se basan en gemcitabina, sola o en asociación con otro quimioterápico y administrando radioterapia (50,4Gy). Recientemente, se han descrito buenos resultados con la combinación FOLFIRINOX, aunque parece que comporta una mayor morbilidad. El estudio metaanalítico ha evidenciado una supervivencia mediana de 17,9 meses (rango: 14-21): de 25,9 meses (rango: 21,1-30,7) para los pacientes resecados y de 11,9 (rango: 10,4-13,5) para los pacientes no resecados, resultados similares a los hallados por nuestro grupo. Así pues, parece que, con el tratamiento preoperatorio, algunos pacientes con enfermedad avanzada podrían ser seleccionados para su resección y se podría conseguir en ellos una supervivencia similar a la demostrada con los casos resecables13.
La afectación venosa en el cáncer de páncreas y el concepto borderline resectableEn los años 60 y 70 se publicaron las primeras experiencias sobre duodenopancreatectomía cefálica con resección vascular20,21. Ahora bien, fue en 1992 cuando Ishikawa22 sentó las bases de la resección venosa en el cáncer de páncreas. Su trabajo demostró que la afectación venosa parcial era tributaria de resección quirúrgica, pero la estenosis y la obliteración venosa la contraindicaría, al no mejorar la supervivencia. Desde entonces, la mayoría de los grupos realizó la resección pancreática con afectación vascular, con supervivencias similares entre pacientes con y sin resección de vena23,24, aunque algunos autores demostraron peor supervivencia entre los pacientes con resección venosa25. En el año 2006, el grupo de Texas publicó un artículo en el que definían nuevos criterios de resecabilidad según la afectación vascular3. Para ellos, la obliteración venosa (con posibilidad de reconstrucción tras neoadyuvancia), la afectación puntual de la AH (con posibilidad de reconstrucción tras neoadyuvancia) y la afectación de la arteria mesentérica superior (menor a 180°) se incluían en una categoría llamada borderline resectable3,4,26,27. Tras la aparición del trabajo del grupo de Texas, el National Comprehensive Cancer Network (NCCN)28 publicó una guía sobre el manejo de estos pacientes y el concepto APBR. Finalmente, en 2009 un consenso internacional de la American Hepatopancreatobiliary Association (AHPBA) de la Society for Surgery of the Alimentary Tract (SSAT) y de la Society of Surgical Oncology (SSO) redefinió el concepto APBR29. Por último, en 2014, el grupo de MD Anderson30 y la Sociedad Americana de Radiología y la Asociación Americana de Pancreatología31 revisaron el concepto APBR teniendo en cuenta el contacto del tumor con la VMS o la AMS (mayor o menor a 180°). Tal y como hemos comentado, en nuestra serie seguimos los criterios publicados por grupo de MD Anderson en 2006, descartando para neoadyuvancia la afectación parcial de la VMS o de la vena porta, al considerarla como resecable. En nuestro estudio fueron incluidas también lesiones de cuerpo pancreático que envolvían al TC. Al analizar la supervivencia a largo plazo, evidenciamos que los pacientes resecados presentaron una supervivencia más larga frente a los no operados (25 vs. 9 meses). Así, la supervivencia de los 11 pacientes resecados por tumor borderline resectable parece comparable a la registrada en pacientes con tumores resecables13. Probablemente, la exhaustiva selección de pacientes tras la neoadyuvancia y el efecto propio del tratamiento preoperatorio explicarían estos resultados.
Morbilidad tras la cirugía posneoadyuvanciaLa morbilidad tras el tratamiento quirúrgico con radioterapia y QT neoadyuvante ya ha sido publicada32. En nuestra experiencia, hasta un 63% de los pacientes intervenidos tuvieron alguna complicación, con una elevada tasa de reintervenciones. Sin embargo, no hemos registrado mortalidad postoperatoria, a pesar de la agresividad de la cirugía llevada a cabo, como lo demuestra que 7/11 pacientes requirieron algún tipo de resección vascular. Entre las complicaciones registradas, la lesión arterial tardía y la isquemia gástrica (en los casos de resección del TC) son las más graves. La combinación del tratamiento preoperatorio, una linfadenectomía con disección arterial agresiva y el efecto de la probable fístula pancreática podrían ser los causantes de las lesiones arteriales32,33. Por otra parte, la resección del TC junto a la resección pancreática o técnica de Appleby12 puede implicar mayor morbilidad, como isquemia gástrica o hepática. Por ello, la embolización preoperatoria es útil para la preparación de los pacientes, ya que disminuye la tasa de isquemia gástrica postoperatoria5,34, de forma similar a la utilizada en el precondicionamiento gástrico previo a la cirugía esofagogástrica35.
En conclusión, el tratamiento neoadyuvante del APBR permite seleccionar un grupo de pacientes en el que la resección consigue una supervivencia significativamente superior al grupo en el que se observa progresión durante la neoadyuvancia. La resección quirúrgica en el cáncer de páncreas borderline resectable implica una elevada tasa de resección vascular y una elevada morbilidad, por lo que debe realizarse en centros de referencia de esta entidad.
Autoría/colaboracionesJ. Busquets: redacción del artículo, revisión crítica y aprobación de la versión final. Coordinación del estudio.
J. Fabregat: redacción del artículo, revisión crítica y aprobación de la versión final.
H. Verdaguer: redacción del artículo, revisión crítica y aprobación de la versión final.
B. Laquente: redacción del artículo, revisión crítica y aprobación de la versión final.
N. Peláez: adquisición y recogida de datos.
Ll. Secanella: adquisición y recogida de datos.
D. Leiva: adquisición y recogida de datos.
T. Serrano: Análisis e interpretación de los resultados.
M. Cambray: análisis e interpretación de los resultados.
R. López-Urdiales: análisis e interpretación de los resultados.
E. Ramos: análisis e interpretación de los resultados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.