La cirugía conservadora de mama tras la quimioterapia neoadyuvante pretende resecar cualquier tumor residual con unos márgenes negativos. El objetivo de este estudio fue analizar los factores clínico-patológicos preoperatorios que influyen sobre el estado de los márgenes de resección tras la cirugía conservadora en pacientes con cáncer de mama tratadas con quimioterapia neoadyuvante.
MétodosEstudio retrospectivo de 91 pacientes con cáncer de mama (92 tumores) tratadas con quimioterapia neoadyuvante durante el periodo 2006-2013. Se realizó un análisis de regresión de Cox para identificar las características basales del tumor asociadas con la afectación de los márgenes de resección tras cirugía conservadora de la mama.
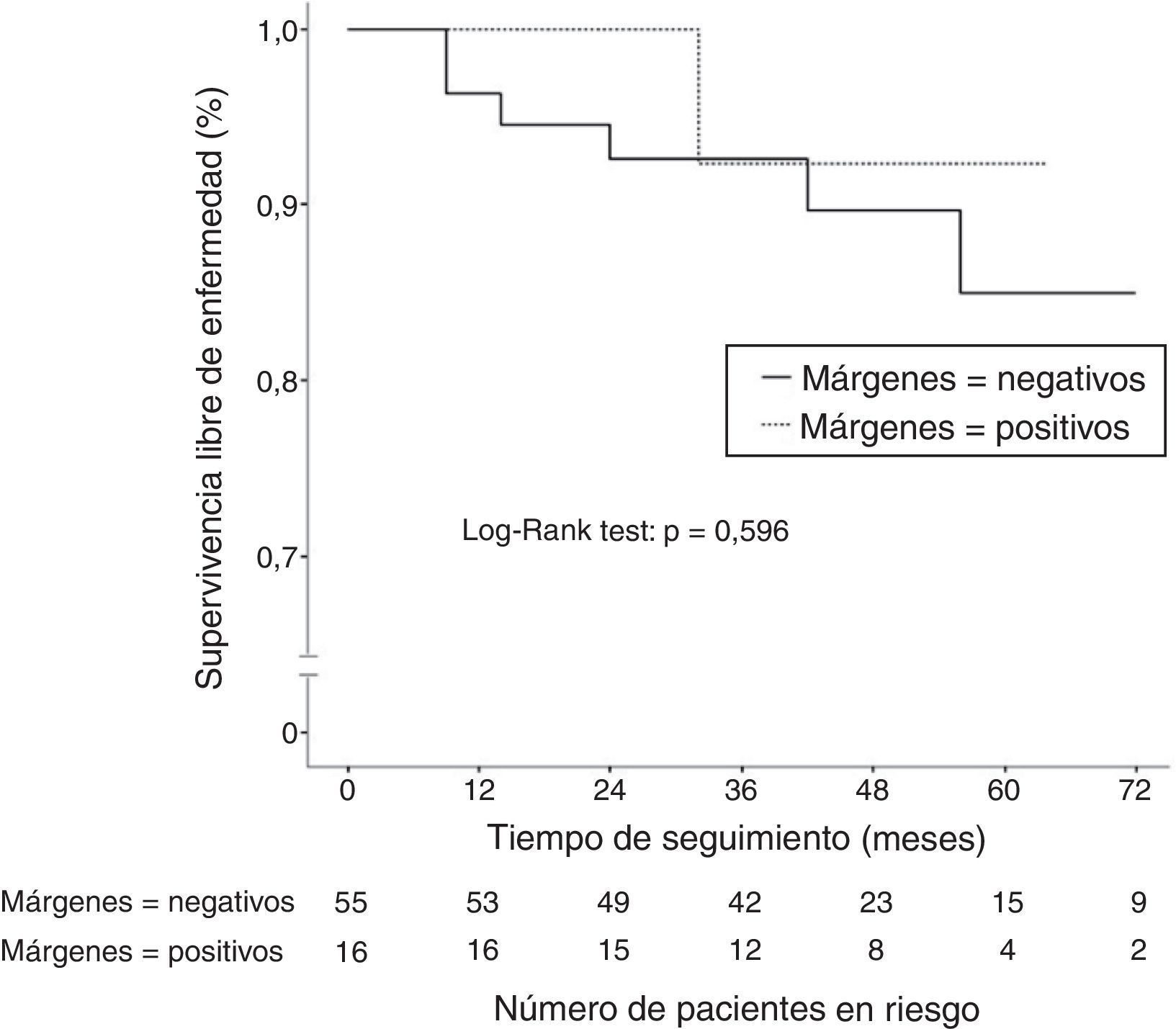
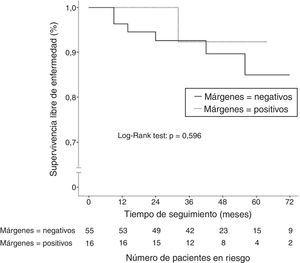
ResultadosDel total de casos del estudio, 71 tumores se trataron inicialmente mediante cirugía conservadora tras la quimioterapia neoadyuvante. El examen patológico reveló afectación de márgenes en 16 de los 71 casos (22,5%). Se observó una mayor incidencia de márgenes positivos en los tumores con un tamaño inicial superior a 5cm (p=0,021), en los tumores de bajo grado histológico (p=0,031) y en los tumores con estatus positivo de los receptores hormonales (p=0,006). Tras un seguimiento medio de 45,2 meses, 7 de las 71 pacientes tratadas con cirugía conservadora presentaron recidiva de la enfermedad (9,8%). No se observaron diferencias estadísticamente significativas en la supervivencia libre de enfermedad según el estado de los márgenes quirúrgicos (p=0,596).
ConclusionesUn tamaño tumoral basal superior a 5cm, el bajo grado tumoral y el estatus positivo de los receptores hormonales incrementan el riesgo para la afectación de los márgenes quirúrgicos en la cirugía conservadora de mama tras quimioterapia neoadyuvante.
Breast conservative surgery after neoadjuvant chemotherapy intends to remove any residual tumor with negative margins. The purpose of this study was to analyze the preoperative clinical-pathological factors influencing the margin status after conservative surgery in breast cancer patients receiving neoadjuvant chemotherapy.
MethodsA retrospective study of 91 breast cancer patients undergoing neoadjuvant chemotherapy (92 breast lesions) during the period 2006 to 2013. A Cox regression analysis to identify baseline tumor characteristics associated with positive margins after breast conservative surgery was performed.
ResultsOf all cases, 71 tumors were initially treated with conservative surgery after neoadjuvant chemotherapy. Pathologic exam revealed positive margins in 16 of the 71 cases (22.5%). The incidence of positive margins was significantly higher in cancers with initial size >5cm (P=.021), in cancers with low tumor grade (P=.031), and in patients with hormone receptor-positive cancer (P=.006). After a median follow-up of 45.2 months, 7 patients of the 71 treated with conservative surgery had disease recurrence (9.8%). There was no significant difference in terms of disease-free survival according to the margin status (P=.596).
ConclusionsA baseline tumor size >5cm, low tumor grade and hormone receptor-positive status increase the risk for surgical margin involvement in breast conservative surgery after neoadjuvant chemotherapy.
La cirugía conservadora con márgenes libres de enfermedad en el cáncer de mama resulta equivalente a la mastectomía en términos de control local y supervivencia1, y presenta la ventaja de un mejor resultado psicosocial2.
La quimioterapia neoadyuvante (QTN) permite aumentar las cifras de cirugía conservadora mamaria sin un incremento significativo en los porcentajes de recurrencia local3–5. Además, una respuesta patológica completa al tratamiento mejora el pronóstico de las pacientes6.
El estado de los márgenes de resección tras la cirugía conservadora es uno de los factores predictivos más importantes del riesgo de recurrencia locorregional en el cáncer de mama7,8. Determinadas características tumorales pueden aumentar el riesgo de reintervención como consecuencia de la afectación de los márgenes quirúrgicos.
El objetivo del estudio ha sido identificar factores clínico-patológicos preoperatorios de riesgo para la afectación de los márgenes quirúrgicos tras cirugía conservadora en pacientes con cáncer de mama tratadas con QTN.
MétodosPoblación del estudioEntre octubre de 2006 y junio de 2013, 91 pacientes consecutivas con diagnóstico histopatológico de carcinoma infiltrante de mama fueron tratadas con QTN en un único centro. El diagnóstico inicial se realizó mediante estudio mamográfico y ecográfico, y la confirmación histopatológica se estableció mediante punción ecoguiada en las lesiones visibles por ecografía, y con esterotaxia en el caso de microcalcificaciones.
Los criterios para el tratamiento neoadyuvante fueron: presentación clínica en estadio IIB-III, índice entre tamaño tumoral y mamario desfavorable o perfil molecular con alta probabilidad de respuesta patológica completa. Se excluyó del estudio a las pacientes con metástasis a distancia en el momento del diagnóstico. Se realizó una revisión retrospectiva de los datos clínicos y patológicos de la serie. El estudio fue aprobado por el Comité de Ética de la Investigación de nuestra Área Sanitaria (N.° 2015/059).
Estudio inmunohistoquímicoConforme al resultado de la biopsia diagnóstica inicial, los tumores se clasificaron en 5 subtipos de acuerdo con las características inmunohistoquímicas: luminal A, luminal B/HER2−, luminal B/HER2+, HER2+ y triple negativo. Los tumores HER2 con puntuación 3+ se consideraron positivos. En caso de que la puntuación fuese 2+ se utilizó la técnica de hibridación fluorescente in situ para determinar la existencia o no de amplificación del gen HER2 y confirmar o no su positividad. Las muestras que no expresaban HER2 o con puntuación 1+ fueron consideradas HER2−. Se fijó el punto de corte del valor ki-67 en el 14%, para determinar si el índice de proliferación celular era alto (≥14%) o bajo (<14%).
Estatus ganglionar axilar previo a la quimioterapia neoadyuvanteEn todas las pacientes se realizó ecografía axilar antes de la QTN. Se realizó una biopsia selectiva de ganglio centinela antes de la QTN para estadificar la axila en las mujeres sin sospecha clínico-radiológica de afectación axilar. En las pacientes con axila sospechosa de afectación ganglionar se realizó una biopsia o punción guiada por ecografía para confirmar la infiltración tumoral, excepto en aquellos casos con afectación ganglionar axilar masiva en el estudio de resonancia magnética (RM).
Protocolo de quimioterapia neoadyuvanteLos protocolos terapéuticos fueron elegidos por el Servicio de Oncología de la Unidad de Patología de Mama. La evaluación inicial de las pacientes incluía una historia clínica completa, examen físico, analítica completa de sangre, radiografía de tórax, tomografía computarizada de tórax y abdomen, y gammagrafía ósea. Se colocó un clip de titanio en el lecho tumoral en todas las pacientes, antes de iniciar la quimioterapia, para poder identificar el área del tumor primario durante la intervención quirúrgica. Se monitorizó la respuesta tumoral mediante RM al inicio y al final del tratamiento sistémico. Todas las pacientes con tumores HER2+ incluían el trastuzumab en su régimen terapéutico preoperatorio.
Cirugía conservadora de la mamaSe indicó una tumorectomía en las pacientes con una proporción favorable entre el volumen tumoral residual y el volumen mamario. En aquellas enfermas en las que se preveía una deformidad severa se indicó un patrón oncoplástico adaptado al tipo de mama y localización tumoral. En lesiones residuales subclínicas se realizó un marcaje radioguiado mediante un arpón en la zona del clip. Se descartó realizar una cirugía conservadora en aquellas pacientes con edema o afectación cutánea, microcalcificaciones difusas, enfermedad residual multicéntrica o contraindicación para el tratamiento con radioterapia. La indicación de cirugía conservadora se consideró correcta cuando los márgenes quirúrgicos estaban libres de enfermedad. Se optó por realizar en un segundo tiempo una ampliación de márgenes o una mastectomía ante la existencia de márgenes positivos.
Evaluación intraoperatoria del tumorEl estudio patológico intraoperatorio de la pieza quirúrgica solo se realizó en aquellas pacientes con persistencia de la lesión tras la QTN y consistió en un análisis macroscópico de la muestra para determinar la distancia del tumor a los bordes de la resección quirúrgica. Se realizó de forma rutinaria una evaluación intraoperatoria radiológica en las muestras marcadas con arpón para identificar el clip, calcificaciones residuales o anormalidades radiológicas.
Análisis histopatológicoLas muestras para el examen histopatológico se prepararon realizando cortes seriados de 5mm en la pieza quirúrgica y fijados en formalina neutral al 10%, intentando identificar cualquier lesión que se correspondiese con el carcinoma invasivo. Si la lesión tumoral era evidente, se incluía en su totalidad para estudio morfológico con hematoxilina-eosina. En ausencia de una lesión tumoral evidente, se identificaba el clip marcador y se incluía para estudio histológico la sección que lo contenía y las secciones del tejido adyacente. Los márgenes se consideraron negativos ante la ausencia microscópica de carcinoma invasivo en el borde quirúrgico.
Análisis estadísticoSe realizó un análisis descriptivo de las variables incluidas en el estudio. Las variables cuantitativas se expresaron como media y desviación típica, y las variables cualitativas se expresaron como valor absoluto y porcentaje con la estimación de su 95% de intervalo de confianza. La asociación de variables cualitativas se estimó mediante el estadístico Chi-cuadrado o test exacto de Fisher, según procediese. La comparación para variables cuantitativas se realizó mediante el test no paramétrico U de Mann-Whitney. Se realizó un análisis bivariante y multivariante mediante modelos de regresión logística de una serie de parámetros clínico-patológicos para predecir la afectación de los márgenes quirúrgicos tras cirugía conservadora. En el análisis multivariante se incluyeron las variables asociadas de forma significativa al estado de los márgenes quirúrgicos tras el análisis bivariado. El tiempo de seguimiento y supervivencia libre de enfermedad (SLE) de cada paciente se determinó mediante la diferencia entre la fecha de la cirugía y la fecha de la recidiva, muerte o fin de estudio. Se realizó un análisis de SLE mediante la estimación de las curvas de Kaplan-Meier y su comparación mediante el test de log-rank.
ResultadosCaracterísticas clínico-patológicas de las pacientesLas características clínico-patológicas basales de las pacientes del estudio se recogen en la tabla 1. Un total de 91 mujeres con cáncer de mama invasivo recibieron QTN y, posteriormente, se indicó la extirpación del tumor primario. Se analizaron 92 tumores, ya que en el estudio se diagnosticó a una paciente con un carcinoma de mama bilateral. La edad media de las pacientes, en el momento del diagnóstico, fue de 47,2 años (rango: 31-75 años). La media del tamaño tumoral basal (TTB), determinado mediante RM, fue de 3,9cm. La mayoría de los tumores fueron T2 (75%) y con grado tumoral 3 (54,4%). Las biopsias revelaron 85 casos de carcinoma ductal (92,4%) y 7 casos de carcinoma lobulillar (7,6%). Los RH fueron negativos en el 32,6% de los casos y no se evidenció sobreexpresión del gen HER2 en el 72,8% de los tumores.
Características clínico-patológicas preoperatorias de las 91 pacientes del estudio (92 tumores)
| Edad (años)a | 47,2 (10,1) | |
| Tamaño tumoral basal (cm)a | 3,9 (1,9) | |
| Estadio clínico del tumor | ||
| T1 | 7 (7,6) | |
| T2 | 69 (75,0) | |
| T3 | 13 (14,1) | |
| T4 | 3 (3,3) | |
| Subtipo histológico | ||
| Ductal | 85 (92,4) | |
| Lobulillar | 7 (7,6) | |
| Grado histológico | ||
| G1 | 9 (10,0) | |
| G2 | 32 (35,6) | |
| G3 | 49 (54,4) | |
| ND | 2 | |
| Expresión de Ki-67 | ||
| <14% | 12 (13,5) | |
| ≥14% | 77 (86,5) | |
| ND | 3 | |
| Receptores hormonales | ||
| Positivo | 60 (65,2) | |
| Negativo | 32 (34,8) | |
| HER2 | ||
| Positivo | 25 (27,2) | |
| Negativo | 67 (72,8) | |
| Fenotipo molecular | ||
| Luminal A | 11 (12,0) | |
| Luminal B/HER2− | 35 (38,0) | |
| Luminal B/HER2+ | 16 (17,4) | |
| HER2+ | 9 (9,8) | |
| Triple negativo | 21 (22,8) | |
| Estatus axilar previo a la QTN | ||
| Positivo | 76 (82,6) | |
| Negativo | 16 (17,4) | |
De los 92 tumores incluidos en el estudio, 76 (82,6%) presentaban enfermedad ganglionar axilar en el momento del diagnóstico. De estos, en 62 casos (81,6%) se obtuvo confirmación histopatológica (46 casos mediante biopsia con aguja gruesa o punción aspiración con aguja fina y 16 casos mediante BSGC realizada antes de la QTN) y en 14 casos (18,4%) la RM reveló afectación ganglionar axilar masiva. En 16 tumores (17,4%) no se evidenció afectación clínico-radiológica axilar en el momento del diagnóstico.
La distribución de las diferentes terapias sistémicas primarias fue la siguiente: 60 pacientes (65,9%) recibieron un régimen que combinaba antraciclina y taxano; 25 pacientes (27,5%) recibieron un régimen que incluía trastuzumab, además de la combinación de antraciclina y taxano; 6 pacientes (6,6%) recibieron un régimen que contenía taxano (nab-paclitaxel). La RM preoperatoria constató una reducción del tamaño tumoral tras la QTN respecto a la RM inicial en el 88% de los casos (81/92). Se observó remisión completa del tumor en 38 casos (41,3%), remisión parcial en 43 casos (46,7%), enfermedad estable en 10 casos (10,9%) y enfermedad progresiva en un único caso (1,1%).
Tras la QTN, se trataron 21 casos (21,8%) mediante mastectomía (una paciente con mastectomía bilateral) y se intentó realizar una cirugía conservadora en 71 casos (77,2%). De este último grupo, 16 pacientes (22,5%) fueron reintervenidas debido a la afectación de los bordes quirúrgicos; fue posible realizar una ampliación conservadora en 13 casos y completar la mastectomía en 3 casos. Los porcentajes finales de conservación mamaria y mastectomía fueron 73,9 y 26,1%, respectivamente. El examen patológico reveló la presencia de tumor residual invasivo en 3 de los 16 casos reoperados (18,7%).
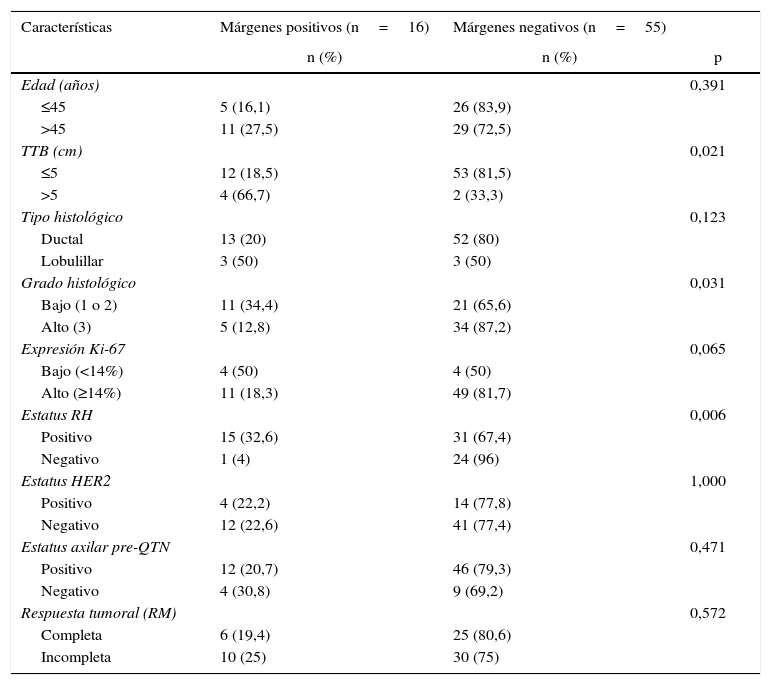
Análisis bivariante y multivariante para predecir el estado de los márgenes quirúrgicosEn la tabla 2 se muestran los resultados de la comparación de las características de las 71 pacientes tratadas inicialmente mediante cirugía conservadora tras QTN respecto al estado de los márgenes quirúrgicos. En el análisis bivariante se observaron diferencias significativas en las variables TTB, grado histológico tumoral y estatus de los RH. Las lesiones con un TTB superior a 5cm tuvieron una mayor incidencia de márgenes positivos respecto a los tumores con un tamaño basal igual o inferior a 5cm (66,7 vs. 18,5%; p=0,021). La incidencia de márgenes positivos también fue mayor en los tumores de bajo grado que en los tumores de alto grado (34,4 vs. 12,8%; p=0,031). Atendiendo al estatus de los RH, se observó afectación de bordes en el 32,6% de los tumores con los RH positivos frente al 4% de los tumores con los RH negativos (p=0,006). No se encontraron diferencias significativas respecto al estado de los márgenes en las variables edad, tipo histológico, ki-67 y estatus del gen HER2.
Comparación de las características de las pacientes del estudio intervenidas inicialmente con cirugía conservadora con el estado de los márgenes quirúrgicos
| Características | Márgenes positivos (n=16) | Márgenes negativos (n=55) | |
|---|---|---|---|
| n (%) | n (%) | p | |
| Edad (años) | 0,391 | ||
| ≤45 | 5 (16,1) | 26 (83,9) | |
| >45 | 11 (27,5) | 29 (72,5) | |
| TTB (cm) | 0,021 | ||
| ≤5 | 12 (18,5) | 53 (81,5) | |
| >5 | 4 (66,7) | 2 (33,3) | |
| Tipo histológico | 0,123 | ||
| Ductal | 13 (20) | 52 (80) | |
| Lobulillar | 3 (50) | 3 (50) | |
| Grado histológico | 0,031 | ||
| Bajo (1 o 2) | 11 (34,4) | 21 (65,6) | |
| Alto (3) | 5 (12,8) | 34 (87,2) | |
| Expresión Ki-67 | 0,065 | ||
| Bajo (<14%) | 4 (50) | 4 (50) | |
| Alto (≥14%) | 11 (18,3) | 49 (81,7) | |
| Estatus RH | 0,006 | ||
| Positivo | 15 (32,6) | 31 (67,4) | |
| Negativo | 1 (4) | 24 (96) | |
| Estatus HER2 | 1,000 | ||
| Positivo | 4 (22,2) | 14 (77,8) | |
| Negativo | 12 (22,6) | 41 (77,4) | |
| Estatus axilar pre-QTN | 0,471 | ||
| Positivo | 12 (20,7) | 46 (79,3) | |
| Negativo | 4 (30,8) | 9 (69,2) | |
| Respuesta tumoral (RM) | 0,572 | ||
| Completa | 6 (19,4) | 25 (80,6) | |
| Incompleta | 10 (25) | 30 (75) |
HER2: receptor 2 de factor de crecimiento epidérmico humano; QTN: quimioterapia neoadyuvante; RH: receptores hormonales; RM: resonancia magnética; TTB: tamaño tumoral basal.
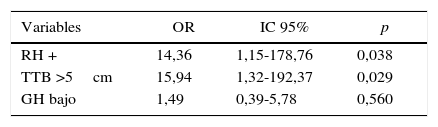
El análisis multivariante reveló que las únicas variables independientes asociadas a un margen de resección positivo fueron el estatus de los RH y el TTB (tabla 3). El riesgo de que existiese afectación de los márgenes quirúrgicos resultó 14 veces mayor en los tumores con los RH positivos que en los tumores con los RH negativos (p=0,038), y este riesgo resultó 16 veces mayor en los tumores con un tamaño inicial superior a 5cm que en los tumores con un tamaño inicial igual o inferior a 5cm (p=0,029).
Supervivencia libre de enfermedadTras un seguimiento medio de 45,2 meses, 13 pacientes (14,3%) presentaron recidiva de la enfermedad (locorregional o sistémica). La SLE a los 2 y 5 años fue del 88,9 y del 83%, respectivamente. En el grupo de pacientes que recibieron inicialmente cirugía conservadora (n=71), 7 pacientes presentaron recidiva de la enfermedad (9,8%). De estas, 2 pacientes presentaron recurrencia tumoral mamaria ipsilateral (RTMI) (2,8%) y 5 presentaron metástasis a distancia (7%). Al comparar la SLE en función del estado de los márgenes quirúrgicos, no se observaron diferencias estadísticamente significativas (p=0,596) (fig. 1). La incidencia de RTMI fue del 1,8% en mujeres con márgenes negativos y del 6,3% en mujeres con márgenes positivos (p=0,402).
DiscusiónLa QTN tiene la capacidad de aumentar el porcentaje de conservación mamaria en pacientes con cáncer de mama operable inicialmente candidatas a una mastectomía. Se han descrito tasas de conversión a cirugía conservadora que oscilan entre el 23 y el 46%3,9–11.
La utilización de una serie de características clínico-patológicas como factores predictores de recidiva locorregional puede mejorar la estratificación del riesgo de recurrencia en pacientes tratadas con QTN y cirugía conservadora12. La presencia de unos márgenes positivos aumenta la incidencia de RTMI, sin un impacto significativo en la supervivencia global13,14.
La evaluación de los márgenes quirúrgicos resulta más complicada tras la QTN, lo que se debe a la variabilidad en los patrones de regresión tumoral15. Sin embargo, no se ha observado una mayor incidencia de márgenes positivos en la cirugía conservadora tras QTN respecto a la cirugía conservadora primaria16. La incidencia de márgenes positivos en nuestra serie (22,5%) es similar a la del 21% que describen otros estudios de pacientes tratadas con QTN16,17.
La resección oncoplástica y la segmentación mamaria pueden disminuir el riesgo de reintervención. Losken et al.18 demostraron una menor incidencia de márgenes positivos en cirugía oncoplástica respecto a la cirugía conservadora clásica (12,2 vs. 20,6%). El conocimiento de las características de cada región mamaria permite mejorar la seguridad oncológica y el resultado estético en la planificación quirúrgica conservadora19.
Entre los factores de riesgo asociados a una mayor incidencia de márgenes positivos destacan el tipo histológico lobulillar, el estatus positivo de los RH y un TTB grande16,20–22. En el ámbito de la QTN, también existen estudios que describen mayor incidencia de afectación tumoral de los márgenes en los carcinomas lobulillares respecto a los carcinomas ductales23,24.
En el grupo de pacientes de nuestro estudio tratadas inicialmente mediante cirugía conservadora, se observó una asociación significativa entre el estado de los márgenes quirúrgicos y las variables TTB, grado tumoral y estatus de los RH. Los tumores con los RH positivos, los tumores de bajo grado y las lesiones con un TTB>5cm presentaron tasas más altas de afectación de los bordes. A pesar de observar una mayor incidencia de márgenes positivos en los carcinomas lobulillares que en los carcinomas ductales (50 vs. 20%), no se observó una asociación significativa con la variable tipo histológico, lo que posiblemente se deba al pequeño tamaño muestral de carcinomas lobulillares del estudio.
En nuestro modelo de regresión logística, el TTB y el estatus de los RH fueron los únicos factores predictivos independientes de afectación de los márgenes quirúrgicos. El riesgo de presentar unos márgenes positivos resultó 16 veces mayor en lesiones con un TTB>5cm respecto a las lesiones con un TTB≤5cm y 14 veces mayor en tumores luminales respecto a los tumores no luminales. Se ha demostrado que las grandes lesiones y los tumores luminales responden peor a la QTN11,15. Además, es relativamente frecuente que los tumores luminales se presenten como lesiones difusas con un patrón de regresión tumoral no concéntrico tras la QTN. Estas circunstancias dificultan la resección con márgenes negativos.
Finalmente, al comparar la SLE en función del estado de los márgenes quirúrgicos, no se encontraron diferencias significativas. La incidencia de RTMI del 2,8% resulta baja (solo 2 casos), Por este motivo, no hubo diferencias significativas al comparar la incidencia de RTMI de acuerdo con el estado de los márgenes, a pesar de que esta resultó mayor en el grupo de mujeres con márgenes positivos respecto al grupo con márgenes negativos (6,3 vs. 1,8%). Estas 2 pacientes presentaban carcinomas ductales infiltrantes de bajo grado con subtipo luminal A y con respuesta radiológica parcial a la QTN.
Existen varias limitaciones en el estudio. La clasificación molecular actual del cáncer de mama sitúa en 20% el punto de corte del nivel de expresión de ki-67 para definir alto y bajo grado25. En el estudio no se incluyen parámetros radiológicos entre los factores de riesgo de afectación de márgenes. Además, solo se han registrado 7 casos con carcinoma lobulillar.
En conclusión, este estudio muestra que, aunque es factible realizar una cirugía conservadora en la mayoría de las pacientes con cáncer de mama operable tratadas con QTN, la probabilidad de lograr unos márgenes negativos es menor en tumores luminales, de bajo grado histológico y con un tamaño inicial superior a 5cm.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.