Introducción
A principios de la década de los noventa, cuando la laparoscopia irrumpió con fuerza en el ámbito de la cirugía, el tratamiento del cáncer gástrico no parecía ser reproducible por laparoscopia debido a la complejidad técnica que presentaba y a las dudas existentes en cuanto a si era posible conseguir una linfadenectomía oncológicamente aceptable1-3.
Sin embargo, 2 factores han permitido cambiar este concepto y que la práctica de la gastrectomía laparoscópica en el cáncer gástrico sea una realidad: por una parte, el progresivo aprendizaje laparoscópico en cirugía gástrica, iniciado con resecciones submucosas o parciales en enfermedad benigna, o bien en tumores estromales, y por otra parte, el desarrollo de instrumentos y material laparoscópico que facilitan la realización de procedimientos laparoscópicos avanzados (bisturí armónico, mejores ópticas, etc.)4,5.
En los últimos años, grupos de expertos han descrito detalladamente la técnica y han referido buenos resultados en el tratamiento laparoscópico del cáncer gástrico, con gastrectomías totales y subtotales con linfadenectomías oncológicamente aceptables. Entre las principales ventajas del acceso laparoscópico destacan la posibilidad de realizar un tratamiento mínimamente invasivo, reduciendo el dolor postoperatorio, el período de recuperación y la morbilidad postoperatoria2,3,6-8.
Presentamos nuestra experiencia inicial en el tratamiento laparoscópico del cáncer gástrico, y describimos la técnica realizada y los resultados existentes en la bibliografía sobre este tema.
Material y método
Durante el período comprendido entre marzo de 2002 y julio de 2005 hemos tratado, por vía laparoscópica, a 12 pacientes que presentaban adenocarcinomas gástricos distales resecables.
En todos los casos se había realizado una fibrogastroscopia previa para estudio histológico y una tomografía computarizada (TC) abdominal como estadificación del cáncer gástrico.
Los pacientes incluidos en esta serie (tabla 1) presentaban tumores antrales o de cuerpo gástrico sin evidencia preoperatoria de metástasis ganglionar o a distancia; se excluyeron los tumores avanzados (T4) y a los pacientes con riesgo anestésico (ASA III-IV), o bien con características anatómicas que dificultaran el abordaje laparoscópico (obesidad, laparotomía previa).
Se informó a todos los pacientes de que serían sometidos a una técnica en fase de implantación y de la existencia de otros procedimientos alternativos, y firmaron su consentimiento.
Preoperatoriamente, se realizó profilaxis antibiótica y tromboembólica en todos los casos.
Gastrectomía subtotal laparoscópica
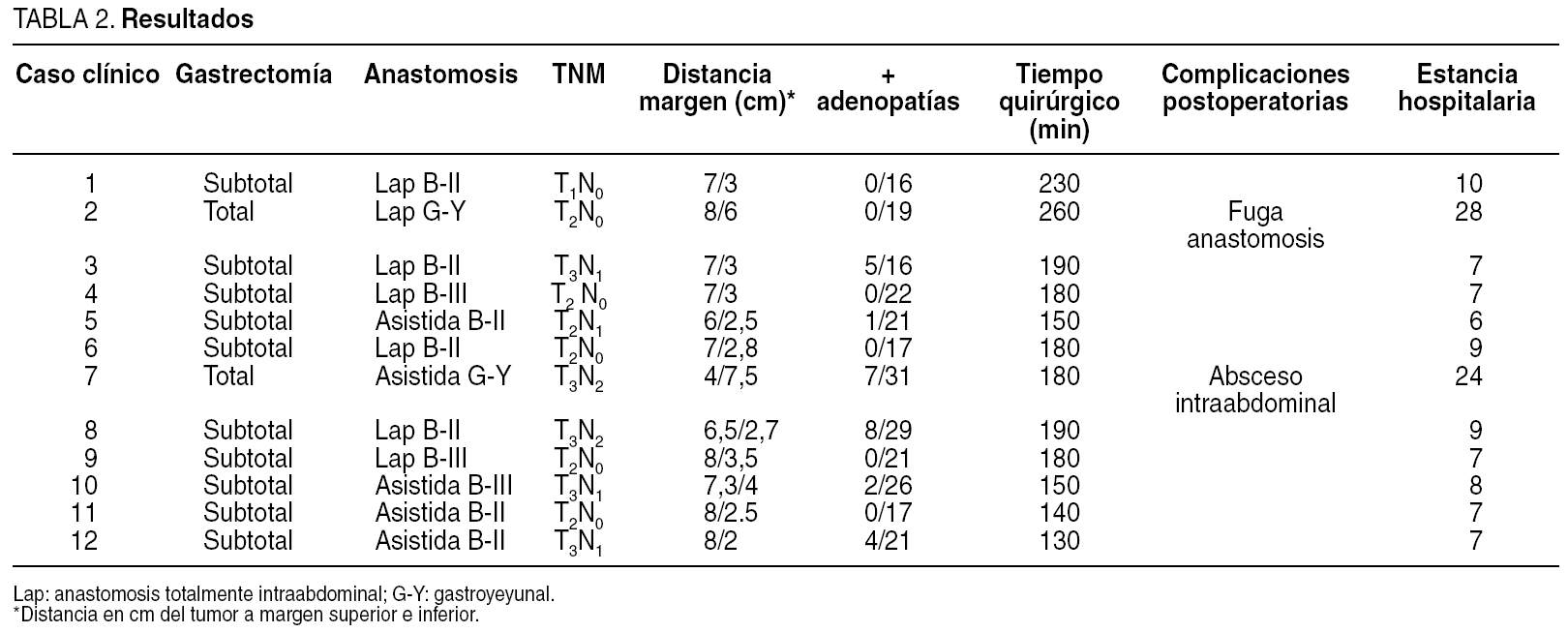
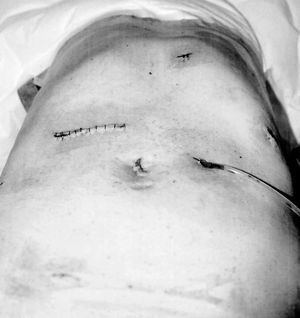
El paciente se coloca en decúbito supino. El cirujano opera en posición "francesa". La intervención se inicia con la inserción de un trocar de Hasson umbilical a través del cual se explora la totalidad de la cavidad abdominal en busca de adenopatías (localización, tamaño, movilidad), afección peritoneal o metástasis. Tras confirmar que presenta una lesión resecable, se colocan 2 trocares de 10-12 mm en cada línea medioclavicular, un trocar de 5 mm inferior a la parrilla costal izquierda y otro suxifoideo (fig. 1).
Fig. 1. Disposición de los trocares e incisión cutánea para extracción de la pieza quirúrgica.
La resección gástrica y la linfadenectomía laparoscópica se realizan con los mismos criterios que por vía abierta. En los pacientes con neoplasia antral se realiza una gastrectomía subtotal con linfadenectomía D2 (grupos 3, 4, 5, 6, 7, 8 y 9), mientras que en tumores de cuerpo gástrico practicamos una gastrectomía total con linfadenectomía D1 ampliada con los grupos 7, 8 y 9. No realizamos linfadenectomía de los grupos 10 y 11 (hilio y arteria esplénica).
La disección empieza en el colon transverso, dividiendo el ligamento gastrocólico con Ligasure (Tyco), y se debe incluir el epiplón mayor en la resección. Es importante no profundizar en la disección para no lesionar los vasos cólicos medios.
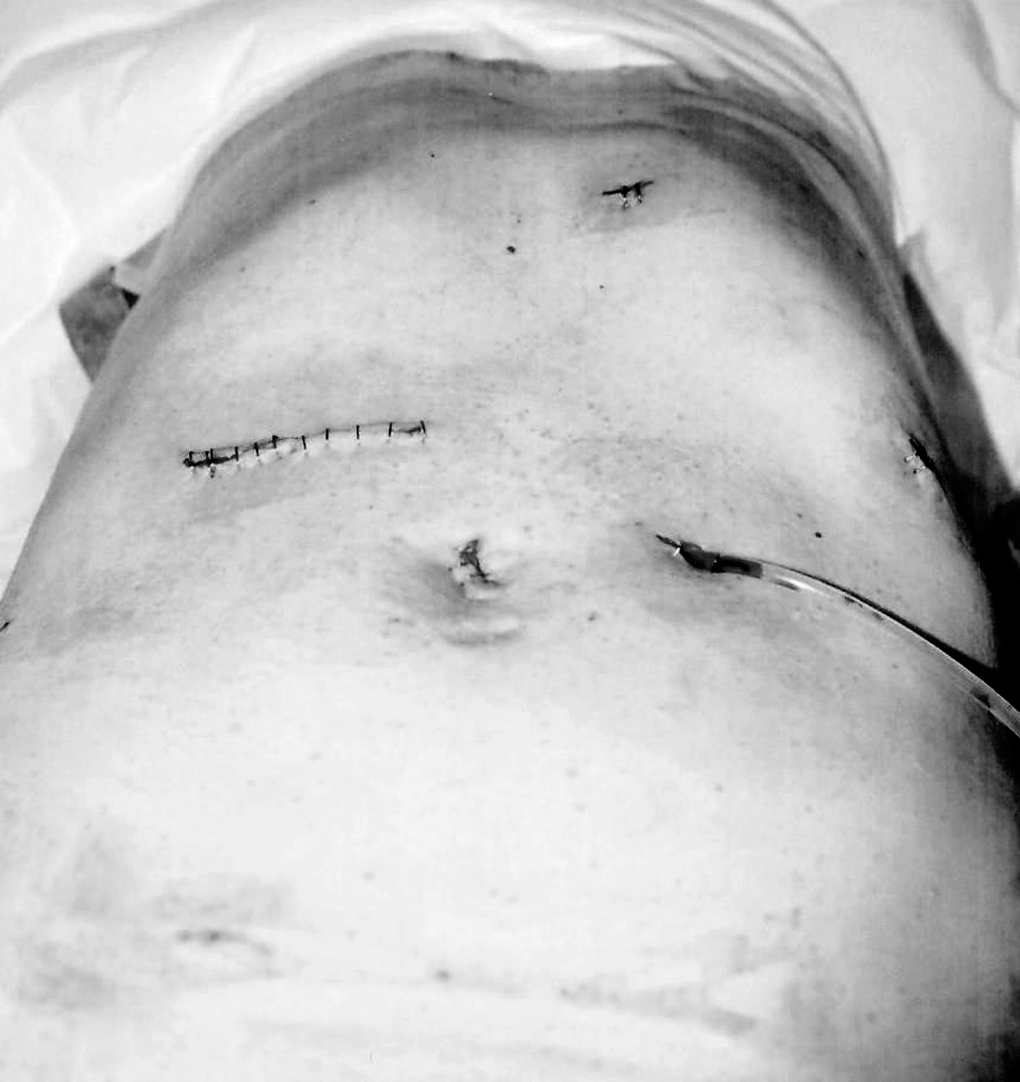
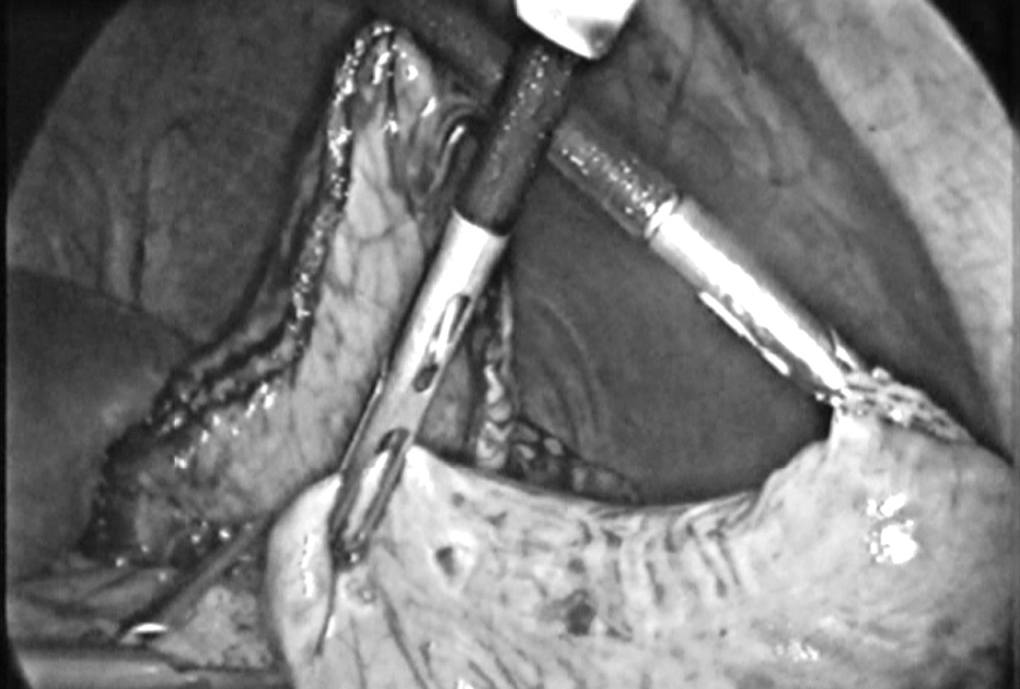
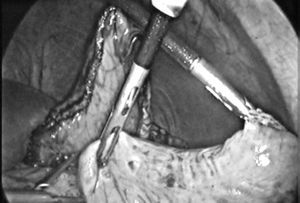
La disección prosigue en sentido caudal hasta seccionar la arteria gastroepiploica derecha y en el píloro, incluyendo las adenopatías peri e infrapilóricas, y se practica una sección pilórica con endograpadora (carga azul) (fig. 2).
Fig. 2. Disección duodenal previa a la sección.
Seguidamente, en sentido ascendente, incluyendo las adenopatías suprapilóricas (grupo 5) y el epiplón menor, se realiza la disección de los grupos ganglionares de la arteria hepática común y el tronco celíaco (grupos 8 y 9). El siguiente paso es exponer y seccionar la arteria gástrica izquierda en su origen, incluyendo las adenopatías correspondientes a la curvatura menor (grupos 3 y 7).
La disección del epiplón mayor prosigue en dirección al bazo hasta alcanzar el nivel de la resección gástrica, habitualmente en el segundo y tercer vasos cortos en gastrectomías subtotales en la curvatura mayor, y unos 3-5 cm en la curvatura menor.
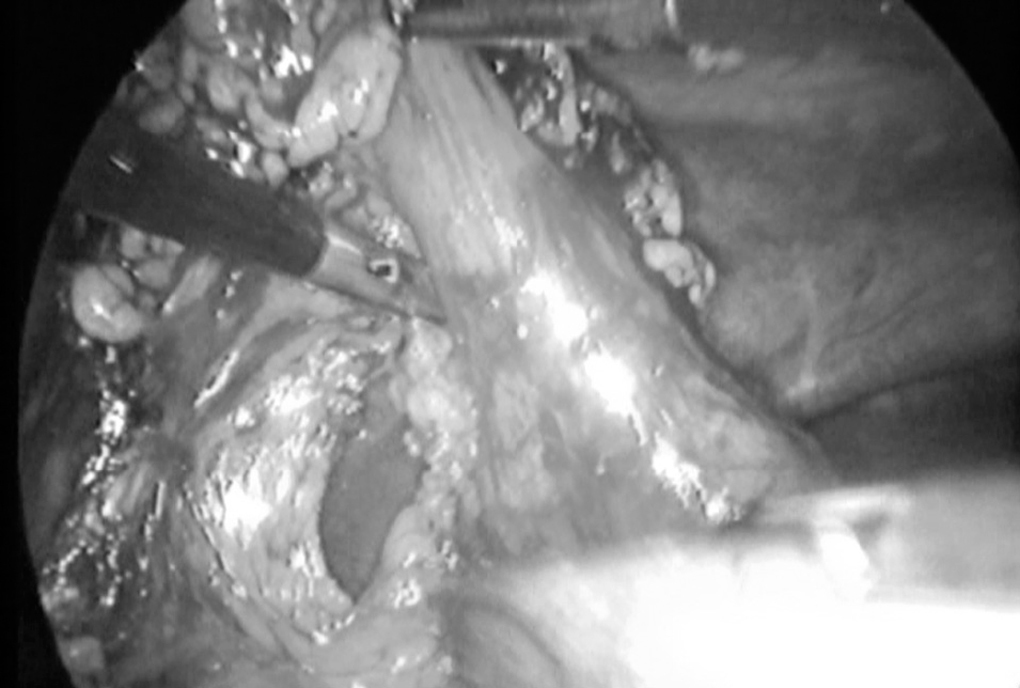
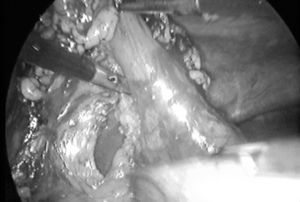
La sección gástrica en la gastrectomía subtotal se realiza con endograpadora, utilizando varias cargas azules de 40 mm (fig. 3). La hemostasia debe ser cuidadosa y, en algunos casos, precisa puntos de sutura, si bien no realizamos sutura manual hemostática sobre la sutura mecánica.
Fig. 3. Sección gástrica con endograpadora.
La pieza se extrae a través de una incisión transversa en el hemiabdomen superior, actualmente subxifoidea de 7-10 cm.
En pacientes de menos de 60 años se ha realizado una anastomosis en "Y" de Roux (Billroth III), mientras que en pacientes de mayor edad se ha optado por una gastroyeyunostomía tipo Billroth II.
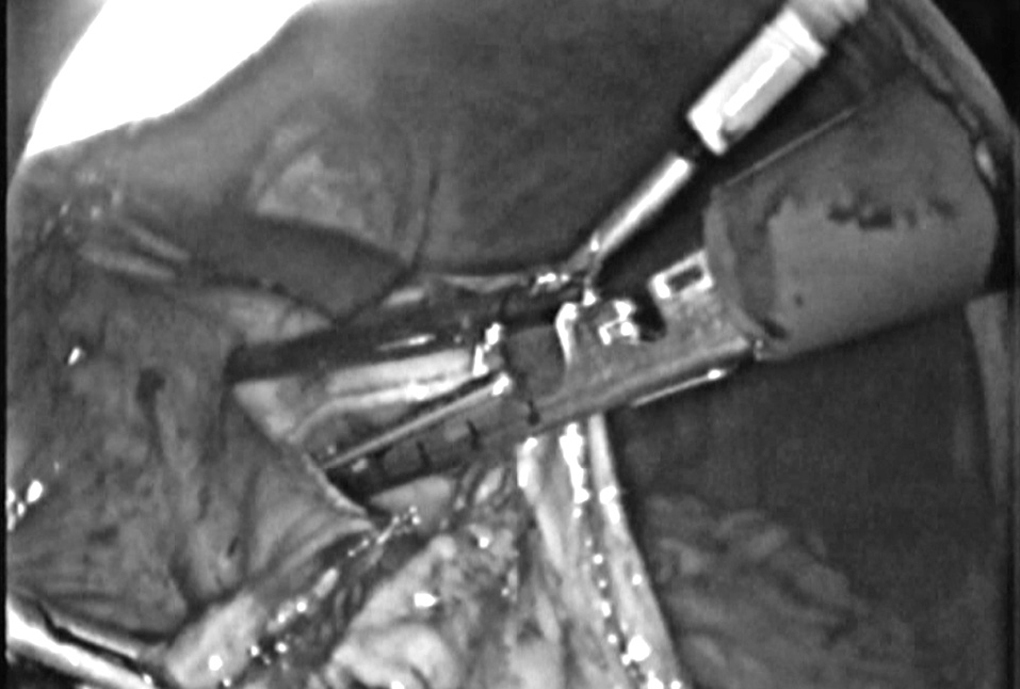
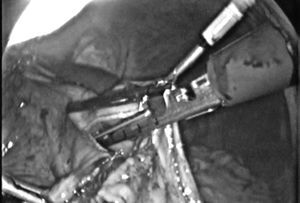
La anastomosis en "Y" de Roux (Billroth III) se realiza antemesocólica con endoanastomosis mecánicas laterolaterales, al igual que en el Billroth II (fig. 4). En los casos en que se practica la sutura asistida extracorpórea se realiza una incisión transversa de 7-10 cm en el epigastrio, a través de la cual se realizan las suturas.
Fig. 4. Reconstrucción del tránsito digestivo con anastomosis mecánica Billroth III laterolateral.
Gastrectomía total laparoscópica
En la gastrectomía total seguimos los mismos pasos descritos en el apartado anterior, y se completa con la disección de las adenopatías paracardiales (grupos 1 y 2), la movilización del esófago abdominal y la sección de todos los vasos cortos en la curvatura mayor.
La anastomosis esofagoyeyunal se realiza terminolateral con sutura circular mecánica (EEA 25 mm [Tyco]), introduciendo el cabezal mediante sonda nasogástrica a través del esófago.
El pie de asa se realiza laterolateral mecánico, aproximadamente a 50 cm de la anastomosis esofagoyeyunal.
El control postoperatorio se ha realizado tras 1, 3 y 6 meses, y anualmente pasados los 12 meses.
Los datos se han recogido en una base de datos Access, de Windows 2000. Las diferencias entre grupos se analizaron utilizando el test de la t de Student. Se consideró que los resultados eran estadísticamente significativos con un valor de p < 0,05.
Resultados
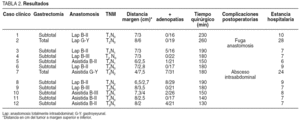
En el período estudiado se ha intervenido a 12 pacientes con cáncer gástrico distal resecable a quienes se han practicado 10 gastrectomías subtotales D2, con reconstrucción Billroth-II en 7 de ellos y Billroth-III en los 3 restantes. En 6 pacientes estas reconstrucciones se llevaron a cabo por laparoscopia en su totalidad, mientras en los otros 4 casos se hicieron asistidas de manera extracorpórea. En cuanto a las 2 gastrectomías totales, una se realizó íntegramente por laparoscopia, mientras que la otra fue asistida; la anastomosis esofagoyeyunal fue extracorpórea (tabla 2).
Nueve pacientes eran varones y 3, mujeres. La edad media fue de 62,6 años (rango, 45-78). Siete pacientes eran ASA I y 5, ASA II.
El tiempo quirúrgico medio fue de 197,66 ± 36,9 (130-260) min, si bien el tiempo del subgrupo de gastrectomía subtotal con anastomosis extracorpórea fue de 142,5 ± 9,6 min frente a los 190,8 ± 20,1 min si la anastomosis se realizaba totalmente laparoscópica (t = 4.416; p < 0,002).
No se produjeron complicaciones intraoperatorias ni conversiones.
Tres pacientes presentaron complicaciones postoperatorias. Un paciente presentó un íleo prolongado durante 7 días; otro, un absceso intraabdominal que precisó laparotomía, y otro caso presentó una fuga anastomótica esofagoyeyunal que se resolvió con tratamiento conservador.
La ingesta oral se reinició a las 72 h en 9 pacientes, mientras que otros 2 precisaron 5 días y el paciente del íleo prolongado, 8.
La estancia media postoperatoria fue de 10,7 ± 7,3 (6-28) días.
La estadificación del cáncer gástrico se muestra en la tabla 3. Todos los adenocarcinomas tenían un mínimo de 5 cm desde el margen de resección. La media de ganglios extirpados fue de 21,3 ± 5 (16-31) cm.
Tras un seguimiento medio de 25,8 meses (4-73) se ha objetivado una recidiva locorregional a los 14 meses en un paciente T3N2. El resto de pacientes están libres de enfermedad.
Discusión
A diferencia de otros tumores digestivos, en los que existe un amplio consenso en su tratamiento, el cáncer gástrico presenta una serie de cuestiones no resueltas todavía. El principal problema radica en que los resultados obtenidos en Asia son mejores que los obtenidos en Occidente, donde no han podido reproducirse. Ello ha generado una enorme controversia, y algunos autores occidentales se han cuestionado si se trata de una enfermedad de diferente comportamiento, si el tipo de paciente es distinto y, en el aspecto quirúrgico, qué linfadenectomía es oncológicamente la más adecuada o qué tipo de reconstrucción digestiva debe realizarse9.
La posibilidad de tratar el cáncer gástrico por vía laparoscópica añade un nuevo dilema a los ya existentes: ¿es posible reproducir por laparoscopia la misma técnica que se realiza por vía abierta y con los mismos resultados?
Probablemente, la enfermedad sea la misma en Oriente que en Occidente, pero sí es cierto que las series asiáticas presentan estadios muy iniciales, mientras que el cáncer gástrico en Europa o Estados Unidos se diagnostica en estadios más avanzados, lo que supone un pronóstico mucho peor10.
En cuanto al tipo de paciente, también hay diferencias destacables. Griffin9 refiere que las series occidentales incluyen a pacientes 10 años mayores y con más comorbilidad que las series orientales. A modo de ejemplo, sólo un 14% de pacientes japoneses con cáncer gástrico tiene un índice de masa corporal (IMC) superior a 25 kg/m2, mientras en Inglaterra esta tasa es del 60%, y se ha demostrado una relación entre la obesidad y el aumento de la morbilidad y la dificultad en la realización de la linfadenectomía.
El tratamiento del cáncer gástrico requiere una resección radical. En tumores del tercio medio y superior es aconsejable practicar una gastrectomía total, mientras que en tumores del tercio inferior, la gastrectomía subtotal con un márgen superior de 5-7 cm, en el tipo intestinal, o 10 cm, en el difuso, es el tratamiento aceptado en nuestro medio10,11.
No existe consenso en la amplitud de la linfadenectomía. Mientras que los grupos asiáticos son partidarios de unas linfadenectomías más extensas, D2 o D3, la mayoría de grupos occidentales prefieren una disección D1, más limitada y que conlleva menor morbimortalidad postoperatoria10,11. Los motivos de estas diferencias se deben a que los grupos japoneses han reportado mejores resultados con extensas linfadenectomías, mientras que en Europa y Estados Unidos no se han logrado reproducir estos resultados10-13. Así, estudios aleatorizados realizados en Europa, por Cuschieri y Bonenkamp, en que se comparaba la linfadenectomía D1 con la D2, no obtuvieron mayor supervivencia realizando la D2 y sí presentaron una morbilidad y una mortalidad mayores14,15.
Nuestro grupo realiza en cirugía abierta una linfadenectomía D2 (grupos 3, 4, 5, 6, 7, 8 y 9) en tumores antrales, mientras que en tumores de cuerpo gástrico practicamos una gastrectomía total con linfadenectomía D1 (grupos 1-6) ampliada con los grupos 7, 8 y 9. No realizamos linfadenectomía de los grupos 10 y 11 (hilio y arteria esplénica). En este contexto, hemos reproducido por laparoscopia los mismos preceptos utilizados en cirugía abierta, de manera que la gastrectomía laparoscópica sólo puede aceptarse como una alternativa eficaz a la cirugía abierta si es capaz de obtener los mismos resultados oncológicos, con una tasa de complicaciones postoperatorias similares o inferiores16.
La reconstrucción digestiva después de una gastrectomía subtotal también es motivo de discrepancias. Los grupos asiáticos son partidarios de la reconstrucción Billroth-I6,8,17,18 o indistintamente I y II19. En cambio, en occidente, la reconstrucción Billroth-I tiene pocos seguidores y la mayoría de autores prefieren una reconstrucción tipo Billroth-II2,11,20 o en "Y" de Roux3,21,22, que presenta ventajas sobre el Billroth-II en cuanto que evita el reflujo biliar a largo plazo y su potencial cancerígeno, aunque diversos estudios no han demostrado diferencias en cuanto a la calidad de vida postoperatoria y la existencia de reflujo esofágico y, en su contra, evidencian una mayor estancia hospitalaria debido a complicaciones postoperatorias como la estasis de la "Y" de Roux y la dehiscencia a pie de asa22,23.
Sociedades, como la FNCLCC, recomiendan realizar la técnica de reconstrucción posgastrectomía en la que el cirujano tenga más experiencia, ya que no existe una técnica mayoritariamente aceptada11.
Nuestro grupo es partidario, tanto en cirugía abierta como en laparoscópica, de realizar una reconstrucción en "Y" de Roux en pacientes jóvenes a fin de minimizar el riesgo de reflujo biliar. En pacientes de edad avanzada preferimos una gastroyeyunostomía tipo Billroth-II, que precisa menor tiempo quirúrgico y evita el riesgo de las citadas complicaciones a pie de asa.
La cirugía laparoscópica en el cáncer gástrico la iniciaron grupos asiáticos, que reportaron buenos resultados en el tratamiento de lesiones mucosas en estadios iniciales, con una recuperación postoperatoria más rápida y la misma eficacia oncológica6,17.
Posteriormente, se han publicado buenos resultados en tumores en estadio II-III, se han practicado gastrectomías subtotales y totales, realizadas íntegramente por laparoscopia o asistidas, con linfadenectomías oncológicamente equiparables a las realizadas por vía abierta y, evidentemente, con una morbilidad y una mortalidad también similares2,3,8,18,24.
Existen pocos estudios aleatorizados que comparen la gastrectomía subtotal laparoscópica frente a la abierta. Lee et al18, en 47 pacientes con early cancer, obtienen, en el grupo laparoscópico, un menor trauma quirúrgico, una menor disminución de la capacidad respiratoria, una menor hospitalización, menos dolor y una más rápida recuperación postoperatoria. Recientemente, Hayashi et al25 obtienen resultados similares en 28 pacientes también con early cancer: una menor pérdida de sangre intraoperatoria, unn menor requerimiento analgésico, una más rápida reanudación de las funciones gastrointestinales y una menor hospitalización en el grupo laparoscópico. En cuanto a la eficacia oncológica, no observan diferencias en el número de adenopatías resecadas y no se han producido recidivas locales ni metástasis en trocares de entrada.
Huscher et al16, en el único estudio europeo aleatorizado en que se compara la gastrectomía subtotal laparoscópica frente a la abierta, con linfadenectomía D2 en tumores gástricos en estadio II-III, confirman la radicalidad de la resección laparoscópica al no objetivar diferencias entre ambos grupos en supervivencia y pacientes libres de enfermedad a los 5 años. Además, al igual que en otros procedimientos laparoscópicos, observan ventajas en cuanto a una menor pérdida de sangre, un más rápido inicio de la ingesta oral y una menor estancia en el hospital.
Nuestros resultados iniciales en el tratamiento laparoscópico del cáncer gástrico, pese a tratarse de un grupo seleccionado de pacientes y estar en plena curva de aprendizaje, nos hacen ser optimistas en el futuro de esta técnica. No se han producido complicaciones intraoperatorias y, desde el punto de vista oncológico, el número de ganglios extraídos y los márgenes quirúrgicos son similares a los obtenidos en cirugía abierta. La mayoría de casos han reiniciado la ingesta oral a las 72 h, mientras que en la gastrectomía abierta esperamos 5 días.
Las 2 complicaciones postoperatorias se han presentado en la anastomosis esofagoyeyunal en gastrectomías totales, a pesar de que una de ellas fue asistida y realizada bajo visión directa. En gastrectomía subtotal no se han producido fugas, estenosis o hemorragia en la anastomosis gástrica ni en el muñón duodenal.
¿Reconstrucción totalmente laparoscópica o anastomosis asistida extracorpórea? Creemos que, al iniciarse en la técnica, puede ser interesante plantearse como objetivo únicamente la disección y aprovechar la minilaparotomía para extraer la pieza y realizar la anastomosis bajo control visual. También, en algunos casos de nuestra serie, la elección de la anastomosis asistida se ha debido a que la disección había sido laboriosa y habíamos consumido mucho tiempo. Sin embargo, si es posible, creemos que la anastomosis debe intentarse totalmente laparoscópica, si bien en nuestra serie el tiempo quirúrgico es significativamente superior al de la gastrectomía con reconstrucción asistida. Creemos que éste es un parámetro que debemos mejorar a medida que aumentemos el número de casos.
En espera de estudios aleatorizados a largo plazo que definan la utilidad real del tratamiento laparoscópico del cáncer gástrico en cuanto a la morbimortalidad postoperatoria y la eficacia oncológica, la gastrectomía laparoscópica en el cáncer gástrico es una técnica segura y reproducible en manos de cirujanos con experiencia laparoscópica y con una adecuada selección de los casos. Se perfila como una alternativa a la cirugía abierta, siempre teniendo presente que debemos ser capaces de reproducir exactamente por laparoscopia los mismos principios oncológicos que con la técnica abierta.
Correspondencia: Dr. X. Feliu-Palà.
Cavall Bernat, 8. 08230 Matadepera. Barcelona. España.
Correo electrónico: 16255xfp@comb.es
Manuscrito recibido el 24-9-2005 y aceptado el 7-1-2006.