El objetivo de este trabajo es presentar nuestra técnica de gastrectomía vertical laparoscópica a través de 3 puertos (GVLTP) como alternativa a la técnica laparoscópica convencional, por un lado, y a la de incisión única por otro; también describimos su viabilidad y presentamos los resultados a corto plazo.
Material y métodosSe realizó un estudio prospectivo con 25 pacientes: 12 hombres y 13 mujeres, con un IMC medio de 53kg/m2 (intervalo: 50-72) y una edad media de 38 años (intervalo: 29-55). Para evaluar la viabilidad de nuestra técnica, hemos respetado siempre 3 condiciones preoperatorias: IMC ≥ 50kg/m2. Tomografía computarizada o ecografía abdominal para medir el hígado y determinar las características hepatoesplénicas. «Intención de tratar» con 3 puertos (2 de 5mm y uno de 12mm de diámetro). Los criterios de valoración del seguimiento a corto plazo incluyen: tiempo perioperatorio, cambio a otra técnica, transfusiones, fístulas, reintervenciones y hernia parietal al mes o a los 3 meses después de la cirugía.
ResultadosExistía hepatomegalia en 19 (76%) pacientes, y en 9 (36%) era mayor en el lóbulo hepático izquierdo. El tiempo medio de intervención fue de 72 min (intervalo: 50-110). No se observaron complicaciones perioperatorias. En un paciente fue necesario cambiar a un procedimiento de 4 puertos. La estancia hospitalaria media fue de 3 días (intervalo: 2-5). La tasa de morbimortalidad a los 30 días de la operación fue cero. Ningún paciente ha desarrollado hernia incisional hasta la fecha.
ConclusiónLa GVLTP reduce el número y tamaño de puertos y, posteriormente, el trauma parietal; además, como utiliza la triangulación instrumental, la cirugía es segura y reproducible.
The aim of this paper is to propose our technique, namely three-port laparoscopic sleeve gastrectomy (TPLSG), to define the feasibility and expose the short-outcomes, as an alternative between the standard laparoscopic approach and the single incision (SILSG) for such patients.
Material and methodsWe conducted a prospective study of 25 patients: 12 male and 13 female, reporting a mean BMI of 53kg/m2 (range: 50-72) and a mean age of 38 years (range: 29-55). To evaluate the feasibility of our technique we have always respecting 3 pre-operatives conditions: BMI ≥ 50kg/m2. Preoperative abdominal US or CT to measure the liver and determine the hepato-splenic characteristics. «Intent to treat by 3 ports» (2 of 5mm and one 12mm in diameter). The short outcomes follow-up include: operative time, conversion, transfusions, fistula, reinterventions and parietal herniation at one and three months after surgery.
ResultsHepatomegaly was present in 19 (76%) patients, and it's greater on the left hepatic lobe in 9 (36%) patients. The mean operation time was 72min (range: 50-110). No per-operative complications were observed. Conversion to four ports procedure was necessary in one patient. The mean hospital stay was 3 days (range: 2-5). No mortality and 30th POD morbidity rate was reported. No patient developed an incisional hernia to date.
ConclusionThe TPLSG reduces the ports in number and in size and subsequently the parietal trauma, it also an instrumental triangulation, making surgery safe and reproducible.
La primera gastrectomía vertical laparoscópica (GVL) se realizó en 1999 por Gagner. Inicialmente se utilizó como componente restrictivo de una intervención más compleja, pero se convirtió en un procedimiento independiente cuando se demostró que podía reducir la morbimortalidad en casos de superobesidad (definida por un índice de masa corporal [IMC] que oscila entre los 50 y los 60kg/m2), al compararlo con otros procedimientos, tales como la derivación biliopancreática con cruce duodenal (BPD-DS) y el bypass gástrico en Y de Roux (RYGB)1–3.
Recientemente, la GVL se está utilizando con mayor frecuencia como procedimiento definitivo para el tratamiento de la obesidad mórbida, obteniéndose resultados a corto plazo aceptables4,5.
Las indicaciones actualmente aceptadas son: primer tiempo quirúrgico en pacientes superobesos que presentan a menudo hepatomegalia, previamente a la intervención definitiva: RYGB o BPD-DS en 2 tiempos, y pacientes con IMC ≥ 40kg/m2, además de una enfermedad médica grave u otras comorbilidades importantes6–10. La GVL podría ser útil en los casos de adolescentes con obesidad mórbida, en pacientes que presentan anatomía distorsionada (múltiples adherencias abdominales, situs inversus viscerum), antecedentes de enfermedad inflamatoria intestinal o linfoma intestinal11–14.
La GVL disminuye el volumen del estómago y la producción de grelina. Este mecanismo parece explicar la fisiopatología de la GVL en términos de la pérdida de peso y de la sensación de hambre15–19.
Un amplio metaanálisis multicéntrico reciente estableció que la morbilidad y la eficacia de la GVL se encuentran entre la banda gástrica ajustable laparoscópica (BGAL) y el RYCB5.
La tasa de conversión a la cirugía abierta de la que se ha informado en las amplias revisiones es inferior al 0,9%. La morbilidad posprocedimiento a los 30 días (MPP 30) y la tasa de reintervención a los 30 días fueron, respectivamente, de un 5 y un 3%. Las complicaciones quirúrgicas a corto plazo son principalmente debidas a fugas y hemorragias, 2,2 y 6% respectivamente. Las estenosis (4%) y el retraso en el vaciamiento gástrico constituyen las complicaciones tardías más frecuentes. La MPP 30 y la tasa de mortalidad al año relacionadas con la GVL es del 0,1 y del 0,2% respectivamente5,20,21.
En cuanto a la técnica, el enfoque estándar en la GVL requiere entre 4 y 7 trocares9,13,22. Recientemente, la gastrectomía vertical laparoscópica con incisión única (single incision laparoscopic sleeve gastrectomy [SILSG]) se ha utilizado con éxito, con resultados posoperatorios alentadores y menos complicaciones de herida8,9,23–27.
El objetivo de este trabajo es presentar la nueva técnica de gastrectomía vertical laparoscópica a través de 3 puertos (GVLTP) (12-5-5) como alternativa factible, reproducible, eficaz y económica al enfoque laparoscópico estándar, por un lado, y al SILSG por otro, teniendo en cuenta los resultados favorables a corto plazo obtenidos en el estudio prospectivo en curso con 25 pacientes superobesos y con hepatomegalia.
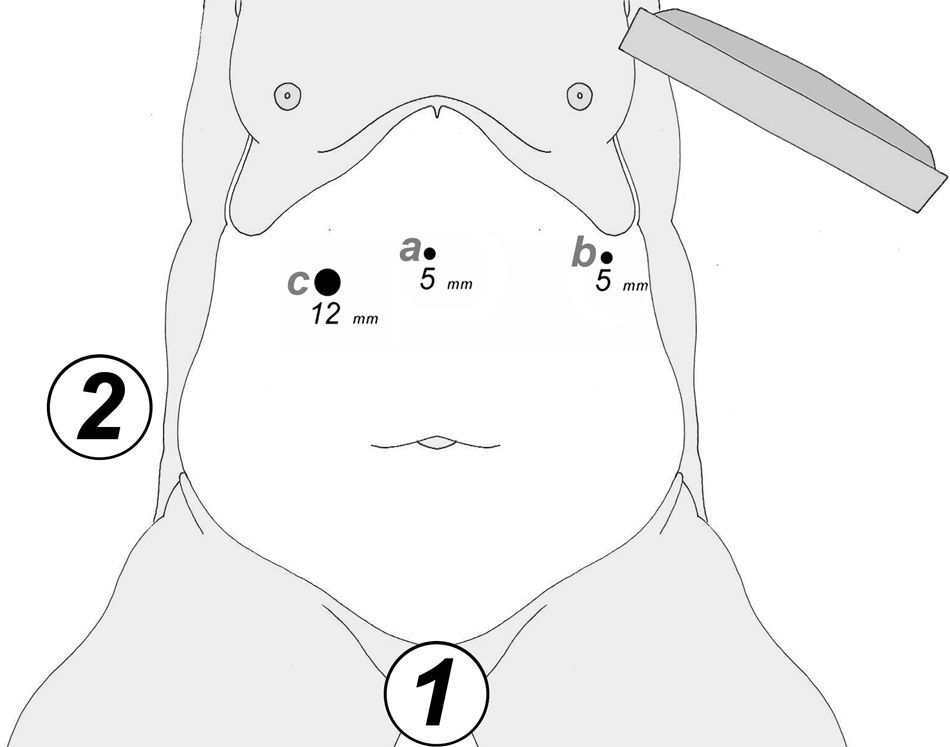
Para evaluar la viabilidad de nuestra técnica, siempre hemos respetado una condición preoperatoria: «intención de tratar con 3 puertos, 2 de 5mm y uno de 12mm de diámetro».
Material y métodosLos pacientes recibieron tratamiento profiláctico para la trombosis venosa profunda (TVP), medias de compresión neumática contra la tromboembolia, junto con la asociación de antibióticos de amplio espectro.
El paciente fue colocado en posición inversa de Trendelenbourg a 20° y la mesa quirúrgica se inclinó hacia el lado derecho del paciente a 15°. El primer cirujano se sitúa entre las piernas en abducción del paciente y el segundo en el lado derecho del paciente.
Se crea un neumoperitoneo de 14mmHg mediante la inserción de una aguja verres (Verres Needle®, Ethicon Endo-Surgery Inc. por Johnson & Johnson, Cincinnati, OH, EE. UU.) en el cuadrante superior izquierdo.
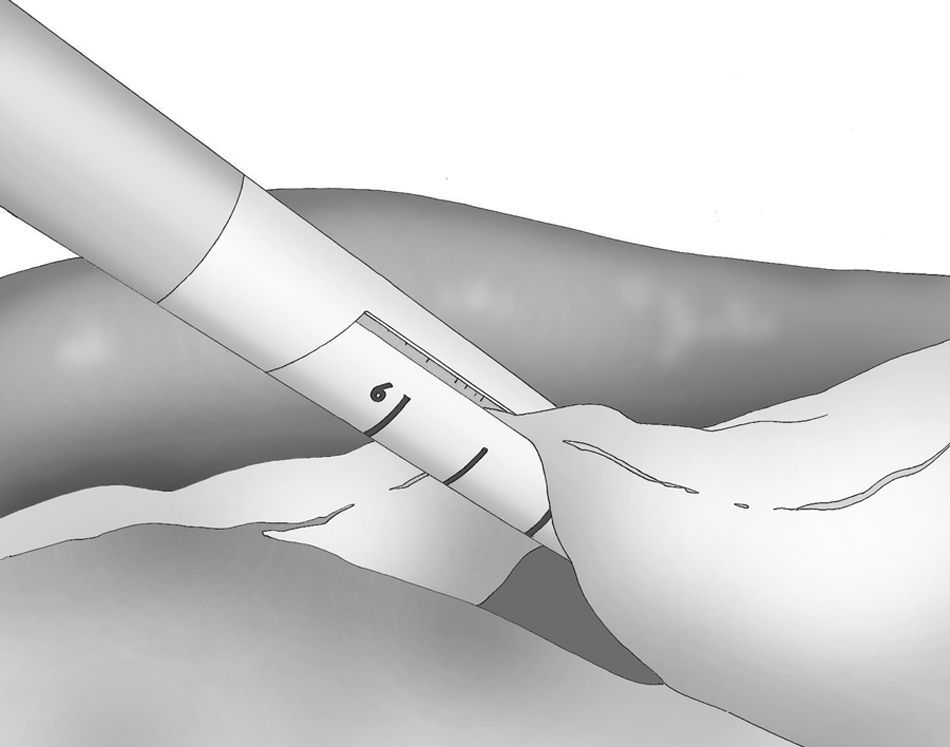
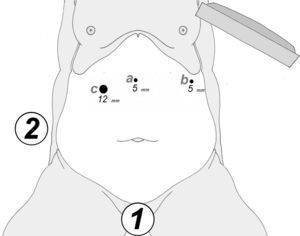
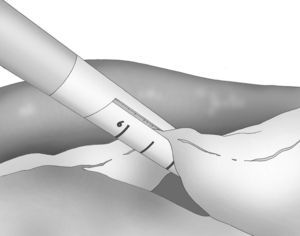
A los 0° o a los 30° se inserta una cámara de 5mm bajo visión directa y a través de un puerto atraumático (ENDOPATH® Xcel™, Ethicon Endo-Surgery Inc. de Johnson & Johnson, Cincinnati, OH, EE. UU.) y otros 2 puertos operatorios (12 y 5mm) colocados bajo control visual como se muestra en la figura 1.
La disección gastroepiploica se inicia en el espacio más delgado y accesible de la curvatura mayor y se lleva a cabo mediante bisturí ultrasónico (Harmonic Scalpel®, Ethicon Endo-Surgery Inc. Johnson & Johnson, Cincinnati, OH, EE. UU.) que se introduce por el puerto lateral izquierdo de 5mm. La división de los vasos de la curvatura mayor se realiza cerca de la pared gástrica para respetar los vasos gastroepiploicos.
Con una pinza atraumática introducida a través del puerto de 12mm, se eleva la superficie posterior del estómago anteriormente y, a continuación, se retrae el hígado sin que haya contacto directo alguno. El endoscopio introducido a través del puerto de 5mm, situado en el epigastrio, ayuda en esta maniobra de crear un «efecto de tienda canadiense» que es particularmente útil en la presencia de hepatomegalia del lóbulo izquierdo.
Una vez que la curvatura mayor está bien liberada, una ligera elevación del estómago permite la cómoda disección de adherencias gástricas posteriores con la superficie pancreática anterior, y siempre manteniéndose en contacto con la pared gástrica.
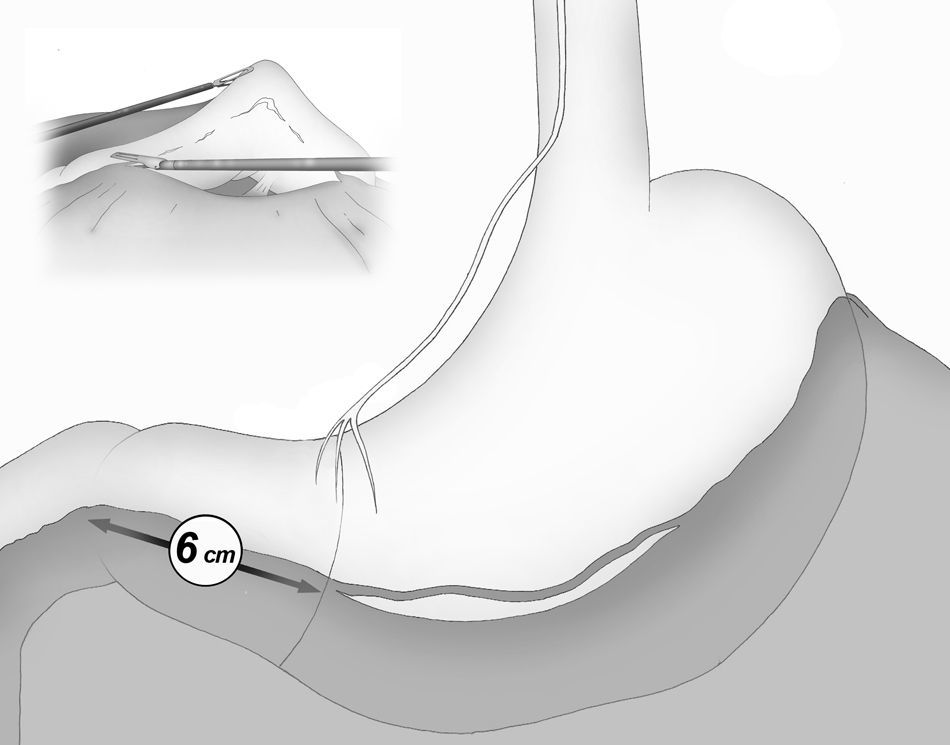
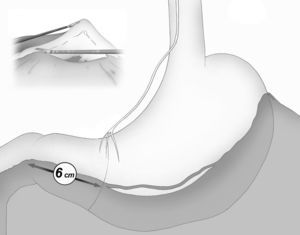
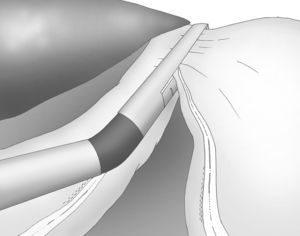
La división gastroepiploica se continúa de forma distal hasta una distancia de unos 6cm proximal desde el píloro, justo a nivel de la segunda rama terminal del nervio de Latarjet (fig. 2).
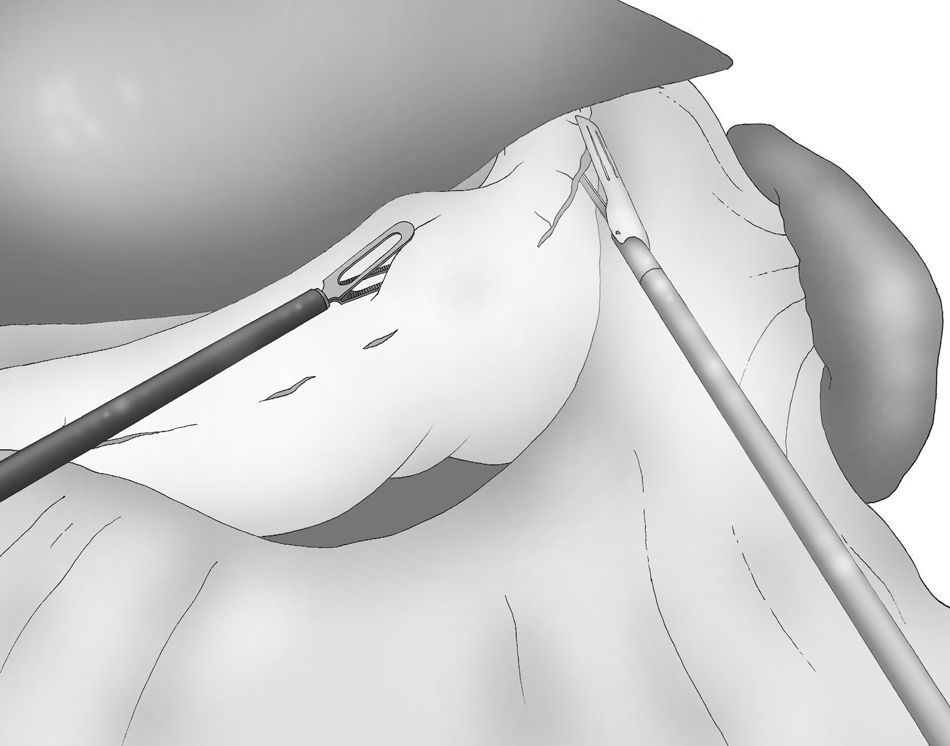
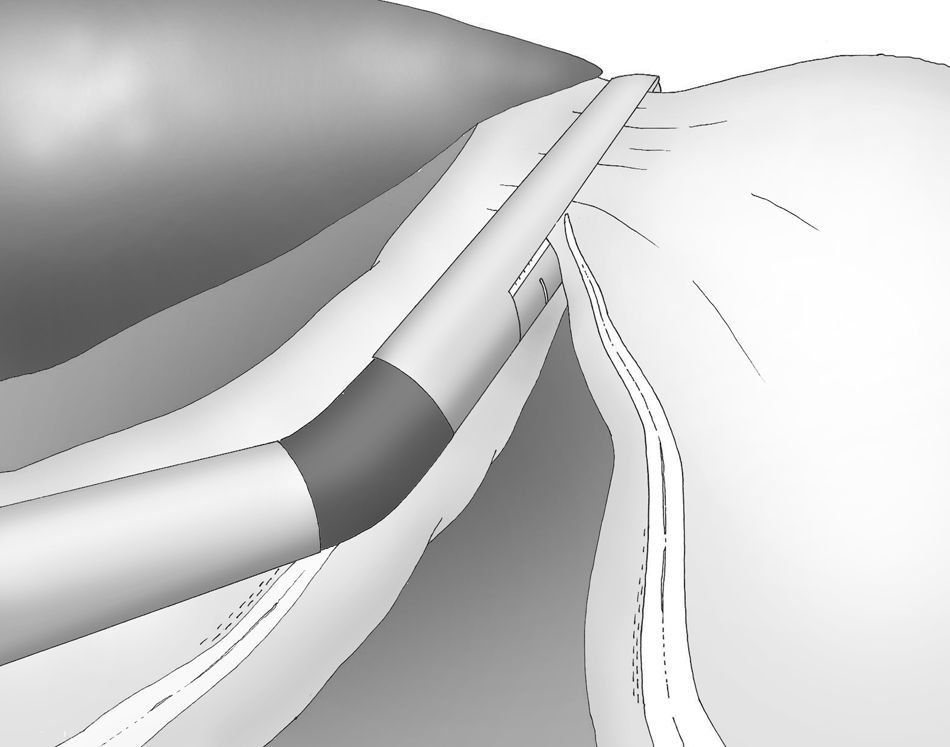
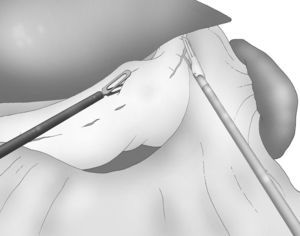
Una adecuada y ligera retracción medial y anterior de la porción libre de la curvatura mayor permite la exposición adecuada de los vasos gástricos cortos a pesar de no emplearse separador hepático alguno (fig. 3).
Puede ser útil colocar una esponja debajo del ligamento gastroesplénico durante la sección de los vasos gástricos cortos, que se realiza también con el bisturí armónico.
El ángulo de Hiss es ahora accesible y, al retraerlo, se logra una clara exposición del pilar izquierdo y de la unión gastroesofágica, donde debe realizarse la disección de la grasa sin riesgo alguno de lesionar el bazo, en contacto estricto y cuidadoso con la pared del estómago. La curvatura mayor está ahora completamente disecada desde el antro a la unión gastroesofágica y la cara posterior gástrica está libre de otras estructuras del saco menor.
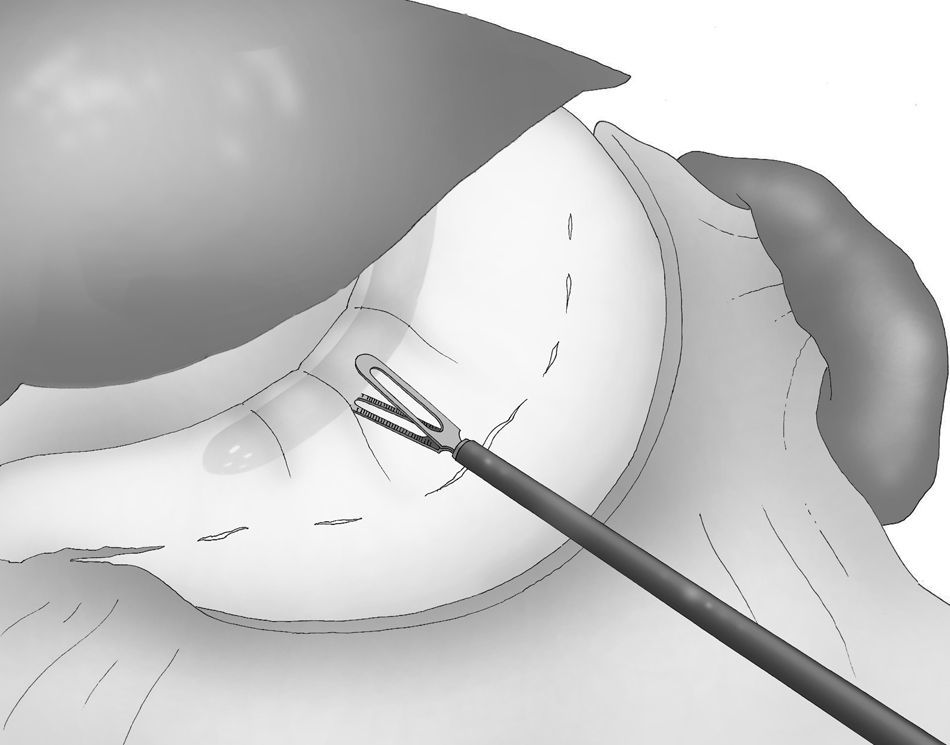
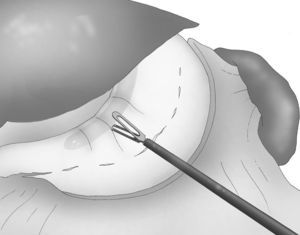
Se introduce un tubo gástrico de 33 F transoral con el fin de obtener una calibración correcta de la GVL (fig. 4).
Se inserta por el trocar derecho de 12mm una grapadora lineal articulada de 6cm (grapadora Echelon Flex™ 60 Endopath®, Ethicon Endo-Surgery Inc. de Johnson & Johnson, Cincinnati, OH, EE. UU.), y la gastrectomía vertical laparoscópica se lleva a cabo mediante disparos secuenciales a lo largo del tubo gástrico, comenzando por el extremo distal de la división gastrocólica. Se seleccionaron cartuchos de carga de grapas doradas para el antro y posteriormente, se utilizaron las cargas de color azul para el resto de la transección gástrica (fig. 5).
Durante el último grapado, es necesario contar con un control visual posterior satisfactorio de la línea de la grapadora para evitar lesiones esplénicas, lo que se logra fácilmente con la cooperación entre la tracción de la grapadora y la inclinación de cámara (fig. 6).
La hemostasia en la línea de grapas se lleva a cabo mediante coagulación monopolar focalizada y, cuando sea necesario, con algunos puntos de sutura. Normalmente, no realizamos suturas continuas en la línea de grapas ni refuerzo de la sutura de la grapa gástrica ya que esto no reduce la tasa de fugas21,28,29.
Finalmente, se retira la muestra gástrica a través del puerto de 12mm y se cierra la fascia del puerto de 12mm mediante puntos de sutura con Vicryl 2/0.
Se inicia la dieta líquida el primer día del postoperatorio que se implementará en el día segundo. Se realiza una orientación sobre nutrición durante la estancia hospitalaria y el paciente es dado de alta generalmente al tercer día del posoperatorio tras un almuerzo ligero, con analgesia oral, protección gástrica mediante inhibidores de la bomba de protones y profilaxis para la TVP mediante una dosis estándar de heparina de bajo peso molecular. Tres semanas más tarde, todos los pacientes son examinados y se programa seguimiento para los 3, 6 y 12 meses. Todos los pacientes son sometidos a una TAC o a una ecografía parietal a los 3 meses para examinar las cicatrices.
ResultadosDespués de haber definido claramente la técnica, de 2010 a 2011, se incluyó a 25 pacientes en una serie prospectiva y continua que siempre respetaba 3 condiciones preoperatorias:
- -
IMC ≥ 50kg/m2.
- -
Ecografía o TAC abdominal en el preoperatorio para medir el hígado y determinar las características hepatoesplénicas.
- -
«Intención de tratar mediante GVL de 3 puertos» (2 de 5mm y uno de 12mm de diámetro).
Se obtuvo el consentimiento informado, aprobado y firmado de todos los pacientes que participaron en este estudio.
Las características de la serie son: hombres: 12 y mujeres: 13, con un IMC medio de 53kg/m2 (intervalo: 50-72) y una edad media de 38 años (intervalo: 29-55).
Todos los pacientes fueron sometidos a una ecografía preoperatoria para determinar el grado de hepatomegalia.
Las intervenciones fueron realizadas por 4 cirujanos diferentes, entre ellos 2 en fase de formación.
El tiempo medio de la intervención fue de 72 min (intervalo: 50-110).
No se observaron complicaciones perioperatorias.
Fue necesario pasar a un procedimiento con 4 puertos en un paciente varón con IMC de 69kg/m2. En este caso, fue necesaria la inserción de un puerto adicional de 5mm para permitir una exposición adecuada de la unión esofagogástrica y del pilar izquierdo del diafragma, ocultado por la grasa del ligamento frenogástrico. Este fue el único paciente que precisó drenaje en toda la serie. Ningún paciente tuvo que recibir transfusión.
La estancia media hospitalaria fue de 3 días (intervalo: 2-5).
No se registró morbimortalidad a los 30 días posoperatorios.
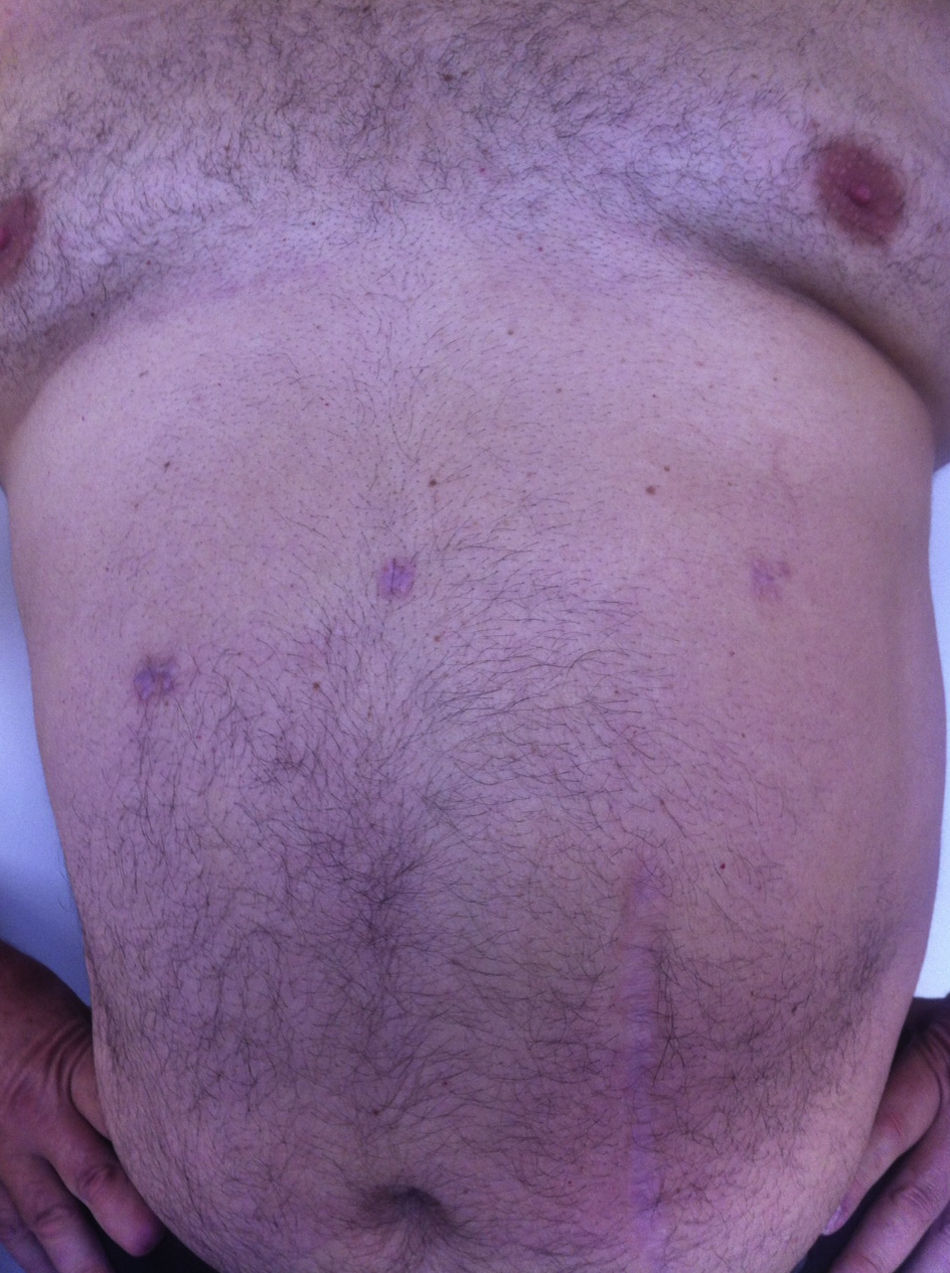
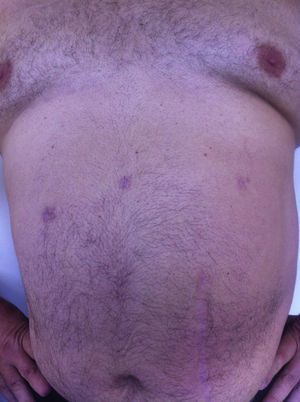
Todos los pacientes fueron examinados al mes y a los 3 meses después de la cirugía; se realizó un seguimiento mínimo de 3 meses (intervalo: 3-15), con una media de 8 meses. No se observó ningún tipo de dolor ni de hernia incisional en el examen de las cicatrices parietales. La TAC o ecografía parietal realizada a todos los pacientes documentó la ausencia de hernia incisional posoperatoria. El efecto cosmético fue excelente ya que las cicatrices de 5mm eran casi invisibles (fig. 7).
En cuanto a la pérdida del exceso de peso y su efecto en las comorbilidades, no se observaron diferencias en comparación con los resultados obtenidos con GVL estándar.
Discusión y conclusionesLa GVL estándar es un nuevo procedimiento bariátrico que se utiliza cada vez con mayor frecuencia para el tratamiento de la obesidad y para enfermedades relacionadas con la obesidad. Actualmente se han publicado guías de práctica clínica basadas en la experiencia internacional30. El procedimiento requiere de manera característica la colocación de entre 4 y 7 puertos laparoscópicos9,13,22, aun cuando algunas experiencias animan a reducir el número y tamaño de los puertos31,32.
Últimamente se ha visto que un número menor de incisiones, concretamente una incisión de acceso de 12 mm, se traduce en última instancia en menores molestias postoperatorias y mejores resultados estéticos, así como una reducción del traumatismo parietal, del dolor y del riesgo de hernia.
Las tasas de infección y de hernia incisional en puertos ≥ 10mm, según la literatura especializada, oscilan entre 0,6 y 2,8%32,33. No existe en la cirugía bariátrica publicada una tasa para este tipo de complicaciones con puertos de 5mm, lo que sugiere que el riesgo de complicaciones de herida es bajo cuando se utilizan puertos de pequeño diámetro.
Recientemente, se ha propuesto el uso de SILSG con éxito, con buenos resultados inmediatos y menos complicaciones de herida. Sin embargo, debido a que la curva de aprendizaje requerida es muy específica y única, la técnica no se ha extendido, debido a las dificultades técnicas asociadas respecto a la navegación de instrumentos dentro de un marco de movimiento limitado. De hecho, la mayoría de autores coinciden en que la pérdida de la clásica triangulación laparoscópica hace la disección extracorpórea y la sutura más difíciles que en la laparoscopia convencional con varios puertos23.
Según nuestros conocimientos, solo existe un estudio prospectivo aleatorizado publicado que compara la GVL tradicional y la SILSG33.
Este estudio se realizó con pacientes seleccionados y por cirujanos altamente capacitados. El estudio muestra que SILSG es tan seguro y efectivo como el GVL estándar (5 puertos de 12mm), aunque la única significación estadística a su favor es un menor uso de analgésicos durante el primer día posoperatorio en el grupo SILSG.
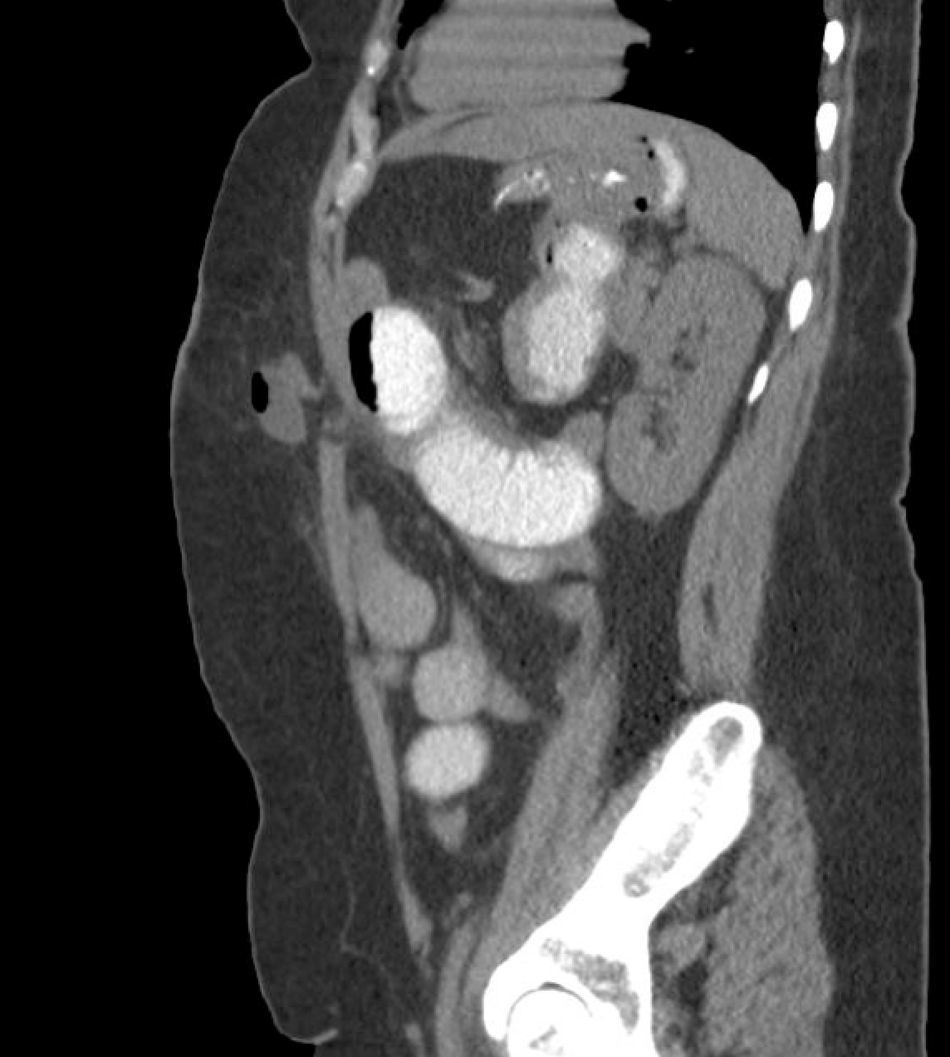
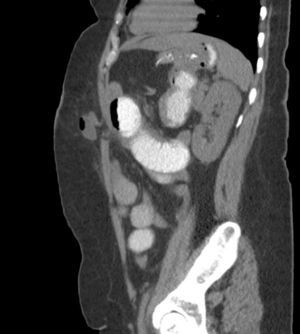
También creemos que la formación de cirujanos para SILSG y la necesidad de utilizar los nuevos instrumentos para una adecuada exposición anatómica limita por el momento la propagación de la técnica SILSG. Por último, consideramos que es fundamental realizar un seguimiento adecuado y usar herramientas de diagnóstico adecuadas para determinar la tasa real de hernia incisional posoperatoria (fig. 8), ya que en estos pacientes la TAC, nos parece esencial en términos de medicina basada en la evidencia.
Sin embargo, el procedimiento descrito podría ser una alternativa cómoda y eficaz al abordaje laparoscópico estándar, para reducir al mínimo el traumatismo parietal, y una opción a la nueva técnica SILSG porque no se necesita habilidades, capacitación ni equipamiento específicos.
La GVLTP aquí descrita y que se emplea en pacientes con obesidad mórbida o con hepatomegalia es una técnica segura, técnicamente factible y reproducible, tal y como muestra la reducida tasa de conversión a un procedimiento laparoscópico estándar (4%) y por la ausencia de conversión en laparotomía.
Las intervenciones en nuestra serie fueron realizadas por distintos cirujanos e incluían a personal en formación, lo que demuestra que es una técnica fácilmente reproducible. Esto se debe, probablemente, a la posibilidad de utilizar la instrumentación convencional y de operar con una cómoda triangulación instrumental.
Nuestros resultados iniciales no permiten llegar a conclusiones estadísticamente significativas.
Además, se necesitan estudios prospectivos aleatorizados y con controles para demostrar los beneficios de la cirugía con menos puertos.
Al reducir el riesgo parietal, la GVLTP mejora los resultados obtenidos con la técnica laparoscópica estándar y se aproxima a la SILSG, sin aumentar el riesgo para los pacientes ni el coste social. Solo unos ensayos aleatorios prospectivos podrán responder a su eficacia en términos de la medicina factual.
Conflicto de interesesLos autores declaran que no tienen nada que declarar.