El hierro intravenoso representa una medida terapéutica eficaz y segura para corregir la anemia, y constituye una alternativa respecto a la transfusión sanguínea clínicamente demostrada. El presente artículo de revisión resume las principales características de los distintos preparados de hierro parenteral, sus ventajas, indicaciones, dosificación y efectos adversos. Asimismo, se analizan algunos de los principales estudios publicados sobre ferroterapia parenteral en Cirugía General y especialidades quirúrgicas afines, y se avanzan algunos datos sobre las nuevas formulaciones próximamente disponibles.
Parenteral iron is a useful and safe therapeutic measure to treat anaemia, and is a proven clinical alternative to blood transfusion. This review article summarises the main characteristics of the different formulations of parenteral iron, their advantages, indications, dosages and adverse effects. Moreover, we analyse some of the most important published articles on parenteral iron therapy in General Surgery and other surgical specialties, as well as providing information about new formulations that will soon be available.
La anemia representa una de las enfermedades más frecuentes en la población general (prevalencia del 17 al 63% en la población mayor de 65 años) y una entidad especialmente habitual (del 5 al 80%) en pacientes quirúrgicos1–7. Aparte de las pérdidas sanguíneas perioperatorias, la ferropenia y la anemia por enfermedad crónica (AEC) son las etiologías más frecuentes de la anemia del paciente quirúrgico, y su tratamiento comporta un abordaje multidisciplinario, en el que la ferroterapia intravenosa desempeña un papel esencial, especialmente como alternativa terapéutica eficaz a la transfusión de sangre alogénica (TSA) (que representa un recurso caro, escaso y asociado a importantes complicaciones y efectos adversos)3,8,9. El uso de hierro parenteral se inició tímidamente en la segunda mitad del siglo xx a raíz de los trabajos de Goetsch et al (1946), Nissim (1947), y Baird y Podmore (1954)10,11. Las progresivas mejorías en el perfil de seguridad y en las tasas de efectos adversos, unidas a su eficacia clínica, posibilitaron la generalización de su uso como arma terapéutica en medicina transfusional12. En 2002 se comercializó la primera preparación de hierro sacarosa intravenoso en España (Venofer®, Vifor Int./Grupo J.Uriach S.A.), que permitió cubrir el vacío farmacológico en aquellas situaciones clínicas en las que el hierro oral resulta ineficaz, insuficiente o contraindicado13. Hasta esa fecha, tan sólo se disponía de una preparación de hierro intramuscular (hierro sorbitol), una fórmula intravenosa accesible únicamente como medicación extranjera (hierro gluconato) y una formulación de hierro dextrano cuyo uso se abandonó debido al elevado riesgo de reacciones anafilácticas.
Ventajas e indicaciones del hierro intravenosoMúltiples ensayos clínicos aleatorizados (ECA) han demostrado una respuesta eritropoyética más rápida y prolongada con hierro parenteral que con suplementos orales2,14. Globalmente, el hierro intravenoso resulta superior en términos de eficacia, tolerancia, efecto predecible y mejoría más rápida de la calidad de vida de los pacientes en comparación con los suplementos ferrosos orales2. Asimismo, la administración de hierro parenteral posibilita una recuperación funcional más rápida y reduce el riesgo de readmisiones hospitalarias15. Los preparados intravenosos solventarían los problemas de intolerancia, malabsorción, lentitud de efecto y abandono del tratamiento asociados al hierro oral16. Por otro lado, el déficit funcional de hierro (DFH) —asociado a la AEC— no puede corregirse eficazmente con hierro oral (debido a la inhibición de la absorción intestinal y de la liberación macrofágica de hierro), pero responde favorablemente a la administración de hierro intravenoso1,15. Las posibles indicaciones de hierro intravenoso en la actualidad quedan reflejadas en la tabla 11,13,16–22.
Indicaciones del hierro intravenoso
|
DFH: déficit funcional de hierro; EII: enfermedad inflamatoria intestinal; ESA: tratamiento con agentes estimuladores de la eritropoyesis.
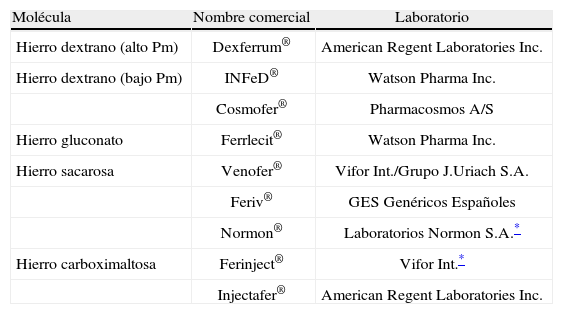
Hay distintas formulaciones de hierro intravenoso en el mercado, con diferencias en sus características físicas y bioquímicas (peso molecular, estabilidad del complejo, cinética de degradación), perfil de seguridad (toxicidad aguda, riesgo de anafilaxia) y dosificación (dosis máxima, necesidad de dosis de prueba, tiempo de infusión, posibilidad de bolo intravenoso)2. Los preparados disponibles son hierro dextrano de alto peso molecular, hierro dextrano de bajo peso molecular, hierro gluconato, hierro sacarosa y hierro carboximaltosa (tabla 2)2,12,23. En España, actualmente sólo están comercializados Venofer®, Feriv®, Hierro Sacarosa Normon® (hierro sacarosa) y Cosmofer® (hierro dextrano de bajo peso molecular). Nuevas preparaciones de hierro parenteral, como Ferumoxytol® (AMAG Pharmaceuticals) —nanopartículas de óxido de hierro— o Iron-HES —suspensión coloidal de oxihidróxido férrico recubierto de hidroxietil almidón—, han demostrado su eficacia y su seguridad en varios ECA (fase iii) en pacientes con insuficiencia renal crónica y anemia24–26. Todas las preparaciones de hierro intravenoso están formadas por un núcleo central (core) de hierro elemental recubierto por una capa glucídica que estabiliza el complejo y ralentiza la liberación del hierro. Los distintos preparados difieren en el tamaño del núcleo férrico y la identidad y densidad de la cubierta de carbohidratos12,27. El peso molecular del complejo, reflejo del tamaño del núcleo y su cubierta, determina su velocidad de degradación, y ésta, a su vez, condiciona la dosis para administrar y el ritmo de infusión26–28. Una dosis excesiva de hierro intravenoso podría implicar una liberación acelerada del hierro elemental del complejo y sobresaturar la capacidad de unión de la transferrina plasmática, con posibilidad de reacciones anafilactoides por exceso de «hierro libre»26,27,29. Tras su administración intravenosa (en forma de bolo o perfusión), los complejos hierro-carbohidrato se mezclan con el plasma y los macrófagos del sistema reticuloendotelial (SRE) del bazo, el hígado y la médula ósea los fagocitan a través del receptor de superficie transportador de metales divalentes o DMT126. Dentro del fagocito, el hierro se libera del complejo con 2 posibles rutas: incorporación al depósito intracelular (unido a la ferritina) o liberación plasmática a un ritmo variable para unirse a la transferrina, disponible así para la eritropoyesis12,15. El hígado aclara los carbohidratos. La tasa de transferencia al plasma es más rápida y completa en casos de ferropenia que en situaciones de DFH. En algunos preparados de hierro intravenoso, como el hierro sacarosa, una pequeña fracción del producto (del 4 al 5%) pasa directamente a la transferrina plasmática, lo que resulta rápidamente disponible para la eritropoyesis14,23,30–32. El hierro sacarosa (hidróxido férrico-sacarosa, semivida plasmática de 5 a 6h), debido a su peso molecular (34–60kDa) y a la alta hidrosolubilidad, posee una rápida difusión tisular y una elevada biodisponibilidad, lo que resulta especialmente eficaz en la donación de hierro directamente a los precursores eritroides medulares20.
Preparados del hierro parenteral
| Molécula | Nombre comercial | Laboratorio |
| Hierro dextrano (alto Pm) | Dexferrum® | American Regent Laboratories Inc. |
| Hierro dextrano (bajo Pm) | INFeD® | Watson Pharma Inc. |
| Cosmofer® | Pharmacosmos A/S | |
| Hierro gluconato | Ferrlecit® | Watson Pharma Inc. |
| Hierro sacarosa | Venofer® | Vifor Int./Grupo J.Uriach S.A. |
| Feriv® | GES Genéricos Españoles | |
| Normon® | Laboratorios Normon S.A.* | |
| Hierro carboximaltosa | Ferinject® | Vifor Int.* |
| Injectafer® | American Regent Laboratories Inc. |
Pm: peso molecular.
El hierro intravenoso posee una rápida biodisponibilidad para la eritropoyesis y acelera la recuperación de la anemia33. El incremento estimado de la hemoglobina es aproximadamente de 1g/dl por cada 150 a 200mg de hierro intravenoso administrado. Su efecto eritropoyético se manifiesta a partir del 7.o al 10.o día de tratamiento, y se consigue una respuesta positiva (incremento de hemoglobina ≥2g/dl) en 2 a 4 semanas2,34. La administración de hierro intravenoso consigue concentraciones máximas plasmáticas de hierro a los 10 min, incorporación de hierro a la médula ósea en menos de una hora y una tasa de utilización para la eritropoyesis del 59 al 99% a las 4 semanas (hierro sacarosa)29,35,36. La dosis de hierro necesaria para corregir el déficit, con el objetivo de restablecer las concentraciones de hemoglobina y reponer los depósitos biológicos, debe calcularse de forma individualizada (mg de hierro elemental) en función del peso del paciente y de la concentración plasmática de hemoglobina mediante la fórmula clásica de Ganzoni: déficit de hierro (mg)=peso (kg)×[hemoglobina «diana» (g/dl)–hemoglobina actual (g/dl)]×2,4+50031–33,37. La rápida liberación del hierro administrado limita la dosis máxima que podría aportarse en una sola administración23. Sin embargo, hay pocos datos sobre la dosificación más óptima y segura, con múltiples regímenes de administración publicados (dosis de 20 a 500mg, únicas o repetidas, en bolo o perfusión)23,38–41. Así, Chandler et al comprobaron la seguridad de dosis de 200mg y de 300mg de hierro sacarosa perfundido en 250ml de suero salino en 2 h, en 189 pacientes nefrópatas23. Bisbe et al confirmaron la eficacia de la administración preoperatoria de 200mg de hierro sacarosa diluidos en 200ml de suero salino en 30min, una a 3 veces por semana, en 27 pacientes candidatos a cirugía ortopédica mayor1. Una de las pautas más empleadas consiste en 100 a 200mg por dosis, con un máximo de 600mg/semana, diluido en 100 a 250ml de suero fisiológico y perfundido en 20 a 30min40,42. Hay experiencia clínica con hierro intravenoso en altas dosis e incluso en monodosis (total dose infusion), con dosis variables de 1.000 a 3.750mg, que permitiría disminuir el número de dosis y simplificar así notablemente su administración, con pocos efectos adversos asociados17,19,33,38,39,43–45. Blaustein et al comprobaron la seguridad y la eficacia de un régimen de 2 dosis de 500mg de hierro sacarosa diluido en 250ml de suero salino en 3 h, en 2 días consecutivos, en un estudio prospectivo en 107 pacientes nefrópatas, con incrementos significativos de los valores del índice de saturación de transferrina (IST) y ferritina y una tasa de efectos adversos atribuibles al tratamiento del 1,8%39. Schröder et al confirmaron la seguridad de una dosis única máxima de 500mg de hierro sacarosa perfundido en 250ml de suero salino en 3,5h en 31 pacientes con anemia ferropénica de origen digestivo, con una tasa de efectos adversos del 6,5% (todos éstos leves y transitorios)38. Algunos estudios han empleado regímenes de perfusión más lentos en un intento de reducir las tasas de efectos adversos23,39.
Efectos adversos del hierro intravenosoLos efectos secundarios clásicamente descritos de los preparados de hierro parenteral son cefalea, urticaria o prurito, dolor torácico, lumbalgia, sabor metálico, artromialgias, temblor, náuseas y vómitos, diarrea, epigastralgia, edemas periféricos, hipotensión, bradicardia, proteinuria y otras reacciones anafilactoides (atribuidas a la presencia de hierro libre) o anafilácticas (sólo descritas con hierro dextrano)32,46. Algunos estudios experimentales y modelos animales indican que un tratamiento excesivo con hierro parenteral podría generar citotoxicidad, estrés oxidativo, disfunción neutrofílica, e incluso, promover la aterosclerosis41,46,47. Globalmente, la prevalencia de efectos adversos graves asociada al hierro intravenoso es muy baja, en torno a 2,2-5casos/millón de dosis (mortalidad estimada de 0,3 a 0,4casos/millón), inferior a la descrita con el uso de TSA, en que la prevalencia de efectos adversos graves es superior a 10casos/millón de dosis (mortalidad de 4casos/millón)8,15,48. Los nuevos preparados de hierro intravenoso comportan menos efectos adversos (<0,5%) que sus predecesores (como el hierro dextrano de alto peso molecular, actualmente obsoleto debido al riesgo potencial de anafilaxia mediada por anticuerpos y de mortalidad), y actualmente representan preparaciones muy eficaces y seguras12,15,41,48–51. En la actualidad se considera al hierro sacarosa la formulación de hierro parenteral más segura, seguida del hierro gluconato50. El uso de hierro intravenoso está contraindicado en anemias con depósitos férricos totalmente completos, indicios de sobrecarga férrica y primer trimestre de embarazo. A pesar de que ningún estudio en humanos ha demostrado un incremento significativo en el riesgo de infecciones (o progresión neoplásica) con la administración de hierro intravenoso, debe emplearse con prudencia en casos de infección aguda o crónica12,41,46,52. Se recomienda detener el tratamiento durante los episodios de bacteriemia. En pacientes con infección crónica activa deben sopesarse los potenciales riesgos y beneficios, y considerar la relevancia de la AEC asociada (subsanable únicamente con ferroterapia parenteral). Durante la administración de hierro parenteral resulta relativamente frecuente un incremento leve y transitorio de los valores de alanina-aminotransferasa (menos del 10% de los casos) o de aspartato-aminotransferasa, gammaglutamil transpeptidasa y lactatodeshidrogenasa (menos del 1%). Según la ficha técnica de algunos preparados, la elevación de las aminotransferasas 3 veces por encima de los valores normales es una contraindicación para su administración. Aunque el hierro parenteral podría contribuir al daño hepatocelular en pacientes con el virus de la hepatitis C (VHC), algunos estudios confirman que su administración controlada (concretamente, en pacientes con VHC en hemodiálisis) representa una medida eficaz y segura en la corrección de la anemia53,54. Por último, debe evitarse la administración de hierro parenteral en pacientes con insuficiencia hepática en que la sobrecarga férrica es un factor desencadenante, como la hemocromatosis o la porfiria cutánea tarda.
Estudios sobre el hierro intravenosoUn gran número de trabajos han demostrado la eficacia clínica del hierro intravenoso en términos de recuperación de las cifras de hemoglobina, reducción de TSA perioperatoria, reducción de infección y complicaciones postoperatorias, estancia hospitalaria y mortalidad1,3,8,13–15,30,34,55–59. Asimismo, el uso de hierro intravenoso, asociado o no a ESA (erythropoiesis stimulating agents ‘agentes estimuladores de la eritropoyesis’), resulta especialmente eficaz en el tratamiento de la anemia preoperatoria en pacientes candidatos a cirugía programada, incluidos los programas de autotransfusión1,13,27,60. Numerosas series confirman el papel del hierro intravenoso, asociado o no a ESA, como parte imprescindible del tratamiento de la anemia en pacientes neoplásicos, enfermos nefrológicos y pacientes en tratamiento quimioterapéutico, con mejorías significativas en las concentraciones de hemoglobina, tasa de TSA, respuesta hematopoyética, efectos adversos y calidad de vida12,30,32,61–66. La mayoría de los estudios sobre ferroterapia intravenosa publicados analizan criterios de valoración similares: el número y la proporción de pacientes que alcanzan las concentraciones «diana» de hemoglobina (habitualmente de 14 a 15g/dl o de 11 a 12g/dl en pacientes nefrológicos y en pacientes oncológicos), IST (≥20 o al 50%) y ferritina (≥100μg/l); el número y la proporción de los pacientes que presentan una respuesta eritropoyética positiva (incremento de hemoglobina ≥2g/dl) y el tiempo medio necesario para alcanzarla; los picos máximos de hemoglobina, ferritina e IST y los tiempos necesarios para alcanzarlos; el número y la proporción de pacientes que precisan TSA perioperatorios y el índice transfusional, así como el porcentaje de abandonos y efectos secundarios leves frente a los efectos secundarios graves19,37,55. Para monitorizar la respuesta a la administración de hierro intravenoso deben solicitarse hemogramas y determinaciones ferrocinéticas seriadas.
Estudios con hierro intravenoso en Cirugía GeneralMúltiples estudios han confirmado la eficacia del hierro intravenoso, asociado o no a ESA, en la corrección de la anemia preoperatoria y postoperatoria en enfermos candidatos a cirugía gastrointestinal13,58,60. El estudio de Kosmadakis et al (ECA, n=63 casos) demostró la eficacia de la administración diaria de hierro sacarosa intravenoso (100mg/día) y de epoetina alfa subcutánea (300U/kg/día) durante 14 días perioperatorios (7 días antes y 7 días después de la intervención) en pacientes candidatos a cirugía oncológica gastrointestinal (el 79% colorrectal y el 21% gástrica), con mejorías significativas en concentraciones de la hemoglobina pre y postoperatorias, disminución de la necesidad de TSA intraoperatoria (el 29% en el grupo de tratamiento frente al 59% en el grupo control, p=0,02) y postoperatoria (el 3 frente al 28%, p=0,001), reducción de las complicaciones postoperatorias (el 13 frente al 41%, p=0,02), estancia hospitalaria (10 días frente a 13 días, p=0,02) y mayor supervivencia al año (el 81 frente al 59%, p=0,04)58. Braga et al demostraron la eficacia de la combinación preoperatoria de gluconato férrico intravenoso (125mg/día durante 15 días) y rHuEPO (recombinant human erythropoyetin 'eritropoyetina humana recombinante') (400U/kg, dividido en 4 dosis cada 4 días) en términos de incremento del valor preoperatorio de hemoglobina (incremento medio de 2,2g/dl) en 20 pacientes afectados de neoplasia gastrointestinal y candidatos a cirugía electiva67. Tsuji et al (ECA, n=10 casos) demostraron la eficacia de la combinación perioperatoria diaria (desde el 7.° día preoperatorio hasta el 14.° día postoperatorio) de rHuEPO (200U/kg/día) y hierro intravenoso (40mg/día) en la prevención de la anemia postoperatoria y en la reducción de las necesidades de TSA tras gastrectomía por neoplasia gástrica59.
Estudios con hierro intravenoso en otras especialidades médicas y quirúrgicasDesde 1998, el hierro parenteral se ha convertido en parte del tratamiento estándar de los pacientes con insuficiencia renal crónica en programa de hemodiálisis18,62. Múltiples estudios han demostrado la superioridad del hierro parenteral frente al hierro oral en pacientes en régimen de tratamiento sustitutivo renal (hemodiálisis y diálisis peritoneal continua) o estado prediálisis, con incrementos significativos en las concentraciones de hemoglobina, ferritina, IST y la tasa de reducción de las dosis necesarias de rHuEPO32,49,68–70. La seguridad del hierro sacarosa también se ha confirmado en este grupo de pacientes en múltiples ensayos24,51,66,71. Varios trabajos han confirmado la seguridad y la eficacia del hierro parenteral en el tratamiento de la anemia ferropénica durante el embarazo57. Así, Al-Momen et al demostraron que la administración diaria de 200mg de hierro sacarosa resultaba superior en términos de concentraciones de hemoglobina alcanzadas (12,8g/dl frente a 11g/dl), valores de ferritina y rapidez de acción (concentración máxima de hemoglobina alcanzado en 6,9 semanas frente a 14,9 semanas) en comparación con un régimen estándar de sulfato ferroso oral72. Perewusnyk et al documentaron el perfil de seguridad del hierro sacarosa (tasa de reacciones adversas del 0,36%) en la anemia asociada al embarazo57. Van Wyck et al demostraron en un ECA con 352 pacientes una respuesta más rápida, eficaz y mejor tolerancia con hierro carboximaltosa intravenoso (dosis máxima de 1.000mg/semana) en comparación con sulfato ferroso oral (325mg/8h) en el tratamiento de la anemia puerperal55. Los trabajos de Breymann et al y Seid et al confirman en sendos ECA, con 349 y 291 casos respectivamente, la eficacia, la seguridad y la tolerancia del hierro carboximaltosa (máximo de 1.000mg/semana) en comparación con el sulfato ferroso oral en el tratamiento de la anemia puerperal, pues acortan el tiempo de respuesta y mejoran la tolerancia digestiva56,73. Asimismo, varios estudios confirman la seguridad y la eficacia del hierro sacarosa en la corrección de la anemia ferropénica en la población pediátrica74. Gasche et al evaluaron en un ensayo clínico (n=40 pacientes) la eficacia de la administración periódica de hierro intravenoso (hierro sacarosa, 200mg/dosis), solo o combinado con ESA, en el tratamiento de la anemia de la enfermedad de Crohn refractaria a hierro oral. La mayoría de los pacientes (el 75% en el grupo sin rHuEPO y el 95% en el grupo que recibió rHuEPO) respondió satisfactoriamente al hierro parenteral; el incremento de la hemoglobina se asoció a cambios positivos en las escalas de calidad de vida e índice de actividad de la enfermedad. Los autores concluyeron que el hierro sacarosa es el tratamiento de elección en pacientes que no responden o que no toleran la ferroterapia oral y que la coadministración de ESA desempeñaría un papel secundario75. Gasche et al demostraron en otro estudio multicéntrico la eficacia del hierro sacarosa (dosis total media de 1,2g) en 103 casos de anemia grave asociada a la enfermedad inflamatoria intestinal (EII), con una respuesta satisfactoria del 65% y una respuesta parcial del 35%76. El estudio retrospectivo de Bodemar et al comprobó la eficacia y la seguridad del hierro sacarosa en 61 pacientes afectados de EII y anemia e intolerancia previa a la ferroterapia oral (32 pacientes con enfermedad de Crohn y 29 enfermos con colitis ulcerosa); la tasa de respuesta satisfactoria fue del 91% a las 12 semanas77. Kulnigg et al comprobaron en un ECA multicéntrico la eficacia y la seguridad del hierro carboximaltosa intravenoso en comparación con el hierro oral en 200 casos de anemia ferropénica asociada a EII (déficit medio estimado de 1.405mg en el grupo de hierro parenteral). El régimen empleado fue hierro carboximaltosa (1.000mg/semana) frente a sulfato ferroso oral (200mg/día); los resultados del estudio mostraron un incremento medio de las cifras de hemoglobina y perfil de seguridad similares, pero con mayor rapidez de acción e incremento de los valores de ferritina en el grupo de hierro parenteral37. La administración perioperatoria de hierro intravenoso (con o sin ESA asociados) ha demostrado una reducción de TSA y complicaciones postoperatorias, especialmente infecciones, en cirugía ortopédica en múltiples estudios14,34,42,78–80. Asimismo, la combinación de ferroterapia y ESA incrementa la eficacia de los programas de donación autóloga de sangre en Traumatología y Ortopedia y Ginecología81. La anemia relacionada con neoplasias, asociada a una disminución en la calidad de vida y peor pronóstico, precisa en ocasiones de un tratamiento multimodal para su corrección (ESA, hierro oral, hierro parenteral, TSA, etc.)18. El estudio multicéntrico de Auerbach et al (ECA, n=157 pacientes afectados de anemia relacionada con quimioterapia en tratamiento con ESA) demostró la superioridad del cotratamiento con hierro intravenoso (hierro dextrano) respecto a hierro oral y a la ausencia de ferroterapia en términos de respuesta eritropoyética (el 68% con hierro parenteral frente al 36% con hierro oral y el 25% sin ferroterapia) y mejoría en la calidad de vida de los pacientes32,65. El estudio de Pedrazzoli et al sobre 149 pacientes afectados de anemia por quimioterapia confirmó la eficacia de la combinación de hierro parenteral (gluconato férrico 125mg/semana) y darbepoetina alfa en términos de respuesta hematopoyética63. Un ECA multicéntrico sobre 396 pacientes neoplásicos con anemia confirmó la superioridad de la combinación de hierro parenteral y darbepoetina sobre el uso aislado de darbepoetina (respuesta hematopoyética en el 86 frente al 73% en el grupo control, p=0,01; y necesidad de TSA del 9 frente al 20%, p=0,005)82.
Hierro carboximaltosaEl hierro carboximaltosa (HCM) es una nueva preparación isoosmolar de hierro trivalente parenteral (50mg de hierro férrico/ml) diseñada para poder administrarse rápidamente en grandes dosis, lo que reduce la necesidad de múltiples infusiones, con un óptimo perfil de seguridad y tolerancia37,55. Resulta especialmente útil en pacientes con anemia ferropénica con intolerancia al hierro oral o en enfermos que precisan una rápida reposición de los depósitos de hierro (próximamente se iniciará la comercialización de esta molécula en España bajo el nombre de Ferinject®, Vifor Int./Grupo J.Uriach S.A.)56. El HCM puede administrarse en dosis de hasta 1.000mg/semana a una velocidad de infusión muy superior a otros preparados de hierro parenteral: en forma de bolo intravenoso de hasta 200mg/día (máximo: 3 administraciones por semana) o mediante perfusión máxima de 1.000mg/semana (de 300 a 400mg diluidos en 100ml de suero salino al 0,9% en 6min o de 500 a 1.000mg diluidos en 250ml de suero salino en 15min)37,38,55. Debido a su perfil de seguridad y rapidez de administración (no precisa dosis inicial de prueba), resulta útil tanto en pacientes ingresados como en pacientes ambulatorios56. Tras su administración se obtienen concentraciones máximas de hierro en plasma en aproximadamente una hora (semivida plasmática de 7 a 12h) y el SRE del bazo, hígado y médula ósea lo capta rápidamente. Estudios de tomografía por emisión de positrones y hierro radiomarcado han demostrado que los hematíes emplean del 61 al 99% del HCM administrado; estos valores se incrementan en caso de ferropenia. Diversos estudios en anemia puerperal, hemorragia uterina, pacientes en hemodiálisis o anemia en EII han corroborado la eficacia y la seguridad del HCM, pues se incrementan rápidamente las cifras de hemoglobina y se rellenan los depósitos biológicos de hierro con pocos efectos secundarios de forma mucho más rápida que con la administración de hierro oral37,55,56,73. El HCM comporta importantes ventajas frente a otros preparados de hierro intravenoso disponibles, por lo que representará una valiosa arma terapéutica en el tratamiento de la anemia.