El aumento en la calidad de vida, la mejora en los cuidados perioperatorios, la aplicación del concepto de fragilidad y un mayor desarrollo de técnicas quirúrgicas permite a pacientes ancianos el acceso a la cirugía hepática. Sin embargo, la edad sigue siendo limitante para la implementación de protocolos ERAS en este grupo.
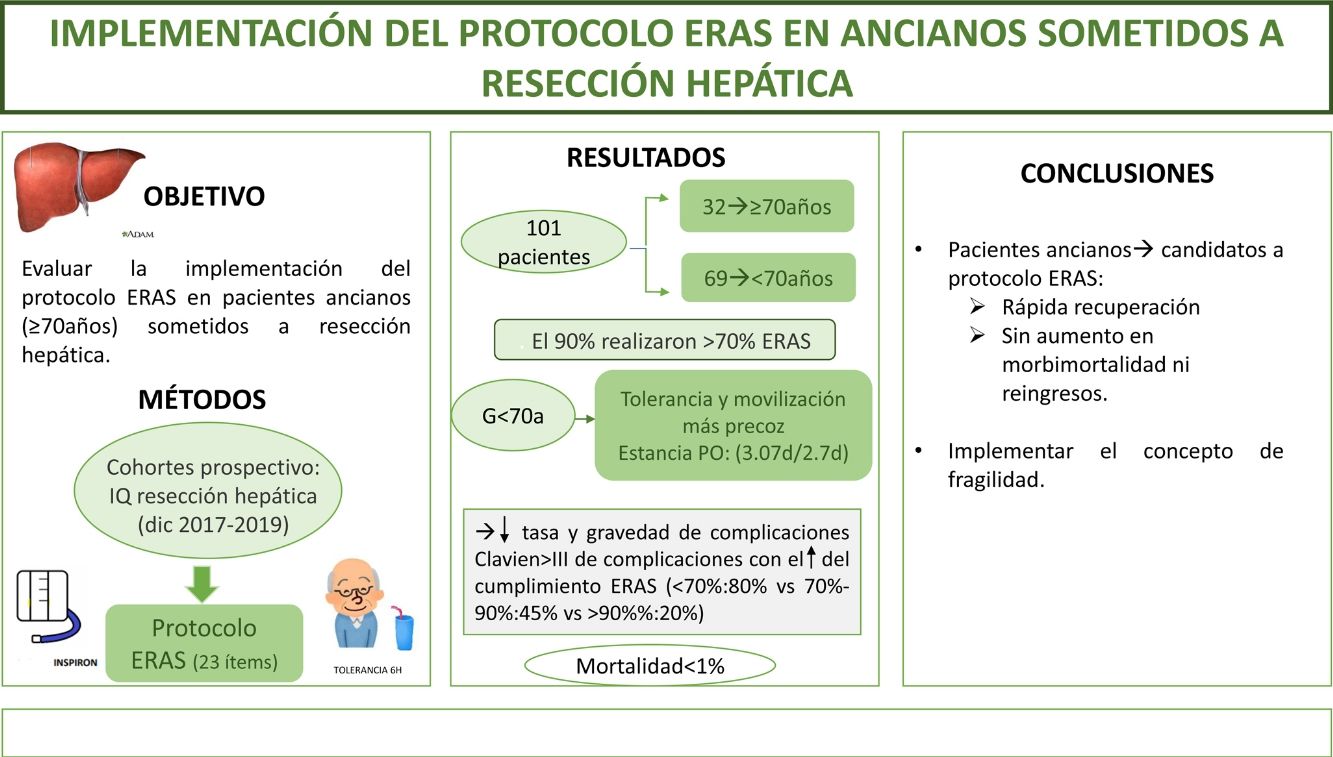
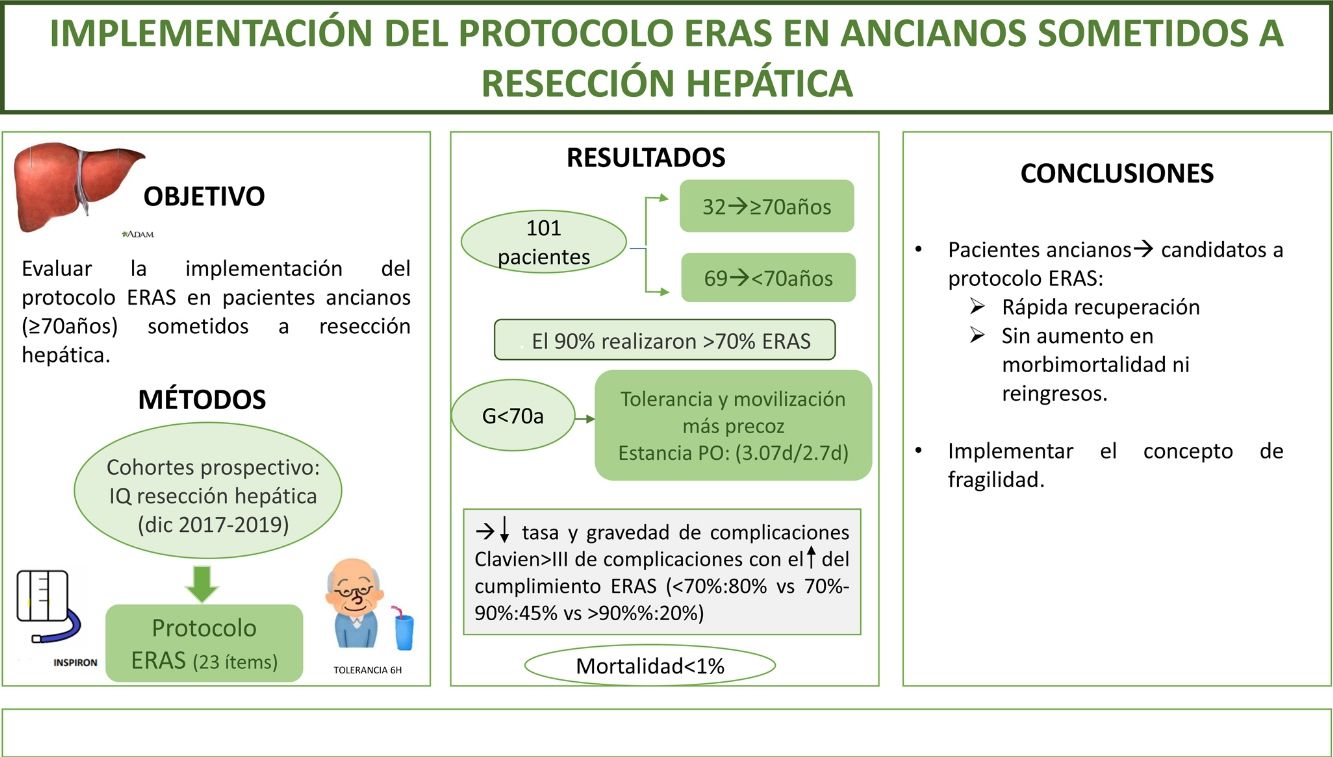
El objetivo del estudio es evaluar la implementación del protocolo ERAS en pacientes ancianos (≥70años) sometidos a resecciones hepáticas.
MétodosEstudio de cohorte prospectivo que incluye pacientes intervenidos de resección hepática durante diciembre de 2017 a diciembre de 2019 sometidos a un programa ERAS, comparando los resultados de pacientes ≥70años (G≥70) frente a <70años (G<70). La fragilidad se midió con el score Physical Frailty Phenotype.
ResultadosSe incluyeron 101 pacientes, de los que 32 (31,6%) correspondieron a G≥70. El 90% de ambos grupos verificaron realizar >70% del ERAS. Se encontraron diferencias a favor del G<70 en el inicio de tolerancia y la movilización activa el primer día postoperatorio. La estancia postoperatoria fue superponible (3,07días vs 2,7días). La morbimortalidad fue similar; ClavienI-II (G≥70: 41% vs G<70: 30,5%) y ≥III (G≥70: 6% vs G<70: 8,5%), al igual que los reingresos. La mortalidad global fue <1%. El cumplimiento del ERAS se asoció a un descenso en las complicaciones (ERAS <70%: 80% vs ERAS >90%: 20%; p=0,02) y de la gravedad de las mismas en la serie global y en ambos grupos a estudio. El 6% del G≥70 presentó fragilidad; el único paciente fallecido alcanzó un índice de fragilidad de 4.
ConclusiónLos pacientes ancianos son candidatos a entrar en protocolo ERAS obteniendo una rápida recuperación, sin aumentar la morbimortalidad ni los reingresos.
The increase of quality of life, the improvement in the perioperative care programs, the use of the frailty index, and the surgical innovation has allowed to access of complex abdominal surgery for elderly patients like liver resection. Despite of this, in patients aged 70 or older there is a limitation for the implementation ERAS protocols.
The aim of this study is to evaluate the implementation ERAS protocol on elderly patients (≥70years) undergoing liver resection.
MethodsA prospective cohort study of patients who underwent liver resection from December 2017 to December 2019 with an ERAS program. We compare the outcomes in patients ≥70years (G≥70) versus <70years (G<70). The frailty was measured with the Physical Frailty Phenotype score.
ResultsA total of 101 patients were included; 32 of these (31.6%) were patients ≥70years. 90% of the both groups had performed >70% of the ERAS. Oral diet tolerance and mobilization on the first postoperative day were quicker in <70years group. The hospital stay was similar in both groups (3.07days/2.7days). Morbidity and mortality were similar; ClavienI-II (G≥70: 41% vs G<70: 30.5%) and Clavien ≥III (G≥70: 6% vs G<70: 8.5%), like hospital readmissions. Mortality was <1%. ERAS protocol compliance was associated with a decrease in complications (ERAS <70%: 80% vs ERAS >90%: 20%; p=0.02) and decrease in severity of complications in both study groups. Frailty was found in 6% of the elderly group; the only patient who died had a frailty index of 4.
ConclusionImplementation of ERAS protocol for elderly patients is possible, with major improvements in perioperative outcomes, without an increase in morbidity, mortality neither readmissions.
En España, a principios de 2019 existían 8.908.151 personas mayores de 65años, lo que suponía un 19% de la población, de los cuales el 6% eran mayores de 80años. Se estima que para el año 2068, más de 14,106 de personas serán mayores de 65años, lo que constituirá casi el 30% de la población1. El aumento de este grupo etario va acompañado de un aumento en el diagnóstico de enfermedades neoplásicas, siendo su segunda causa de mortalidad1. Este grupo social ha presentado una mejoría franca en su calidad de vida, que, junto a las mejoras en los cuidados perioperatorios y un mayor desarrollo de las técnicas quirúrgicas, encabezado por la implantación de la vía laparoscópica2, les han permitido el acceso a cirugías de alta complejidad como las resecciones hepáticas.
Es una realidad que la implantación de los protocolos de rehabilitación multimodal en diferentes áreas de la cirugía abdominal3-6 aportan una clara disminución de las tasas de morbilidad, una recuperación funcional más precoz y una disminución de la estancia postoperatoria (EPO).
La edad por sí sola no parece ser un factor predisponente de complicaciones postoperatorias7. El concepto de fragilidad, entendido como un deterioro fisiológico multisistémico y una mayor vulnerabilidad a factores estresantes, es el que se ha mostrado como el más importante predictor del curso postoperatorio8. Existen múltiples scores para definir la fragilidad; sin embargo, independientemente de la definición y de la combinación de dominios, la fragilidad está asociada significativamente con un mayor riesgo de morbimortalidad postoperatoria después de una cirugía abdominal mayor9.
Aun así, en la práctica clínica habitual la edad sigue siendo un factor limitante para la implementación de los protocolos de rehabilitación multimodal (Protocolo Enhanced Recovery After Surgery [ERAS] o P-ERAS) en cirugías abdominales mayores como es la cirugía hepática.
Este estudio pretende evaluar los resultados tras la implantación de un P-ERAS en pacientes ancianos (≥70años) sometidos a resección hepática (RH) frente a los pacientes más jóvenes (<70años), en donde ya se aplicaban de manera rutinaria.
El objetivo principal del estudio es observar los resultados de la implantación del P-ERAS en pacientes ancianos(G≥70) sometidos a RH y su influencia en la EPO, en la morbimortalidad y en los reingresos.
El objetivo secundario es valorar si el cumplimiento ERAS se relaciona con menos complicaciones.
Material y métodosPacientes y diseño del estudioPresentamos un estudio de cohortes prospectivo donde se incluyeron pacientes sometidos a RH sin otra técnica asociada para el tratamiento de las lesiones hepáticas, desde diciembre de 2017 a diciembre de 2019, ≥18años, que firmaron el consentimiento informado y aceptaron ser incluidos en el P-ERAS. Obtuvimos el permiso por parte del Comité de Ética de la Investigación Provincial de Málaga (n.° 2099-N-19).
Se excluyeron: pacientes con resección de otro órgano, hemodiálisis, valvulopatía severa, fracción de eyección <35%, enfermedad pulmonar obstructiva crónica (EPOC) gradoIV, tumores Klatskin, Associating Liver Partition and Portal vein ligation for Staged hepatectomy (ALPPS) y con irresecabilidad intraoperatoria.
Datos analizadosLas variables recogidas fueron: demográficas, etiología, American Society of Anesthesiologists Physical Status Classification (ASA), fragilidad, CHILD/Model for End Stage liver Disease (MELD), número de lesiones, vía de abordaje, técnica quirúrgica, transfusión, tiempo quirúrgico, P-ERAS, controles analíticos, morbimortalidad postoperatoria (Clavien-Dindo) y a los 30días, EPO y reingreso.
Manejo del pacienteTodos los pacientes fueron discutidos en el Comité Multidisciplinario de Tumores Digestivos, donde se consideraron candidatos para cirugía con intención curativa.
Programa ERASEl P-ERAS fue explicado por los cirujanos en consulta externa (tabla 1). Se les dio un folleto informativo de los diferentes periodos y pautas de su intervención. Se les insistió en una prehabilitación basada en: a)fisioterapia respiratoria: inspiraciones profundas ≥4 veces/día usando un inspirómetro incentivador respiratorio de flujo; b)fisioterapia motora: caminar (30-60min, 5 veces/semana), y c)nutrición: se recetaron batidos hiperproteicos 3 veces/día a todos los pacientes independientemente del estado nutricional, basado en evidencias de mejora en los resultados postoperatorios10. El tiempo medio entre la consulta y la intervención osciló entre 2 y 4 semanas.
Programa ERAS
| Programa ERAS | |
|---|---|
| 1.° Preoperatorio | |
| Consulta externa | Educación del paciente: información sobre el proceso y sobre la necesidad de su implicación durante todo el procedimientoExplicación del consentimiento informadoInformación sobre el programa ERAS que deben entender y aceptarEntrega inspirómetro y tríptico (Anexo 2) |
| Ingreso en planta: (día previo a la intervención quirúrgica) | Disminuir el tiempo de ayuno preoperatorio (6 horas)Ingesta de hidratos de carbono la noche previaPre-medicación anestésica |
| 2.° Intraoperatorio | |
| Quirófano | Medias de compresión neumática como medida antitrombóticaManta térmica para evitar la hipotermiaProfilaxis antibióticaOptimización de la fluidoterapiaUtilizar analgesia intravenosa/epiduralRetirar la SNG al finalizar la cirugíaReducir las indicaciones de drenajes después del procedimiento quirúrgico |
| 3.° Postoperatorio | |
| Tarde cirugía | Iniciar la ingesta oral la tarde de la cirugía a las 4-6 horasIncorporación la tarde de la cirugía para conseguir una deambulación precozEvitar el uso de opioides. Uso de analgesia siguiendo las recomendaciones del departamento de anestesia |
| 1-3.° día postoperatorio | Retirar la SNG si no se había retirado previamenteRetirar la sonda vesicalProgresar dietaDeambulación activaControles analíticos seriados |
ERAS: Enhanced Recovery After Surgery; SNG: sonda nasogástrica.
El P-ERAS (tabla 1) fue realizado de forma multidisciplinaria por los diferentes profesionales que participan en este proceso.
AuditoríaPara determinar el cumplimiento del P-ERAS, al igual que el estudio de Pisarska et al.11 sobre la adherencia al protocolo, consideramos un cumplimiento adecuado cuando alcanzaban entre el 70 y el 90% de los ítems establecidos.
Todo el equipo multidisciplinar implicado en el P-ERAS auditó su parte del proceso. El investigador principal analizó los datos obtenidos. Enfermería: 1)al ingreso, comprueba ítems que debieron realizar en domicilio. 2)En quirófano, chequean cuidados pre/intraoperatorios. Al alta, anestesia registra su actuación en una tabla Excel. Los intensivistas recogen los datos de las primeras 24 horas (h). En planta, los cirujanos redactan la evolución clínica hasta su alta. Todo queda reflejado en la historia electrónica del paciente.
FragilidadA los pacientes ≥70años se le aplicó el test de fragilidad, Physical Frailty Phenotype (PFP)12 que analiza 5 características clínicas: disminución de la masa corporal magra, fuerza de agarre, resistencia, velocidad al caminar y actividad física. Los pacientes que muestran más de 3 características se consideran frágiles, 1-2 son pre-frágiles y 0 son no frágiles. Se analizaron las complicaciones en los diferentes subgrupos.
Criterios de alta y seguimiento postoperatorioLos pacientes deben cumplir unos criterios para ser alta: tolerar dieta sólida, dolor controlado con analgesia oral, controles analíticos adecuados (hemoglobina, leucocitos, enzimas hepáticas y factores de síntesis) y presentar movilización activa.
El seguimiento se realizó: a la semana, revisión por enfermería, y al mes, en consulta externa médica. Los datos recogidos fueron: grado de dolor (escala visual analógica [EVA]), necesidad de analgesia, complicaciones, reincorporación a la vida normal, control analítico y tasas de reingreso.
AnestesiaPara el control del dolor postoperatorio, independientemente de la etiología del paciente, se han utilizado analgésicos de primer escalón, como describen Melloul et al.13. El uso de opioides quedó a decisión de anestesia en función del paciente y del tipo de intervención. En caso de precisarlos, se valoraron la farmacocinética y la farmacodinamia previo a decidir cuál usar. Dentro del P-ERAS se indican: bomba de analgesia epidural en cirugía abierta y analgesia intravenosa o bomba de analgesia intravenosa en laparoscopia. En pacientes cirróticos, debido al potencial riesgo de hemorragia secundario a trombopenia y/o alteración de coagulación, no se utilizan catéteres epidurales.
CirugíaDesde 2004 se inició el abordaje laparoscópico para RH en nuestra unidad6, el cual ha ido aumentando progresivamente hasta alcanzar esta vía el 82% en 2019. En vía abierta se realiza incisión subcostal derecha ampliada, y en la vía laparoscópica, posición francesa para los segmentos anteriores y decúbito lateral izquierdo para los segmentos VI-VII. Sistemáticamente se prepara el hilio hepático para la maniobra de Pringle y se usa ecografía intraoperatoria.
Se consideró resección hepática mayor (RHM) y resección hepática menor según las definiciones de la enciclopedia médico-quirúrgica14.
En pacientes con patología neoplásica utilizamos verde de indocianina para delimitar la zona anatómica hepática y la línea de transección. La RH se realiza mediante coagulación bipolar, disector ultrasónico y mixto. Utilizamos endograpadoras de 35mm para seccionar los pedículos vasculares.
Análisis estadísticoPara el análisis estadístico se empleó el programa Statistical Package for Social Sciences (SPSS). Las variables categóricas se expresaron en número y porcentaje, y las cuantitativas, como media y desviación estándar. El análisis bivariante se realizó con t de Student en las variables cuantitativas y chi-cuadrado en las cualitativas. Se realizó un modelo de regresión logística multivariante tomando como variable resultado las complicaciones postoperatorias. Para alcanzar un nivel de significación estadística se usó p<0,05.
ResultadosTuvieron indicación de RH 116 pacientes. De ellos, 15 pacientes (13%) fueron excluidos del estudio por: irresecabilidad intraoperatoria (7), infiltración diafragmática (3) y por asociar algún tipo de sutura intestinal (5). Un total de 101 resecciones fueron incluidas en el estudio, de las cuales 32 (31,6%) correspondieron a G≥70.
DemográficosAmbos grupos fueron homogéneos respecto a sus características demográficas (tabla 2). La indicación quirúrgica fue similar en ambos grupos, siendo la causa más frecuente las metástasis de cáncer colorrectal (CCR) (G≥70: 50% vs G<70: 56%; p=0,489), seguidas del hepatocarcinoma. El porcentaje de pacientes cirróticos también fue similar en los dos grupos (G≥70: 34% vs el grupo <70 (G<70): 27%). Funcionalmente el 95% de la serie eran ChildA y el MELD varió entre 6 y 14. Aunque no alcanzó diferencias estadísticamente significativas, el G<70 presentó mayor índice de hipertensión portal (HTP) (G≥70: 9% vs G<70: 12%). La HTP se definió como pacientes con recuento de plaquetas inferior a 80×109/l, presencia de esplenomegalia y/o varices en el TAC abdominal.
Variables demográficas
| ≥ 70 años (n=32) | < 70 años (n=69) | p | |
|---|---|---|---|
| Sexo (H/M) | 69% (22)/31% (10) | 65% (45)/35% (24) | p = 0,727 |
| ASA | |||
| I | 0% | 6% (4) | p = 0,372 |
| II | 47% (15) | 46% (32) | |
| III | 53% (17) | 48% (33) | |
| Cirrosisa | 34% (11) | 27% (19) | p = 0,484 |
| MELD | 7 (6-14) | 6 (6 – 13) | p = 0,126 |
| Child A | 90% | 100% | p = 0,271 |
| HTP | 9% (3) | 12% (8) | p = 0,496 |
| Etiología | p = 0,489 | ||
| Metástasis CCR | 50% (16) | 56% (39) | |
| CHC | 37% (12) | 27% (19) | |
| Colangiocarcinoma | 6% (2) | 3% (2) | |
| Otros | 6% (2) | 13% (9) | |
| Physical Frailty Phenotype | |||
| No frágil | 23 (71%) | ||
| Pre-frágil | 7 (21%) | ||
| Frágil | 2 (6%) | ||
Las variables cuantitativas son expresadas en porcentajes (n).
ASA: American Society of Anesthesiologists Physical Status Classification; CCR: cáncer colorrectal; CHC: carcinoma hepatocelular; H: hombre; HTP: hipertensión portal (definido como pacientes con recuento de plaquetas inferior a 80×109/l, presencia de esplenomegalia y/o varices en el TAC abdominal); M: mujer; MELD: Model for End Stage liver Disease.
Los pacientes con diagnóstico de metástasis de cáncer colorrectal (CCR) recibieron QT según los protocolos de diagnóstico y tratamiento del cáncer de la unidad de gestión clínica intercentros de los Hospitales Universitarios Regional y Virgen de la Victoria de Málaga y el área de Oncología del Hospital Costa del Sol (Marbella) (Anexo 2). Sin embargo, fue significativamente mayor su utilización en el G<70 (G≥70: 12% vs G<70: 32%).
FragilidadLos 32 pacientes G≥70 realizaron el score de fragilidad (PFP). Solo 2 pacientes (6%) presentaron un score 4 y, por tanto, cumplían criterios de fragilidad. Un primer paciente de 77años, cirrótico, con insuficiencia renal crónica (IRC) y EPOC moderada se intervino por colangiocarcinoma, precisando RHM. Falleció por insuficiencia hepática aguda y reagudización de su IRC. El segundo paciente, de 73años, con cirrosis enólica, fue intervenido por hepatocarcinoma, realizándose resección limitada. Presentó desorientación e íleo postoperatorio.
Cumplimiento ERASEl 72% de la muestra habían cumplido correctamente >90% del P-ERAS (tabla 3), alcanzando cifras similares en ambos grupos (G≥70: 62,5% vs G<70: 78%; p=0,135). Hubo una disminución significativa en la tasa de complicaciones con el aumento del cumplimiento del ERAS (ERAS <70%: 80% vs ERAS 70%-90%: 45% vs ERAS >90%: 20%; p=0,002) y de la gravedad de las complicaciones Clavien >III (ERAS <70%: 20% vs ERAS 70%-90%: 8,2% vs ERAS >90%: 3,3%; p=0,03).
Ítems protocolo ERAS
| ≥ 70 años (n=32) | <70 años (n=69) | p | |
|---|---|---|---|
| Cumplimiento ERAS | p = 0,468 | ||
| 100% | 22% | 33% | |
| 70%-90% | 69% | 57% | |
| <70% | 9% | 10% | |
| Consentimiento informado firmado | 100% | 100% | |
| Asesoramiento preoperatorio | 100% | 100% | |
| Nutrición preoperatoria | 100% | 100% | |
| Ayuno de 6 horas | 100% | 100% | |
| Medicación preanestésica | 100% | 100% | |
| Medias compresivas | 100% | 100% | |
| Profilaxis antibiótica | 100% | 100% | |
| Esteroides perioperatorios | 95% | 98% | |
| Control glucémico | 100% | 100% | |
| Fluidoterapia guiada | 100% | 100% | |
| Cirugía laparoscópica | 87% | 84% | |
| Profilaxis de náuseas y vómitos | 100% | 100% | |
| Calentamiento activo | 100% | 100% | |
| Evitar drenajes | 47% | 60% | |
| Retirada de la SNG intraoperatoria | 93% | 94% | |
| Bomba de analgesia (epidural o intravenosa) | 22% | 22% | |
| AINE como coadyuvantes | 100% | 100% | ns |
| Fisioterapia respiratoria | 100% | 100% | ns |
| Tolerancia 6 horas tras cirugía | 62% | 81% | p = 0,043 |
| Movilización precoz | 69% | 78% | ns |
| Retirada de la SV el primer día postoperatorio | 75% | 81% | ns |
| Movilización activa primer día postoperatorio | 38% | 67% | p = 0,041 |
| Auditoría | 100% | 100% | ns |
Las variables cuantitativas son expresadas en porcentajes (n).
AINE: antiinflamatorios no esteroideos; ERAS: Enhanced Recovery After Surgery; ns: no significativo; SNG: sonda nasogástrica; SV: sondaje vesical.
Hallamos diferencias significativas en el inicio de la tolerancia a las 6h (G≥70: 62% vs G<70: 81%; p=0,043) y en la movilización activa el primer día postoperatorio (DPO) (G≥70: 38% vs G<70: 67%; p=0,041) a favor del G<70años.
OperatoriosNo encontramos diferencia en las variables intraoperatorias (tabla 4). El abordaje fue fundamentalmente laparoscópico: 85% en la serie. La técnica quirúrgica más utilizada fue la resección limitada, pero en ambos grupos destacan casi un 20% de RHM (G≥70: 19% vs G<70: 22%). La necesidad de trasfusión fue <10%.
Datos intraoperatorios, expresados en porcentajes, con el número de pacientes entre paréntesis
| ≥ 70 años (n=32) | <70 años (n=69) | p | |
|---|---|---|---|
| Laparoscopia | 87% (28) | 84% (58) | p = 0,651 |
| Conversión | 6,3% (2) | 1,4% (1) | p = 0,186 |
| Resección hepática | p = 0,487 | ||
| RHM | 19% (6) | 22% (15) | |
| Resección limitada | 59% (19) | 53% (37) | |
| Segmentectomía | 22% (7) | 16% (11) | |
| Lobectomía izquierda | 0 | 4% (3) | |
| Quistoperiquistectomíaa | 0 | 4% (3) | |
| Pringle | p = 0,292 | ||
| Sí | 90% (29) | 82% (15) | |
| Duración | 62 min (15 – 137) | 60 min (11 – 170) | |
| Transfusión | 12% (4) | 6% (4) | p = 0,246 |
| Pérdidas hemáticas | 400 cc (50 – 600) | 600 cc (50 – 800) | p = 0,134 |
| Tiempo quirúrgico | 210 min (70 -400) | 240 min (120- 450) | p = 0,576 |
| Drenaje | 53% (17) | 40% (28) | p = 0,238 |
cc: centímetros cúbicos; min: minutos; RHM: resección hepática mayor.
La morbimortalidad fue similar; ClavienI-II (G≥70: 41% vs G<70: 30,5%; p=0,258) y ≥III (G≥70: 6% vs G<70: 8,5%; p=0,672). La mortalidad global fue <1%. Tampoco hallamos diferencias en la EPO ni en los reingresos (tabla 5). En la serie global se analizaron los posibles factores influyentes en el desarrollo de complicaciones Clavien≥III: edad, RHM, transfusión, tiempo quirúrgico y MELD. Mostrando asociación sólo la necesidad de transfusión (HR: 1,399; IC95%: 1,260-1,998; p=0,049).
Variables en el postoperatorio
| ≥ 70 años (n=32) | <70 años (n=69) | p | |
|---|---|---|---|
| Complicaciones | |||
| No | 53% (17) | 61% (42) | p = 0,248 |
| I/II | 41% (13) | 30,5% (21) | p = 0,258 |
| Ascitis | 4 | 2 | |
| Desorientación | 3 | 0 | |
| Deterioro de la función renal | 2 | 2 | |
| Respiratorio | 0 | 3 | |
| Anemia (hierro) | 0 | 2 | |
| Íleo postoperatorio | 1 | 3 | |
| Taquicardia sinusal | 0 | 2 | |
| FA RVR | 1 | 2 | |
| Fístula biliar | 0 | 2 | |
| Transfusión | 1 | 1 | |
| Hiperbilirrubinemia | 0 | 1 | |
| Colección postoperatoria | 1 | 0 | |
| Trombosis yugular | 0 | 1 | |
| III/IV | 3% (1) | 8,5% (6) | p = 0,672 |
| Hematoma | 0 | 1 | |
| Absceso | 0 | 1 | |
| Biloma | 0 | 2 | |
| Insuficiencia hepática grado B | 0 | 1 | |
| Inestabilidad HD | 0 | 1 | |
| Epistaxis por SNG | 1 | 0 | |
| Muerte | 3% (1) | 0% | p = 0,14 |
| Reingresos | 3% (1) | 10% (7) | p = 0,224 |
| Fístula biliar | 1 | 2 | |
| Colección postoperatoria | 4 | ||
| Síndrome febril | 1 | ||
| Estancia (días) | 2,7 (1-6) | 3,07 (1-23) | p = 0,528 |
Las variables cuantitativas son expresadas en porcentajes (n).
FA: fibrilación auricular; HD: hemodinámica; RVR: respuesta ventricular rápida; SNG: sonda nasogástrica.
La aplicación de protocolos ERAS en cirugía hepática data de principios del sigloxxi15. Sin embargo, su incorporación a la práctica clínica ha sido más lenta que en otras disciplinas. Nuestro grupo lleva aplicando dichos protocolos desde hace más de una década6. La llegada de la laparoscopia y sus beneficios, claramente demostrados en la Conferencia de Southampton16, ha impulsado de forma importante la aplicación del P-ERAS, permitiendo aplicarlo a subgrupos para los que existían ciertas reticencias, como los pacientes ancianos.
La edad por sí sola no debe ser un criterio para evaluar a un anciano. El concepto de fragilidad es fundamental a la hora de plantear una cirugía en estos pacientes. Hewitt et al.17 publicaron un metaanálisis con 2.281 pacientes de entre 61 y 77años en cirugía abdominal, mostrando mayor mortalidad a 30días para los pacientes frágiles (8%)/pre-frágiles (4%) frente a los no frágiles (1%). La morbilidad fue más común en pacientes frágiles (24%) vs pre-frágiles (9%) o no frágiles (5%). Sandini et al.9, en una revisión con 1.153.684 pacientes en cirugía abdominal mayor, confirmaron que la fragilidad, independientemente de la definición, estaba asociada a un incremento de la morbilidad (OR: 2,56) y de la mortalidad (0,57) postoperatoria. El score PFP fue usado para medir la fragilidad en el G≥70. Solo dos pacientes fueron catalogados como frágiles. Esta fragilidad se relacionó con el incumplimiento del protocolo, con la aparición de complicaciones y con el único paciente fallecido en la serie. No hallamos diferencias entre pre-frágiles y no frágiles.
El 72% de la serie cumplió >90% del P-ERAS, siendo similar en ambos grupos. El 90% de los pacientes de ambos grupos verificaron realizar >70% del P-ERAS. Así que la edad no constituyó un problema para el cumplimiento del protocolo. Sin embargo, Takamoto et al.18 reportan un 82,5% de cumplimiento (objetivo: alta 6.° DPO), e indican como factores independientes de fallo de ERAS la edad >65años (OR: 3,48) y las transfusiones sanguíneas (OR: 5,47). El uso de la vía abierta, los días tardíos en retirada de sondas y los catéteres epidurales es posible que hayan condicionado el alta de los pacientes añosos.
Al igual que mostraron Pisarska et al.11 en cirugía colorrectal, observamos un mayor número de complicaciones (ERAS <70%: 80% vs ERAS 70%-90%: 45% vs ERAS >90%: 20%; p=0,02) y una mayor gravedad (Clavien>III; p=0,03) a menor cumplimiento ERAS.
La técnica quirúrgica fue superponible en ambos grupos. Destacamos el uso de la vía laparoscópica (G≥70: 87%), siendo superior a lo publicado en estos pacientes19,20. Aunque el uso de drenajes en ERAS debe ser restringido, G≥70 precisó su uso en un 53% de los casos, condicionado posiblemente por el 30% de cirróticos y el 19% de RHM. Tufo et al.21 reportan P-ERAS en cirugía hepática en 161 pacientes >70años, con un 61% de uso de drenaje, superior a nuestro grupo, lo que puede ser justificado por un uso predominante de la vía abierta y mayor número de RHM (29%).
Se ha reportado15,21-23 una rápida introducción de la dieta y la movilización tras cirugía hepática con P-ERAS. Encontramos diferencias a favor de G<70 en la tolerancia a las 6h (G≥70: 62% vs G<70: 81%). Estas diferencias desaparecieron el primer DPO, alcanzando el 97% una tolerancia completa. También observamos diferencias en la movilización activa el primer DPO (G≥70: 38% vs G<70: 67%) a favor del G<70, que volvieron a igualarse al segundo DPO (G≥70: 97% vs G<70: 98%). Todos los pacientes pasaron sus primeras 24h en la unidad de vigilancia intensiva (UVI) sin acompañante; esto pudo retrasar estos parámetros, ya que en cuanto tuvieron un cuidador los datos se igualaron. La literatura muestra que la ausencia de cuidadores en los pacientes ancianos puede elevar la morbilidad y aumentar la EPO24. A pesar de esto, el G≥70 presentó una EPO similar (G≥70: 2,7días vs G<70: 3,07días). Tufo et al.21 reportan una EPO de 6días. Solo describen un 4% de cirugía laparoscópica, lo que podría justificar su aumento de estancia. Chong et al.22 refieren en el grupo ERAS (edad media: 58años) un 30% de cirróticos, con una EPO de 5días, a pesar de un 45% de vía laparoscópica. Destaca una EPO mayor que la nuestra a pesar de tener una edad media más baja y similar porcentaje de cirróticos. Wabitsch et al.23, en su serie de 67 pacientes >70años, sin aplicación de ERAS, con el uso mínimamente invasivo, describen una estancia de 9días. La aplicación de la vía laparoscópica mejora la EPO20-23,25, pero es dentro de un P-ERAS donde se consigue la verdadera recuperación de los pacientes ancianos, como demostramos en nuestra serie.
Varias revisiones sistemáticas y metaanálisis26,27 han demostrado la reducción de complicaciones tras la aplicación de P-ERAS en cirugía hepática. Observamos un leve aumento de las complicaciones ClavienI/II en G≥70, a expensas de la ascitis en los pacientes cirróticos y de la desorientación propia de los ancianos sometidos a cirugía, que mejoró con la presencia de sus cuidadores, como ya está descrito en la literatura28. Esto no impidió su adecuada recuperación ni su alta. Las complicaciones Clavien≥III (G≥70: 6% vs G<70: 8,5%) fueron inferiores a lo publicado tanto por Tufo et al.21(11%) o por Wang et al.15 en ERAS y también menor en los estudios de ancianos y laparoscopia19,23-25, que oscilan entre el 11 y el 24%. Creemos que la falta de abordaje laparoscópico en unos y la falta de aplicación de P-ERAS es lo que justifica el aumento de sus complicaciones.
Como limitaciones encontramos: 1)Estudio unicéntrico con la consiguiente limitación en el reclutamiento de pacientes. 2)La falta de análisis de la influencia de la prehabilitación y del score de fragilidad en el desarrollo de complicaciones en la serie global por falta de recogida de datos. 3)La utilidad de la fragilidad en la práctica clínica, sobre todo en la población anciana, ya que su aplicación puede permitirnos seleccionar pacientes que no se beneficien de un tratamiento quirúrgico.
ConclusiónLos pacientes ancianos son claros candidatos a entrar en protocolos ERAS. La implementación del concepto de fragilidad, como se describe en el resto del texto, puede ayudarnos a seleccionar los pacientes para ser sometidos a RH. El perfecto cumplimiento del ERAS nos permitirá reducir las complicaciones. Aunque nos falta evidencia clínica, consideramos que la laparoscopia aporta un pilar fundamental en el cumplimiento de los protocolos ERAS, permitiendo obtener mínimas complicaciones y una rápida recuperación a la vida normal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.