La cirugía bariátrica y metabólica está desarrollando nuevos conceptos sobre la asimilación y absorción de alimentos en el intestino. Estudios recientes han destacado la función del tracto gastrointestinal en la génesis y evolución de la diabetes mellitus tipo 2. En esta revisión pretendemos dar respuesta a preguntas frecuentes sobre los mecanismos de acción y los resultados de la cirugía metabólica. Realizamos una búsqueda bibliográfica no sistemática en diferentes bases de datos, identificando artículos publicados en la última década y referidos a los mecanismos de acción de la cirugía metabólica. Entender dichos mecanismos ayudará a comprender por qué unas cirugías son más efectivas que otras y por qué los resultados pueden llegar a ser tan dispares entre pacientes sometidos a la misma técnica quirúrgica.
Bariatric and metabolic surgery is creating new concepts about how the intestine assimilates food. Recent studies highlight the role of the gastrointestinal tract in the genesis and evolution of type 2 diabetes. This article has been written to answer frequent questions about metabolic surgery results and the mechanisms of action. For this purpose, a non-systematic search of different databases was carried out, identifying articles published in the last decade referring to the mechanisms of action of metabolic techniques. Understanding these mechanisms will help grasp why some surgeries are more effective than others and why the results can be so disparate among patients undergoing the same surgical approach.
La diabetes mellitus tipo 2 (DM2) representa el 90-95% de todos los casos de diabetes diagnosticados en el mundo. La Federación Internacional de Diabetes estima que para 2040, habrá 642 millones de diabéticos1. La cirugía gastrointestinal para el tratamiento de la obesidad y sus comorbilidades ha demostrado ser la terapia más eficaz para el control de la DM2, pero actualmente aún se desconocen muchos de los mecanismos de acción. Al no estar identificados la mayoría de los mediadores de estos efectos quirúrgicos, no resulta fácil mejorarlos para hacerlos más efectivos y/o menos invasivos.
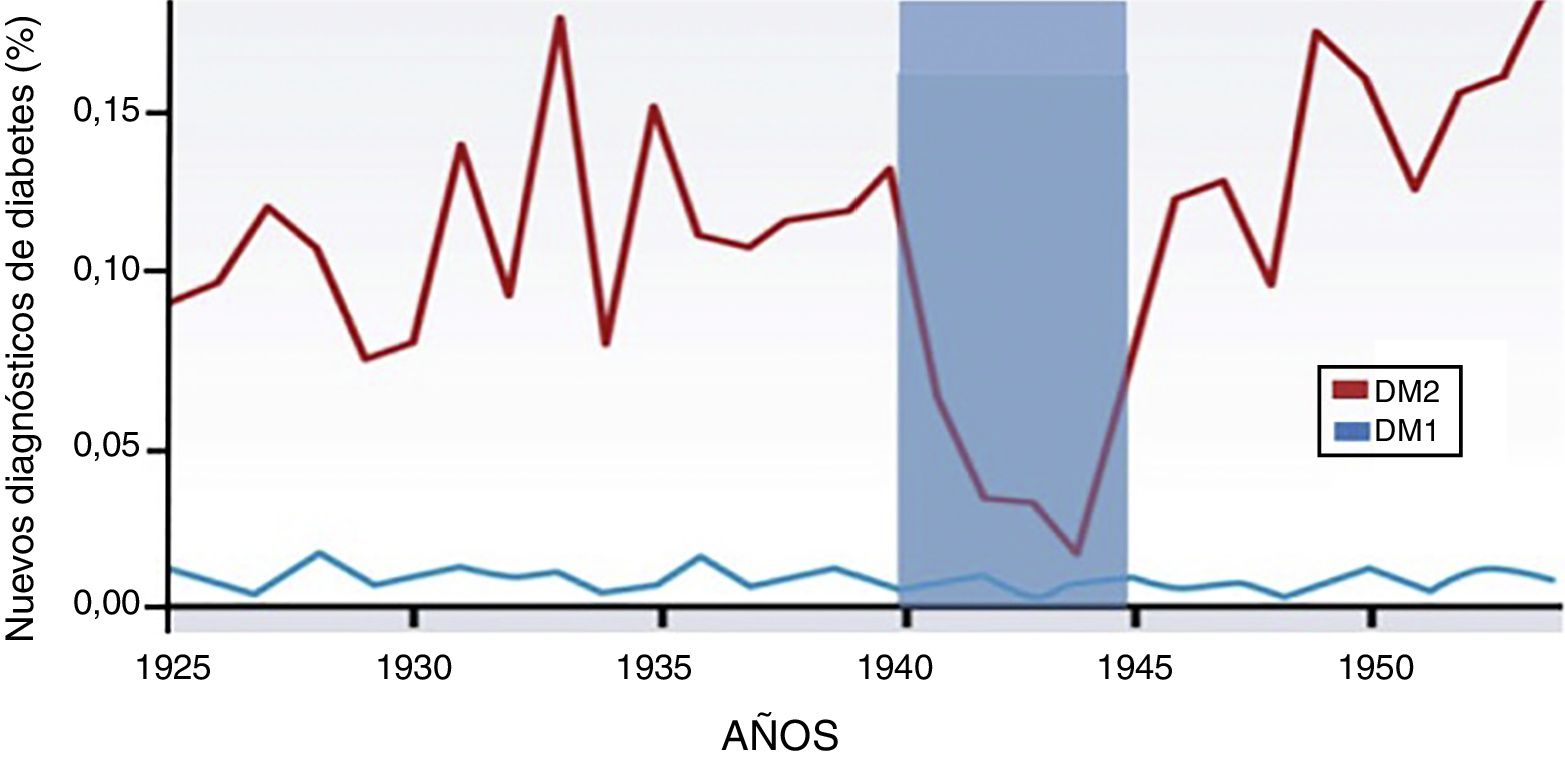
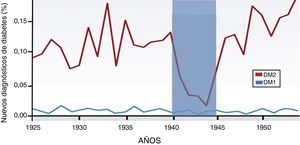
La incidencia de la diabetes tipo 1 no ha variado con el paso de los años. Sin embargo, la incidencia y prevalencia de la DM2 va aumentando y es evidente que este incremento se asocia a los cambios en la alimentación2 (fig. 1). Actualmente, los patrones nutricionales en países desarrollados muestran un alza en el consumo de productos hipercalóricos, con elevado índice glucémico, baja calidad nutritiva y cantidades no adaptadas al gasto energético. Los alimentos ingeridos inician su recorrido metabólico en el tracto gastrointestinal, por lo que conviene dejar de ver a este sistema solamente como un gestor de nutrientes y desechos, para resaltar que es un órgano endocrino-metabólico en sí mismo3.
Aumento de la incidencia de la DM2 asociada a la alimentación. Nuevos casos de diabetes diagnosticados en Noruega durante los años 1925-1955 (expresados en porcentaje-población). La incidencia de diabetes tipo 1 se mantiene durante el período de estudio. Sin embargo, la DM2 aumenta progresivamente y solo se observa una caída del 85% durante la ocupación alemana de 1940-1945. Este gráfico muestra cómo la génesis y desarrollo de la DM2 están íntimamente ligadas a la alimentación y por ende a la función del tracto gastrointestinal. El intestino tiene mayor peso en esta patología y el daño pancreático es secundario. Adaptado de Ashcroft y Rossman2.
A pesar de que cada día aumenta el número de cirugías bariátricas-metabólicas realizadas en el mundo, los resultados de las investigaciones científicas en este campo no son concluyentes y todos los días se abren nuevas hipótesis. De hecho, da la impresión de que en ocasiones los investigadores básicos y los clínicos trabajan en paralelo, pero no conjuntamente para dar respuesta a las incógnitas sobre los mecanismos de acción de la cirugía metabólica4.
Por este motivo se llevó a cabo una búsqueda no sistemática en las bases de datos MEDLINE, Cochrane Library, SCOPUS, ISI Web of Science y Ovid, identificando artículos publicados en la última década, fundamentalmente en ciencias básicas y referidos a los mecanismos de acción de la cirugía metabólica, utilizando como palabras clave: «type 2 diabetes», «bariatric surgery», «intestinal adaptation», «incretin effect», «bile acids», «microbiota», «intestinal neoglucogenesis», «glucotransporters», «enteroplasticity» y «gut/bowel flow». De esta forma, se busca dar repuesta a algunas de las preguntas frecuentemente planteadas por los cirujanos bariátricos en relación a por qué unas cirugías son más efectivas que otras y por qué los resultados pueden llegar a ser tan dispares entre los pacientes.
Nuevos conceptos sobre diabetes mellitus tipo 2 derivados de cirugía metabólicaDe las incretinas a las antiincretinasEl efecto incretínico o teoría del «hindgut» (intestino distal) es el mecanismo de acción de la cirugía metabólica más conocido. Se postula que la rápida llegada de alimentos poco digeridos al intestino distal promueve un aumento en la secreción de las hormonas intestinales denominadas incretinas. Conocer el efecto incretínico permitió el desarrollo de medicamentos antidiabéticos, como los análogos del GLP-1 (péptido similar al glucagón de tipo 1) o los inhibidores de la enzima que degrada estas hormonas (los inhibidores de la dipeptidil peptidasa-4 o anti-DPP4). Todas las técnicas bariátricas modulan de alguna manera los niveles de incretinas y, en función de esta respuesta, el efecto metabólico es mayor o menor, temporal o prolongado. Durante un tiempo, los cirujanos se limitaron a demostrar cuál de las técnicas existentes producía mayor elevación de incretinas para así «curar» la DM2. Con los años se vio que el efecto incretínico es solo un eslabón en la resolución de la enfermedad. Estudios en humanos y animales han demostrado que la glucemia puede mejorar sin necesidad de aumentar las incretinas5,6. Además, Habener et al.7 han sugerido recientemente que es el GLP-1 producido en el páncreas, y no el secretado en el intestino, el que en realidad estimula la secreción de insulina.
Otra teoría extendida se basa en la afirmación contraria: la existencia de las llamadas «antiincretinas», descritas en diversos artículos por Rubino8,9. Este autor ha señalado que todo evento en el organismo tiene una respuesta contrarreguladora. De forma que, si existe un efecto incretínico que regula la hiperglucemia, debería existir un mecanismo contrarregulador que impida la hipoglucemia. Este autor plantea que el desequilibrio entre ambos mecanismos podría ser la causa del desarrollo de la DM2. De esta forma Rubino ha sugerido la existencia de algún péptido con efecto antagónico a las incretinas, llamadas por tanto «antiincretinas». La existencia de las antiincretinas se sustenta en la teoría del «foregut» (intestino proximal), ya que se supone que estos péptidos «X» se generan en el duodeno. Por lo tanto, una sobreproducción de «antiincretinas» podría estimular los factores causantes de la DM2. Por este motivo, Rubino propone técnicas de exclusión duodenal para controlar el efecto «antiincretina». No obstante, las moléculas o péptidos que explicarían el efecto «antiincretina» son aún desconocidos, si bien Salinari et al.10 han aportado datos indirectos sobre su existencia.
Más evidencias sobre la importancia del intestino proximalSobre la exclusión duodenal son muchas las hipótesis planteadas, pero pocas las confirmadas. Se sabe que uno de los factores fundamentales en la génesis y progresión de la DM2 es la pérdida de las señales de retroalimentación entre el intestino y el hígado, principal productor de glucosa endógena. En el hígado la gluconeogénesis se activa mucho antes de que los nutrientes lleguen al sistema portal; de hecho, se activa cuando los alimentos circulan por el duodeno11. Por consiguiente, la exclusión duodenal es clave en la mejoría metabólica de la diabetes y, por ello, procedimientos endoscópicos como el «Endobarrier» han encontrado su fundamento12. Por otro lado, existe la creencia de que las señales entre el intestino proximal y el hígado difieren entre los fenotipos sanos y los diabéticos. Salinari et al.13 publicaron en 2012 un estudio demostrando que la exclusión duodenal mejora el metabolismo glucídico en ratas diabéticas no obesas (Goto-Kakizaki), pero no en ratas normales, dando a entender que el fenotipo diabético responde de manera diferente a la manipulación intestinal. Por su parte, Known et al.14 describieron que en los pacientes sometidos a bypass gástrico como tratamiento del cáncer de estómago, la insulinorresistencia mejoró en los diabéticos, pero no se modificó en los no diabéticos. En conjunto, estos hallazgos sugieren que el duodeno y el yeyuno proximal podrían contribuir a la homeostasis de la glucosa de manera diferente en los estados diabéticos frente a los no diabéticos. Otros trabajos con ratas Goto-Kakizaki demostraron que la exclusión duodenal redujo los niveles de glucemia posprandial, sin aumentar la insulina ni elevar las incretinas15,16. De hecho, en uno de estos estudios, este efecto se produjo sin necesidad de resección gástrica ni derivar amplias porciones de intestino malabsortivo, lo cual induce a pensar que los cambios a nivel de la primera porción de intestino delgado son clave16.
Importancia de la bilis: los ácidos biliares y la concentración de sodioLas técnicas bariátricas que promueven la derivación biliar (separar la bilis de los alimentos) suelen tener mejor respuesta metabólica que las técnicas únicamente restrictivas. La bilis es un líquido complejo que actúa de forma diferente según la porción intestinal. La bilis presente en el duodeno es diferente cualitativa y cuantitativamente de la bilis presente en el íleon, ya que a lo largo del intestino existen varios circuitos encargados de reabsorber los ácidos biliares y devolverlos a la circulación enterohepática17,18. La alteración del flujo intestinal de las técnicas derivativas cambia la circulación normal de la bilis, y por tanto modifica la reabsorción de ácidos biliares, lo que justifica el aumento de los ácidos biliares séricos (ABS) en la circulación19,20. Los ABS suprimen la expresión de múltiples genes implicados en la gluconeogénesis hepática, por lo tanto un aumento de ABS plasmático disminuye la neoglucogénesis hepática y en consecuencia baja la glucemia. Por otro lado, los ABS inducen la secreción de incretinas de forma directa en el intestino distal a través de la estimulación de ciertas proteínas de membrana de tipo G acopladas a un receptor conocido como TGR521. El efecto de los ABS sobre las incretinas se demostró en un estudio que administró ácidos biliares por vía rectal (ácido taurocólico)22. En este trabajo se observó que la secreción de GLP-1 e insulina aumentaba de forma dosis-dependiente al ácido taurocólico administrado. Sin embargo al bloquear los receptores del GLP-1, apenas se observaron cambios en la glucemia. Es por ello que el efecto de los ácidos biliares parece estar asociado al efecto incretínico.
Pero la bilis no es solo relevante por el contenido en ácidos biliares, sino también por el sodio, siendo el fluido corporal con mayor concentración de sodio23. Baud et al.24 describieron que la absorción de glucosa desde la luz intestinal a la circulación sanguínea se altera en el bypass gástrico debido a cambios del flujo biliar, rico en sodio. En este trabajo se centraron en la actividad de los transportadores de glucosa que se hallan en las microvellosidades de los enterocitos (polo luminal del intestino). En la luz del intestino, el principal transportador de glucosa es el cotransportador sodio-glucosa de tipo 1 (SGLT1), de tipo activo que utiliza un gradiente electroquímico, por el cual dos iones de sodio condicionan el paso de una molécula de glucosa al enterocito. Por ello, cualquier procedimiento quirúrgico o endoscópico que excluya la bilis (el sodio) de una parte del tránsito intestinal supone una actividad a la baja de los cotransportadores SGLT1 y por ende una disminución en la absorción de glucosa.
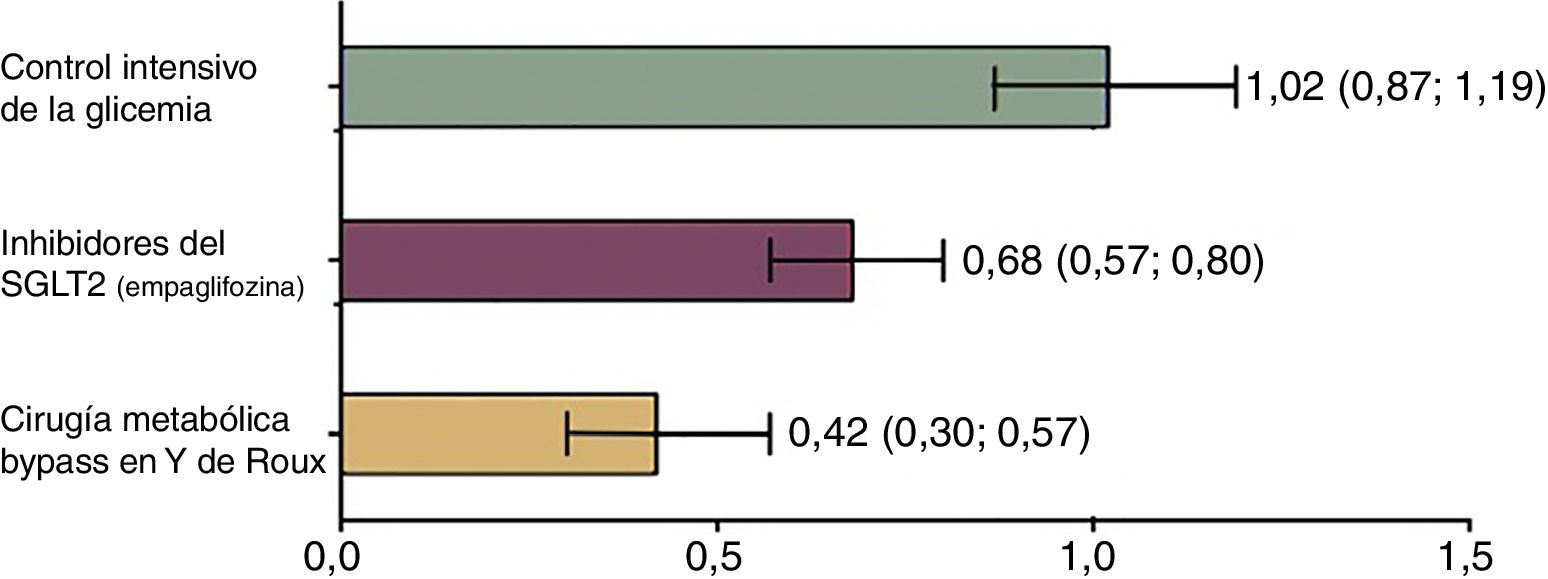
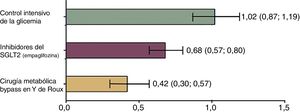
Actualmente están en desarrollo fármacos que actúan como inhibidores selectivos del SGLT1. Dichos fármacos prometen reducir la absorción de glucosa de la dieta por lo que serán claves en el tratamiento de la DM2 y de la obesidad25. Por el momento en el mercado solo están disponibles los inhibidores selectivos del cotransportador sodio-glucosa de tipo 2 (SGLT2), que son los principales cotransportadores que operan en el riñón y favorecen la excreción de glucosa por la orina26. Estos medicamentos (entre ellos la dapaglifozina, la canaglifozina y la empaglifozina) disminuyen la glucemia sin inducir la secreción de insulina y logran regular la hemoglobina glucosilada y prevenir eventos cardiovasculares27. No obstante, su potencia es aún menor que el de la cirugía28 (fig. 2). Del mismo modo, los inhibidores no selectivos de ambos transportadores (SGLT1/SGLT2) están en desarrollo y aún no se comercializan. Entre ellos están la ertugliflozina, la remogliflozina y la sotagliflozina. Se espera que en un futuro ofrecerán una alternativa terapéutica en la diabetes por su capacidad dual de acción para disminuir la glucemia29.
Relación entre el riesgo relativo de mortalidad en pacientes con DM2 según el tratamiento aplicado versus controles. La mortalidad fue analizada según todas las causas observadas entre un grupo control que no recibió intervención médica alguna y 3 grupos que recibieron diferentes terapias. Grupo 1: manejo intensivo de glucemia con medidas estándar (dieta y cambios del estilo de vida). Grupo 2: control mediante fármacos utilizando inhibidores del SGLT2 que representan la última tendencia en el tratamiento de la diabetes. Grupo 3: pacientes sometidos a cirugía metabólica (bypass gástrico en Y de Roux). El grupo 1 presentó un riesgo relativo de mortalidad similar al grupo control que no recibió terapia alguna. Mientras que el grupo sometido a cirugía mostró ser la mejor opción para reducir el riesgo de mortalidad; mejor incluso, que las nuevas terapias. Adaptado de Baud et al.28.
En el intestino conviven millones de microorganismos que se relacionan simbióticamente con el huésped. La flora bacteriana se ocupa de funciones que el intestino no puede realizar, como la síntesis de algunas vitaminas y el metabolismo de algunos polisacáridos complejos. Así mismo, mantiene activo el sistema inmune intestinal30,31. El tipo de microbiota intestinal (composición proteica y carga genética exógena) viene determinado en parte por el tipo de nutrientes ingeridos30. Existe la hipótesis que defiende que si una persona se alimenta con una dieta rica en grasas, puede incrementar la proporción de bacterias productoras de endotoxinas y generar una «endotoxemia metabólica interna». Esta endotoxemia es un estado inflamatorio crónico que induce la resistencia a la insulina31. El efecto de la cirugía sobre la flora intestinal es evidente, pues al cambiar la anatomía del tracto gastrointestinal, cambia la cantidad y calidad de los nutrientes32–35. El cambio más notable producido tras cirugía es el cambio de la relación Firmicutes/Bacteroidetes. Así pues, tras cirugía disminuyen los Firmicutes (bacterias gramnegativas) y aumentan los Bacteroidetes (bacterias grampositivas). Los Firmicutes se caracterizan por poseer niveles elevados de lipopolisacáridos (LPS), componente de la membrana bacteriana que favorece la inflamación36. Esta inflamación parece asociarse a problemas de permeabilidad, tal y como ocurre en casos de intolerancia alimentaria (lactosa, gluten, etc.). Los LPS alteran el metabolismo glucídico a través de una respuesta inflamatoria crónica37. Disminuir la proporción de Firmicutes baja el grado de inflamación, con lo cual modificar la ratio Firmicutes/Bacteroidetes tiene un efecto beneficioso per se, al margen de la pérdida de peso. Membrez et al.38 describieron que el uso de antibióticos en ratones obesos eliminó casi por completo la flora intestinal y la glucemia en ayunas mejoró, aunque persistía la obesidad.
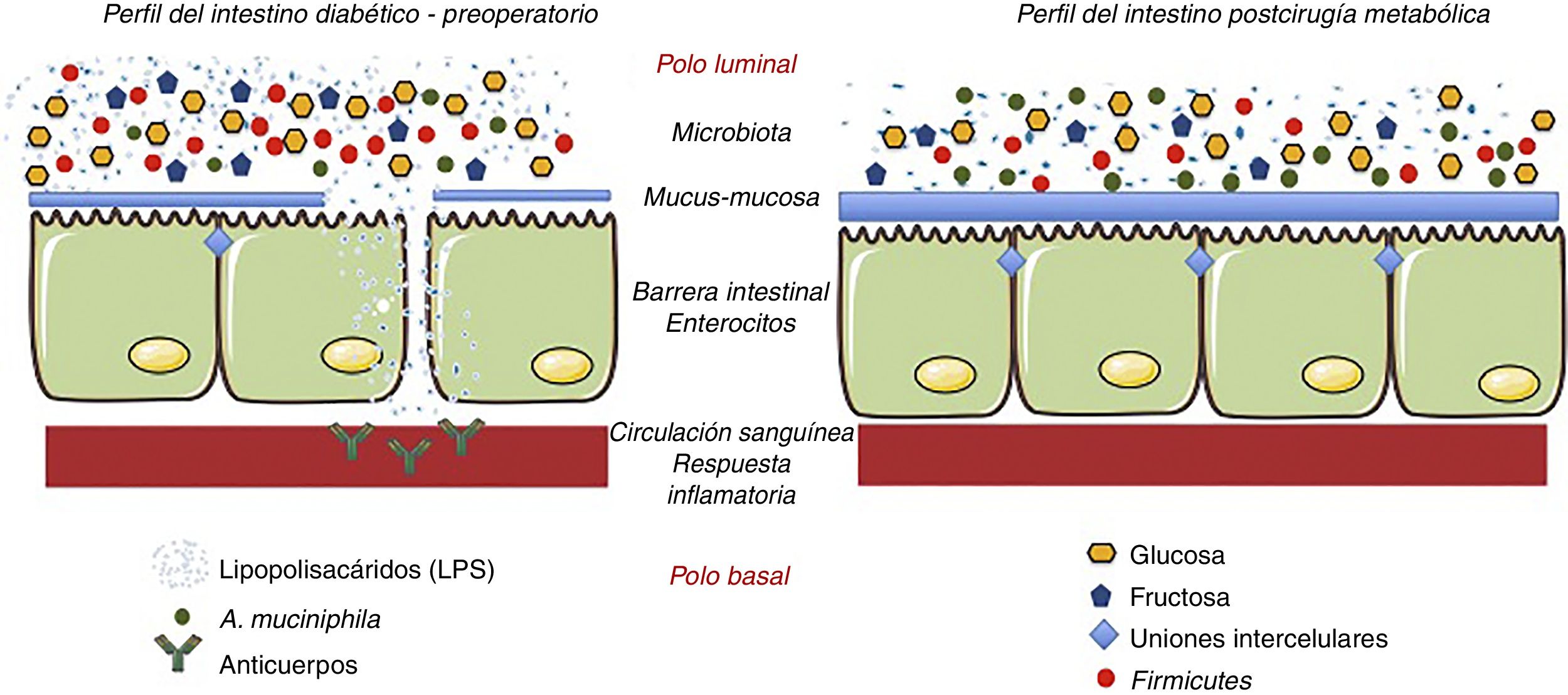
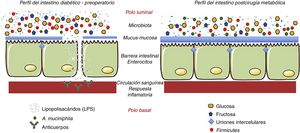
Otra hipótesis describe la presencia de una bacteria en específico, como responsable del efecto beneficioso metabólico: la Akkermansia muciniphila (A. muciniphila)39. Se cree que A. muciniphila tiene efectos antiinflamatorios en los humanos, y los estudios han mostrado relaciones inversas entre la colonización de esta bacteria y condiciones inflamatorias intestinales tales como la obesidad y la diabetes40. Es decir, los individuos obesos y diabéticos tienen menor proporción de esta bacteria y el moco en la superficie de la mucosa intestinal es menor. Por el contrario, cuando se le ha suministrado esta bacteria a sujetos obesos y/o diabéticos, recuperan la integridad de la barrera intestinal y mejoran su perfil metabólico41. Este mismo fenómeno ocurre en pacientes sometidos a cirugía metabólica, donde la presencia de esta bacteria incrementa el espesor del moco y los niveles de inflamación disminuyen42 (fig. 3).
Hipótesis sobre los mecanismos de acción que explican los efectos de la cirugía metabólica asociados a la microbiota. La cirugía metabólica cambia la disposición de alimentos en el tracto gastrointestinal. Estos cambios alteran a su vez la flora bacteriana o microbiota. El principal cambio es la reducción de Firmicutes productores de lipopolisacáridos. Al disminuir los lipopolisacáridos disminuye la respuesta inflamatoria asociada a la diabetes. De igual forma, la hiperplasia-hipertrofia del epitelio intestinal después de cirugía y la presencia de la A. muciniphila mejoran la integridad de la función barrera del intestino. Adaptado de Cani et al.36 a través de Servier Medical Art by Creative Commons Attribution 3.0.
De todas formas en las hipótesis sobre la microbiota es difícil discernir si los efectos son causa o consecuencia de modificar las relaciones entre el huésped y los microorganismos, o si son las bacterias de forma aislada las que condicionan la génesis de la enfermedad36,43. Futuros estudios en proteómica, genómica y metabolómica aportarán mucha información.
Hipótesis que apoyan la gluconeogénesis intestinalEl intestino delgado contribuye también a la síntesis de glucosa a través de un proceso llamado gluconeogénesis intestinal44. La observación de que el intestino delgado es capaz de sintetizar glucosa y liberarla en la circulación portal ha ayudado a la comprensión de la diabetes, sin embargo es aún un proceso poco conocido. Este mecanismo involucra a la glucosa-6-fosfato-sintetasa (G6P-asa) y la fosfoenolpiruvato carbokinasa (PEPCK), enzimas que se hallan en altas concentraciones en el hígado, pero ausentes en el intestino normal44. Sin embargo, tras un reordenamiento quirúrgico gastrointestinal, se ha observado una marcada elevación de ambas enzimas en segmentos de yeyuno e íleon45. La liberación de glucosa intestinal al flujo portal puede interpretarse en los receptores hepáticos como glucosa procedente de los alimentos, alterando así las señales reguladoras de la gluconeogénesis hepática46. El debate sobre la existencia de la gluconeogénesis intestinal, así como renal, ha sido aceptado en el estudio de los pacientes con trasplante hepático47. La producción de glucosa endógena es primordial en la fase anhepática durante el trasplante hepático y la evidencia de que órganos como el riñón o el intestino contribuyen a este proceso es innegable.
Conceptos de adaptación intestinalEntre las nuevas hipótesis sobre el intestino que explican el efecto metabólico de la cirugía se encuentran antiguos conceptos derivados del síndrome de intestino corto y las adaptaciones del intestino debidas a múltiples resecciones48. La mucosa intestinal modifica la señalización del recambio celular, apoptosis e hiperplasia debido al cambio de los nutrientes en la luz intestinal. Estos nutrientes no solo actúan como combustible, sino también como moléculas de señalización de diferentes vías metabólicas y, en consecuencia, influyen directamente en la adaptación intestinal49. Así surge el concepto de enteroplasticidad, donde los cambios más evidentes después de la cirugía metabólica son la hiperplasia y la hipertrofia de la mucosa3,50.
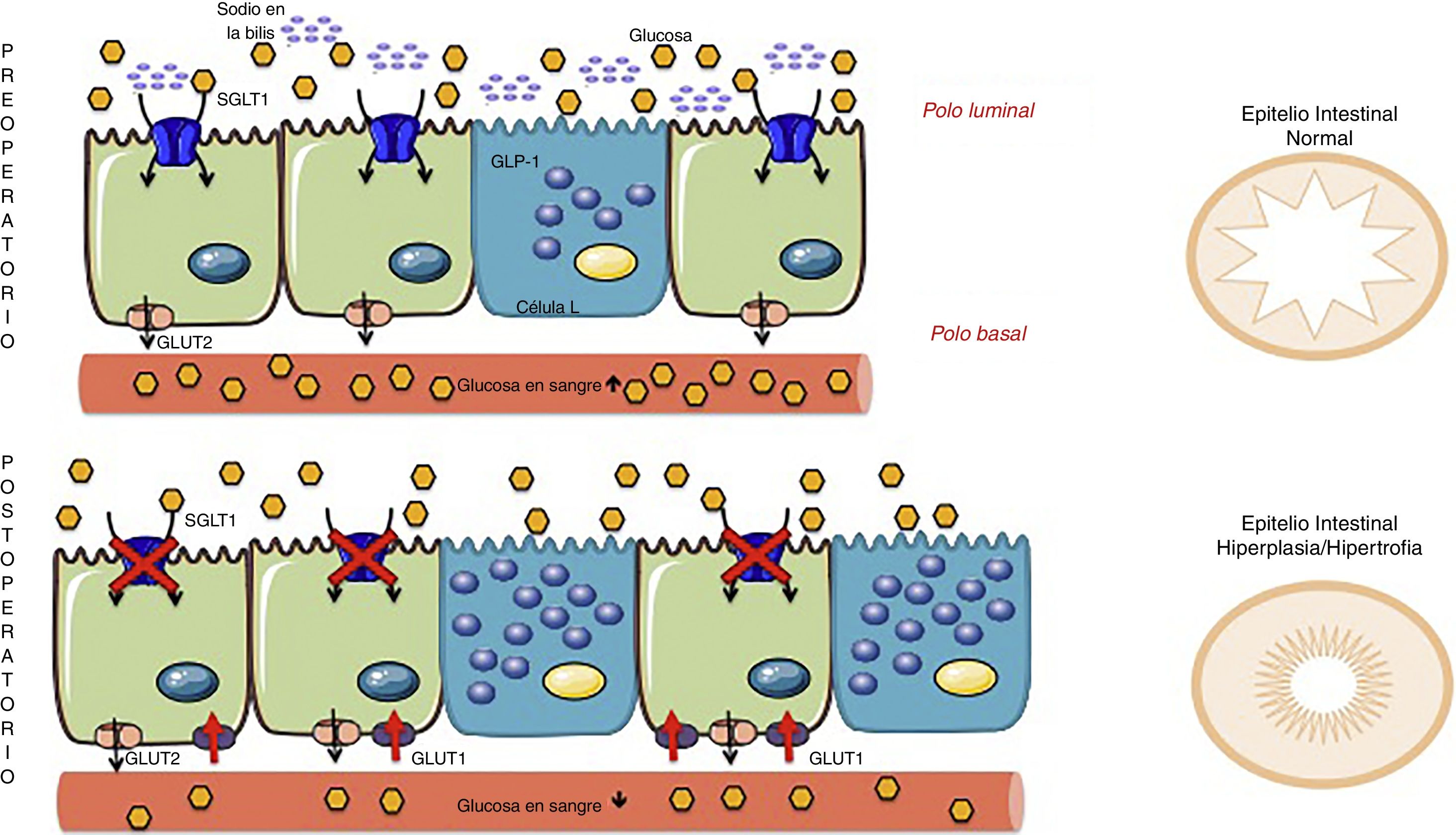
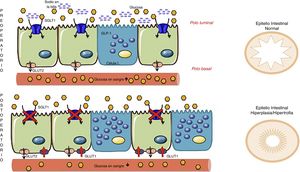
Anteriormente se mencionó el trabajo de Baud et al.24 donde se demostró que el bypass gástrico modifica el contenido de sodio y por tanto la absorción de glucosa que deben estar presentes al mismo tiempo en la luz intestinal (polo apical del enterocito). Por ello, las cirugías derivativas alteran aún más la absorción de glucosa, ya que el SGLT1 se ve inhabilitado para obtener glucosa de la luz intestinal y por ello la mucosa se hiperplasia/hipertrofia. No obstante, el nuevo epitelio engrosado sigue teniendo déficit de combustible de la dieta por lo que debe activar otro mecanismo compensador. Saeidi51 y Cavin52 describen una reestructuración de los transportadores de glucosa intestinal, pero explicados desde la membrana basolateral (polo basal del enterocito). La nueva mucosa intestinal debe satisfacer la creciente demanda bioenergética y es por ello que en el polo basal (en contacto con el torrente sanguíneo) surgen los transportadores de glucosa llamados transportadores de glucosa de tipo 1 (GLUT1). Estos transportadores de tipo pasivo (no requieren energía) no son habituales en el intestino adulto, pero su expresión aumenta tras un bypass intestinal, a tal punto que su concentración es la segunda por detrás del cerebro (el órgano con más GLUT1 del organismo)51. Es por ello que el intestino, para su mantenimiento, extrae la glucosa que necesita desde la circulación sanguínea y así se produce una rápida y considerable caída de la glucemia (fig. 4). En los trabajos de Cavin52,53 también se describe el aumento de las células enteroendocrinas (células L y K productoras de incretinas) después de la cirugía. Sin embargo, hay que tener en cuenta que los enterocitos son el grupo celular más numeroso del intestino y aunque el aumento de células que secretan GLP-1/GIP es innegable, se considera que los cambios en los enterocitos son cuantitativamente más importantes. Cavin et al.53 hicieron comparaciones entre los diferentes tipos de cirugía, en especial entre el bypass gástrico y la gastrectomía vertical (GV). Si bien tras GV existe un aumento de células secretoras de incretinas, no se observa el mismo grado de hiperplasia-hipertrofia a nivel intestinal que con las cirugías derivativas y, por lo tanto, se concluye que en la GV no existe una demanda extra de glucosa por parte del intestino que deba cubrirse desde la circulación sanguínea. Esto puede explicar por qué las recaídas de DM2 son más frecuentes en pacientes sometidos a GV que a bypass. Aún así, Cavin enfatiza que la absorción intestinal de glucosa alimentaria está retardada en una GV, probablemente debido a que alguno de los componentes de los jugos gástricos modifica la composición biliar53. No obstante, a falta de estudios con resultados a largo plazo, aún se desconoce si el beneficio metabólico de la GV será duradero o si se verá afectado por una nueva adaptación del tubo digestivo54.
Mecanismos de adaptación intestinal después de cirugía bariátrica. Las cirugías derivativas (aquellas que separan la bilis de los alimentos) tienen un componente malabsortivo asociado al transportador sodio-glucosa en la membrana apical del enterocito (SGLT1) el cual disminuye la capacidad de absorción de glucosa de los alimentos (Baud 2016). Para compensar este fenómeno, el intestino se hiperplasia e hipertrofia. Sin embargo este proceso no es suficiente, y por ello el enterocito despierta a un transportador pasivo de la etapa embrionaria, llamado GLUT1 que se expresa en la membrana basolateral (Saeidi51 y Cavin52). Este transportador GLUT1 capta la glucosa de la sangre para proveer de energía a las nuevas células y por tanto la glucemia desciende. Adaptado de Cavin et al.52 a través de Servier Medical Art by Creative Commons Attribution 3.0.
La dieta occidental es rica en hidratos de carbono de fácil asimilación (principalmente líquidos), en grasas y en alimentos de «grano refinado». Se definen como alimentos de «grano refinado» aquellos que han perdido el endospermo almidonado, el germen y el salvado en el proceso de molienda y por lo tanto tienen una pérdida sustancial de fibra, vitaminas, hierro, magnesio, y otros componentes dietéticos. Como consecuencia, los productos de grano refinado son nutricionalmente inferiores, tienen un mayor contenido de almidón, son menos densos, no favorecen el tránsito intestinal y son menos saciantes que sus contrapartes de «granos enteros»55.
El tránsito intestinal está favorecido siempre y cuando exista un gradiente peristáltico de craneal a caudal para asegurar que el contenido intestinal sea propulsado a porciones intestinales más bajas. De hecho, el alimento que entra en el yeyuno induce un reflejo vagal que ralentiza el peristaltismo para permitir la digestión-absorción de los alimentos56. Si el alimento que entra en el yeyuno no favorece la peristalsis, se retarda aún más su paso por el intestino, lo que suele acompañarse de signos y síntomas asociados al estreñimiento57.
Tras la cirugía, en especial tras el bypass gástrico, es frecuente observar la llegada de alimentos mal dirigidos al intestino por el vaciamiento gástrico acelerado58. De igual forma, cuanto más malabsortiva sea la técnica, mayor contenido de moléculas de gran tamaño habrá en el intestino y ello conducirá también al arrastre de agua e iones. Todo esto aumenta el peristaltismo y acelera la llegada del contenido intestinal al colon, lo que justifica los episodios de diarreas en algunos pacientes tras la intervención. El tránsito intestinal acelerado se considera un determinante mayor en la efectividad de la cirugía59. En este sentido, el grupo de Nguyen et al.60 señaló que después de un bypass gástrico la velocidad del tránsito intestinal aumenta, lo que genera malabsorción siempre y cuando la velocidad no sea menor a 4Kcal/min. Si la exposición es mayor supone una mayor absorción de glucosa, pudiendo disminuir de forma considerable la efectividad de la cirugía59,60.
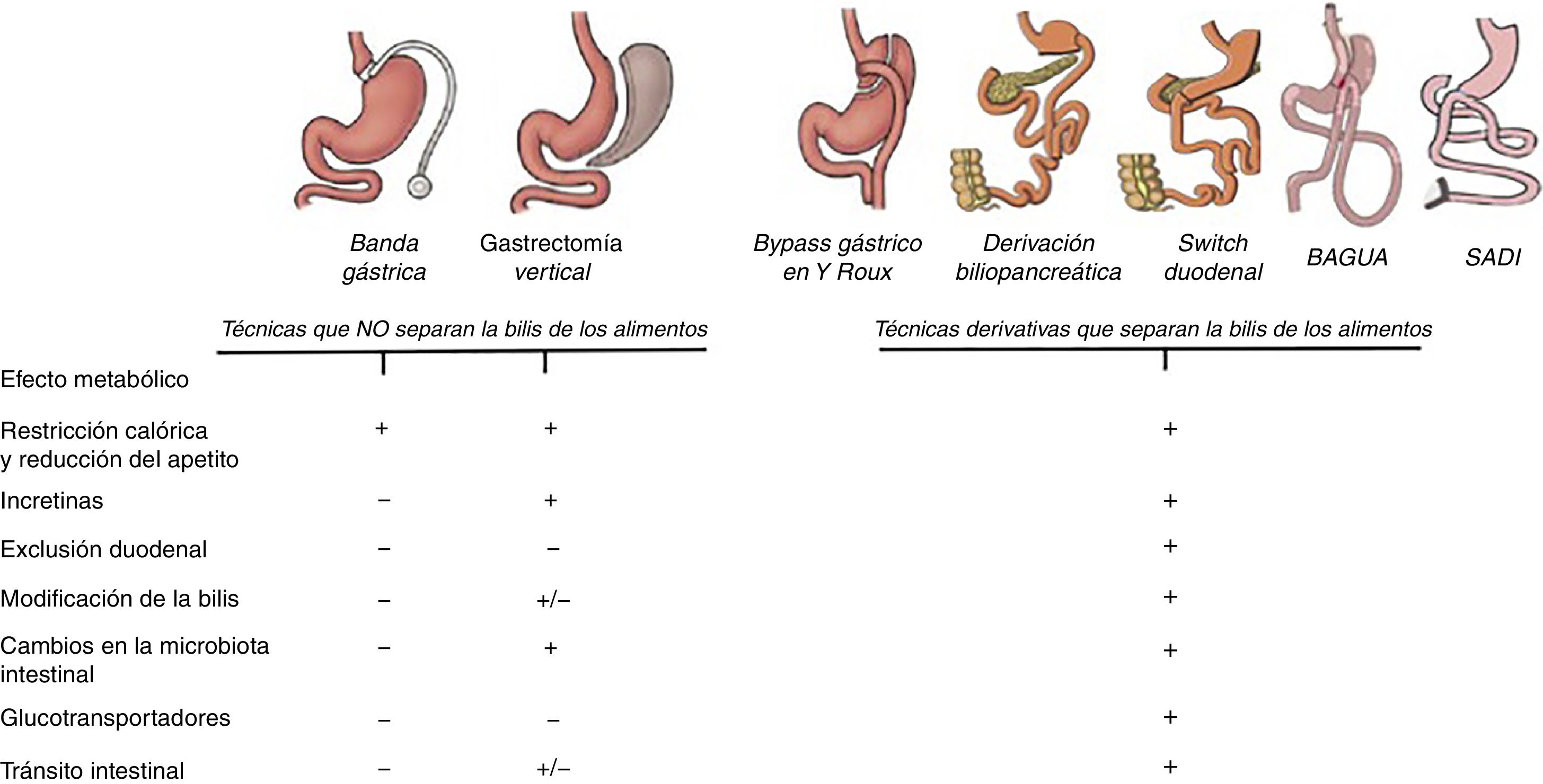
ConclusionesLa incidencia y prevalencia de la DM2 aumenta de forma significativa y por ahora la cirugía metabólica es el único procedimiento con resultados sólidos a largo plazo. Los beneficios de la cirugía van más allá de la secreción de incretinas y existen otros factores que influyen también en la mejoría de la glucemia independientemente de la pérdida de peso. En esta revisión se han descrito una serie de mecanismos de acción que explican cómo disminuye la glucemia tras cirugía y la mayoría de estos mecanismos están asociados a cambios que ocurren especialmente en el intestino (fig. 5). Conocer estos mecanismos es básico a la hora de elegir la técnica quirúrgica, siendo los procedimientos derivativos los más aconsejables en pacientes diabéticos. Las técnicas restrictivas o la GV no están contraindicadas, pero han de ser valoradas de forma individual. Desafortunadamente, la ausencia de estudios aleatorizados y ensayos clínicos limita las conclusiones acerca de cuál es la mejor opción quirúrgica entre las diferentes técnicas derivativas. El desarrollo de investigaciones, tanto en el área clínica como en ciencias básicas es esencial, pero más aún la comunicación efectiva entre ambos campos.
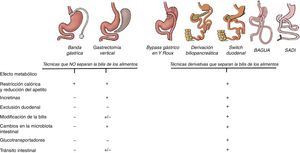
Principales mecanismos que explican el control de los niveles de glucemia en las diferentes técnicas de cirugía bariátrica. Todas las técnicas tienen un efecto mecánico de tipo restrictivo que conduce a la disminución del apetito y de la ingesta calórica. Hasta ahora el efecto metabólico era principalmente atribuido al efecto incretínico que, a excepción de la banda gástrica, se observa en todas las técnicas. Sin embargo, las técnicas derivativas, además de todo lo anterior, modifican la estructura intestinal y convierten al intestino en un sistema que consume glucosa de la sangre. Es por ello que excluir el duodeno y separar la bilis de los alimentos logra una mayor reducción de la glucemia.
Los autores declaran no tener ningún conflicto de intereses.