La cirugía todavía tiene gran importancia en el tratamiento primario del cáncer de mama. Durante los últimos 30 años la cirugía del cáncer de mama ha sido menos agresiva y desfigurante. Las estrategias quirúrgicas han cambiado significativamente y el objetivo de la cirugía moderna en el cáncer de mama es mantener su eficacia oncológica, pero reducir el número de procedimientos radicales, con la finalidad de disminuir el trauma físico y psicológico de las pacientes. La mastectomía radical modificada, la cirugía conservadora1,2 y la linfadenectomía selectiva, según la biopsia del ganglio centinela, son ejemplos de esta progresiva evolución. Desde la introducción de la cirugía conservadora de la mama y la quimioterapia neoadyuvante, la incidencia de las mastectomías han ido declinando, pero todavía son inevitables en pacientes con tumores desproporcionados con respecto al tamaño de la mama o multicéntricos, en aquellas con alto riesgo familiar o personal, cuando haya contraindicación de radioterapia postoperatoria o bien si la preferencia de la paciente es una mastectomía de entrada. En los últimos años se han incrementado las reconstrucciones mamarias inmediatas con el objetivo de dar una mejor calidad de vida a las pacientes sometidas a una mastectomía, ya que parece disminuir la morbilidad psicológica3 y se obtiene unos buenos resultados estéticos. Además se ha probado que la reconstrucción inmediata (RMI), comparada con la diferida, mejora la relación coste/efectividad (eficiencia) ya que requiere una sola operación y un único ingreso hospitalario, y disminuye las bajas laborales por enfermedad4,5. No obstante, hay que tener en cuenta que hay pocos datos sobre el impacto de la RMI en la supervivencia, en el diagnóstico precoz de las recidivas y su influencia en los tratamientos adyuvantes, así como el número de complicaciones y el resultado estético y el grado de satisfacción de las pacientes. Como en otros tipos de tratamientos quirúrgicos, la mejora en los resultados estéticos ha sido significativa y, en parte, se ha debido a la demanda de las propias pacientes. La mastectomía ahorradora de piel (MAP), donde se conserva la mayoría de la piel natural de la paciente con la intención de una RMI, es el resultado de estas tendencias6. En este tipo de mastectomía se intenta conservar al máximo la piel envolvente y el surco submamario, lo que facilita la reconstrucción de la mama con una forma más natural y con escasos cambios en el color dérmico y en la simetría, consiguiendo así un resultado estético más favorable. La reconstrucción mamaria ha pasado de ser un proceso de formación de una mama a un proceso de rellenar una mama7.
Consideraciones quirúrgicasDesde la introducción de la MAP por Toth et al8 ha habido pocas variaciones en su técnica9,10, pero debemos tener en cuenta que la MAP requiere experiencia técnica, pues las complicaciones, como las epidermólisis o pérdidas completas del grosor de la piel, pueden comprometer el resultado final y retrasar el inicio de los tratamientos adyuvantes11. Como se ha comentado previamente, la MAP incluye la reseción del complejo areola-pezón, cualquier cicatriz de biopsia previa y la extirpación completa de la glándula mamaria, lo que a continuación permite rellenar el hueco glandular con tejidos autólogos, prótesis o ambos. La diferencia fundamental con la mastectomía estándar es que en la MAP se limita al máximo la extirpación de piel, con lo que se facilita una reconstrucción inmediata satisfactoria y se consigue una mayor simetría con la mama contralateral lo que evita cirugías adicionales. La biopsia del ganglio centinela se podría hacer previa12 o simultáneamente a la MAP con la linfadenectomía si fuera necesaria.
Tipo de incisionesEl tipo de incisión elegido será lo que facilite la extirpación completa del tumor mamario y de las cicatrices de las biopsias quirúrgicas previas. Las incisiones variarán según el tamaño y la configuración de la mama afecta y de la contralateral, del tamaño y la localización del tumor, de la localización de la biopsia previa y de la preferencia del cirujano, y se deben planear con vistas a una reconstrucción mamaria inmediata. Las incisiones más utilizadas son la periareolar (circular), periareolar con prolongación lateral (en raqueta de tenis), periareolar con prolongaciones lateral y medial, periareolar elíptica y las del tipo mamoplastia de reducción o mastopexia13 (fig. 1). En la incisión periareolar se realiza una incisión circular a 1 mm del borde areolar; cuando la areola es pequeña, es necesaria una incisión en raqueta, con una prolongación lateral, para facilitar la extirpación glandular. La periareolar elíptica es una versión en miniatura de la incisión de la mastectomía clásica no ahorradora de piel. La incisión de mamoplastia de reducción es la incisión según el típico patrón de Weis donde, además de la incisión periareolar, hay una prolongación vertical hacia el surco submamario con una extensión lateral y medial a lo largo del surco14. Otros autores15 prefieren una patrón vertical de mamoplastia (Lejour), para evitar necrosis dérmicas en la unión de la T del patrón de Weis.
Fig. 1. Tipos de incisiones. I: periareolar y en raqueta de tenis; II: elíptica periareolar que incorpore cicatrices de biopsias; III: elíptica periareolar con incisión independiente para cicatriz previa; IV: periareolar elíptica, y V: patrón de mamoplastia de reducción.
Carlson9 clasificó la MAP en cuatro tipos según el tipo de incisión y la cantidad de piel extirpada. En el tipo I, solamente se extirpa el complejo areola-pezón y se utiliza en la mastectomías profilácticas y en los cánceres diagnosticados mediante biopsia con aguja. Se puede prolongar lateralmente para facilitar el acceso a la axila. La MAP tipo II se utiliza cuando el tumor o la cicatriz de la biopsia están muy próximos a la areola, con lo que se extirpa el complejo areola-pezón y la piel supratumoral o de la biopsia previa. En el tipo III, se extirpa el complejo areo la-pezón, y por una incisión independiente, debido a la distancia de la areola, la piel supratumoral o de la biopsia previa. El tipo IV de MAP se utiliza en mamas ptósicas cuando se planea una reducción bilateral simultánea o retrasada. A través de estas incisiones se puede realizar, cuando fuera necesario, una biopsia de ganglio centinela (BGC)16 o una linfadenectomía axilar, aunque muchos autores prefieren una incisión axilar tranversa independiente que facilita la linfadenectomía axilar y no lesiona la piel conservada durante la mastectomía9,12,17. Esta incisión es muy poco visible y es muy útil en la disección del pedículo vascular del músculo dorsal ancho cuando se va a utilizar para la reconstrucción mamaria. La BGC se puede realizar en el mismo acto quirúrgico mediante estudio intraoperatorio citohistológico o bien realizarlo una semana antes de la mastectomía y, de esta manera, conocer previamente el estado axilar, con lo que se evita la linfadenectomía axilar de rescate en pacientes con una reconstrucción mamaria inmediata12. No obstante, cuanto menor es el riesgo de metástasis axilar ganglionar y mayor la sensibilidad en el estudio intraoperatorio del ganglio centinela, más factible sería realizar la BGC en el mismo acto quirúrgico que la MAP y la reconstrucción14.
Aspectos técnicos de la mastectomía ahorradora de pielLa disección de los colgajos dérmicos se realiza de una manera semejante a la mastectomía estándar, siguiendo la aponeurosis subcutánea y la liberación de la glándula del músculo pectoral mayor. No obstante, este tipo de mastectomía requiere una técnica meticulosa y un manejo suave de los tejidos para prevenir la isquemia de los colgajos dérmicos. La disección glandular debería ir por encima de la fascia que envuelve la mama para conseguir un extirpación lo más completa posible del tejido mamario (fig. 2) y llegaría a los límites anatómicos de la mama: el borde anterior del músculo dorsal ancho, el surco submamario, el margen esternal y el polo superior de la mama que, generalmente, está localizado a nivel de la segunda costilla. La disección del borde esternal del colgajo dérmico debe ser cuidadosa para evitar la lesión de las ramas dérmicas de las perforantes de la arteria mamaria interna que producen la vascularización de los colgajos dérmicos mediales.
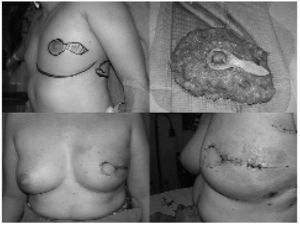
Fig. 2. Paciente con mastectomía ahorradora de piel mediante incisión periareolar con prolongación lateral, espécimen operatorio y resultado postoperatorio después de reconstrucción autóloga con colgajo miocutáneo de dorsal ancho extendido.
Las complicaciones necróticas de la piel no se producen con más frecuencia que en la mastectomía estándar. En una de las series publicadas11 la epidermólisis y la necrosis dérmica que requirieron desbridamiento ocurrió en el 10,7% en las MAP y en el 11,2% en las otras mastectomías. En las incisiones de la MAP tipo IV fue más frecuente este tipo de complicación. Los separadores con iluminación o la luz fibroóptica consiguen una iluminación centrada en el campo operatorio, lo que facilita un buen plano de disección y una buena hemostasia, que al realizarla con electrocoagulación bipolar o argón sería más selectiva y con menos efectos secundarios. La viabilidad de los colgajos dérmicos se determina por apreciación clínica, aunque se han utilizado métodos más o menos sofisticados que no han logrado una amplia aplicación, como los colorantes fluorescentes, la termografía, la fotopletismografía y la flujometría mediante Doppler.
Tipos de reconstrucción posteriorEl objetivo final de la MAP es realizar una RMI, que se puede conseguir mediante tejido autólogo transferido (fig. 3), implantes (fig. 4) o ambos18. Los dos tipos principales de tejidos autólogos disponibles proceden del abdomen inferior (TRAM, DIEP, SIEA) y del músculo dorsal ancho. Cuando se utilizan implantes, éstos pueden ser prótesis definitivas, expansores protésicos tipo Becker o expansores subpectorales. Utilizar una técnica u otra dependerá de cada institución o preferencia del cirujano, ya que no hay contraindicación absoluta para ninguna de ellas, aunque es recomendable evitar la reconstrucción con prótesis si se prevé aplicar radioterapia postoperatoria. En grandes series de MAP13 cada una de estas modalidades reconstructoras, tejidos autólogos o implantes, se distribuyen aproximadamente al 50%.
Fig. 3. Pacientes con mastectomía ahorradora de piel y posterior reconstrucción con tejido autólogo.
Fig. 4. Diversos abordajes de pacientes con mastectomía ahorradora de piel y posterior reconstrucción con prótesis.
Conservación del complejo areola-pezónAunque la MAP con RMI ofrece grandes beneficios cosméticos en relación con la mastectomía estándar, la extirpación del complejo areola-pezón (CAP) impacta de una manera significativa en el resultado final, aunque se ofrezca a las pacientes una reconstrucción diferida del pezón y un tatuaje o una prótesis. El CAP se extirpa porque se cree que él y los conductos galactóforos adyacentes pueden contener células tumorales que se han extendido hasta los conductos desde el tumor primario. La conservación del CAP significa transformar la MAP en una mastectomía subcutánea que tiene unas implicaciones oncológicas diferentes. No obstante, es necesario comentar algunos estudios recientes que han demostrado que el riesgo de afectación tumoral del CAP ha sido sobrestimado19,20. Varias publicaciones21-23 han demostrado que la afectación del CAP (10,6%) está relacionada con la proximidad del tumor a la areola (< 2 cm), la multicentricidad, el tamaño tumoral y la afectación axilar. Gerber et al22 demuestran que cuando se preservaba el CAP, en tumores situados a más de 2 cm de la areola y en que el estudio histológico intraoperatorio del tejido subareolar fue negativo para la extensión tumoral, las recidivas locales eran muy escasas (1,6%) y con resultados estéticos muy superiores. Otro de los problemas de la conservación del CAP es su necrosis parcial o total (el 6-7% de las pacientes) y dependerá fundamentalmente de la técnica quirúrgica24,25. Si sólo se extirpa el pezón del CAP, se ha comprobado que la areola conservada estaba afectada en un 0,9% de los casos y eran tumores de más de 5 cm de diámetro y en situación retroareolar20,23.
Consideraciones oncológicas. Recidivas localesEl principal problema oncológico de la MAP está relacionado con la posibilidad de dejar tumor residual en el envoltorio dérmico, que luego se podría manifestar por una recidiva local. Los paradigmas iniciales sobre el tratamiento del cáncer de mama enfatizaron las resecciones radicales, pero el éxito de la cirugía conservadora de la mama ha creado la duda sobre la necesidad de la extirpación de la piel que no esté afectada por el tumor. También hay que resaltar que cuando se realiza una mastectomía estándar, se extirpa una amplia elipse de piel, que incluye la areola, el pezón y la cicatriz de la biopsia previa, pero el resto de la piel que recubre la mama se conserva y se libera como colgajos de deslizamiento que permitirán una buena aproximación y adherencia plana de la piel a la pared torácica. En el pasado se ha discutido las diferentes cantidades de piel a extirpar para evitar la recidiva local tras la mastectomía. A pesar de los diferentes tipos de mastectomías realizados, la recidiva local ha permanecido constante a lo largo de los años. Es decir que el incremento de la resección dérmica no ha conseguido un mejor control local. La recidiva está influida por múltiples factores diferentes de la amplitud de resección dérmica26,27. Debido a que la recidiva local es más un componente de la biología tumoral que un fallo en la técnica quirúrgica, ampliar los límites de resección dérmica no parece ofrecer una alternativa terapéutica lógica, ya que si se quisiera realizar una RMI, se necesitaría movilizar piel con tejido autólogo de otras partes del cuerpo, en una cantidad semejante a la extirpada, y que al tener diferente color y textura disminuye el resultado estético.
En relación con la recidiva local, la MAP se ha descrito como un tratamiento seguro en los cánceres de mama en estadios iniciales, pero la mayoría de los estudios publicados tienen un corto seguimiento clínico, pocos son prospectivos y en su mayor parte son experiencias de un solo hospital (tabla 1)7,22,26,28-34,36-38,42,57-59. Carlson et al28 0-4 y una media de seguimiento de 65 meses, y observan el 5,5% de recidivas locales, pero con la particularidad de que el 30,6% de los casos correspondían a tumores no invasivos. Cuando se analizaron los tumores en estadios 0-2 las recidivas locales fueron del 4,8%; cifras aproximadas han obtenido otros autores29,30 en los carcinomas ductales in situ (CDIS) después de MAP y RMI. En dos series31,32, de tumores T1 y T2, se hallaron unas incidencias de recidivas del 6,2 y el 7%, respectivamente, y en una de ellas32 las recidivas locales con mastectomías convencionales fueron similares a las de MAP. Medina- Franco et al33 encontraron unas incidencias de recidivas del 4,5% después de MAP más RMI y después de un seguimiento de 73 meses. Aunque Meretoja et al34 no hallaron relación entre la recidiva local y el estadio clínico, Carlson et al28 observaron más recidivas dérmicas con mayor estadio clínico. Si se analizan las recidivas locales en la mastectomía convencional o estándar, con o sin reconstrucción, se observa un número de recidivas locales similar al de la MAP, tanto en tumores invasivos como no invasivos26,27,29- 32,35-39. En un metaanálisis reciente40 se notifica un 6,3% de recidiva local a los 5 años de seguimiento después de una mastectomía convencional con linfadenectomía sin radioterapia y un 5,8% en las axilas positivas con radioterapia, lo que apunta a que en la recidiva local influye más la biología tumoral y el estadio de la enfermedad en el momento de la cirugía que la técnica quirúrgica empleada para la mastectomía26,27, pero esta afirmación no está avalada por estudios prospectivos aleatorizados que comparen la mastectomía convencional con la MAP. Además, la comparación entre las diferentes publicaciones es difícil debido a que se incluye a pacientes en diferentes estadios clínicos y que los protocolos de quimioterapia y radioterapia pueden diferir entre los distintos países, y se ha demostrado que la radioterapia reduce sustancialmente las recidivas locales independientemente de las características tumorales40. El seguimiento de la MAP más reconstrucción inmediata se fundamenta, como en todos los protocolos, en una exploración clínica periódica –cada 4-6 meses durante los primeros 2 años–, pero hay variaciones sobre la periodicidad de las mamografías, ultrasonografías o resonancias magnéticas. El tratamiento de la recidiva local radica en un diagnóstico precoz que posibilita una cirugía menos agresiva y terapias adyuvantes posteriores. La recidiva local después de una mastectomía generalmente se ha considerado como un signo de mal pronóstico. Cuando se analizan las recidivas después de una MAP o una RMI, se objetiva que alrededor del 70% de las pacientes con recidivas locales desarrollan metástasis a distancia36,41.
TABLA 1. Recidivas locales después de mastectomía ahorradora de piel en el cáncer de mama
Indicaciones y contraindicacionesLa MAP está indicada en las pacientes con CDIS cuando no se pueda realizar cirugía conservadora y siempre que se obtengan márgenes adecuados respetando la piel del cuadrante donde asiente el tumor. Parece ser tan efectiva como la mastectomía estándar, ya que se consigue un control local del 98% sin radioterapia postoperatoria. En los casos de carcinomas infiltrantes iniciales, donde no se pueda realizar una cirugía conservadora, también se podría realizar una MAP, ya que se han descrito recurrencias locales similares a las descritas después de una mastectomía estándar. Aunque no hay estudios prospectivos que comparen estos dos procedimientos, la recurrencia local tras mastectomía se correlaciona más con el estadio tumoral que con la cantidad de piel conservada18,27,36. Además de estas dos situaciones clínicas, se han publicado trabajos puntuales en otras situaciones con buenos resultados, pero deben respaldarlos otros con mayor casuística para ampliar las indicaciones. Es el caso de la enfermedad localmente avanzada después de quimioterapia neadyuvante para disminuir el tamaño tumoral42; asimismo, la MAP se ha utilizado en pacientes con recidiva local después de cirugía conservadora, con un buen control local de la enfermedad y buenos resultados estéticos43. También en las pacientes con mamas grandes o péndulas se puede realizar una MAP del tipo mastectomía reductora de piel según el patrón de Wise para conseguir una reconstrucción final de mamas menos ptósicas y de menor tamaño, y normalmente se acompaña de un mamoplastia de reducción contralateral inmediata o retrasada para conseguir una simetría14,15. A la inversa, en las pacientes con aumento mamario y que presentan un carcinoma en estadios iniciales hay autores44 que realizan una MAP seguida de reconstrucción. Lógicamente, la MAP está claramente contraindicada en las pacientes que tengan afección de la piel por el tumor subyacente. Tampoco estaría indicada en las situaciones en que el riesgo de necrosis dérmica e infección esté incrementado, como la radioterapia previa, la obesidad y la diabetes y en las grandes fumadoras35. Además, la realización de la MAP con RMI estaría influida por otros factores, como la información recibida por la paciente, la edad, la raza, los factores psicosociales, la región geográfica y el tipo de hospital35,45.
Influencia de los tratamientos adyuvantesMastectomía ahorradora de piel y quimioterapiaEn la gran mayoría de las pacientes con cáncer de mama está indicada la quimioterapia (QT) porque mejora la supervivencia y disminuye la recidiva locorregional. La RMI puede influir en la QT, y viceversa; la primera puede retrasar la QT por las complicaciones quirúrgicas inmediatas y la segunda puede incrementar las complicaciones propias de la reconstrucción. Estos dos hechos no se han objetivado estadísticamente en los estudios realizados, con lo que se puede resumir que la RMI no interfiere en el inicio ni en los efectos de la QT adyuvante y neoadyuvante46-48.
Mastectomía ahorradora de piel y radioterapiaLas indicaciones de radioterapia (RT) después de una MAP con RMI son las mismas que después de una mastectomía estándar, es decir, en cánceres de gran tamaño (T3-T4) y/o con 4 o más ganglios axilares metastásicos, pues está comprobado que disminuye la recurrencia locorregional y puede incrementar la supervivencia. La RMI después de una mastectomía estándar estaría relativamente contraindicada en este tipo de pacientes, ya que la RT puede empeorar el resultado estético reconstructivo al aumentar las complicaciones locales. Las más frecuentes serían la infección, la expansión difícil y la contractura capsular cuando se utilizan prótesis o expansores35,49 y el incremento de necrosis grasa o pérdida de volumen cuando la reconstrucción se realiza con tejidos autólogos42. Sin embargo, Hazard et al51 y Hunt et al52, en estudios retrospectivos, no contraindican la RMI en las pacientes con RT adyuvante, ya que no empeora la supervivencia ni incrementa las recidivas locales, con unos resultados estéticos aceptables. Cuando se analiza la influencia de la RT en las pacientes con MAP y RMI, se observa que hay pocos estudios prospectivos53. Uno de los más interesantes es el de Cordeiro et al54 que, aunque encuentran mayor número de complicaciones tras RT, no contraindican la RMI debido a los resultados estéticos y a la satisfacción de las pacientes. Estos mismos autores recomiendan una expansión rápida en el postoperatorio inmediato y cambiar el expansor por la prótesis definitiva a las 3-4 semanas de terminar la quimioterapia y comenzar la RT a las 3-4 semanas del recambio. Kronowitz et al55, con la finalidad de evitar los problemas de la RT y no perder las ventajas de la MAP, realizan MAP y RMI con expansor que mantendrían durante la QT; lo desinflarían previamente a la RT y volverían a inflar después de la RT. Luego, realizarían la reconstrucción definitiva con TRAM o dorsal ancho más prótesis.
Respecto a los efectos de la RT en la MAP con RMI con tejidos autólogos hay similares discusiones. Autores como Tran et al50 contraindican la RMI por las complicaciones que produce la RT, otros, como Soong et al56, no encuentran aumento de complicaciones en la MAP con reconstrucción con TRAM. Con la finalidad de evitar una MAP con RMI en las pacientes candidatas a RT postoperatoria, la BGC y las microbiopsias ecoguiadas de las adenopatías axilares sospechosas nos pueden ayudar a conocer previamente12 o intraoperatoriamente17 el estado axilar de las pacientes. No obstante, hay que tener en cuenta que en la mitad de las pacientes con GC positivo, éste será el único ganglio positivo y, por tanto, no podemos desestimar totalmente la MAP y la RMI en este grupo de pacientes, pues no recibirían la radioterapia.
Correspondencia: Dr. M. Ramos Boyero. Crespo Rascón, 1, 5.° D. 37002 Salamanca. España. Correo electrónico: mramos@usal.es Manuscrito recibido el 5-2-2008 y aceptado el 13-5-2008.