La neoplasia quística hepática es una neoplasia poco frecuente, que representa aproximadamente el 5% de las lesiones quísticas del hígado. El diagnóstico preoperatorio es difícil y puede causar confusión. El objetivo del estudio es analizar una serie de casos operados en nuestro centro con diagnóstico anatomopatológico de neoplasia quística hepática y describir la sintomatología, diagnóstico y tratamiento de acuerdo con la actual clasificación.
MétodosSe realizó un análisis retrospectivo de todas las neoplasias quísticas hepáticas operadas entre enero de 2000 y diciembre de 2019. El estudio se basó en los informes de anatomía patológica ya existentes. Los casos anteriores al 2010 fueron reclasificados según la clasificación de la OMS del año 2010.
ResultadosLa muestra total del estudio resultó en 10 pacientes: 6 fueron neoplasias mucinosas quísticas hepáticas y 4 neoplasias papilares intraductales biliares. La mayoría de los pacientes fueron mujeres (8/10) y la edad media fue de 47 años. En cuanto al tratamiento, hubo 3 hepatectomías y 7 enucleaciones. En ningún caso se realizó una biopsia intraoperatoria de los márgenes quirúrgicos. En un caso se observó atipia celular variable con zonas de adenocarcinoma, por lo que el paciente recibió quimioterapia adyuvante con taxol y carboplatino. En todos los casos los márgenes de resección fueron negativos.
ConclusiónLas neoplasias quísticas hepáticas son tumores poco frecuentes, que plantean un dilema en el diagnóstico diferencial, por lo que, ante la sospecha radiológica, el tratamiento de elección debería ser la resección completa del tumor para evitar su malignización y la recidiva.
The hepatic cystic tumour is a very rare neoplasm, representing about 5% of all cystic liver neoplasms. The preoperative diagnosis is difficult and can lead to confusion. The aim of this study is to analyze a number of cases operated at our centre with an histologic diagnosis of liver cystic neoplasms and also to describe the sintomathology, diagnosis and management as per the recent classification.
MethodsA retrospective analysis was performed including all the cystic liver neoplasms operated between January 2000 and December 2019. The study was performed based on the pre-existing pathology archives. The 2010 previous cases were reclassified following the new 2010 OMS classification.
ResultsThe study sample was of 10 patients, identifying 6 of them as mucinous cystic liver neoplasms, and the other 4 as intraductal papillary biliary neoplasms. The majority of the patients were women (8/10) and the median age was 47 years. Regarding the treatment, 3 hepatectomy and 7 enucleations were performed. Frozen section intraoperatively was not required in any case. In one case, variable cellular atypia with areas of adenocarcinoma was observed, and the patient received neoadyuvant chemotherapy with taxol and carboplatin. In all cases the resection margins were negative.
ConclusionCystic liver neoplasms are infrequent tumours with a difficult differential diagnosis. Therefore, with a high radiological suspicious, the treatment should be a complete resection to avoid recurrences and malignancies.
Los tumores quísticos hepáticos con epitelio biliar y productores de mucina tradicionalmente se denominaban cistoadenomas o cistoadenocarcinomas mucinosos, en función del grado de agresividad1,2. En el 2010, la Organización Mundial de la Salud (OMS) propuso una nueva clasificación: la neoplasia papilar intraductal biliar (NPIB) y la neoplasia mucinosa quística (NMQ)3.
Estos tumores representan un 5% de las lesiones quísticas hepáticas no parasitarias, habitualmente se presentan en mujeres de edad media y suelen ser asintomáticos. La NPIB y la NMQ son formaciones quísticas, de aspecto multilocular y de contenido mucinoso en la mayor parte de los casos. Además, suelen ser de crecimiento lento y es infrecuente la afectación de ganglios linfáticos y la aparición de metástasis4,5.
En los últimos años, su incidencia ha aumentado debido al diagnóstico incidental al hacer pruebas radiológicas por otras causas. Sin embargo, a pesar de los avances en las técnicas de imagen, su diagnóstico y manejo constituyen un reto en la práctica clínica diaria.
El objetivo del estudio es analizar una serie de casos operados en nuestro centro con diagnóstico anatomopatológico de neoplasia quística hepática y describir la sintomatología, diagnóstico y tratamiento de acuerdo con la actual clasificación.
MétodosSe ha realizado un análisis retrospectivo de todas las neoplasias quísticas hepáticas operadas en nuestro centro entre enero de 2000 y diciembre de 2019. En el manejo de datos de los pacientes se han seguido las recomendaciones del Comité Ético del hospital.
El estudio se basó en los informes de anatomía patológica ya existentes. Los casos anteriores al 2010 fueron reclasificados según la 4.ª edición de tumores digestivos (OMS, 2010) que clasifica estos tumores en NMQ y NPIB3. Asimismo, para este trabajo, todos los casos fueron revisados por el mismo patólogo.
La NMQ se caracteriza por la formación de quistes en el hígado o en la vía biliar, revestidos de epitelio cuboide o columnar con producción variable de mucina y asociada a estroma ovárico, que no siempre es fácilmente reconocible. La presencia de estroma ovárico se confirmó mediante inmunohistoquímica a través de la caracterización de receptores de estrógenos o de progesterona. Puede ser categorizada como NMQ con displasia de bajo, intermedio o de alto grado, e incluso asociarse a carcinoma invasivo.
Por otro lado, las NPIB son lesiones premalignas que se caracterizan por el crecimiento velloso o papilar del epitelio intraductal. El epitelio columnar puede evolucionar de displasia de bajo a alto grado, e incluso a un carcinoma invasivo. La diferenciación del epitelio puede ser de tipo intestinal, biliar, oncocítico o gástrico; aunque la mitad de los casos contienen al menos 2tipos de epitelio, por lo que son clasificadas en función del predominante. Además, la NPIB de tipo pancreatobiliar se asocia con mayor frecuencia a un carcinoma invasivo, con un patrón más agresivo y más frecuencia de metástasis6. Estas neoplasias no presentan signos de diferenciación hacia estroma ovárico y la producción de mucina es variable7. Al diagnóstico de NPIB se llegó mediante la visualización de proliferaciones papilares en ausencia de estroma ovárico, además de con la presencia de comunicación entre el quiste y los conductos biliares.
También, se registraron los datos demográficos, sintomatología, pruebas de función hepática, marcadores tumorales y pruebas de imagen.
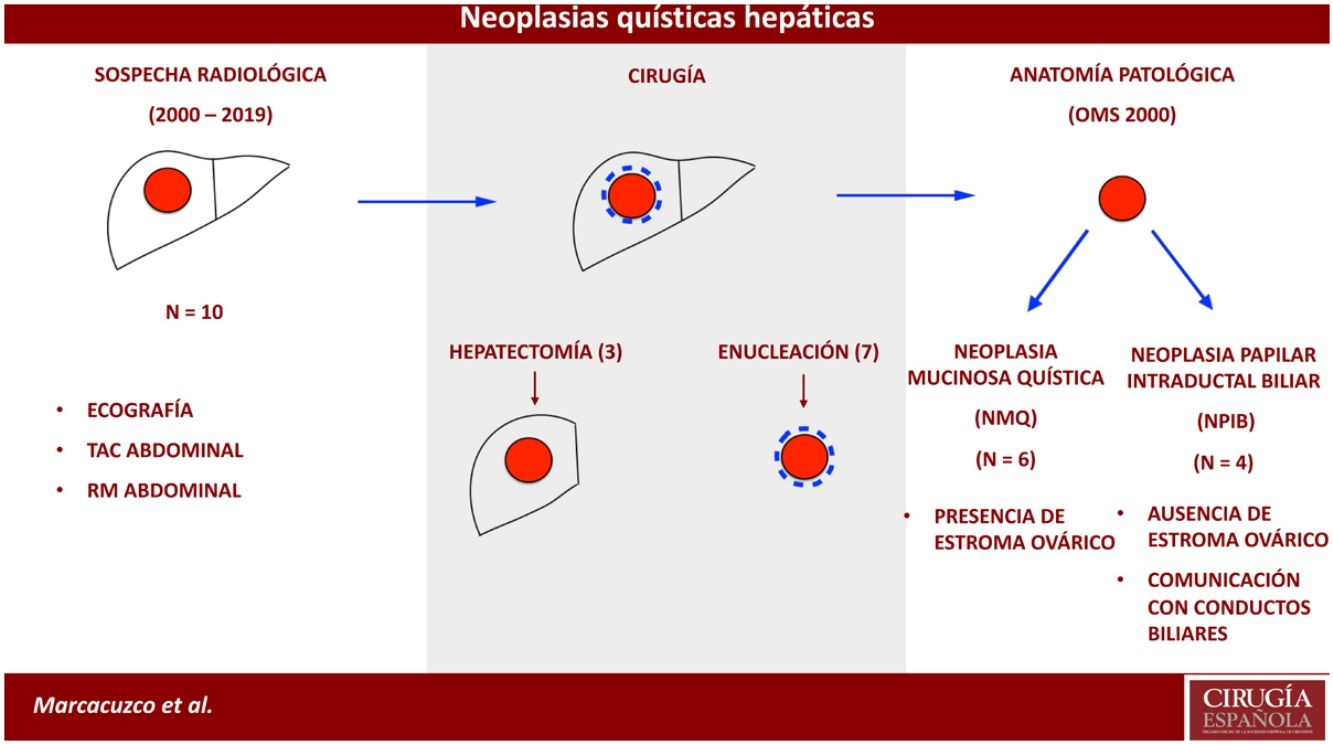
La indicación quirúrgica se estableció ante la presencia de una lesión quística que no cumplía los criterios radiológicos de quiste benigno, parasitario, ni de absceso hepático. El objetivo del tratamiento quirúrgico en todos los casos fue la resección completa de la lesión: se proponía bien una hepatectomía o una enucleación en función del tamaño, localización o sospecha de malignidad. Los casos en los que se confirmó malignidad fueron valorados de manera conjunta con oncología médica.
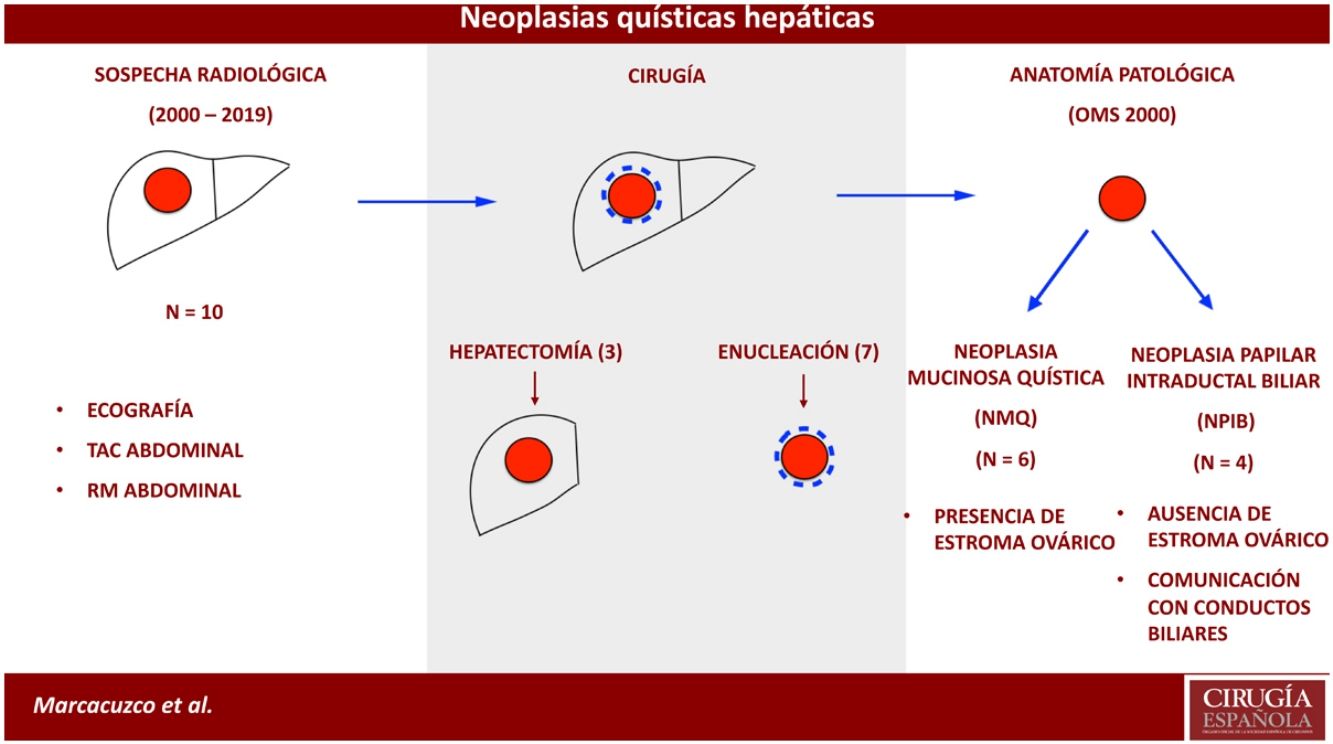
ResultadosDel 2000 al 2010, se identificaron 4 casos con diagnóstico anatomopatológico de cistoadenoma o cistoadenocarcinoma mucinoso, que posteriormente fueron reclasificados según la clasificación de la OMS de 2010. Además, desde el 2010 se observaron otros 6 casos de NMQ o NPIB. Por tanto, la muestra total del estudio resultó en 10 casos: 6 fueron NMQ (uno de ellos con carcinoma infiltrante) y 4 NPIB. La mayoría de los pacientes fueron mujeres (8/10) y la edad media fue de 47 años.
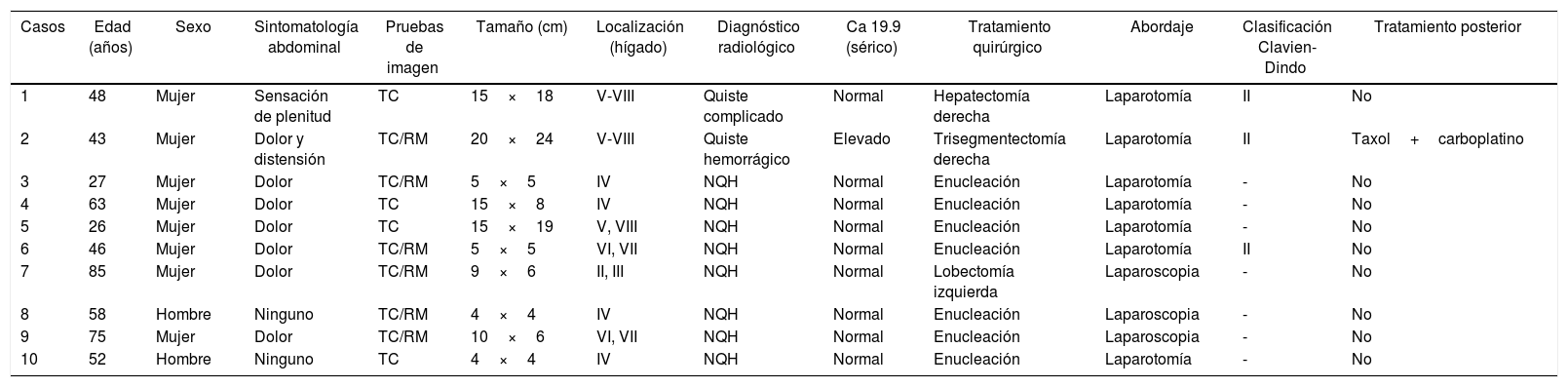
El dolor abdominal fue el síntoma más frecuente (6 pacientes); además, un enfermo presentó una rotura del quiste con hemoperitoneo que requirió una cirugía urgente diferida. En ningún caso se observaron signos de ictericia obstructiva ni sintomatología derivada de la compresión del tumor sobre estructuras principales (tabla 1).
Características clínicas, radiológicas y tratamiento en los pacientes con neoplasias quísticas hepáticas
| Casos | Edad (años) | Sexo | Sintomatología abdominal | Pruebas de imagen | Tamaño (cm) | Localización (hígado) | Diagnóstico radiológico | Ca 19.9 (sérico) | Tratamiento quirúrgico | Abordaje | Clasificación Clavien-Dindo | Tratamiento posterior |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 48 | Mujer | Sensación de plenitud | TC | 15×18 | V-VIII | Quiste complicado | Normal | Hepatectomía derecha | Laparotomía | II | No |
| 2 | 43 | Mujer | Dolor y distensión | TC/RM | 20×24 | V-VIII | Quiste hemorrágico | Elevado | Trisegmentectomía derecha | Laparotomía | II | Taxol+carboplatino |
| 3 | 27 | Mujer | Dolor | TC/RM | 5×5 | IV | NQH | Normal | Enucleación | Laparotomía | - | No |
| 4 | 63 | Mujer | Dolor | TC | 15×8 | IV | NQH | Normal | Enucleación | Laparotomía | - | No |
| 5 | 26 | Mujer | Dolor | TC | 15×19 | V, VIII | NQH | Normal | Enucleación | Laparotomía | - | No |
| 6 | 46 | Mujer | Dolor | TC/RM | 5×5 | VI, VII | NQH | Normal | Enucleación | Laparotomía | II | No |
| 7 | 85 | Mujer | Dolor | TC/RM | 9×6 | II, III | NQH | Normal | Lobectomía izquierda | Laparoscopia | - | No |
| 8 | 58 | Hombre | Ninguno | TC/RM | 4×4 | IV | NQH | Normal | Enucleación | Laparoscopia | - | No |
| 9 | 75 | Mujer | Dolor | TC/RM | 10×6 | VI, VII | NQH | Normal | Enucleación | Laparoscopia | - | No |
| 10 | 52 | Hombre | Ninguno | TC | 4×4 | IV | NQH | Normal | Enucleación | Laparotomía | - | No |
NQH: neoplasia quística hepática; RM: resonancia magnética; TC: tomografía computarizada.
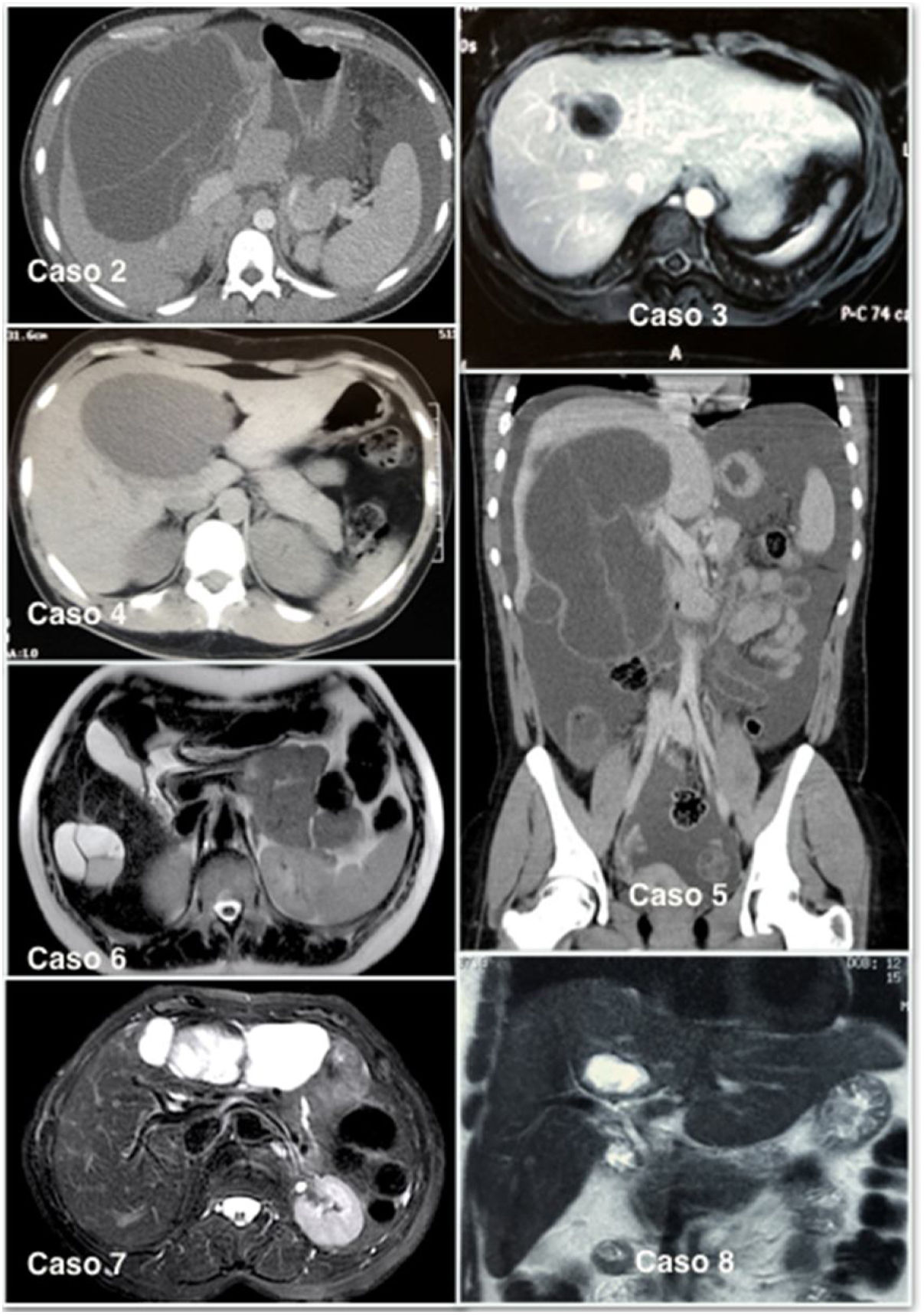
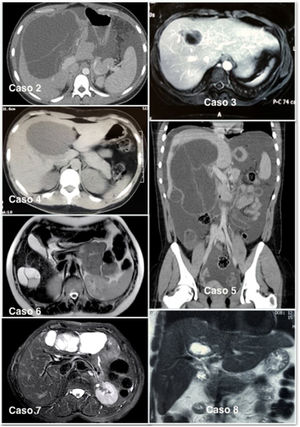
La aproximación diagnóstica se hizo inicialmente con ayuda de una ecografía; en todos los casos el estudio se completó con una tomografía (TC) abdominal (fig. 1). En 6 pacientes también se realizó una resonancia para una mejor caracterización de la lesión, en los que se observaron complejos quísticos multiloculados con septos internos vascularizados. En nuestra serie, la tumoración se localizó en el lóbulo hepático derecho en 5 pacientes y en ningún caso se empleó una PET-TC o una colangiopancreatografía retrógrada endoscópica como parte del estudio preoperatorio, tampoco se hizo una punción del quiste para el análisis de marcadores tumorales en el líquido.
Las pruebas de función hepática y la serología hidatídica fueron normales en todos los pacientes. Además, solo una paciente presentó elevación de los marcadores tumorales.
En cuanto al tratamiento quirúrgico, se efectuaron 3 hepatectomías (una derecha, una trisegmentectomía derecha y una lobectomía izquierda por el tamaño de las lesiones) y 7 enucleaciones (fig. 2). En ningún caso se realizó una biopsia intraoperatoria de los márgenes quirúrgicos.
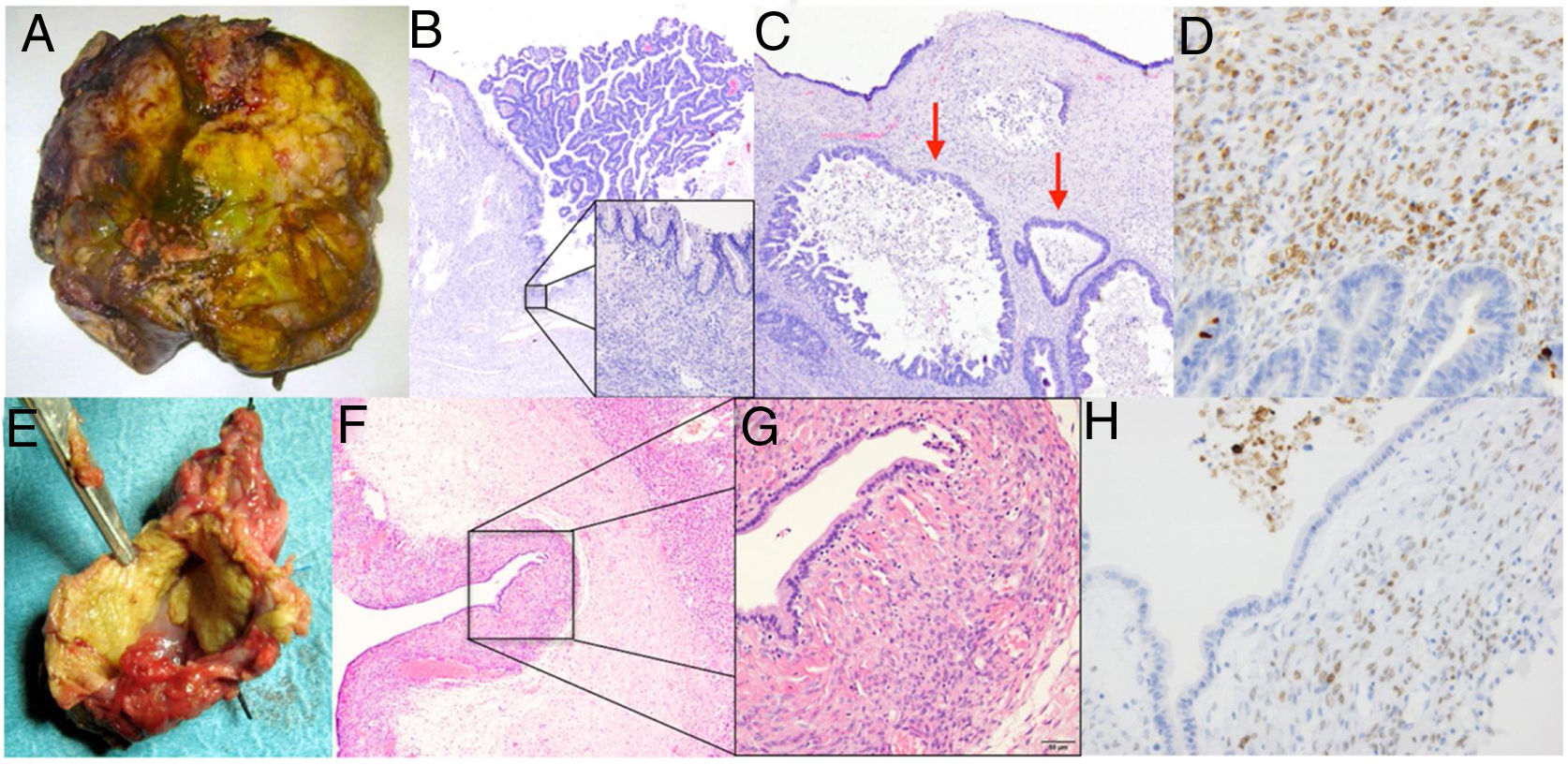
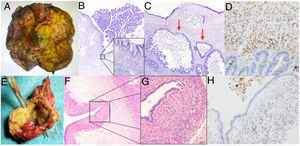
Caso 2. A) Pieza de hepatectomía que incluye la lesión quística. B) Dicha lesión presenta un revestimiento epitelial mucinoso y algunas áreas con proliferación intraluminal (40x, hematoxilina eosina). C) Presencia de zonas con displasia de alto grado en superficie y carcinoma invasivo (flechas) (200x, hematoxilina eosina). D) Inmunohistoquímica positiva para marcadores de estroma mülleriano.Caso 3. E) Imagen macroscópica de pieza de resección hepática atípica. F) El estudio histológico muestra la presencia de un quiste revestido de epitelio simple (40x, hematoxilina eosina). G) Bajo el epitelio se observa un denso estroma celular subyacente característico de las neoplasias quísticas mucinosas (400x, hematoxilina eosina). H) Imagen de tinción inmunohistoquímica que muestra células estromales con núcleos positivos para anticuerpos antirreceptores de progesterona y estrógenos con tinción nuclear positiva.
La evolución posoperatoria fue favorable en todos los enfermos, si bien se observó una complicación tipo II (Clavien-Dindo) en 3 pacientes.
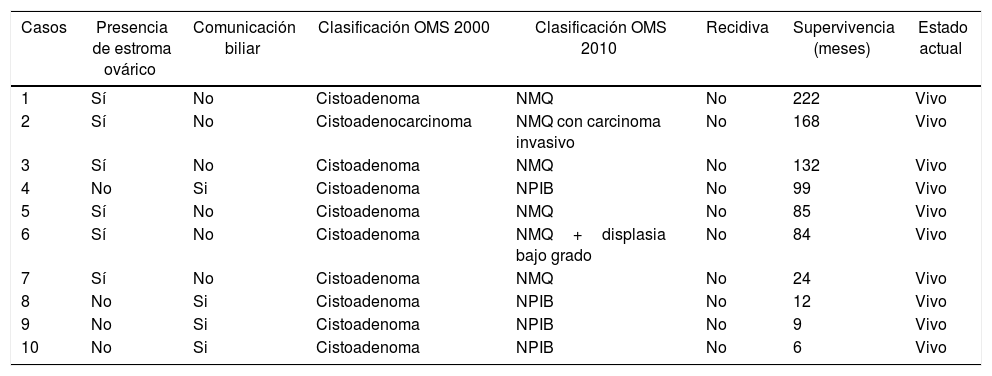
El informe anatomopatológico confirmó la presencia de neoplasias quísticas hepáticas, todas ellas mucinosas con presencia de epitelio biliar. En 6 casos se objetivó estroma ovárico con positividad en los receptores estrogénicos, mientras que en los 4 restantes no se evidenció presencia de estroma, aunque sí presencia de comunicación con las ramas biliares adyacentes y crecimiento papilar en el epitelio neoplásico. En un caso se observó atipia celular con displasia y zonas de adenocarcinoma infiltrante y en todos los casos los márgenes de resección fueron negativos (tabla 2).
Clasificación de las neoplasias quísticas intrahepáticas según histología
| Casos | Presencia de estroma ovárico | Comunicación biliar | Clasificación OMS 2000 | Clasificación OMS 2010 | Recidiva | Supervivencia (meses) | Estado actual |
|---|---|---|---|---|---|---|---|
| 1 | Sí | No | Cistoadenoma | NMQ | No | 222 | Vivo |
| 2 | Sí | No | Cistoadenocarcinoma | NMQ con carcinoma invasivo | No | 168 | Vivo |
| 3 | Sí | No | Cistoadenoma | NMQ | No | 132 | Vivo |
| 4 | No | Si | Cistoadenoma | NPIB | No | 99 | Vivo |
| 5 | Sí | No | Cistoadenoma | NMQ | No | 85 | Vivo |
| 6 | Sí | No | Cistoadenoma | NMQ+displasia bajo grado | No | 84 | Vivo |
| 7 | Sí | No | Cistoadenoma | NMQ | No | 24 | Vivo |
| 8 | No | Si | Cistoadenoma | NPIB | No | 12 | Vivo |
| 9 | No | Si | Cistoadenoma | NPIB | No | 9 | Vivo |
| 10 | No | Si | Cistoadenoma | NPIB | No | 6 | Vivo |
NMQ: neoplasia mucinosa quística; NPIB: neoplasia papilar intraductal biliar.
La mediana de seguimiento fue de 60 meses, con una ecografía o una TC abdominal a los 6 y 12 meses. En ningún caso se observó una recidiva de la tumoración en las pruebas de imagen. Por otro lado, el seguimiento de la paciente con presencia de un carcinoma infiltrante se realizó mediante TC anual durante 5 años. Además, esta paciente recibió quimioterapia adyuvante con taxol y carboplatino.
DiscusiónLas neoplasias quísticas hepáticas pueden cursar de forma asintomática y ser un hallazgo incidental, sobre todo en lesiones de pequeño tamaño. En otras ocasiones, pueden originar síntomas como dolor abdominal, masa palpable, sensación de plenitud y, en raras ocasiones, ictericia o síntomas relacionados con la localización del tumor8.
El diagnóstico radiológico es difícil y con frecuencia puede conducir a un diagnóstico erróneo, al poder confundirse con un absceso hepático, quiste hemorrágico, quiste simple, quiste hidatídico o con la enfermedad de Caroli9. Sin embargo, las mejoras en las técnicas de imagen se han traducido en un aumento de la detección de este tumor, aunque no son suficientes para un diagnóstico definitivo10. El patrón radiológico de una neoplasia quística hepática puede ser el de una masa con dilatación de la vía biliar proximal o distal, o el de un quiste unilocular o multilocular con áreas sólidas en su luz. En nuestra serie, 8 pacientes fueron diagnosticados de una neoplasia quística hepática con las pruebas de imagen.
Aunque estas neoplasias suelen tener pruebas de función hepática dentro de la normalidad, hay casos que cursan con elevación de transaminasas, bilirrubina, gammaglutamil transferasa y fosfatasa alcalina, aunque no fue así en nuestra serie. Sin embargo, estas alteraciones analíticas no permiten diferenciar una neoplasia quística hepática de un quiste simple11.
El análisis sérico y en el líquido quístico del Ca 19.9 y el CEA es controvertido. Su sensibilidad y especificidad no son suficientemente altas12 y no permiten discernir entre un tumor benigno o maligno, por tanto, puede estar elevado de forma indiferente tanto en una NMQ de bajo grado como en una NPIB con carcinoma in situ. Sin embargo, un incremento de los marcadores tumorales durante el seguimiento del paciente podría ser un indicador de transformación maligna o de recidiva en casos de resecciones incompletas13. En nuestra serie, solo en un paciente se observó una elevación del Ca 19.9 sérico, el análisis anatomopatológico fue de un NMQ con carcinoma invasivo y en ningún caso se hizo un análisis del Ca 19.9 del líquido quístico.
Por otro lado, una PAAF del quiste es poco específica y, en ocasiones, se ha relacionado con diseminación pleural y peritoneal, por lo que no se recomienda14. Así, en nuestra serie no se empleó en ningún caso.
No obstante, existen factores de riesgo que nos pueden hacer sospechar de un comportamiento maligno de una neoplasia quística hepática como: la edad, ser varón, tener síntomas de poco tiempo de evolución, el tamaño tumoral y la presentación en el hígado derecho15. Además, radiológicamente la presencia de nódulos murales con paredes irregulares y engrosados puede ir a favor de una malignización de una neoplasia quística hepática16.
En el 2000, la OMS denominó cistoadenomas o cistoadenocarcinoma mucinoso a cualquier lesión quística revestida de epitelio localizada en el hígado o el tracto biliar17. Posteriormente, en el 2010, la OMS clasificó estos tumores en NMQ (con presencia de estroma ovárico en el análisis inmunohistoquímico) y NPIB (es esencial en este tipo de tumor la ausencia de estroma ovárico y la comunicación del tumor con la vía biliar)3. Además, cada una de estas entidades puede asociar distintos grados de displasia, e incluso adenocarcinoma invasivo.
Quigley et al.18 revisaron las lesiones quísticas hepáticas en búsqueda de estroma ovárico y de reclasificarlos según la definición de la OMS de 2010, y obtuvieron 36 pacientes con NMQ. No obstante, el 25% de los pacientes diagnosticados previamente como cistoadenomas o cistadenocarcinoma no presentaron estroma ovárico y no pudieron ser clasificados como NMQ. Además, los tumores se localizaron de forma mayoritaria en el hígado izquierdo, circunstancia que se explicaría por la teoría del desarrollo embriológico de las gónadas en el mismo eje que el hígado izquierdo y el páncreas. En nuestra serie, en 5 casos la localización de las neoplasias fue en el hígado izquierdo, 2 de ellos fueron NMQ.
Zen et al.19 describieron una serie de 29 casos de NMQ y 12 de NPIB durante un periodo de 20 años. En este estudio multicéntrico, las diferencias entre ambos tumores fueron notorias desde el punto de vista radiológico, microscópico e inmunohistoquímico, de tal forma que las NMQ eran tumores más grandes, con presencia de quistes multiloculares septados o apariencia de quiste dentro de otro quiste y con mayor prevalencia de múltiples quistes; en el caso de la NPIB, con la presencia de nódulos papilares intramurales.
Budzynska et al.20 mencionaron la presencia de estroma ovárico y comunicación con la vía biliar en la misma tumoración quística hepática, lo que hace suponer que en casos excepcionales las NMQ pueden romper la vía biliar o que puedan existir casos de superposición: por tanto, la clasificación de la OMS (2010) resulta algo rígida.
Por otra parte, Albores Saavedra et al.21 describieron tumores que contenían estroma ovárico, pero cuyo epitelio era no mucinoso, que, además, carecían de epitelio displásico y, por tanto, no se asociaban a un carcinoma invasivo. Así, es importante tener en cuenta que la tasa de transformación maligna de este tipo de tumores puede ser de hasta un 20%. Cobra especial importancia la descripción del epitelio no mucinoso, al considerarse que el potencial maligno de las NMQ aumenta después de que el epitelio presente diferenciación mucinosa. Por tanto, la presencia de un epitelio biliar no mucinoso podría ser la fase inicial en el desarrollo de la lesión, en el que el siguiente paso sería la aparición de un epitelio mucinoso22. Además, la producción de mucina por las células hepáticas tumorales se ha asociado con una diferenciación biliar.
Nakanuma et al.23 (2018) propusieron dividir las NPIB en 2tipos: el tipo 1 o el clásico tumor mucinoso papilar intraductal similar al del páncreas productor de mucina, con epitelios de diferenciación gástrica o intestinal; y el tipo 2, que siempre presenta epitelio con displasia de alto grado, caracterizado por la diferenciación intestinal o pancreatobiliar, con áreas más irregulares en las papilas y patrón complejo, cribiforme o infiltrante.
El tratamiento de elección debe ser la resección quirúrgica completa de la lesión con márgenes negativos para evitar recidivas. Así, la resección quirúrgica se puede ejecutar tanto de forma anatómica como no anatómica, según la localización del tumor y su relación con estructuras vasculares principales. En nuestra serie, las resecciones han sido tanto anatómicas como enucleaciones, en función de los segmentos hepáticos involucrados y de la afectación de estructuras biliares o vasculares principales. Por tanto, la enucleación se recomienda en tumores centrales con extensión bilateral o asentados sobre hígados con daño parenquimatoso previo24. En relación con la vía de abordaje, el uso de la laparoscopia está cada vez más aceptado, al no haberse demostrado una mayor tasa de recidiva con su empleo. La biopsia intraoperatoria del margen de sección es controversial, al no ser habitualmente representativa25.
Otros tratamientos como la aspiración percutánea, esclerosis, etanolización, marsupialización o el destechamiento son considerados inapropiados debido al potencial maligno y a una alta tasa de recidiva. De manera que, ante la sospecha de una neoplasia quística hepática y a la dificultad para diferenciar entre aquellos casos benignos o malignos en el estudio preoperatorio, el tratamiento de elección debería ser la resección completa del tumor26,27.
En casos excepcionales podría estar indicado el trasplante hepático. Así, Romagnoli et al.28 describieron el caso de una paciente de 53 años con una tumoración compatible con NMQ de localización central con historia de ictericia obstructiva en la que, debido a la imposibilidad técnica de una resección quirúrgica con márgenes libres, se propuso un trasplante hepático, que se llevó a cabo sin incidencias. Sin embargo, un trasplante hepático en este tipo de tumores plantea varias cuestiones, tales como la necesidad de inmunosupresión de por vida y la posibilidad de recidiva tumoral, aspecto desconocido hasta el momento debido al escaso número de publicaciones, dado que el trasplante solo se ha llevado a cabo en casos anecdóticos. En el caso concreto de las NMQ, el hecho de presentar estroma ovárico refuerza el bajo potencial maligno de estas lesiones, comparable con la tasa de recidiva del carcinoma hepatocelular, la adenomatosis hepática o la hemangiomatosis. Por lo tanto, la indicación de trasplante hepático en estos pacientes no debería ser la norma, pero sí podría ser una alternativa en pacientes sintomáticos y con grandes tumoraciones, en los que la resección hepática podría suponer un riesgo excesivo.
En conclusión, las neoplasias quísticas hepáticas son tumores poco frecuentes, que plantean un dilema en el diagnóstico diferencial, por lo que, ante la sospecha radiológica, el tratamiento de elección debería ser la resección completa del tumor para evitar su malignización y la recidiva.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.