La expresión esófago de Barrett (EB) se refiere a la sustitución de un segmento de epitelio escamoso del esófago distal por epitelio columnar (metaplasia) como consecuencia del reflujo gastroesofágico crónico de ácido y contenido duodenal. Por su histología, el EB se define por presentar metaplasia intestinal con sus características células caliciformes1,2. El EB es la lesión premaligna del adenocarcinoma del esófago a lo largo de la secuencia metaplasia-displasia-cáncer3.
El objetivo de esta revisión es presentar los nuevos avances en el diagnóstico endoscópico de la displasia y el adenocarcinoma precoz en pacientes con EB, así como las distintas opciones terapéuticas, tanto endoscópicas como quirúrgicas, que podrían plantearse, de una manera individualizada, en estos pacientes.
Displasia y las dificultades de su diagnóstico histológicoLa displasia en el EB se reconoce histológicamente por la combinación de alteraciones tanto celulares como en la arquitectura del epitelio4,5. Según las alteraciones observadas, la displasia se clasifica en grados de progresiva gravedad. Los patólogos distinguen fundamentalmente entre displasia de bajo grado (DBG) y displasia de alto grado (DAG). Desde la introducción de la clasificación de Viena para las lesiones premalignas del tracto digestivo, algunos autores recomiendan sustituir el término displasia por «neoplasia intraepitelial» (neoplasia intraepitelial de bajo grado o alto grado), con el objetivo de subrayar el carácter neoplásico del tejido6. El término carcinoma in situ ya no se utiliza y sería sinónimo de DAG. Cuando las células neoplásicas sobrepasan la membrana basal e infiltran la lámina propia, nos encontramos ante un carcinoma intramucoso.
Las variaciones intraobservador y entre observadores a la hora de diagnosticar la displasia es uno de los problemas fundamentales con los que se enfrenta el patólogo gastrointestinal. Entre patólogos expertos el grado de acuerdo en el diagnóstico de la DBG es menor del 50%7–9. Para distinguir la DAG de las demás lesiones epiteliales de menor gravedad, el consenso entre patólogos es mayor (85%), aunque no el óptimo deseable. También puede ser difícil distinguir, especialmente en biopsias superficiales, la DAG del adenocarcinoma intramucoso10.
Adenocarcinoma precoz: clasificación y riesgo de afectación ganglionarLas lesiones invasivas precoces son los cánceres intramucosos y las neoplasias que infiltran la submucosa6,11. Para definir mejor el riesgo de metástasis en los ganglios linfáticos, se han dividido las capas mucosa (m) y submucosa (sm) en tres secciones cada una. Se habla de m1 cuando está afectado el epitelio (neoplasia intraepitelial de alto grado) sin invasión de la membrana basal; m2, cuando hay infiltración de la lámina propia, y m3, cuando la invasión alcanza la muscularis mucosae (mm). El espesor total de la submucosa puede evaluarse sólo en las muestras resecadas quirúrgicamente, lo que permite medir, de forma semicuantitativa, la profundidad de la invasion tumoral, y estratificar la submucosa en tres capas iguales: sm1, sm2 y sm3. Buskens et al12 estudiaron 77 muestras de esofagectomía que contenían DAG o carcinoma T1. Se detectaron metástasis ganglionares en el 23% de los tumores sm2 y en el 69% de los tumores sm3, pero no en las lesiones m1, m2, m3 y sm1.
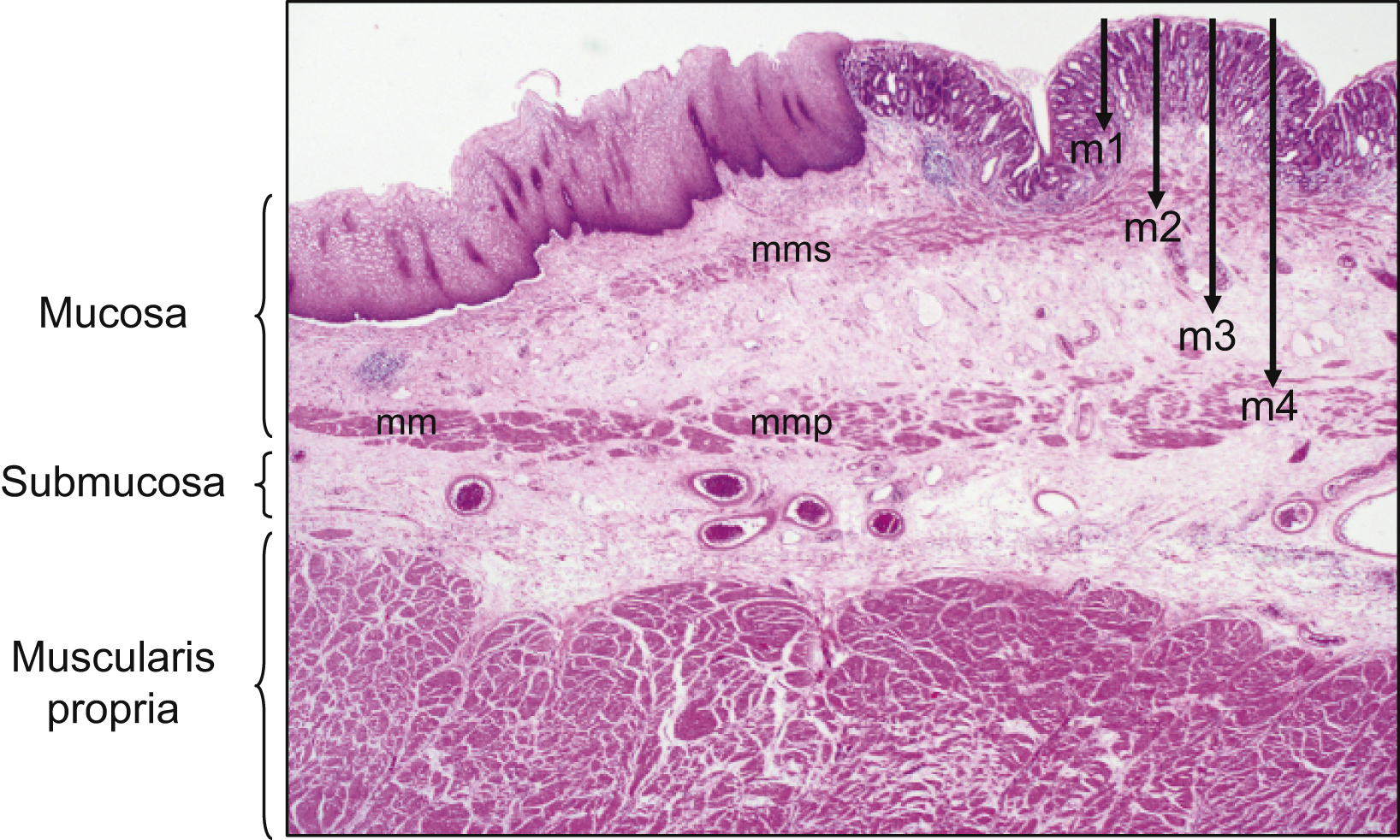
Se ha confirmado, como hecho histológico característico del EB, que hay una mm doble13. Algunos patólogos podrían confundir la mm superficial con una mm única e interpretar la infiltración más allá de esta primera mm como invasión de la submucosa, cuando en realidad la lesión no ha alcanzado la mm profunda. Vieth et al14 han propuesto una nueva clasificación de las diferentes capas de la mucosa (fig. 1). Cuando el tumor contacta con la mm profunda puede haber invasión linfática en el 2,8–10% de los casos13,14. Los informes patológicos deben describir con precisión el grado de infiltración del adenocarcinoma en lugar de utilizar descripciones generales, como invasión de la mucosa o la submucosa.
Figura 1. Clasificación del adenocarcinoma de Barrett según el grado de infiltración en profundidad71. Se observa el desdoblamiento de la muscularis mucosae (mm) en dos haces, uno superficial (mms) y otro profundo (mmp), desde la zona de epitelio escamoso (izquierda) hacia la zona de epitelio columnar de Barrett. m1: infiltración de la lámina propia; m2: infiltración de la mm superficial; m3: invasión del espacio entre las dos mm; m4: invasion de la mm profunda.
Diagnóstico endoscópico
Los protocolos de seguimiento en los pacientes con EB recomiendan endoscopias periódicas con toma de biopsias en cada uno de los cuadrantes del esófago a intervalos de 1 o 2 cm y de las alteraciones visibles como nódulos o úlceras (Protocolo de Seattle)15. La DAG y el adenocarcinoma precoz no son visibles habitualmente en las endoscopias convencionales e identificarlos puede ser difícil a pesar de seguir protocolos rigurosos en la toma de biopsias.
Se han evaluado o están en proceso de evaluación diversos métodos para identificar con mayor seguridad la metaplasia intestinal, la displasia y el adenocarcinoma en el EB. El valor potencial de estas técnicas diagnósticas de imagen está en la posibilidad de examinar en su totalidad el segmento de Barrett, con el fin de identificar la displasia, sin necesidad de tomar biopsias, o de facilitar su toma selectiva en áreas que probablemente contienen epitelio displásico.
Técnicas de imagen por vía endoscópicaLas técnicas de diagnóstico por la imagen pueden identificar el epitelio de Barrett tanto por la naturaleza absortiva de sus células como por la magnificación de la imagen, hasta alcanzar una resolución que permita poner de manifiesto su estructura glandular y detectar mínimas alteraciones en su superfice indicativas de displasia.
CromoendoscopiaLa cromoendoscopia consiste en la aplicación de colorantes sobre la mucosa esofágica con el fin de resaltar los patrones de la superficie mucosa y mejorar la detección y los límites de lesiones neoplásicas precoces. Este método haría posible realizar biopsias dirigidas hacia zonas sospechosas en lugar de hacerlo de forma aleatoria.
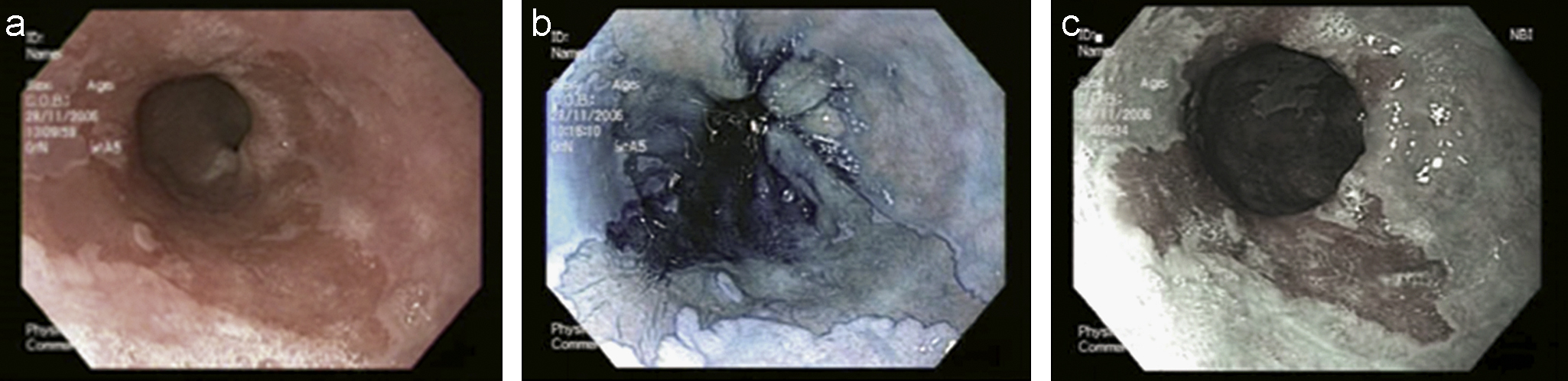
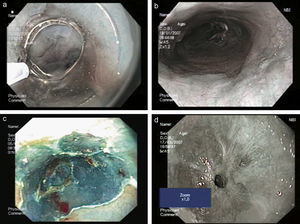
El azul de metileno tiñe de forma reversible las células absortivas de la metaplasia intestinal (fig. 2). Las áreas con DAG no absorben el colorante, mientras que las áreas con DBG no se comportan de manera homogénea. A pesar de la plétora de artículos dedicados a la posible utilidad del azul de metileno en el diagnóstico del EB, los resultados son controvertidos16,17, y su precisión diagnóstica está reducida en los pacientes con esofagitis concomitante18,19. El azul de metileno es menos sensible para detectar la displasia que el Protocolo de Seattle20. En consecuencia, no parece recomendable utilizar la cromoendoscopia con azul de metileno en el seguimiento del EB. Se ha descrito, con cierta preocupación, que el azul de metileno se une al ADN y, cuando se expone el EB a la luz blanca, podrían inducirse alteraciones genéticas21.
Figura 2. Esófago de Barrett. A: endoscopia de alta definición. B: después de tinción con azul de metileno. C: imagen de banda estrecha.
El índigo carmín es un colorante azul que no se absorbe por las células, pero que resalta las pequeñas irregularidades de la superficie mucosa, por lo que ha demostrado su utilidad cuando se combina con la endoscopia con magnificación22. Sharma et al23 describieron tres patrones de EB: el estriado/velloso, el circular y el irregular/distorsionado. El patrón estriado/velloso se observó en el EB sin displasia y en la DBG. El patrón irregular/distorsionado se observó en la DAG con una sensibilidad y una especificidad del 100%.
El ácido acético (AA) elimina la capa superficial de moco y produce una desnaturalización reversible de la proteína citoplasmática intracelular que pone al descubierto el patrón mucoso y permite identificar la metaplasia intestinal. Guelrud et al24 distinguieron con esta técnica 4 tipos de patrones de la superficie mucosa y 2 de ellos (III: patrón velloso; IV: patrón distorsionado) tuvieron un alto valor predictivo (el 87 frente al 100%, respectivamente) para la metaplasia intestinal. Hoffman et al25 demostraron que la endoscopia con magnificación, junto con la toma de biopsias guiada por la tinción previa con AA, era mejor que la videoendoscopia convencional con toma aleatoria de biopsias para diagnosticar el EB (el 78 frente al 57%, respectivamente). Otros autores han confirmado estas observaciones en pacientes con segmentos cortos de Barrett (<3 cm)26. No se dispone de información relevante sobre la aplicación del AA para el diagnóstico de la displasia y el adenocarcinoma precoz en el EB.
Imagen de banda estrecha (narrow-band imaging)La imagen de banda estrecha (NBI) es una técnica endoscópica de alta resolución que utiliza filtros ópticos adicionales que permiten la transmisión de la luz azul, mientras que eliminan las luces de otras longitudes de onda. La profundidad de la penetración de la luz depende de su longitud de onda y la luz azul de 475 nm penetra sólo superficialmente el tejido y permite, por una parte, la mejor visión de la morfología de la mucosa sin el uso de colorantes y, por otra, al ser absorbida por la hemoglobina, pone de manifiesto la distribución vascular27–31 (fig. 2).
Sharma et al30,31 definieron tres patrones de la mucosa en pacientes con EB: estriado/velloso, circular e irregular/distorsionado y dos patrones vasculares: normal y anormal. Los mismos autores encontraron que el patrón estriado/velloso tenía una relación significativa con el EB sin DAG, mientras que los patrones irregular/distorsionado y vascular anormal tenían relación con el EB con DAG. Kara et al28 han descrito que el patrón mucoso irregular o desestructurado, el patrón vascular irregular y los vasos sanguíneos anormales fueron factores predictivos independientes de la DAG.
La endoscopia de alta resolución (EAR) seguida de NBI es equivalente, en sus resultados, a la EAR seguida de cromoendoscopia con índigo carmín (el 86 frente al 93%, respectivamente) para la detección de DAG o adenocarcinoma precoz en el EB32.
AutofluorescenciaCuando los tejidos se exponen a una luz de una longitud de onda corta (ultravioleta o luz azul), determinadas sustancias endógenas (fluoróforos) absorben la energía lumínica y alcanzan un estado de excitación. Desde este estado de excitación, los fluoróforos emiten luz de una mayor longitud de onda que la luz que produjo el estado de excitación. Este fenómeno recibe el nombre de autofluorescencia. Los fluoróforos que causan la autofluorescencia de los tejidos son el NADH del colágeno, las porfirinas y los aminoácidos aromáticos33,34. Las variaciones en la composición molecular y en la microestructura de los tejidos producen diferencias en la fluorescencia, de esta forma, se establecen las condiciones para diferenciar los tejidos neoplásicos de los no neoplásicos. La aplicación de la autofluorescencia mediante el endoscopio como fuente de las ondas de luz excitadoras se ha denominado endoscopia con fluorescencia inducida por la luz35.
Pese a sus teóricas ventajas y a los esfuerzos por mejorar su eficacia (administración de fluoróforos intravenosos o tópicos, como el ácido 5-aminolevulínico36, técnicas de imagen con autofluorescencia [autofluorescence imaging, AFI] que utilizan endoscopios de alta resolución y algoritmos de imagen que incorporan la reflectancia37, asociación de AFI y NBI38, y utilización de la combinación de la EAR, NBI y AFI en un solo endoscopio39), el papel de la AFI en el EB está aún por definir. Datos recientes muestran que esta técnica todavía carece de sensibilidad y especificidad suficientes para aconsejar su uso en el seguimiento de estos pacientes. Algunos grupos utilizan la AFI para la detección inicial de áreas sospechosas de displasia y luego combinan el NBI para su inspección meticulosa. Se ha demostrado que el NBI reduce los falsos positivos de la AFI40.
Resección endoscópica de la mucosa en el diagnóstico de displasia y adenocarcinoma precozLa resección endoscópica de la mucosa (REM) es, al mismo tiempo, una opción diagnóstica y una alternativa terapéutica en pacientes seleccionados con lesiones neoplásicas superficiales41. Entre las técnicas más habituales de REM se encuentran las siguientes: biopsia en tiras (strip biopsy), REM asistida con cápsula (cap-assisted) y técnica de succionar y ligar (suck-and-ligate technique). El tamaño de las muestras obtenidas con estos procedimientos varía entre 10 y 15 mm. La REM puede acompañarse de complicaciones, entre las que se incluyen la hemorragia y la perforación (<1%).
Tratamiento del EB con displasia y adenocarcinoma precozLa esofagectomía, al eliminar todo el epitelio displásico, ha sido el tratamiento estándar para la DAG y el adenocarcinoma precoz en pacientes con EB, con una probabilidad de supervivencia a los 5 años mayor del 90–95%42. Sin embargo, esta técnica conlleva una morbilidad significativa y una mortalidad del 3–5% en centros de referencia. Los adenocarcinomas intramucosos tienen un riesgo muy bajo de afectación ganglionar, lo que permitiría su tratamiento local. Se han desarrollado diferentes técnicas endoscópicas para tratar la displasia y el adenocarcinoma precoz.
Tratamiento endoscópicoEl objetivo del tratamiento endoscópico es eliminar el EB displásico, al facilitar la restitución del epitelio escamoso. Entre los métodos utilizados para eliminar la DAG se encuentran la terapia fotodinámica (TFD), la coagulación con plasma de argón (CPA) y la radiofrecuencia (RF), así como la REM (tabla 1). Después de estos procedimientos, es necesario mantener un control prolongado del reflujo gastroesofágico.
Tabla 1. Opciones terapéuticas para el adenocarcinoma precoz en el esófago de Barrett
| Tratamiento | Ventajas | Inconvenientes | Resultado |
| REM | Evaluación histológica. Exéresis de EB circunferencial hasta 4 cm | Tratamiento incompleto de focos ocultos de DAG en segmentos largos de EB | Favorable en el adenocarcinoma intramucosoa |
| TFD | Fácil de realizar | Ausencia de un examen histológico adecuado. Fotosensibilidad y estenosis esofágicas. Tratamiento incompleto de la MI residual. Islotes ocultos de MI por debajo del neoepitelio escamoso | Favorable en el adenocarcinoma intramucosob |
| Radiofrecuencia (HALO®) | Fácil de realizar. Ablación circunferencial. Sin complicaciones | Tratamiento incompleto de la MI residual (en menor proporción que la TFD) | Favorable en la DAG. Favorable en el adenocarcinoma intramucoso (sin resultados a largo plazo)b |
| Cirugía | Exéresis completa del EB. Evaluación histológica de los ganglios linfáticos | Morbilidad y mortalidad no despreciables. Deterioro de la calidad de vida | Tratamiento radical |
DAG: displasia de alto grado; EB: esófago de Barrett; MI: metaplasia intestinal; REM: resección endoscópica de la mucosa; RF: radiofrecuencia; TFD: terapia fotodinámica.
a Debe combinarse con TFD o RF en segmentos de Barrett >4 cm.
b Siempre debe realizarse REM antes de la ablación para eliminar lesiones visibles.
Resección endoscópica de la mucosa como tratamiento: indicaciones y resultados
La REM, al contrario que las técnicas ablativas (TFD, CPA y RF), permite la evaluación histológica de la lesión y define tanto el margen lateral de infiltración como la afectación en profundidad. Conio et al43 y Mino-Kenudson et al44 observaron un cambio en el diagnóstico histológico en el 26 y el 37%, respectivamente, de los pacientes con EB a quienes se realizó una REM (tabla 2).
Tabla 2. Estudios seleccionados de resección endoscópica de la mucosa en la displasia de alto grado y el adenocarcinoma precoz en el esófago de Barrett
| Autor | Pacientes, n | Tamaño de la lesión (cm), mediana | Histología pre-REM | Histología post-REM | Complicaciones | Cirugía | Seguimiento (meses), media | Recidiva |
| Peters et al67, 2005 | 28/33 (REM) | 1,5 | 9 DAG; 10 DAG/AC; 14 AC | 8 DAG; 15 CIM; 7 CSM; 3 sin displasia | Hemorragia leve, 54% (15/28); estenosis, 3,5% (1/28) | 5 (4 CSM, 1 CIM) | 19* | 19% (5/26) |
| Mino-Kenudson et al44, 2005 | 18 | 1,1 | 10 DAG; 7 CIM; 2 CSM | 2 DBG; 5 DAG; 10 CIM; 2 CSM | 0 | 1 AC | SD | 47% (8/17) |
| Conio et al43, 2005 | 39 | 1,5 | 35 DAG; 4 CIM | 5 DBG; 27 DAG; 2 CIM; 5 CSM | Hemorragia, 10% (4/39); estenosis, 3% (1/39) | 3 (1 DAG, 2 CSM) | 35* | |
| Giovannini et al48, 2004 | 21 | 1,6 | 12 DAG; 9 CIM | 12 DAG; 9 CIM | Hemorragia, 19% (4/21) | 1 (CIM) | 18 | 0 |
| Seewald et al50, 2003 | 12 | SD | 3 DAG; 2 DAG/CIM; 7 CIM | 2 EB; 1 DBG; 5 DAG; 4 CIM | Hemorragia, 33% (4/12); estenosis, 17% (2/12) | 0 | 9* | 0 |
| May et al45, 2002 | 80 | SD | 7 DAG; 73 AP | 7 DAG; 62 CIM; 11 CSM | Hemorragia, 6% (5/80); estenosis, 4% (3/80) | 0 | 34 | 30% (24/80) |
| Buttar et al, 200168 | 17 | SD | 7 CIM; 10 ACi | 7 CIM; 10 ACi | Hemorragia, 6% (1/17); estenosis, 30% (5/17) | 1 | 13 | 0 |
| Nijhawan et al69, 2000 | 25 | SD | 2 EB; 8 DBG; 5 DAG; 9 AC; 1 otro | 2 EB; 3 DBG; 5 DAG; 7 CIM; 6 CSM; 2 otro | 0 | 2/13 (AC) | 14,6 | 31% (4/13) |
| Ell et al70, 2000 | 35 | 0,9 | 3 DAG; 32 CIM | 3 DAG; 32 CIM | Hemorragia, 20% (7/35) | SD | 12 | 11% (4/35) |
AC: adenocarcinoma; ACi: adenocarcinoma invasivo (probablemente invasión submucosa); AP: adenocarcinoma precoz; CIM: cáncer intramucoso; CSM: cáncer submucoso; DAG: displasia de alto grado; DBG: displasia de bajo grado; EB: esófago de Barrett; REM: resección endoscópica de la mucosa; SD: sin datos. *Mediana.
Diferentes estudios apuntan a que la REM puede eliminar con éxito adenocarcinomas precoces con una baja tasa de complicaciones, si bien se reconoce que la REM conlleva tasas de recidivas del 25–30% durante los primeros 3 años cuando se utiliza como único tratamiento en pacientes con DAG o con adenocarcinoma intramucoso45. Este hecho indica una desventaja de esta técnica, por lo que es necesario un seguimiento endoscópico muy estricto tras la REM o tratar el EB residual mediante técnicas ablativas.
Ell et al46 realizaron 144 REM en 100 pacientes con adenocarcinomas de esófago de bajo riesgo (tipos macroscópicos I [polipoideo], IIa [elevado], IIb [plano] y IIc [deprimido]; diámetro no mayor de 20 mm, lesión mucosa sin evidencia de invasión linfática y venosa, y grados histológicos G1 y G2) sin complicaciones importantes. Los autores consiguieron la remisión local completa en 99 pacientes tras un máximo de 3 resecciones. Durante una media de seguimiento de 36,7 meses, el 11% de los pacientes desarrollaron recidivas o lesiones metacrónicas y nuevamente fueron tratados con éxito con REM. A 49 pacientes se les realizó ablación de la mucosa remanente con CPA o TFD para segmentos cortos o largos de Barrett, respectivamente.
La mucosectomía circunferencial (stepwise radical endoscopic resection) es un paso más en la técnica resectiva que permitiría la extirpación completa y radical del epitelio metaplásico, con una evaluación histologica óptima, y evita la persistencia de focos residuales de EB. Sin embargo, realizarla no es fácil y sólo estaría indicada en segmentos de Barrett con una longitud<5 cm47–51 (fig. 3). El índice de complicaciones (hemorragia y perforación) es bajo (2%), aunque la incidencia de estenosis es elevada (20–50%).
Figura 3. Resección endoscópica circunferencial de la mucosa de Barrett. A: la alteración de la mucosa (adenocarcinoma intramucoso) antes de la resección endoscópica de la mucosa. B: resección de la lesión visible en el esófago inferior. C: la resección circunferencial completa del esófago de Barrett ya se ha realizado. D: la estenosis benigna 3 semanas después.
Ablación del epitelio de Barrett
Durante estos años se han propuesto, como alternativa a la esofagectomía, tratamientos endoscópicos que utilizan energía térmica (coagulación con plasma de argón, láser, radiofrecuencia, electrocoagulación multipolar) o fotoquímica (TFD) para destruir el EB con displasia. Tras la ablación del epitelio, se precisa el control del reflujo gastroesofágico mediante fármacos antisecretores o cirugía antirreflujo; todo ello crea, en principio, las condiciones para la restitución de la zona destruida por epitelio escamoso.
La técnica más utilizada es la TFD. Los pacientes reciben un fámaco fotosensibilizador (porfímero o ácido 5-aminolevulínico) que es captado por las células del epitelio displásico. La aplicación de luz láser sobre la mucosa del esófago produce la activación del fármaco y la generación de radicales libres de oxígeno que destruyen selectivamente el tejido. El ácido 5-aminolevulínico se acumula en la mucosa, mientras que el porfímero lo hace en la submucosa y causa una necrosis más profunda.
Si bien diversos trabajos han descrito la viabilidad de esta técnica para eliminar el epitelio neoplásico52, su beneficio clínico como técnica aislada en el tratamiento de la DAG y el adenocarcinoma intramucoso no ha quedado bien establecido. La TFD es una técnica costosa que conlleva riesgos, como la estenosis (25–30%), e inconvenientes. Además de la persistencia de áreas de epitelio de Barrett tras la aplicación de esta técnica, también se han detectado islotes de epitelio intestinal por debajo del nuevo epitelio escamoso. Se ha demostrado, asimismo, la persistencia de las alteraciones histológicas y celulares en el epitelio de Barrett residual tras la ablación con TFD.
La aplicación de la TFD como tratamiento adyuvante de la REM es una opción terapéutica más atractiva en el paciente con DAG y adenocarcinoma intramucoso. La REM permite la exéresis de lesiones visibles y de otras áreas sospechosas con el subsiguiente estudio histológico. Si se descarta un adenocarcinoma submucoso y la resección del adenocarcinoma intramucoso ha sido radical, entonces el epitelio de Barrett residual puede ser tratado con TFD. Un reciente estudio retrospectivo de cohortes, realizado en la Clínica Mayo, no observó diferencias en la mortalidad general entre un grupo de pacientes con DAG tratados con TFD en combinación con REM y otro grupo con DAG tratado con esofagectomía (el 9 frente al 8,5%)53. La mediana de seguimiento en ambos grupos fue mayor de 5 años. La mortalidad operatoria fue del 1,4% y se halló adenocarcinoma oculto en el 12,8% de las piezas de esofagectomía. Durante el seguimiento de los pacientes tratados con TFD, 8 (6,2%) pacientes desarrollaron adenocarcinoma, 5 de los cuales eran intramucosos. Estos resultados, procedentes de un centro con una especial competencia en el tratamiento multidisciplinario de esta enfermedad, no son fácilmente extrapolables y deben ser confirmados con otros estudios prospectivos.
La ablación circunferencial y/o focal del EB mediante RF con el sistema HALO es una nueva y prometedora técnica. La ablación circunferencial inicial se realiza con un electrodo bipolar acoplado a un balón, mientras que el tratamiento secundario de la áreas residuales de Barrett se lleva a cabo con un electrodo bipolar que se incorpora al extremo del endoscopio. Datos recientes, procedentes de ensayos clínicos en los que se incluía a pacientes con EB sin displasia, con DBG o DAG, y con adenocarcinomas intramucosos tras su eliminación con REM, demuestran que la ablación con RF, en combinación o no con REM, es segura y efectiva para la erradicación de la displasia y la metaplasia intestinal54–56. Pouw et al55 trataron con RF a 44 pacientes con EB más DBG, DAG o adenocarcinoma intramucoso. En 31 casos se realizó una REM antes de la ablación. Los autores describen, tras una media de seguimiento de 21 meses, la erradicación completa de la displasia y la metaplasia intestinal en el 98% de los casos. El punto clave cuando se compara esta técnica con la TFD es la ausencia de focos ocultos de metaplasia intestinal por debajo del nuevo epitelio escamoso55,56. Asimismo, la ablación con RF preserva la funcionalidad del esófago sin causar estenosis. Se precisan estudios con un largo seguimiento para confirmar que la eliminación del EB se mantiene con el tiempo.
El papel de la cirugíaDurante muchos años la esofagectomía ha sido el tratamiento de elección en pacientes con DAG. Los argumentos esgrimidos son: el elevado riesgo de progresión de la displasia a adenocarcinoma, la resección de todo el segmento de esófago con epitelio columnar sin posibilidad de que el epitelio de Barrett y el adenocarcinoma reaparezcan en el futuro y los datos de series quirúrgicas que confirman carcinomas ocultos T1a o T1b tras la esofagectomía en hasta el 50% de los pacientes inicialmente diagnosticados de DAG57–59.
Estudios recientes han proporcionado información que podría modificar, en casos seleccionados, la indicación de la esofagectomía. Hay datos que indican que la estimación más real sobre la incidencia de adenocarcinoma en pacientes diagnosticados de DAG sería de 6,6/100 pacientes-año de seguimiento, siempre que la evaluación endoscópica sea rigurosa60. Konda et al61 determinaron, recientemente, la prevalencia de adenocarcinomas invasivos (submucosos), con alta prevalencia de afectación ganglionar, en pacientes con DAG tratados con esofagectomía. De un total de 14 estudios analizados, sólo el 12,7% de los pacientes tenían adenocarcinoma submucoso, una prevalencia muy inferior comparada con el 40–50% que frecuentemente se describe en la literatura. La falta de un protocolo estricto en la toma de biopsias, una insuficiente inspección para la detección de mínimos cambios en la mucosa y la experiencia de los patólogos pueden influir en estos resultados. En un momento en que las técnicas endoscópicas (REM en combinación con RF o TFD), todavía experimentales, muestran resultados prometedores, la información que proporciona este estudio tiene relevancia ya que pone de manifiesto la baja prevalencia de adenocarcinomas submucosos (indicación de esofagectomía) y establece un escenario en el que la distinción entre adenocarcinoma intramucoso y adenocarcinoma invasivo es un punto crítico a la hora de plantear las distintas opciones terapéuticas con el paciente61.
Por el momento, los resultados de la esofagectomía en pacientes con DAG y adenocarcinoma precoz de Barrett deben considerarse el estándar con el que comparar otras modalidades terapéuticas. Datos de la literatura muestran una supervivencia libre de cáncer de más del 90% en los pacientes con DAG y adenocarcinoma intramucoso62.
Los resultados de la esofagectomía para los tumores que invaden la submucosa dependen de si hay o no afectación ganglionar. En ausencia de afectación ganglionar, la probabilidad de supervivencia a los 5 años supera el 90%, mientras que en caso de afectación ganglionar es del 40–60%. A pesar de estos excelentes resultados oncológicos, los principales inconvenientes son la morbilidad (20–45%) y la baja, pero significativa, mortalidad (1–5%) que acompañan a este procedimiento cuando se realiza en centros de excelencia.
En un esfuerzo por disminuir aún más las cifras de morbilidad y mortalidad y por igualar el nuevo reto que suponen las técnicas endoscópicas, el interés reciente se centra en el desarrollo de intervenciones quirúrgicas menos invasivas. La ausencia de afectación ganglionar y micrometástasis en pacientes con DAG y adenocarcinoma intramucoso apoyaría esta propuesta.
La primera opción consiste en una esofagectomía distal muy limitada con resección del cardias, seguida de una interposición de yeyuno para reconstruir el tránsito intestinal (operación de Merendino). Stein et al63 publicaron los resultados de una serie de 70 pacientes con tumores uT1 sin afectación ganglionar tras la evaluación con ecoendoscopia a quienes se realizó esta técnica. En el estudio histopatológico de la pieza quirúrgica no se observó afectación ganglionar. Tras una mediana de seguimiento de 69 meses, la probabilidad de supervivencia a los 5 años fue del 83,4%. La evaluación de la calidad de vida no detectó reflujo gastroesofágico y se valoró la deglución como buena-excelente en el 92% de los pacientes.
Una segunda opción para el paciente con DAG o adenocarcinoma intramucoso sin lesión endoscópica visible consiste en la esofagectomía subtotal con preservación de los nervios vagos y reconstrucción con estómago o colon. Banki et al64, en una serie de 15 pacientes, describieron la ausencia de diarrea y una incidencia significativamente más baja de dumping (6,6%) en comparación con las resecciones estándar con interposición de colon o estómago (el 30 y el 60%).
Una tercera opción consiste en la esofagectomía realizada por toracoscopia y laparoscopia, seguida de tubulización gástrica y anastomosis esofagogástrica a nivel cervical. En una serie de 222 pacientes tratados con este abordaje, la mortalidad a los 30 días fue del 1,4%65. La supervivencia a los 40 meses en un grupo de 45 pacientes con DAG fue del 96%, y en los pacientes en estadio I fue del 70%. Algunos autores cuestionan esta técnica por la falta de una linfadenectomía adecuada y el insuficiente estudio de extensión consiguiente, lo que condicionaría un mayor riesgo de recidiva. Esta preocupación se centra específicamente en los pacientes con adenocarcinoma submucoso, en los que se ha descrito recidiva en el 50% tras esofagectomía transhiatal66.
ConclusionesEl diagnóstico y el tratamiento de la DAG y el adenocarcinoma precoz en el EB deben realizarse de forma multidisciplinaria. Para la detección óptima de estas lesiones se requiere de métodos endoscópicos de alta resolución y una experta evaluación histológica. La REM es fundamental pues mejora la valoración del estadio de estas lesiones y permite adoptar decisiones individualizadas. La detección de un adenocarcinoma submucoso es indicación de esofagectomía. En el caso del adenocarcinoma intramucoso, con mínimo riesgo de afectación ganglionar, la REM puede convertirse en una opción terapéutica de elección, siempre que la exéresis sea radical y se asuma la necesidad del tratamiento complementario del EB residual con técnicas ablativas, como la radiofrecuencia. La ablación con radiofrecuencia puede convertirse en el tratamiento de elección de la DAG siempre que se haya evaluado previamente mediante REM todas las lesiones sospechosas de adenocarcinoma.
FinanciaciónEste estudio se realizó con el apoyo de una Ayuda para la Investigación del Fondo de Investigaciones Sanitarias (PI061376).
Autor para correspondencia.
Manuel Pera
Dirección: pera@imas.imim.es