Pese a no haberse evidenciado ventajas de su empleo, la preparación mecánica anterógrada (PMA) sigue siendo usual en cirugía colorrectal. Nuestro objetivo es analizar el impacto de su empleo selectivo respecto a confort y resultados en pacientes de un programa de rehabilitación multimodal perioperatoria (RHMM) o con cuidados convencionales (CC).
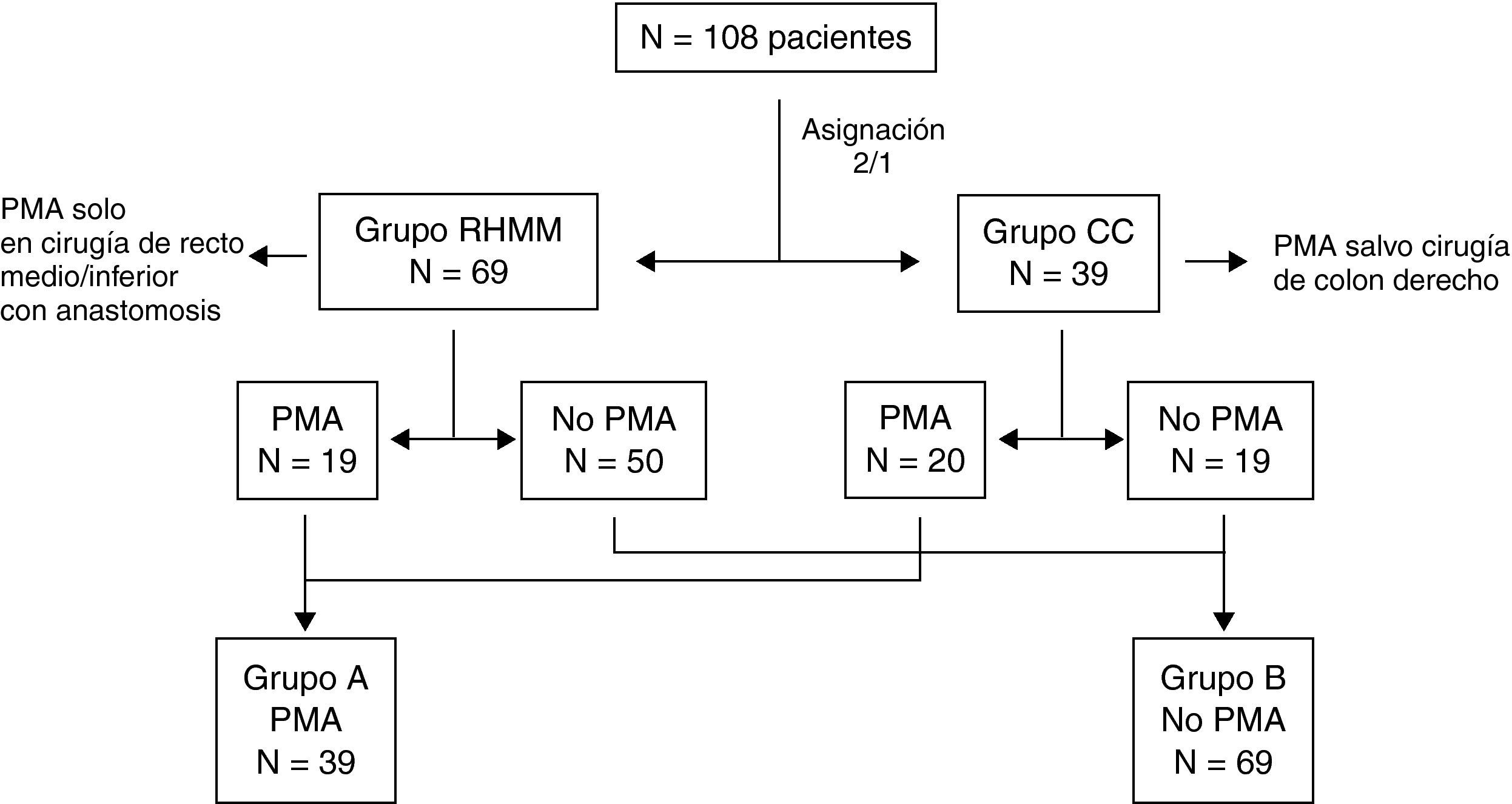
Material y métodosEstudio prospectivo de 108 pacientes propuestos para cirugía electiva, asignados consecutivamente 2:1 a un protocolo de RHMM que incluyó emplear solamente PMA en cirugía rectal con anastomosis baja o a CC en los que se empleó PMA, salvo en cirugía del colon derecho. Además se estudiaron dos grupos (A y B) en función de si se usó o no PMA. Se analizaron su tolerabilidad, sus resultados y las variables de recuperación postoperatoria.
ResultadosSe incluyó a 39 pacientes en el grupo A y a 69 en el B; 69 siguieron el protocolo de RHMM. Los pacientes del grupo A presentaron más dolor abdominal, malestar anal, náuseas y sed, pero no hubo diferencias en lo que respecta a la tasa de muertes, complicaciones globales o su tipo, mientras que sí tuvieron menos complicaciones, fallos de sutura y muertes los pacientes del grupo RHMM (p<0,05). Tampoco hubo ventajas del empleo de PMA respecto al inicio del tránsito intestinal, tolerancia a la dieta o estancias, pero estos parámetros fueron favorables al grupo de RHMM.
ConclusionesLa restricción de la PMA a casos seleccionados es segura, y asociada a un programa de RHMM contribuye a una recuperación más rápida y cómoda sin incrementar las complicaciones.
Despite there being no evidence of the advantages of its use, mechanical bowel preparation (MBP) continues to be routine in colorectal surgery. Our objective is to analyse the impact of its selective use, as regards patient comfort and results, comparing a perioperative multimodal rehabilitation program (MMRH) with conventional care (CC).
Material and methodsA prospective study of 108 patients proposed for elective surgery, assigned consecutively 2:1 to an MMRH protocol which only included MBP in rectal surgery with low anastomosis, or to CC in whom MBP was used except in right colon surgery. We also studied two Groups (A and B) with and without the use of MBP. Their tolerance, results and postoperative recovery variables were analysed.
ResultsThirty-nine patients were included in Group A, and 69 in Group B. A MMRH protocol was used in another 69 patients. The Group A patients had more abdominal pain, anal discomfort, nausea and thirst, but there were no differences as regards, death, overall or local complications, whilst there was less complications, suture failures and death in the MMRH when compared with CC Group (P<.05). There were no advantages observed in the use of MBP as regards the start of bowel movements, tolerance to diet or hospital stay, but these parameters were favourable to the MMRH when compared with CC Group.
ConclusionsThe restriction of MBP is safe, and associated with an MMRH program, contributes to a faster and more comfortable recovery, without increasing complications.
La preparación mecánica intestinal anterógrada (PMA) sigue siendo una práctica bastante habitual en la cirugía de colon en la creencia de que la reducción de la flora bacteriana fecal se asocia a menor riesgo de infecciones y complicaciones anastomóticas1. Pese a no haberse demostrado sus ventajas, el 99% de los cirujanos norteamericanos afirmaban usarla en 20032, y una reciente encuesta puso de manifiesto que el 98% de los cirujanos colorrectales españoles continúan empleándola3. Sin embargo, la evidencia contra su uso sistemático es patente, ya que varios estudios aleatorizados han mostrado iguales o más complicaciones infecciosas y anastomóticas cuando se emplea, es decir, lo contrario de su objetivo4–6. Además, hay trastornos hidroelectrolíticos asociados a su uso, especialmente en combinación con la agresión quirúrgica7. Si a ello unimos el temor a lo que supone para algunos pacientes la peor experiencia del perioperatorio si se incluye la preparación para endoscopia, cirugía e incluso otras pruebas (enemas, colonografía por TC), se hace evidente que debemos plantear su uso racional y selectivo.
La omisión de la PMA es uno de los pilares de la rehabilitación multimodal (RHMM) perioperatoria (fast-track), que pretende disminuir la morbimortalidad y promover una recuperación más rápida, al reducir el impacto de los factores que generan el estrés quirúrgico, basados en la evidencia científica8. Esta recuperación incentivada ha mostrado su efectividad9 y, aunque de forma lenta, va permeabilizando la opinión de los cirujanos y captando adeptos para lo que será el estándar de cuidados en los próximos años10.
El objetivo primario de nuestro trabajo es analizar los resultados de un uso selectivo de PMA en el confort perioperatorio y los resultados posquirúrgicos en pacientes de un programa de RHMM y con cuidados perioperatorios convencionales tras cirugía colorrectal. Como objetivo secundario, se analizan los resultados de la RHMM.
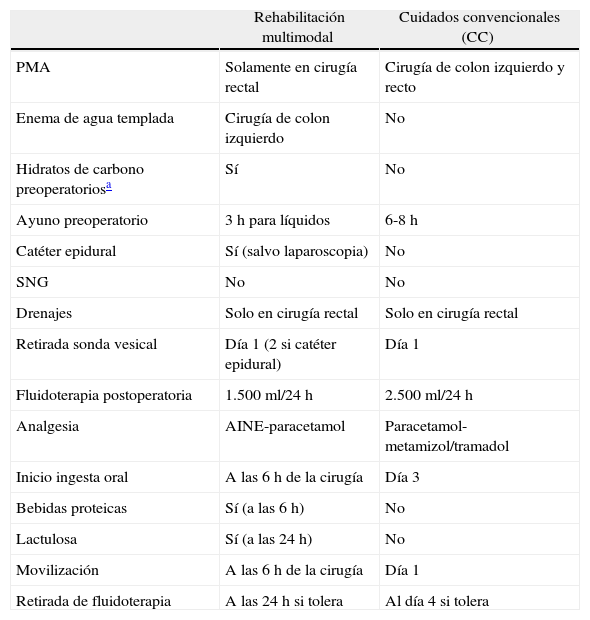
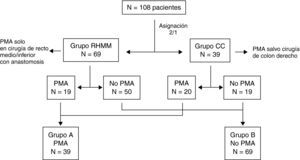
Material y métodosSe efectuó un estudio prospectivo en una cohorte de 108 pacientes, 63 varones y 45 mujeres, con una media de edad de 67,7±10 (34-86) años, cuyo criterio de inclusión fue la indicación de cirugía colorrectal electiva y los de exclusión, cierre simple de estomas, suboclusión intestinal y subsidiarios de nutrición parenteral postoperatoria. Se les asignó consecutivamente 2:1, en el momento de su inclusión en lista de espera, a uno de los dos grupos siguientes: RHMM, en el que no se empleó PMA, excepto en cirugía de tercios medio e inferior rectal con anastomosis, y cuidados convencionales (CC), en el que se empleó PMA, a excepción de la cirugía de colon derecho. El hecho de efectuar esta asignación 2:1 se debe a que dentro del grupo de RHMM se incluyeron dos subgrupos (con y sin sobrecarga oral preoperatoria de carbohidratos), para su análisis en otro estudio. Los protocolos básicos de actuación (análisis por intención de tratar) se describen en la tabla 1. La PMA consistió en una solución de fosfatos monosódico y disódico (Fosfosoda®; Laboratorios Casen-Fleet) en dos tomas de 45 ml cada una, la mañana y la tarde anteriores a la cirugía, asociados a dieta líquida las 24 h previas a la intervención. Los demás pacientes no tuvieron restricción dietética alguna.
Características de los grupos de estudio
| Rehabilitación multimodal | Cuidados convencionales (CC) | |
| PMA | Solamente en cirugía rectal | Cirugía de colon izquierdo y recto |
| Enema de agua templada | Cirugía de colon izquierdo | No |
| Hidratos de carbono preoperatoriosa | Sí | No |
| Ayuno preoperatorio | 3 h para líquidos | 6-8 h |
| Catéter epidural | Sí (salvo laparoscopia) | No |
| SNG | No | No |
| Drenajes | Solo en cirugía rectal | Solo en cirugía rectal |
| Retirada sonda vesical | Día 1 (2 si catéter epidural) | Día 1 |
| Fluidoterapia postoperatoria | 1.500 ml/24 h | 2.500 ml/24 h |
| Analgesia | AINE-paracetamol | Paracetamol-metamizol/tramadol |
| Inicio ingesta oral | A las 6 h de la cirugía | Día 3 |
| Bebidas proteicas | Sí (a las 6 h) | No |
| Lactulosa | Sí (a las 24 h) | No |
| Movilización | A las 6 h de la cirugía | Día 1 |
| Retirada de fluidoterapia | A las 24 h si tolera | Al día 4 si tolera |
PMA: preparación mecánica anterógrada; SNG: sonda nasogástrica.
Se dividió a los sujetos en dos grupos (A y B) en función de que hubiesen recibido o no PMA preoperatoria (fig. 1). Se aplicó a todos una encuesta sobre la preparación efectuada, y se analizaron: riesgo quirúrgico según la clasificación de la Asociación Americana de Anestesiólogos (ASA)11, puntuación POSSUM (Physiologic and Operative Severity Score)12, complicaciones postoperatorias, tolerancia a ingesta oral, tiempo a la primera evacuación, movilización, fuerza de la mano no dominante, medida en kilogramos con un dinamómetro (día 1), y estancia hospitalaria. Asimismo se valoraron dichos parámetros considerando solamente si se empleó o no un programa de fast-track (grupos RHMM y CC), independientemente de que hubieran recibido PMA o no.
El estudio fue aprobado por los comités de investigación y ético del centro. Los datos fueron procesados mediante el paquete estadístico SPSS (versión 15) para Windows (SPSS Inc.; Chicago, Illinois, Estados Unidos). Se calculó que, para obtener una reducción del 40 al 10% de las alteraciones preoperatorias a un 5% de significación estadística, con una potencia del 80%, se requería al menos 38 pacientes por brazo. Se emplearon los test de la χ2 y el test exacto de Fisher para la comparación de variables categóricas. Para la de medias de variables independientes, se empleó el test de la t de Student tras comprobar mediante el de Kolmogorov-Smirnov su ajuste a una distribución normal. Se consideró estadísticamente significativo un valor de p<0,05.
ResultadosSiguieron un protocolo de RHMM 69 pacientes, formando el grupo control (CC) otros 39; las medias de edad fueron 66,6±9 y 69,8±10 años respectivamente (p=0,101).
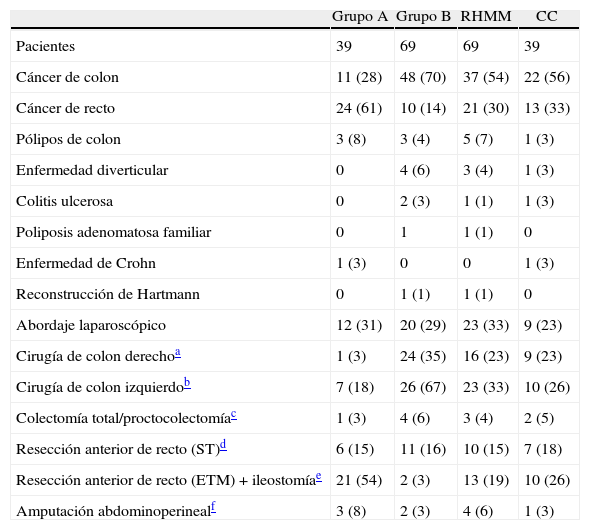
Un total de 39 pacientes (36%) recibieron PMA (grupo A): 19 (27%) del grupo RHMM y 20 (51%) del grupo CC (p=0,014). Lógicamente, hubo diferencias estadísticamente significativas entre los diagnósticos y las técnicas quirúrgicas incluidos en los grupos A y B, ya que los criterios de selección fueron distintos, aunque no las hubo al clasificarlos como RHMM o CC (tabla 2) ni en el modo de abordaje quirúrgico: abierto o laparoscópico. No hubo diferencias en la clasificación de riesgo quirúrgico ASA entre los grupos A y B (p=0,332), aunque sí al comparar el manejo tuvo protocolo de fast-track o no, más frecuente en el grupo B (p=0,014). Tampoco las hubo con la puntuación de POSSUM fisiológico (grupo A frente a B, 16,9±8 frente a 14,7±9; p=0,303; RHMM frente a CC, 14,7±8 frente a 17±10; p=0,315). Sin embargo, el POSSUM quirúrgico fue superior en los pacientes del grupo A que en los del B (12,8±6 frente a 9,4±6; p=0,029), aunque no hubo diferencias al comparar a los pacientes de RHMM con los controles (CC) (11,3±6 frente a 10,2±7; p=0,501).
Diagnósticos, tipo de cirugía y vía de abordaje
| Grupo A | Grupo B | RHMM | CC | |
| Pacientes | 39 | 69 | 69 | 39 |
| Cáncer de colon | 11 (28) | 48 (70) | 37 (54) | 22 (56) |
| Cáncer de recto | 24 (61) | 10 (14) | 21 (30) | 13 (33) |
| Pólipos de colon | 3 (8) | 3 (4) | 5 (7) | 1 (3) |
| Enfermedad diverticular | 0 | 4 (6) | 3 (4) | 1 (3) |
| Colitis ulcerosa | 0 | 2 (3) | 1 (1) | 1 (3) |
| Poliposis adenomatosa familiar | 0 | 1 | 1 (1) | 0 |
| Enfermedad de Crohn | 1 (3) | 0 | 0 | 1 (3) |
| Reconstrucción de Hartmann | 0 | 1 (1) | 1 (1) | 0 |
| Abordaje laparoscópico | 12 (31) | 20 (29) | 23 (33) | 9 (23) |
| Cirugía de colon derechoa | 1 (3) | 24 (35) | 16 (23) | 9 (23) |
| Cirugía de colon izquierdob | 7 (18) | 26 (67) | 23 (33) | 10 (26) |
| Colectomía total/proctocolectomíac | 1 (3) | 4 (6) | 3 (4) | 2 (5) |
| Resección anterior de recto (ST)d | 6 (15) | 11 (16) | 10 (15) | 7 (18) |
| Resección anterior de recto (ETM)+ileostomíae | 21 (54) | 2 (3) | 13 (19) | 10 (26) |
| Amputación abdominoperinealf | 3 (8) | 2 (3) | 4 (6) | 1 (3) |
CC: cuidados convencionales; ETM: excisión total del mesorrecto; RHMM: rehabilitación multimodal; ST: subtotal.
Diagnósticos: grupo A frente a grupo B, p<0,001; RHMM frente a CC, p=0,853. Abordaje laparoscópico: grupo A frente a grupo B, p<0,456; RHMM frente a CC, p=0,261. Tipo de resección: grupo A frente a grupo B, p<0,001; RHMM frente a CC, p=0,878.
Los datos expresan n (%).
PMA en 1 paciente del grupo CC con neoplasia de ángulo esplénico (se efectuó hemicolectomía derecha ampliada).
Tres pacientes del grupo CC no recibieron PMA (por dudas de hacer una hemicolectomía derecha ampliada).
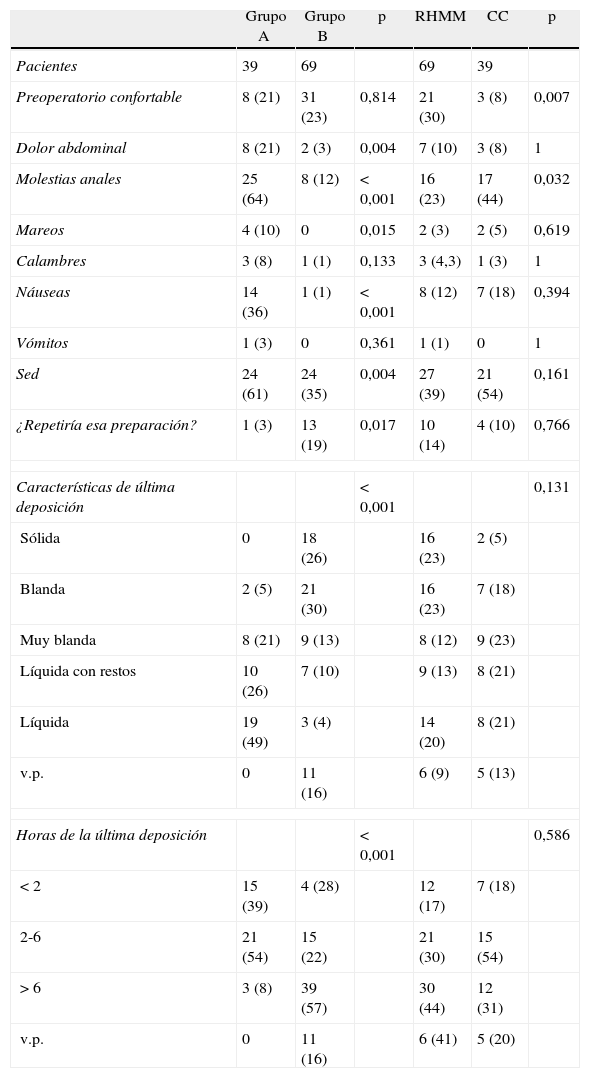
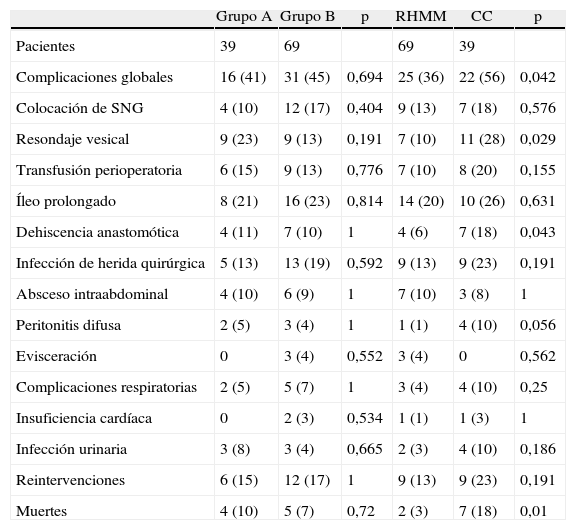
Los pacientes del grupo A presentaron más dolor abdominal, malestar anal, mareo, calambres, náuseas y sed que los del grupo B (tabla 3), finalizando la preparación 36 pacientes (92%). También un total de 36 (92%) pacientes con PMA defecaron en las últimas 6 h del preoperatorio frente a 34 (49%) de los no preparados (p<0,001), y sus deposiciones fueron significativamente más líquidas. Sin embargo, no hubo diferencias en la tasa de complicaciones postoperatorias, íleo, fugas anastomóticas o infecciones de herida entre ellos, mientras que, al comparar a los pacientes del grupo RHMM con los CC, los primeros tuvieron significativamente menos complicaciones (el 36 vs. el 56%; p=0,042) y dehiscencias anastomóticas (el 6 vs. el 18%; p=0,043) (tabla 4).
Encuesta sobre síntomas preoperatorios
| Grupo A | Grupo B | p | RHMM | CC | p | |
| Pacientes | 39 | 69 | 69 | 39 | ||
| Preoperatorio confortable | 8 (21) | 31 (23) | 0,814 | 21 (30) | 3 (8) | 0,007 |
| Dolor abdominal | 8 (21) | 2 (3) | 0,004 | 7 (10) | 3 (8) | 1 |
| Molestias anales | 25 (64) | 8 (12) | < 0,001 | 16 (23) | 17 (44) | 0,032 |
| Mareos | 4 (10) | 0 | 0,015 | 2 (3) | 2 (5) | 0,619 |
| Calambres | 3 (8) | 1 (1) | 0,133 | 3 (4,3) | 1 (3) | 1 |
| Náuseas | 14 (36) | 1 (1) | < 0,001 | 8 (12) | 7 (18) | 0,394 |
| Vómitos | 1 (3) | 0 | 0,361 | 1 (1) | 0 | 1 |
| Sed | 24 (61) | 24 (35) | 0,004 | 27 (39) | 21 (54) | 0,161 |
| ¿Repetiría esa preparación? | 1 (3) | 13 (19) | 0,017 | 10 (14) | 4 (10) | 0,766 |
| Características de última deposición | < 0,001 | 0,131 | ||||
| Sólida | 0 | 18 (26) | 16 (23) | 2 (5) | ||
| Blanda | 2 (5) | 21 (30) | 16 (23) | 7 (18) | ||
| Muy blanda | 8 (21) | 9 (13) | 8 (12) | 9 (23) | ||
| Líquida con restos | 10 (26) | 7 (10) | 9 (13) | 8 (21) | ||
| Líquida | 19 (49) | 3 (4) | 14 (20) | 8 (21) | ||
| v.p. | 0 | 11 (16) | 6 (9) | 5 (13) | ||
| Horas de la última deposición | < 0,001 | 0,586 | ||||
| < 2 | 15 (39) | 4 (28) | 12 (17) | 7 (18) | ||
| 2-6 | 21 (54) | 15 (22) | 21 (30) | 15 (54) | ||
| > 6 | 3 (8) | 39 (57) | 30 (44) | 12 (31) | ||
| v.p. | 0 | 11 (16) | 6 (41) | 5 (20) | ||
CC: cuidados convencionales; RHMM: rehabilitación multimodal; v.p.: valores perdidos.
Los datos expresan n (%).
Complicaciones postoperatorias
| Grupo A | Grupo B | p | RHMM | CC | p | |
| Pacientes | 39 | 69 | 69 | 39 | ||
| Complicaciones globales | 16 (41) | 31 (45) | 0,694 | 25 (36) | 22 (56) | 0,042 |
| Colocación de SNG | 4 (10) | 12 (17) | 0,404 | 9 (13) | 7 (18) | 0,576 |
| Resondaje vesical | 9 (23) | 9 (13) | 0,191 | 7 (10) | 11 (28) | 0,029 |
| Transfusión perioperatoria | 6 (15) | 9 (13) | 0,776 | 7 (10) | 8 (20) | 0,155 |
| Íleo prolongado | 8 (21) | 16 (23) | 0,814 | 14 (20) | 10 (26) | 0,631 |
| Dehiscencia anastomótica | 4 (11) | 7 (10) | 1 | 4 (6) | 7 (18) | 0,043 |
| Infección de herida quirúrgica | 5 (13) | 13 (19) | 0,592 | 9 (13) | 9 (23) | 0,191 |
| Absceso intraabdominal | 4 (10) | 6 (9) | 1 | 7 (10) | 3 (8) | 1 |
| Peritonitis difusa | 2 (5) | 3 (4) | 1 | 1 (1) | 4 (10) | 0,056 |
| Evisceración | 0 | 3 (4) | 0,552 | 3 (4) | 0 | 0,562 |
| Complicaciones respiratorias | 2 (5) | 5 (7) | 1 | 3 (4) | 4 (10) | 0,25 |
| Insuficiencia cardíaca | 0 | 2 (3) | 0,534 | 1 (1) | 1 (3) | 1 |
| Infección urinaria | 3 (8) | 3 (4) | 0,665 | 2 (3) | 4 (10) | 0,186 |
| Reintervenciones | 6 (15) | 12 (17) | 1 | 9 (13) | 9 (23) | 0,191 |
| Muertes | 4 (10) | 5 (7) | 0,72 | 2 (3) | 7 (18) | 0,01 |
CC: cuidados convencionales; RHMM: rehabilitación multimodal; v.p.: valores perdidos.
Los datos expresan n (%).
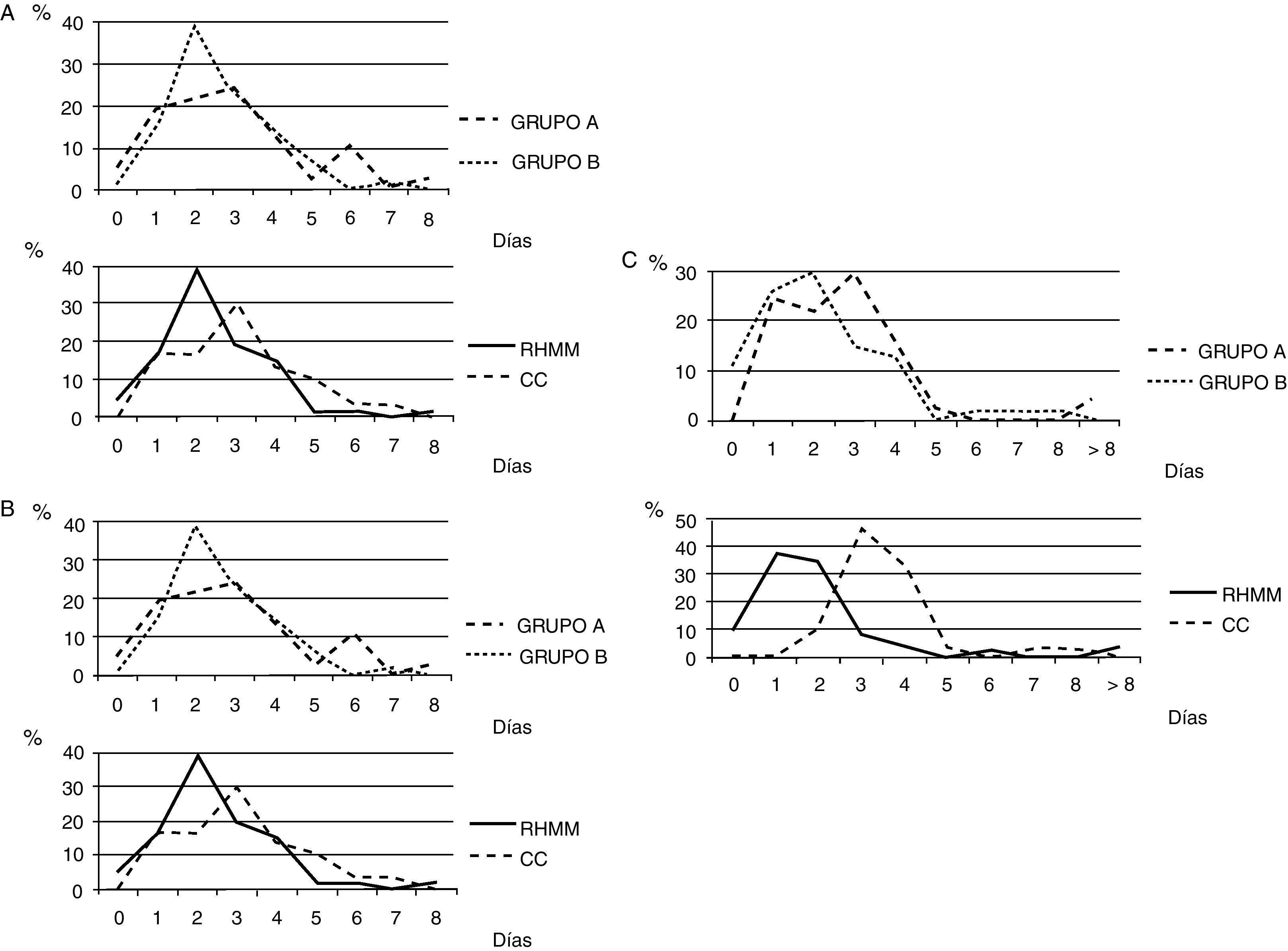
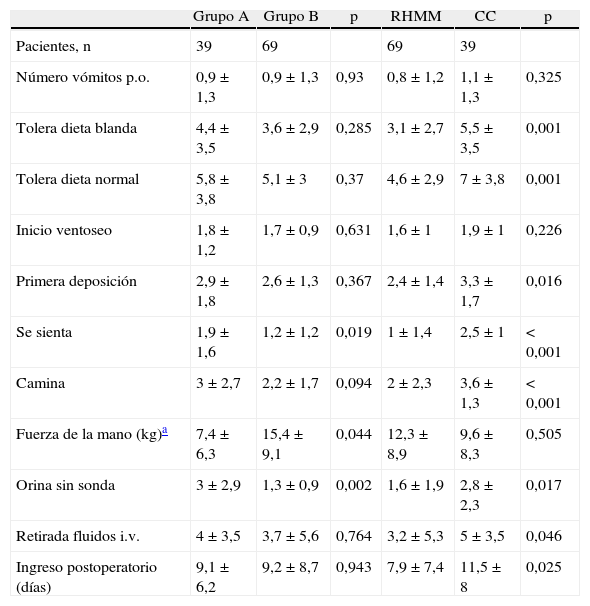
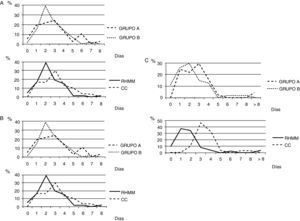
El grupo sin PMA no presentó desventajas en lo que respecta a la tolerancia a la ingesta en función del día postoperatorio, ni en lo que atañe al reinicio del tránsito intestinal o en la capacidad de caminar (fig. 2). Tampoco las hubo en el día promedio al que se produjeron los primeros dos eventos o las estancias postoperatorias, y únicamente se observaron diferencias a favor del grupo B en la capacidad funcional (levantarse, caminar) y también en la micción espontánea. Por el contrario, los pacientes a quienes se aplicó un protocolo de RHMM presentaron un postoperatorio significativamente más rápido prácticamente en todos los parámetros analizados (tabla 5).
Porcentaje de pacientes que cumplen determinados criterios según el día postoperatorio. A: toleran dieta blanda; grupo A vs. B, p=0,272; RHMM vs. CC, p < 0,001. B: primera defecación; grupo A vs. B, p=0,171; RHMM vs. CC, p=0,067. C: caminan; grupo A vs. B, p=0,192; RHMM vs. CC, p < 0,001. CC: cuidados convencionales; RHMM: rehabilitación multimodal.
Curso postoperatorio
| Grupo A | Grupo B | p | RHMM | CC | p | |
| Pacientes, n | 39 | 69 | 69 | 39 | ||
| Número vómitos p.o. | 0,9±1,3 | 0,9±1,3 | 0,93 | 0,8±1,2 | 1,1±1,3 | 0,325 |
| Tolera dieta blanda | 4,4±3,5 | 3,6±2,9 | 0,285 | 3,1±2,7 | 5,5±3,5 | 0,001 |
| Tolera dieta normal | 5,8±3,8 | 5,1±3 | 0,37 | 4,6±2,9 | 7±3,8 | 0,001 |
| Inicio ventoseo | 1,8±1,2 | 1,7±0,9 | 0,631 | 1,6±1 | 1,9±1 | 0,226 |
| Primera deposición | 2,9±1,8 | 2,6±1,3 | 0,367 | 2,4±1,4 | 3,3±1,7 | 0,016 |
| Se sienta | 1,9±1,6 | 1,2±1,2 | 0,019 | 1±1,4 | 2,5±1 | < 0,001 |
| Camina | 3±2,7 | 2,2±1,7 | 0,094 | 2±2,3 | 3,6±1,3 | < 0,001 |
| Fuerza de la mano (kg)a | 7,4±6,3 | 15,4±9,1 | 0,044 | 12,3±8,9 | 9,6±8,3 | 0,505 |
| Orina sin sonda | 3±2,9 | 1,3±0,9 | 0,002 | 1,6±1,9 | 2,8±2,3 | 0,017 |
| Retirada fluidos i.v. | 4±3,5 | 3,7±5,6 | 0,764 | 3,2±5,3 | 5±3,5 | 0,046 |
| Ingreso postoperatorio (días) | 9,1±6,2 | 9,2±8,7 | 0,943 | 7,9±7,4 | 11,5±8 | 0,025 |
CC: cuidados convencionales; RHMM: rehabilitación multimodal; v.p.: valores perdidos.
Los valores son medias±desviación estándar del día postoperatorio que se produjo cada evento, a excepción del número de vómitos.
La preparación mecánica de colon es una reminiscencia heredada de una práctica emprendida a inicios del siglo xx, cuando la cirugía abdominal se asociaba a alta tasa de infecciones. En la era antibiótica, se asociaron antimicrobianos a dicha preparación y las infecciones se redujeron, lo que reforzó el uso de la preparación mecánica, que se ha efectuado, además de con laxantes diversos, tanto con enemas como incluso con irrigación de grandes volúmenes de suero fisiológico a través de una sonda nasogástrica1,13,14.
Ante las evidencias sobre la prescindibilidad del uso de PMA1,4–6 y la experiencia de años sin emplearla sistemáticamente de algunos de los autores (JVR, JGA), pero frente a una realidad nacional e internacional aún reacia a adoptar esta política2,3, nuestra hipótesis de trabajo era demostrar la no inferioridad del uso selectivo de PMA. Para ello, comparamos dos grupos de pacientes, con y sin PMA preoperatoria, de una cohorte de 108 sujetos sometidos a cirugía colorrectal asignados consecutivamente a un protocolo de RHMM o de CC. Seguimos empleando PMA en la cirugía rectal con exéresis mesorrectal completa y anastomosis baja, dado que en ese caso actualmente no se dispone de potencia estadística suficiente para demostrar ventajas no preparando el colon5. Además, porque en ellos efectuamos sistemáticamente una ileostomía derivativa, lo que podría entrar en conflicto con la omisión de la PMA. También la empleamos en quienes se pretendía realizar una colonoscopia intraoperatoria y en algunos candidatos a cirugía laparoscópica a criterio del cirujano, por una (no demostrada) mayor manejabilidad del colon preparado.
El empleo de PMA en cirugía de colon era, en una reciente encuesta a cirujanos colorrectales españoles, del 59% en el colon derecho, el 90% en el izquierdo y el 98% en el recto3, datos muy superiores al 9,5, el 42,1 y el 72,2%, respectivamente, de la Asociación de Cirujanos Colorrectales de Gran Bretaña e Irlanda15.
Los pacientes en que se efectuó PMA presentaron síntomas relacionados, como sed y molestias anales en más del 60%, náuseas en el 36% o dolor abdominal en el 20%, así como deposiciones más líquidas y en las horas más cercanas a la intervención, al igual que han referido otros autores16. Además, el empleo de fosfato sódico tiene contraindicaciones específicas en pacientes con insuficiencia renal, hepática o cardíaca, y la deshidratación puede facilitar una hipotensión durante la inducción anestésica1. Aunque no analizamos los cambios analíticos tras la PMA, Holte et al17 evidenciaron en voluntarios sanos una pérdida de 1,2 kg de peso y una disminución significativa de la capacidad de ejercicio de un 9%, a pesar de una gran ingesta de líquidos, un incremento de las concentraciones de urea y fosfato y reducción de las de potasio y calcio. Es difícil que sujetos ancianos o con comorbilidad acudan en condiciones idóneas a la cirugía, ya que el principal efecto fisiológico de la PMA es la deshidratación18,19 que, potenciada por un ayuno prolongado prequirúrgico injustificado20, requiere de optimizar el manejo intraoperatorio de fluidos21. Cuando analizamos a los pacientes que siguieron un programa de RHMM, estos refirieron un preoperatorio más confortable.
Sin embargo, estas mayores molestias asociadas a la PMA no se compensaron con un beneficio postoperatorio en lo que concierne a menores complicaciones. No obstante, al analizar a los pacientes según se empleara o no un programa de RHMM, observamos menos complicaciones, dehiscencias anastomóticas y muertes. Así pues, en nuestra serie, la omisión de la PMA no ha mostrado desventajas en la tolerancia y las molestias preoperatorias ni previniendo complicaciones. De hecho, desde hace varios años, ya no efectuamos preparación intestinal de ningún tipo ni dieta especial en cirugía del colon derecho y transverso, y además planteamos, incluso en nuestro grupo de CC, una actitud que se podría considerar avanzada, ya que una reciente encuesta efectuada a cirujanos miembros de la Sección de Coloproctología de la Asociación Española de Cirujanos y de la Asociación Española de Coloproctología mostró una actitud bastante tradicional en el manejo perioperatorio22, similar a otro estudio que valoraba varios países europeos y Estados Unidos23. En cirugía del colon izquierdo o recto alto, empleamos un único enema o lavativa que pueden aplicar el propio paciente o sus familiares, sin restricción dietética previa alguna, similar a lo utilizado por el 42,1% de los cirujanos británicos15, básicamente para hacer más fácil una anastomosis, generalmente mecánica. Ello es más cómodo, y su empleo no se asocia al proceso inflamatorio que induce una PMA24,25 con agentes irritantes. Evidentemente, la intención de efectuar una técnica quirúrgica determinada previo uno u otro tipo de preparación no se cumplió en todos los pacientes, ya que se adoptaron algunas decisiones intraoperatorias, cambiando el tipo de cirugía o el abordaje previstos. Ello puede suponer un sesgo del estudio, pero hemos querido mantenerlo para ofrecer una aproximación más real a la práctica cotidiana. Otro de los sesgos ya comentado es que el grupo B (sin PMA) estuvo compuesto significativamente por más pacientes con programa de RHMM que el grupo A. Esto no pudo influir en los resultados preoperatorios relativos a la PMA, dado que aún no se habían aplicado las demás medidas de RHMM en ellos, aunque sí en los postoperatorios.
Finalmente, se analizaron la restauración de la ingesta oral, el reinicio del tránsito intestinal o la capacidad funcional para movilizarse, y no hubo diferencias entre los grupos A y B, salvo en lo que atañe a la capacidad funcional y la micción espontánea, aun cuando estos datos deben ser tomados con cautela debido al predominio de pacientes con RHMM en el grupo B. Aunque la cirugía rectal baja con anastomosis, que asocia dos procedimientos quirúrgicos (anastomosis+estoma derivativo), se incluyó en el grupo A y tenía tanto una mayor puntuación POSSUM quirúrgica como mayor riesgo de alteraciones miccionales, al menos se demostró la no inferioridad de obviar la PMA en la mayor parte de las cirugías colorrectales. Otros autores han evidenciado en estudios aleatorizados que la PMA no ahorra estancias ni facilita el reinicio del tránsito intestinal26–29 y, una vez más, en nuestra serie los pacientes que siguieron un protocolo de RHMM se recuperaron más tempranamente que los controles en lo que atañe a tolerancia a la ingesta, recuperación del tránsito intestinal, capacidad funcional y días de estancia.
Nuestro grupo apuesta por una preparación intestinal individualizada adaptada al tipo de cirugía. Las evidencias de la literatura hacen referencia a una preparación intestinal completa; muchos cirujanos interpretan «no preparar el colon» de muy diversas formas, ya que se utilizan o no restricción dietética, laxantes, enemas de fosfato o salino, y en función de la vía de abordaje, etc. Creemos conveniente adoptar una política poco drástica, evitando dogmas científicos en uno u otro sentido, ya que hay puntos no aclarados todavía en la literatura. Tales son el previamente comentado de si es necesario o no efectuar PMA en cirugía rectal con estoma derivativo asociado, las posibles ventajas de emplearla ante un acceso laparoscópico o la gravedad de una dehiscencia en función de su uso.
El presente estudio avala los múltiples metaanálisis en los que la PMA no ha mostrado beneficio4-6,30 y aporta la idea de una indicación selectiva. Es más, con el advenimiento de los cuidados tipo fast-track, hay que tener muy en cuenta su uso restringido, que contribuye a un perioperatorio más cómodo y rápido, con impacto en la reducción de costes9,31,32. Este cambio de actitud tiene aspectos para los que la tradición supone una barrera intangible difícil de eliminar33, y básicamente son los relativos a la PMA, alimentación precoz, ingesta preoperatoria de hidratos de carbono y optimización de la fluidoterapia los que plantean mayores dificultades. Afortunadamente, los cirujanos con más dedicación, experiencia y acreditación en cirugía colorrectal ya tienen comportamientos acordes con la evidencia científica en este terreno21,34.
En conclusión, la restricción de la PMA a casos seleccionados es segura y, combinada con un programa de rehabilitación multimodal perioperatoria, contribuye a una recuperación más rápida y cómoda sin incrementar las complicaciones posquirúrgicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Trabajo científico premiado por la Sociedad Valenciana de Cirugía (enero 2011).