La resección hepática por laparoscopia del hepatocarcinoma sobre cirrosis podría asociarse a un mayor riesgo de hemorragia y a un mayor uso de la maniobra de Pringle que cuando se realiza por vía abierta.
ObjetivoValorar si la quimioembolización intraarterial preoperatoria (QMEP) reduce la hemorragia durante la resección laparoscópica y se evita así el empleo de la maniobra de Pringle y sus posibles complicaciones.
Pacientes y métodosSe presentan 3 pacientes con cirrosis Child A con carcinoma hepatocelular (CHC) precoz, a los que se practicó QMEP de los segmentos por resecar. Todos los nódulos se localizaron en el lóbulo hepático derecho. Un caso fue intervenido por cirugía totalmente laparoscópica y los 2 restantes se convirtieron a cirugía laparoscópica asistida con la mano. En un caso se realizó bisegmentectomía VI–VII, en otro se realizó segmentectomía VI más radiofrecuencia de un segundo nódulo en segmento VII, y en el otro caso se realizó segmentectomía V.
ResultadosNo hubo morbimortalidad. No se transfundió ningún paciente, las pérdidas hemáticas fueron de 100, 50 y 150ml, respectivamente, y no fue necesaria la maniobra de Pringle. La resección se completó en los 3 casos con un margen superior a 1cm y la estancia hospitalaria fue de 3, 3 y 4 días, respectivamente.
ConclusiónLa QMEP permite realizar la resección laparoscópica del CHC sobre cirrosis con pocas pérdidas hemáticas sin el uso de la maniobra de Pringle. Estudios prospectivos aleatorizados son necesarios con un mayor número de pacientes para evaluar esta técnica.
To assess whether preoperative transarterial chemoembolisation (TACE) reduces haemorrhage during laparoscopic resection, thus making the Pringle manoeuvre unnecessary and avoiding any subsequent complications.
Patients and methodsWe present 3 cirrhotic Child A patients with early hepatocellular carcinoma, all of whom had been given the same treatment involving resection by laparoscopy and preoperative TACE of the segments to remove. All the nodules were located in the right hepatic lobe. One case was treated using total laparoscopic surgery and the two remaining cases were converted to the hand-assisted technique. In the first case we carried out bisegmentectomy VI–VII; in the second, segmentectomy VI plus radiofrequency of a second nodule in segment VII, and in the third case, segmentectomy V.
ResultsThere was no morbidity or mortality. Blood transfusion was not required by any of the patients; in fact blood losses were 100, 50 and 150ml, respectively, and it was not necessary to carry out the Pringle manoeuvre. Surgical margin was greater than 1cm in the three cases and hospital stay was less than 3, 3 and 4 days, respectively.
ConclusionTACE prior to early hepatocellular carcinoma resection in cirrhotic patients seems to improve surgical safety with low blood losses without the use of the Pringle manoeuvre. Prospective random studies should be carried out on a larger number of patients in order to assess this technique.
La resección hepática laparoscópica (RHL) del carcinoma hepatocelular (CHC) sobre cirrosis se indica generalmente en pacientes Child A con tumores menores de 5cm y localizados en segmentos periféricos (II–VI)1–6 y con menos frecuencia en segmentos VII y VIII7–9. Por las características especiales del hígado y del paciente cirrótico, la RHL podría suponer un mayor riesgo de hemorragia que en resecciones sobre hígado sano, y puede requerirse el uso excesivamente prolongado de la maniobra de Pringle1,5–8.
La quimioembolización arterial preoperatoria (QMEP) hasta ahora se ha empleado en el CHC de grandes dimensiones con los objetivos10–12 de disminuir el tamaño tumoral e incrementar la resecabilidad. El objetivo de este estudio es utilizar la QMEP de los segmentos por resecar mediante laparoscopia, en los casos con hepatocarcinoma precoz, con la finalidad de disminuir la irrigación de estos segmentos por resecar. El fundamento de esta técnica está basado en la irrigación por vía arterial del hepatocarcinoma, por lo que la QMEP podría conseguir una menor vascularización.
En este artículo se presentan los resultados intraoperatorios y postoperatorios inmediatos de 3 pacientes cirróticos Child A con CHC estadios 0 y A de la Barcelona Clasification Liver Cancer13, en los que se empleó QMEP previa a la RHL.
Pacientes y métodoEntre enero de 1996 y mayo de 2009 se han realizado 590 resecciones hepáticas (RH) en tumores hepáticos sólidos, 70 de ellas por laparoscopia. En 3 casos se realizó RH por CHC sobre cirrosis Child A por laparoscopia, y se realizó una QMEP con la finalidad de disminuir la hemorragia intraoperatoria.
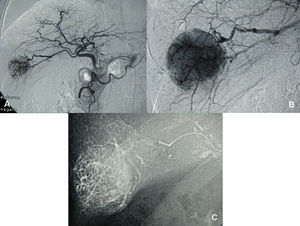
Técnica de la QME: en 2 casos tras la cateterización selectiva de la arteria hepática, se realizó la inyección de adriamicina embebida en lipiodol y posterior oclusión del flujo arterial de los segmentos por resecar14. En el tercer caso, se emplearon esferas de alcohol polivinilo cargadas de adriamicina15.
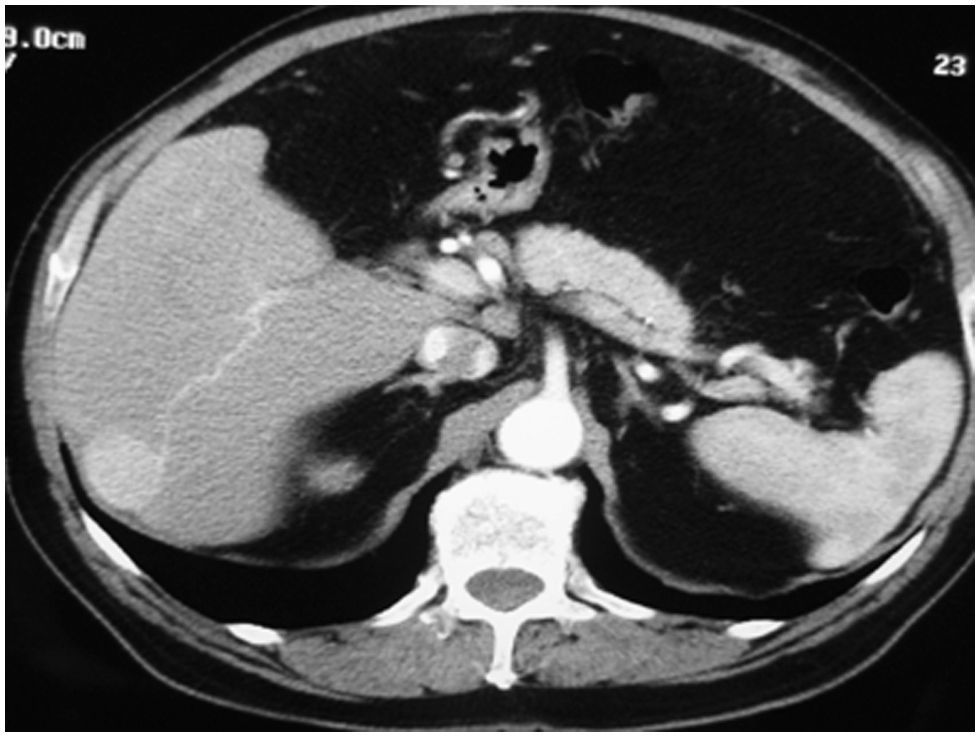
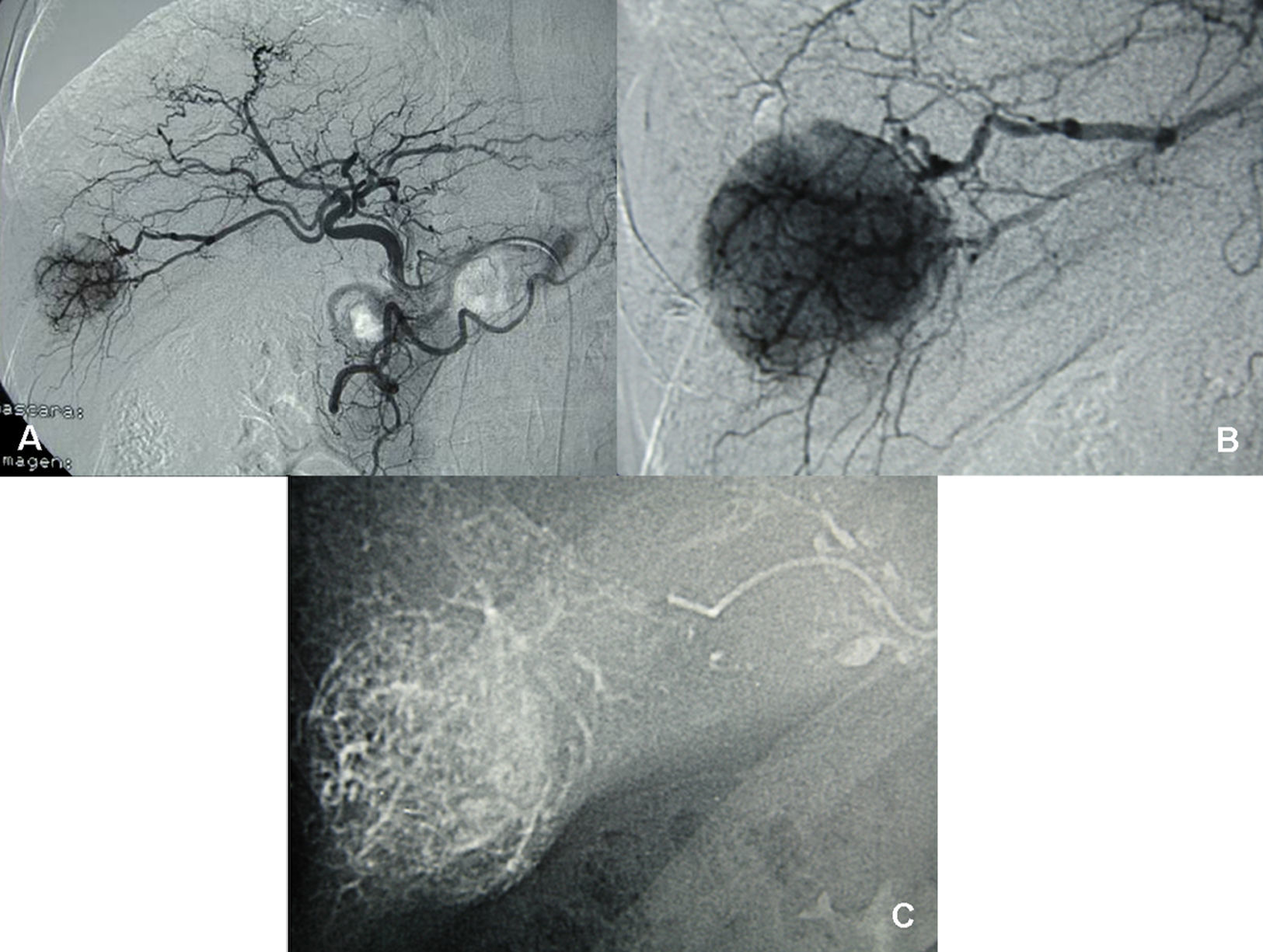
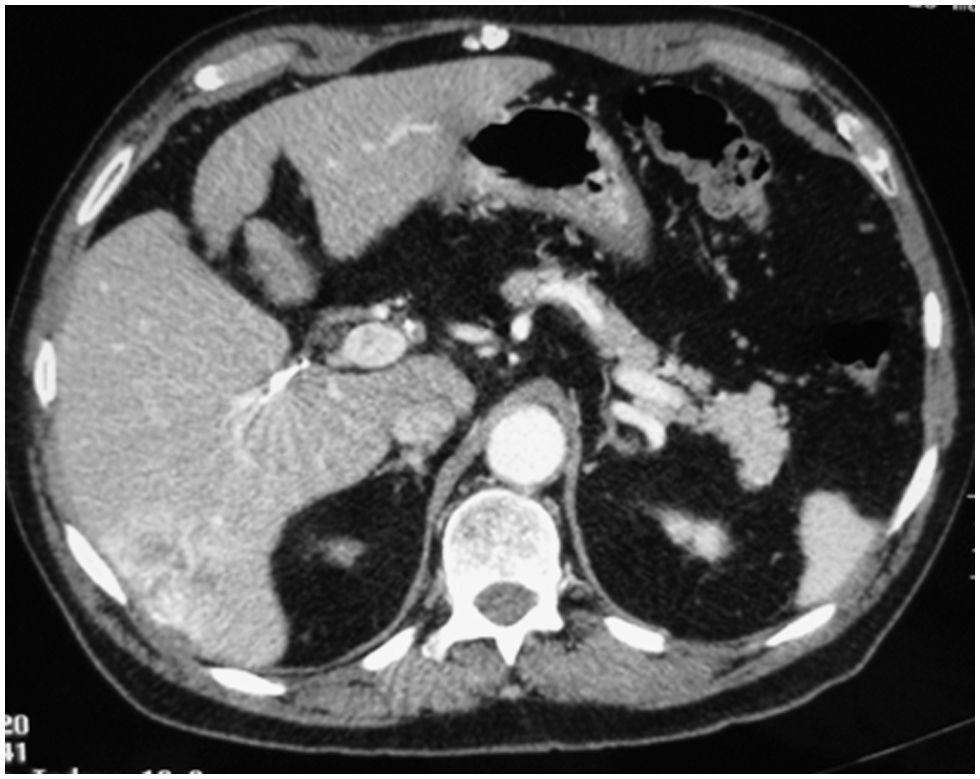
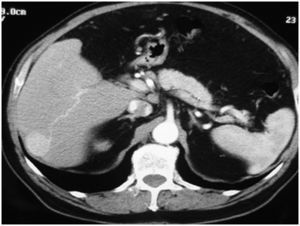
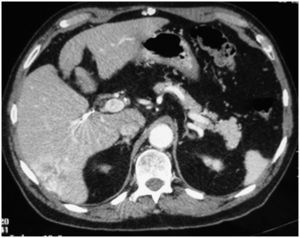
Caso clínico 1Paciente de 65 años, con cirrosis alcohólica Child A, sin hipertensión portal (gastroscopia sin várices, plaquetas de 120.000, sin esplenomegalia) y birrubina total (BT) de 1mg/dl. En el seguimiento ecográfico se detecta un nódulo hipoecogénico entre los segmentos VI y VII, de 3cm. Alfafetoproteína (AFP): 40ng/ml. Se realiza tomografía computarizada (TC), y se aprecia en la fase arterial un nódulo vascularizado por la rama arterial del segmento VI (fig. 1). Previo a la consulta en este hospital, se realizó punción biopsia que identificó un CHC. Se realiza QMEP de los segmentos VI–VII (fig. 2), previa a la resección por laparoscopia. A las 3 semanas se realiza TC de control (fig. 3), donde se observa la respuesta del tumor al tratamiento y la escasa vascularización de los segmentos VI–VII. Se interviene a las 4 semanas por cirugía totalmente laparoscópica (CTL) y se realiza bisegmentectomía VI–VII. Con el paciente en decúbito supino se emplean 4 trocares; las pérdidas hemáticas son de 100ml, el tiempo quirúrgico es de 180min y no se emplea maniobra de Pringle. No existen complicaciones postoperatorias y la estancia hospitalaria es de 3 días. Anatomía patológica: CHC con una necrosis del 90% y un margen mayor de 1cm.
Varón de 64 años, con cirrosis alcohólica Child A sin hipertensión portal (gastroscopia sin várices, plaquetas de 105.000, sin esplenomegalia) y BT de 0,9mg/dl. En el seguimiento se detecta un nódulo de 2cm entre los segmentos VI y VII, y otro de 1,5cm localizado en el segmento VII, próximo a la vena hepática derecha. AFP: 20ng/ml. Ambos nódulos son hipervasculares en la ecografía con SonoVue, en TC y en resonancia magnética, compatibles con CHC. La punción biopsia del nódulo de 2cm es positiva para CHC. Previo a la resección por laparoscopia, se realiza QMEP selectiva de los segmentos VI y VII. A las 5 semanas, se interviene mediante cirugía CTL, se realiza segmentectomía VI con CTL, pero se precisa conversión a cirugía laparoscópica asistida con la mano (CLAM) con la técnica descrita en la Unidad de este hospital16,17 para realizar movilización completa del lóbulo derecho y practicar radiofrecuencia bajo control ecográfico intraoperatorio del nódulo del segmento VII, dada la proximidad de éste a la vena hepática derecha. El tiempo quirúrgico es de 180min y las pérdidas hemáticas son de 50ml. No existen complicaciones postoperatorias, con una estancia hospitalaria de 3 días. Anatomía patológica: CHC con necrosis del 95% y margen de resección mayor de 1cm.
Caso clínico 3Mujer de 64 años, colecistectomizada en 1983 por incisión subcostal derecha, que precisa transfusión y adquiere el virus C. Hace 10 años se la diagnostica de cirrosis hepática en situación Child A, sin hipertensión portal (endoscopia sin várices esofágicas, plaquetas de 107.000, sin esplenomegalia) y BT de 1mg/dl; presenta en el último control una elevación de la AFP a 40ng/ml, y la ecografía detecta un nódulo de 2,5cm en segmento V. Se realiza TC que confirma la existencia de una lesión hipervascular en ese segmento, con punción biopsia positiva para CHC, exploraciones realizadas fuera de este hospital. Se realiza QMEP selectiva del segmento V y se interviene a las 4 semanas. Se realiza un abordaje con CTL y se encuentra un bloqueo adherencial, lo que obliga a convertir a CLAM. Se liberan adherencias, se moviliza el lóbulo hepático derecho y se realiza segmentectomía v sin oclusión del hilio hepático. El tiempo quirúrgico es de 120min y las pérdidas hemáticas de 150ml. No existen complicaciones postoperatorias y la estancia hospitalaria es de 4 días. Anatomía patológica: CHC de 2,5cm con necrosis del 90% y margen de resección superior a 1cm.
DiscusiónPara la mayoría de los autores, la RHL entraña numerosas dificultades1–9, especialmente en el hígado cirrótico1–9,16–19 debido a la mayor dureza del hígado, a la hipertensión portal y a las alteraciones de la coagulación que presentan estos pacientes. Esta dificultad conlleva un mayor porcentaje de conversiones a laparotomía, principalmente por hemorragia. Así, para Cherqui et al1, en 27 pacientes con CHC resecados por laparoscopia, la tasa de conversión fue del 26% (7 pacientes), 5 de ellos por hemorragia; 6 pacientes presentaron unas pérdidas hemáticas superiores a 1.000ml y a 3 de ellos se los transfundió (15%). El riesgo de hemorragia hizo que los autores realizaran de forma sistemática la maniobra de Pringle intermitente (con un tiempo medio de 55min) y puede explicar el que existiera un tiempo quirúrgico medio prolongado (240min)1. Las dificultades técnicas fueron mayores en los tumores localizados en el segmento VI (incluso empleando la posición de decúbito lateral izquierdo) que en el caso de la seccionectomía lateral izquierda, debido a la mayor sencillez de realización de esta técnica.
Debido a este mayor riesgo de hemorragia durante la RHL del CHC, los autores del presente estudio proponen realizar una QMEP, ya que al tratarse de un tumor irrigado fundamentalmente por vía arterial, la QMEP selectiva de los segmentos por resecar podría condicionar una menor vascularización y, por tanto, una menor hemorragia durante la resección laparoscópica. Podría existir una menor necesidad de oclusión del hilio hepático (evitaría la isquemia hepática secundaria y, por tanto, se podría tener un menor riesgo de insuficiencia hepática postoperatoria), un menor tiempo quirúrgico y una menor transfusión. Esto parece confirmarse en los 3 primeros pacientes de la presente serie, en los que, a pesar de localizarse el tumor en el lóbulo derecho (se realizaron segmentectomía VI–VII, segmentectomía VI y segmentectomía V), cuya resección entraña mayores dificultades técnicas por laparoscopia, el tiempo quirúrgico medio fue bajo (160min), las pérdidas hemáticas medias fueron escasas (100ml) y se realizaron sin maniobra de Pringle.
En esta serie, a diferencia de otros autores1–3, el paciente se situó en decúbito supino, incluso para lesiones de los segmentos VI y VII. Se tuvo que convertir en 2 casos a CLAM, pero ninguno por hemorragia, a diferencia de lo que ocurre en otras series en las que la mayoría de las conversiones se realizan por hemorragia8,9,18. En un caso se convirtió para movilizar el lóbulo hepático derecho para realizar radiofrecuencia de un nódulo de 1,5cm situado posterior a la vena hepática derecha (previamente se había realizado una segmentectomía VI) y, en el otro caso, la conversión a CLAM fue necesaria por la existencia de un bloqueo adherencial completo del espacio subhepático debido a una colecistectomía realizada 20 años antes.
En otras series, la hemorragia intraoperatoria es menor que la publicada por Cherqui et al1. Así, Belli et al3 realizan un estudio retrospectivo en el que comparan 23 pacientes con CHC sobre cirrosis intervenidos por laparoscopia frente a 23 pacientes por cirugía abierta (CA). Las pérdidas hemáticas (260ml vs. 376ml por CA), la transfusión (el 0 vs. el 17% por CA) y la maniobra de Pringle (el 0 vs. el 21% por CA) fueron inferiores en el grupo de laparoscopia, mientras que el tiempo quirúrgico fue superior con laparoscopia (148min vs. 125min con CA). Además, sólo convirtieron uno de 23 pacientes (4,3%), en un tumor localizado en el segmento vi, debido a dificultades de exposición para la resección, a pesar de colocar al paciente en decúbito lateral. Tal vez estos buenos resultados estén en relación con la localización del tumor (el 50% en el lóbulo izquierdo) y con una mejor selección de pacientes, ya que en todos los casos se trata de tumores subcapsulares y exofíticos. En estos tumores tan periféricos, probablemente tampoco estaría indicada la realización de una QMEP.
Existen estudios retrospectivos por cirugía abierta11,12 que comparan los pacientes con RH del CHC sobre cirrosis con y sin QMEP. Para Choi et al11 no existen diferencias de supervivencia a 5 años entre ambos grupos y para Chen et al12 la supervivencia a 5 años fue superior en el grupo con QMEP. Además, Choi et al11 comparan los resultados operatorios de ambos grupos y observan que existieron unas pérdidas hemáticas algo superiores en el grupo con QMEP, aunque las diferencias no fueron estadísticamente significativas. Estos resultados son contradictorios a los obtenidos en el presente estudio, y es probable que esto se deba a que los grupos no son comparables, ya que la QMEP se realizó en tumores grandes mayores de 5cm y centrales, y se realizó un mayor tanto por ciento de RH mayores.
En conclusión, la QMEP selectiva de los segmentos por resecar mediante laparoscopia en pacientes con CHC en estadios precoces, Child A sin hipertensión portal, permite realizar la resección con pocas pérdidas hemáticas sin el uso de la maniobra de Pringle. Estudios prospectivos aleatorizados con un mayor número de pacientes y que comparen la resección laparoscópica con y sin QMEP en casos seleccionados de CHC sobre cirrosis son necesarios para analizar las ventajas en el postoperatorio inmediato y los posibles efectos sobre la supervivencia a largo plazo.