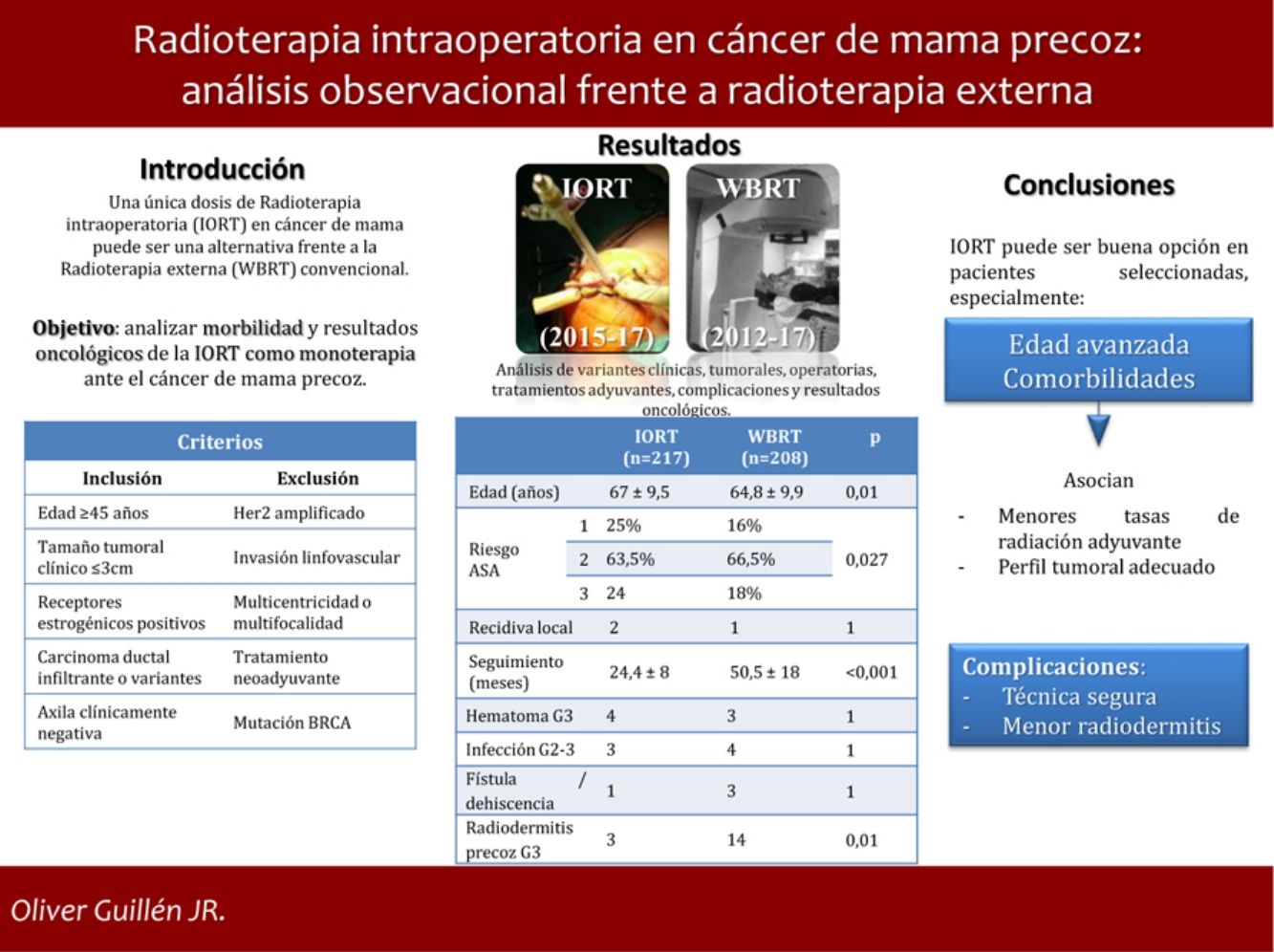
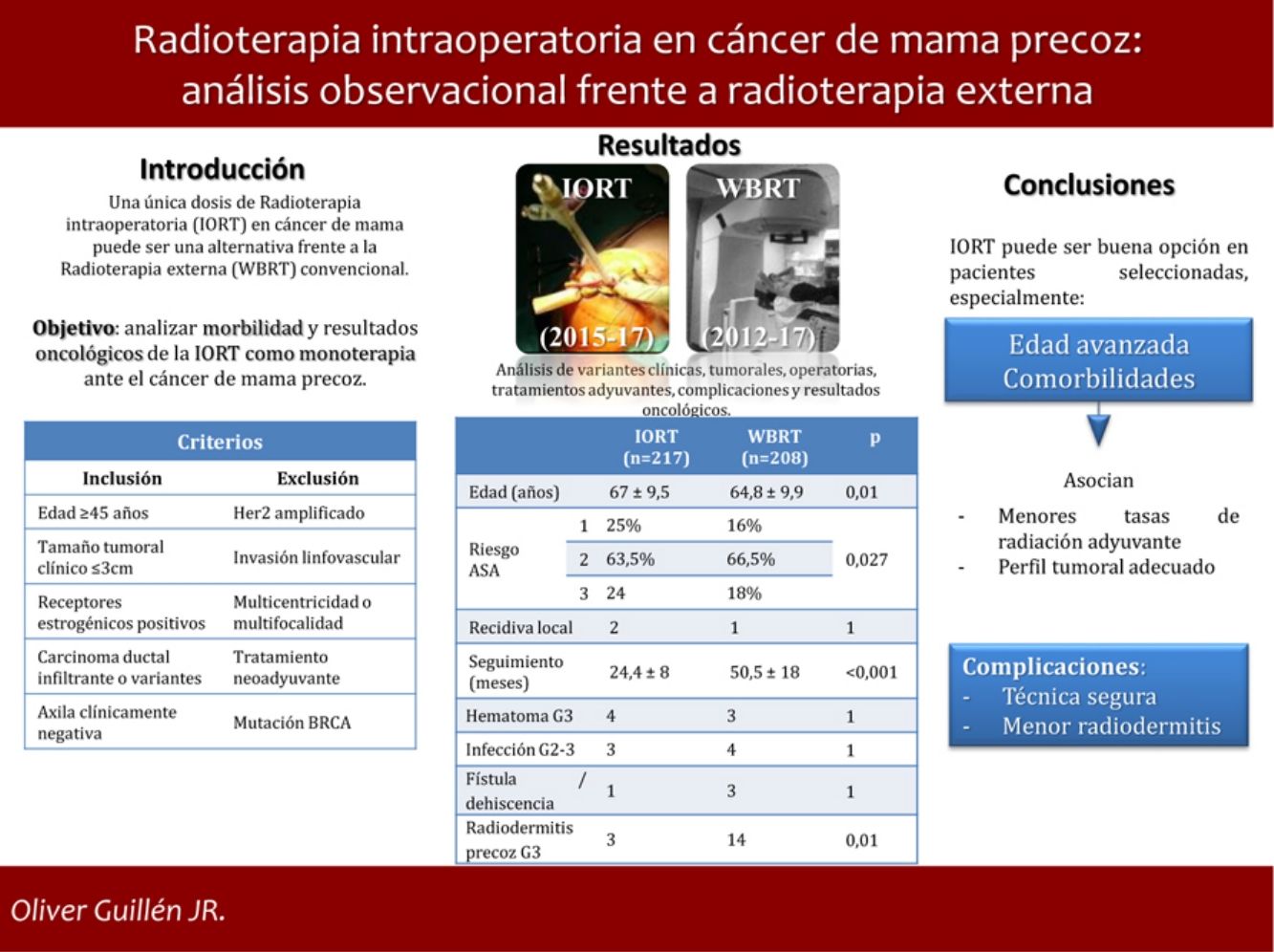
Una única dosis de radioterapia intraoperatoria (IORT) en cáncer de mama precoz (EBC) puede ser una opción frente a la radioterapia externa estándar (WBRT). Sin embargo, no existe consenso sobre su uso y resultados.
ObjetivoAnalizar la morbilidad y resultados oncológicos de la IORT como monoterapia en el tratamiento del EBC.
MétodosSe realiza un estudio analítico observacional unicéntrico, comparando una cohorte prospectiva IORT (2015-17) con una cohorte retrospectiva WBRT (2012-17). Los criterios de selección aplicados son: ≥ 45 años de edad, carcinoma ductal infiltrante o variantes, tamaño tumoral radiológico ≤ 3 cm, receptores estrogénicos positivos, HER2 negativo, cN0; criterios de exclusión: invasión linfovascular, multicentricidad/multifocalidad, mutaciones BRCA y tratamiento neoadyuvante.
Se valoran características clínicas, tumorales, quirúrgicas, oncológicas y complicaciones.
ResultadosSe estudiaron 425 casos: 217 tratados con IORT y 208 con WBRT. La edad media en IORT y WBRT fue 67 ± 9,5 y 64,8 ± 9,9 años, respectivamente (p = 0,01). El riesgo ASA 3 en IORT fue 17,7%, frente a 24 casos de WBRT (p = 0,027). No hubo diferencias en resultados anatomopatológicos o estadificación. El seguimiento medio de IORT fue 24,4 ± 8 meses, frente a 50,5 ± 18 meses de WBRT (p < 0,001). No se hallaron diferencias significativas en recidiva local, metástasis o mortalidad. Las complicaciones que precisaron reintervención u hospitalización resultaron equiparables. La radiodermitis precoz grave se presentó en tres casos IORT frente a 14 casos WBRT (p = 0,01).
ConclusionesLa IORT como monoterapia en pacientes seleccionadas con EBC representa una opción alternativa frente a WBRT, especialmente en aquellas con edad avanzada y comorbilidades. Se asocia, además, con menos radiodermitis precoz grave.
In early breast cancer (EBC), a single dose of intraoperative radiotherapy (IORT) might be an option to standard whole breast radiotherapy (WBRT). However, there is no consensus about its use and clinical results.
Aimto analyse the morbidity and oncological outcomes of IORT as monotherapy in EBC.
MethodsA single centre observational analytic study was performed. A prospective IORT cohort (2015-17) and a retrospective WBRT cohort (2012-17) were selected following the same criteria: ≥ 45 y.o., invasive ductal carcinoma or variants, radiological tumour size ≤ 3 cm, positive oestrogenic receptors, negative HER2, cN0; exclusion criteria: lymphovascular invasion, multicentricity/multifocality, BRCA mutation and neoadjuvant therapy. Clinical, histological, surgical, oncological characteristics and complications were collected.
ResultsA total of 425 cases were selected: 217 in IORT cohort and 208 in WBRT cohort. Average age in IORT and WBRT groups was 67±9.5 and 64.8 ± 9.9 y.o. respectively (p = 0.01). ASA 3 risk score patients were 17.7% in IORT and 24 cases in WBRT (p = 0.027). There were no differences in histological results or tumoral stage. Average follow up was 24.4 ± 8 months in IORT and 50.5 ± 18 months in WBRT (p < 0.001). No differences were detected in local recurrence, metastases or mortality. Complications that required reintervention or hospitalization were similar in both groups. A total of 3 and 14 cases developed early severe dermatitis in IORT and WBRT groups respectively (p = 0.01).
ConclusionIORT as monotherapy in selected patients with EBC stands for an alternative option versus WBRT. It seems especially useful in advanced-age patients with severe comorbidities. IORT associates lesser early severe dermatitis.
El tratamiento estándar en cáncer de mama en estadio precoz (early breast cancer, EBC) es la cirugía conservadora (CC) seguida de radioterapia externa adyuvante (WBRT) durante tres a cinco semanas1.
De 15-30% de las pacientes en estadios iniciales no completan el tratamiento adyuvante (especialmente aquellas que viven alejadas de los centros de radioterapia o con edad avanzada), optándose por cirugías más radicales2.
Hasta el 90% de las recurrencias de cáncer de mama se localizan en la proximidad del tumor primario3. De ahí surgió un nuevo paradigma, la irradiación parcial de la mama (accelerated partial breast irradiation, APBI) que centra la terapia en la región de mayor riesgo de recidiva.
La radioterapia intraoperatoria (IORT) es una forma de APBI. Permite irradiar la zona de mayor probabilidad de recurrencia tumoral en una única sesión, además de disminuir los problemas de cumplimiento de tratamiento, la exposición a la radiación de los tejidos normales y la toxicidad radioinducida4. Puede ser administrada como monoterapia cuando se cumplen unos criterios establecidos, o como boost en caso contrario, complementando la terapia con WBRT.
La IORT es actualmente objeto de controversia. Ha sido evaluada en dos ensayos clínicos aleatorizados de gran relevancia5,6, además de series. Sin embargo, su uso como monoterapia es actualmente cuestionado por algunas sociedades7.
Nuestro objetivo es analizar la morbilidad y los resultados oncológicos de la IORT como monoterapia en el tratamiento de cáncer de mama en estadio precoz.
MétodosSe ha realizado un estudio analítico observacional unicéntrico entre una cohorte IORT y una cohorte WBRT. La cohorte IORT es una serie prospectiva de pacientes diagnosticadas de EBC tratadas con CC e IORT como monoterapia, entre los años 2015 y 2017, que cumplen los criterios de selección establecidos en el Comité Multidisciplinar de Tumores y han aceptado el tratamiento. La cohorte WBRT es retrospectiva; se seleccionaron pacientes con EBC tratadas con CC y WBRT, entre los años 2012 y 2017, aplicando los criterios de selección que posteriormente se han establecido para administrar la IORT. El objetivo es evaluar ante un mismo perfil de paciente los dos tipos de tratamiento.
Criterios de selecciónDiversas organizaciones internacionales establecieron unos criterios de «conveniencia» para administrar APBI8,9. Los criterios de selección establecidos en nuestro centro, para administrar tratamiento con IORT como monoterapia, son muy similares: edad ≥ 45 años, histología de carcinoma ductal infiltrante (CDI) o variantes de buen pronóstico, tamaño tumoral radiológico ≤ 3 cm, receptores estrogénicos (RE) positivos, HER2 negativo, ausencia de invasión linfovascular (ILV), ausencia de multicentricidad o multifocalidad, axila clínicamente negativa, ausencia de mutaciones BRCA y ausencia de tratamiento neoadyuvante.
Todas las pacientes fueron evaluadas clínicamente mediante mamografía, ecografía y biopsia. La resonancia magnética mamaria bilateral se realizó en casos de patrón glandular denso (categoría d). Se realizó gammagrafía ósea en los tumores cT2.
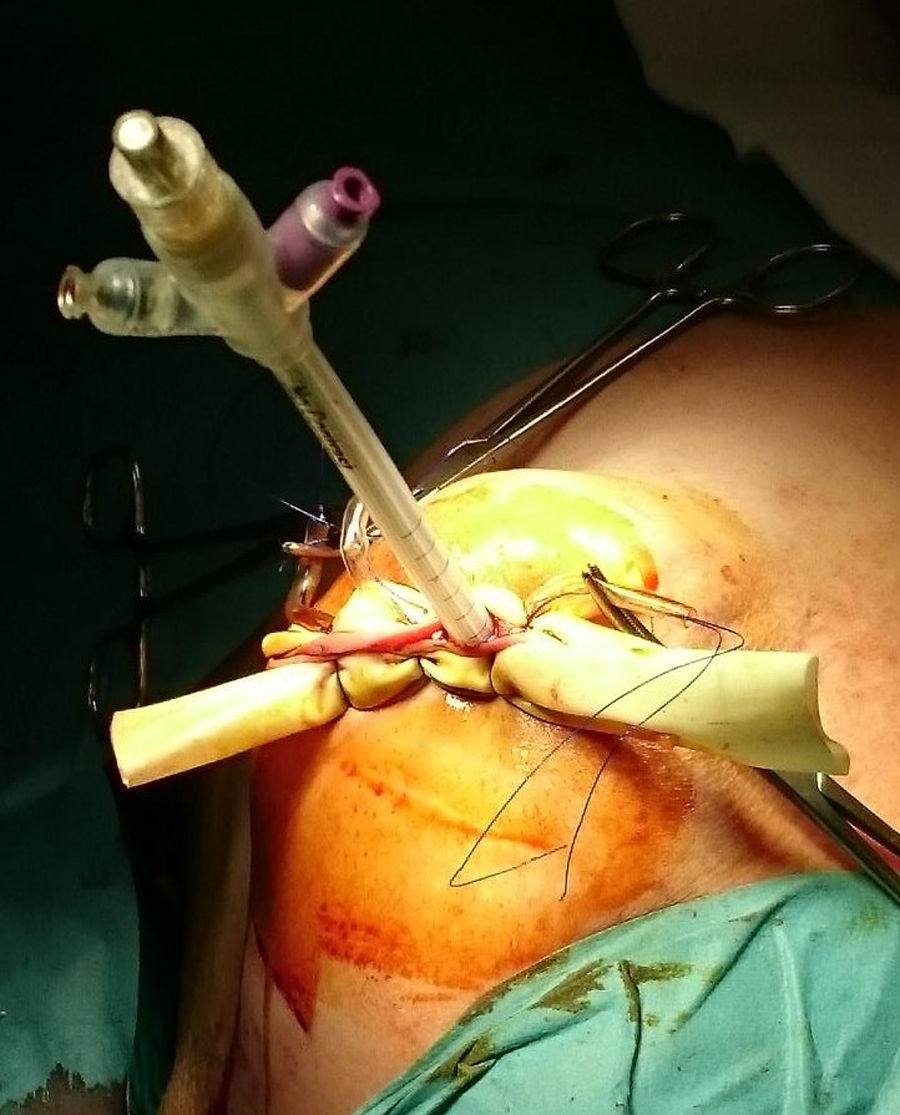
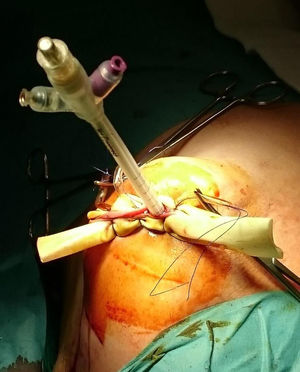
ProcedimientoEn la cohorte IORT las pacientes fueron tratadas mediante CC, biopsia selectiva del ganglio centinela (BSGC) e IORT. Se empleó Axxent®Xoft, Inc., Sunnyvale, CA, un dispositivo electrónico de alta dosis y baja energía (50 kV de energía máxima) que emplea un tubo integrado de rayos X en un catéter multilumen flexible para administrar la radiación10. Tras completar la CC y confirmar intraoperatoriamente la ausencia de afectación de los bordes, el balón aplicador se introduce y adapta a la cavidad administrando la radiación (fig. 1).
En la cohorte WBRT las pacientes fueron intervenidas mediante CC y BSGC. Recibieron WBRT, tanto terapias convencionales como hipofraccionadas.
En ambas cohortes el estudio axilar se realizó con técnica OSNA® (one step nucleic acid amplification) en tumores CK19+ y con HE (hematoxilina-eosina) ante CK19-. A partir del año 2016 se implantaron los criterios ACOSOG (American College of Surgeons Oncology Group) Z001111.
Variables a estudioSe han recogido variables clínicas (edad, riesgo ASA [American Society of Anesthesiologists]), tumorales (histología, grado histológico, estudio inmunohistoquímico (IHQ), estadificación), operatorias (tipo de intervención, tiempo de IORT, tiempo de intervención, manejo axilar), tratamientos adyuvantes, complicaciones mayores y resultados oncológicos en ambos grupos.
La recidiva local, regional y la metástasis a distancia han sido diagnosticadas mediante pruebas radiológicas, biopsias, o ambas cosas.
Se han definido como complicaciones mayores: radiodermitis grados 3 y 4 (criterios RTOG/EORTC12), la infección que requirió antibioterapia endovenosa (grado 2) o drenaje quirúrgico (grado 3) y hematoma que precisó drenaje quirúrgico (grado 3) (criterios CTCAE13), además de fístula que requirió reparación quirúrgica (definida como un retraso en la cicatrización de una porción de la herida quirúrgica).
Se evaluaron los distintos grados de radiodermitis precoz en ambos grupos y tardía en el grupo IORT. No se dispone de algunos datos en la cohorte retrospectiva WBRT, entre ellos la radiodermitis tardía, por lo que en las tablas el número de datos recogidos puede no coincidir con el total de casos.
Análisis estadísticoEn el estudio descriptivo los resultados se expresaron mediante la media y desviación estándar para las variables continuas y el número de casos y sus frecuencias para las variables categóricas. Las variables se compararon mediante la t de Student en el caso de variables continuas, y la prueba de la χ2 para variables categóricas. Se aplicó la corrección de Yates en la prueba χ2 cuando al menos el valor de una frecuencia esperada era menor que 5. Los resultados se consideraron significativos cuando p < 0,05. Todos los cálculos estadísticos se han realizado utilizando el software estadístico R versión 3.1.3 (www. https://www.r-project.org/).
ResultadosSe han estudiado 215 pacientes en la cohorte IORT, presentando dos de ellas cáncer bilateral y 208 controles en la cohorte WBRT.
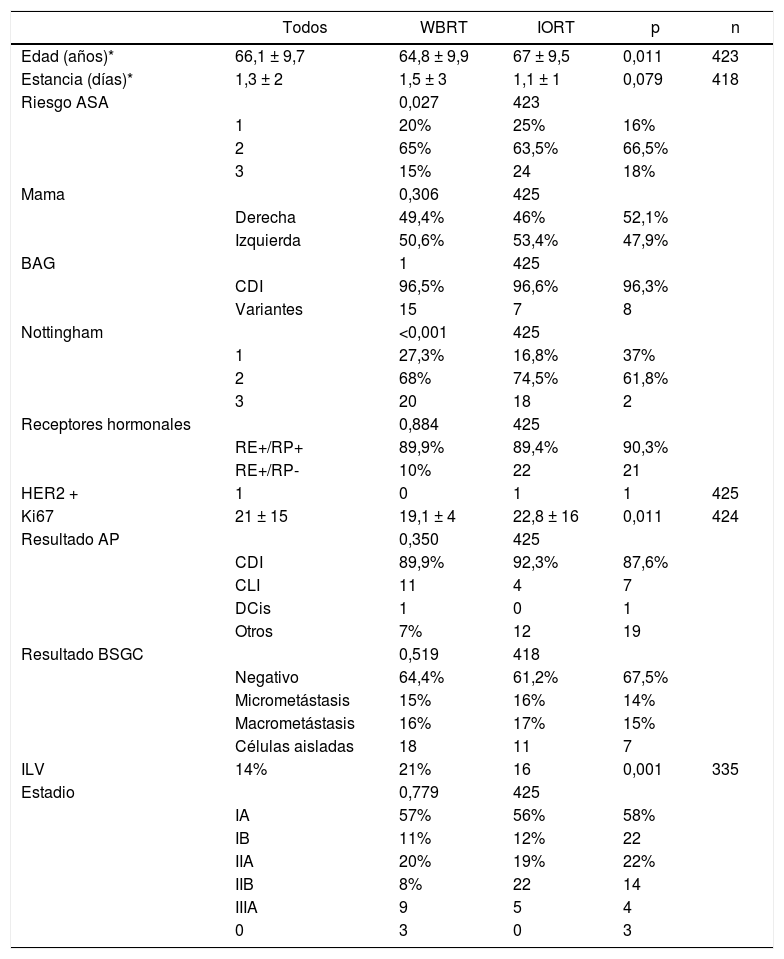
La media de edad en el grupo IORT y WBRT fue de 67 ± 9,5 años y 64,8 ± 9,9, respectivamente (p = 0,01). El riesgo ASA 3 en el grupo IORT fue 18%, frente a 24 casos del grupo WBRT (p = 0,027) (tabla 1).
- Características de las pacientes (edad, comorbilidades) y tumorales
| Todos | WBRT | IORT | p | n | |
|---|---|---|---|---|---|
| Edad (años)* | 66,1 ± 9,7 | 64,8 ± 9,9 | 67 ± 9,5 | 0,011 | 423 |
| Estancia (días)* | 1,3 ± 2 | 1,5 ± 3 | 1,1 ± 1 | 0,079 | 418 |
| Riesgo ASA | 0,027 | 423 | |||
| 1 | 20% | 25% | 16% | ||
| 2 | 65% | 63,5% | 66,5% | ||
| 3 | 15% | 24 | 18% | ||
| Mama | 0,306 | 425 | |||
| Derecha | 49,4% | 46% | 52,1% | ||
| Izquierda | 50,6% | 53,4% | 47,9% | ||
| BAG | 1 | 425 | |||
| CDI | 96,5% | 96,6% | 96,3% | ||
| Variantes | 15 | 7 | 8 | ||
| Nottingham | <0,001 | 425 | |||
| 1 | 27,3% | 16,8% | 37% | ||
| 2 | 68% | 74,5% | 61,8% | ||
| 3 | 20 | 18 | 2 | ||
| Receptores hormonales | 0,884 | 425 | |||
| RE+/RP+ | 89,9% | 89,4% | 90,3% | ||
| RE+/RP- | 10% | 22 | 21 | ||
| HER2 + | 1 | 0 | 1 | 1 | 425 |
| Ki67 | 21 ± 15 | 19,1 ± 4 | 22,8 ± 16 | 0,011 | 424 |
| Resultado AP | 0,350 | 425 | |||
| CDI | 89,9% | 92,3% | 87,6% | ||
| CLI | 11 | 4 | 7 | ||
| DCis | 1 | 0 | 1 | ||
| Otros | 7% | 12 | 19 | ||
| Resultado BSGC | 0,519 | 418 | |||
| Negativo | 64,4% | 61,2% | 67,5% | ||
| Micrometástasis | 15% | 16% | 14% | ||
| Macrometástasis | 16% | 17% | 15% | ||
| Células aisladas | 18 | 11 | 7 | ||
| ILV | 14% | 21% | 16 | 0,001 | 335 |
| Estadio | 0,779 | 425 | |||
| IA | 57% | 56% | 58% | ||
| IB | 11% | 12% | 22 | ||
| IIA | 20% | 19% | 22% | ||
| IIB | 8% | 22 | 14 | ||
| IIIA | 9 | 5 | 4 | ||
| 0 | 3 | 0 | 3 |
n: núm. de pacientes de los que se dispone información.
Media ± desviación estándar. ASA: American Society Anesthesiologists. BAG: biopsia con aguja gruesa. CDI: carcinoma ductal infiltrante. CLI: carcinoma lobulillar infiltrante. DCis: carcinoma ductal in situ. RE: receptores de estrógenos. RP: receptores de progesterona. BSGC: biopsia selectiva de ganglio centinela. ILV: invasión linfovascular. CC: cirugía conservadora. ALND: linfadenectomía axilar.
Se consideraron como tumores hormonosensibles aquellos que presentaron receptores hormonales positivos en ≥ 1% de las células. Todos los casos presentaron receptores estrogénicos positivos.
No se han identificado diferencias significativas en cuanto a histología en la biopsia inicial, lateralidad, afectación ganglionar o estadificación tumoral. A pesar de que las biopsias iniciales fuesen en su totalidad de CDI o sus variantes, en un pequeño número de casos el resultado definitivo fue de carcinoma lobulillar infiltrante (CLI) y carcinoma ductal in situ (CDis); sin embargo, los datos resultaron equiparables y no se hallaron diferencias significativas entre ambos grupos. Se incluyeron en la categoría «otros» los subtipos tumorales papilar, mucinoso y tubular. La estadificación definitiva reveló 46 pacientes con estadios IIB y IIIA. Se trató de tumores pT2 con afectación ganglionar pN1-2. En la cohorte IORT se incluyeron tres casos como estadio 0 por obtenerse en el resultado definitivo un caso de CDis y dos casos de carcinoma papilar encapsulado (tabla 1).
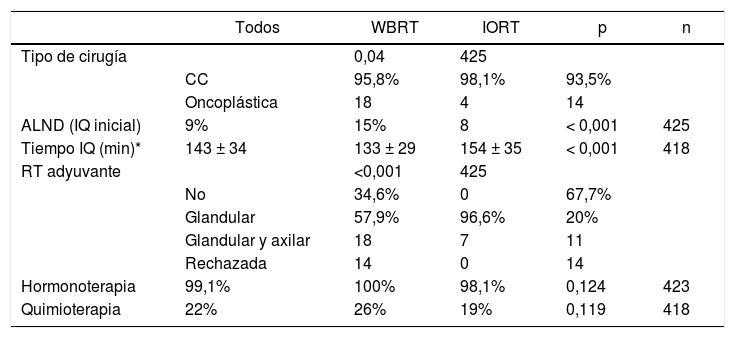
En cuanto a los datos quirúrgicos, se ha constatado un mayor número de cirugías oncoplásticas en el grupo IORT (IORT: 14 casos vs. WBRT: 4 casos; p = 0,04) (tabla 2), sin hallarse márgenes afectos en las piezas extraídas mediante estas técnicas en ambas cohortes. El número de linfadenectomías axilares (axillary lymph node dissection, ALND) en la intervención inicial fue superior en el grupo WBRT. En general, los tiempos quirúrgicos resultaron más prolongados en el grupo IORT (IORT: 154 ± 35 min vs. WBRT: 133 ± 29 min; p < 0,001) (tabla 2).
Características quirúrgicas y terapias adyuvantes
| Todos | WBRT | IORT | p | n | |
|---|---|---|---|---|---|
| Tipo de cirugía | 0,04 | 425 | |||
| CC | 95,8% | 98,1% | 93,5% | ||
| Oncoplástica | 18 | 4 | 14 | ||
| ALND (IQ inicial) | 9% | 15% | 8 | < 0,001 | 425 |
| Tiempo IQ (min)* | 143 ± 34 | 133 ± 29 | 154 ± 35 | < 0,001 | 418 |
| RT adyuvante | <0,001 | 425 | |||
| No | 34,6% | 0 | 67,7% | ||
| Glandular | 57,9% | 96,6% | 20% | ||
| Glandular y axilar | 18 | 7 | 11 | ||
| Rechazada | 14 | 0 | 14 | ||
| Hormonoterapia | 99,1% | 100% | 98,1% | 0,124 | 423 |
| Quimioterapia | 22% | 26% | 19% | 0,119 | 418 |
n: núm. de pacientes de los que se dispone información.
Los márgenes en el estudio anatomopatológico (AP) definitivo resultaron afectados en siete casos en la cohorte IORT y 10 en la cohorte WBRT. Todos ellos fueron reintervenidos mediante rescisión, exceptuando un caso en la cohorte IORT que precisó mastectomía radical modificada (MRM) por resultado AP definitivo de CLI (tabla 3). Esta paciente se ha excluido de los resultados de complicaciones por no presentar tejido mamario (tablas 3 y 4).
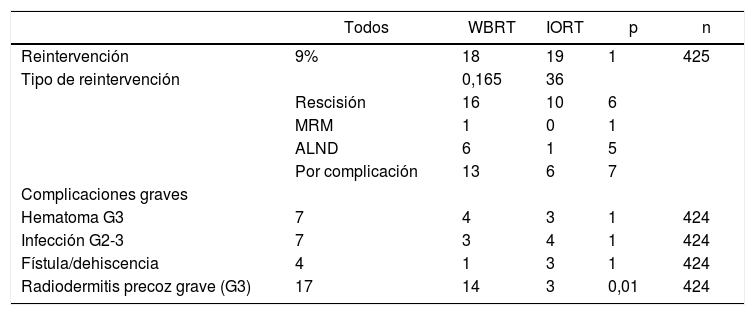
Reintervenciones y complicaciones presentadas
| Todos | WBRT | IORT | p | n | |
|---|---|---|---|---|---|
| Reintervención | 9% | 18 | 19 | 1 | 425 |
| Tipo de reintervención | 0,165 | 36 | |||
| Rescisión | 16 | 10 | 6 | ||
| MRM | 1 | 0 | 1 | ||
| ALND | 6 | 1 | 5 | ||
| Por complicación | 13 | 6 | 7 | ||
| Complicaciones graves | |||||
| Hematoma G3 | 7 | 4 | 3 | 1 | 424 |
| Infección G2-3 | 7 | 3 | 4 | 1 | 424 |
| Fístula/dehiscencia | 4 | 1 | 3 | 1 | 424 |
| Radiodermitis precoz grave (G3) | 17 | 14 | 3 | 0,01 | 424 |
n: núm. de pacientes de los que se dispone información. MRM: mastectomía radical modificada. Hematoma G3: requiere intervención quirúrgica urgente. Infección G2: requiere tratamiento antibiótico intravenoso. Infección G3: requiere tratamiento quirúrgico urgente. Radiodermitis precoz G3: descamación húmeda confluente, edema importante.
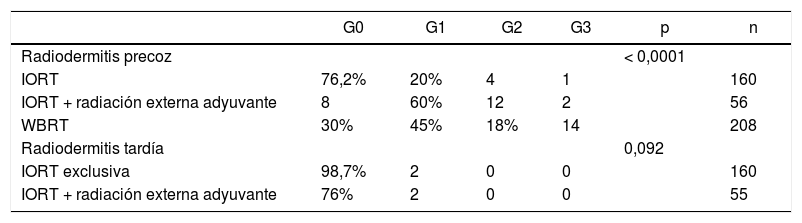
Radiodermitis (grados RTOG/EORTC)
| G0 | G1 | G2 | G3 | p | n | |
|---|---|---|---|---|---|---|
| Radiodermitis precoz | < 0,0001 | |||||
| IORT | 76,2% | 20% | 4 | 1 | 160 | |
| IORT + radiación externa adyuvante | 8 | 60% | 12 | 2 | 56 | |
| WBRT | 30% | 45% | 18% | 14 | 208 | |
| Radiodermitis tardía | 0,092 | |||||
| IORT exclusiva | 98,7% | 2 | 0 | 0 | 160 | |
| IORT + radiación externa adyuvante | 76% | 2 | 0 | 0 | 55 |
n: núm. de pacientes de los que se dispone información. RTOG/EORTC: Acute and Late Radiation Morbidity Scoring Schema12. G: grado.
RTOG precoz (radiodermitis aguda): G0: sin cambios. G1: eritema leve o sordo, depilación, escamación seca, disminución de la sudoración. G2: eritema brillante, descamación húmeda y parcheada, edema moderado. G3: descamación húmeda confluente, edema importante.
RTOG tardía (seis meses después de finalizar el tratamiento): G0: ausente. G1: atrofia leve, cambios de pigmentación, pérdida leve de cabello, ligera induración y pérdida de grasa subcutánea. G2: atrofia parcheada, telangiectasia moderada, pérdida total de cabello, fibrosis moderada, contractura leve < 10%. G3: atrofia severa, telangiectasia marcada, induración severa, pérdida de tejido subcutáneo, contractura > 10%.
En la cohorte IORT el 26% de las pacientes recibió WBRT adyuvante, debido a hallazgos AP definitivos de: pN+, CLI e ILV. No hubo diferencias significativas en los tratamientos adyuvantes de hormonoterapia (HT) ni quimioterapia (QT), administrada por criterios OncotypeDx, estadificación, pN+ y grado histológico.
No se han hallado diferencias en número y tipos de reintervención, incluyendo aquellas por complicación (tabla 3). No se presentaron casos de radiodermitis RTOG (Radiation Therapy Oncology Group) grado 4. La radiodermitis aguda global resultó superior en la cohorte WBRT (tabla 4). En la tabla 4 se detallan los distintos grados de radiodermitis aguda diferenciando aquellas tratadas con IORT exclusiva frente a aquellas tratadas con IORT que precisaron WBRT adyuvante y frente a las controles. Analizando exclusivamente la radiodermitis precoz grave RTOG grado 3, ésta resultó inferior en la cohorte IORT frente a la cohorte WBRT (radiodermitis grave G3: IORT: 3 casos vs. WBRT: 14 casos; p = 0,01).
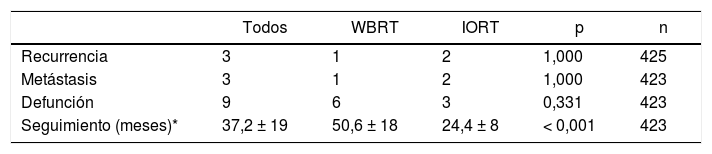
Con una media de seguimiento de 24,4 ± 8 meses en la cohorte IORT y 50,5 ± 18 meses en la cohorte WBRT (p < 0,001), los resultados de recidiva local, metástasis y mortalidad no presentaron diferencias. No se identificaron muertes atribuibles al cáncer de mama (tabla 5).
Resultados oncológicos y mortalidad
| Todos | WBRT | IORT | p | n | |
|---|---|---|---|---|---|
| Recurrencia | 3 | 1 | 2 | 1,000 | 425 |
| Metástasis | 3 | 1 | 2 | 1,000 | 423 |
| Defunción | 9 | 6 | 3 | 0,331 | 423 |
| Seguimiento (meses)* | 37,2 ± 19 | 50,6 ± 18 | 24,4 ± 8 | < 0,001 | 423 |
n: núm. de pacientes de los que se dispone información.
Las causas de defunción en la cohorte IORT fueron: sepsis respiratoria, carcinoma escamoso de trígono metastásico y sospecha de autolisis. En la cohorte WBRT las defunciones se debieron a: neoplasia de páncreas metastásico en dos pacientes, neumonía agravada por fibrosis pulmonar idiopática, encefalopatía hepática secundaria a carcinoma colorrectal metastásico, cirrosis enólica con descompensación edematoascítica y sepsis urinaria.
DiscusiónEn el tratamiento estándar del EBC la CC se acompaña de WBRT14. En estos casos, la recidiva local se calcula en 1%, llegando a una tasa acumulada, a los 20 años, del 14%, frente al 39% si no se ha aplicado WBRT. Esta reducción se ha observado incluso en pacientes ancianas de bajo riesgo en las que se había planteado omitirla15,16.
La población anciana presenta menores tasas de radiación adyuvante17. Únicamente el 79% y el 41% de las pacientes con edad ≥ 70 años y ≥ 80 años recibe WBRT tras la CC, respectivamente18. Más aún en pacientes que viven en áreas rurales, que tienden a presentar mayor edad y el transporte puede resultar una barrera que afecta negativamente la tasa de radiación adyuvante17. Es especialmente en estos casos donde la IORT como monoterapia se presenta como una buena alternativa terapéutica19.
Otras técnicas de braquiterapia (intersticial, tridimensional conformada, de intensidad modulada) han sido evaluadas en diferentes ensayos clínicos frente a WBRT con seguimientos superiores a cinco años y con mayor aceptación por algunas sociedades. Sin embargo, la IORT es actualmente objeto de debate7.
Al igual que en otras series17,20, la cohorte IORT presentó una edad superior a la de la cohorte WBRT, así como las comorbilidades valoradas mediante la escala ASA. Estas dos características, al igual que en la población general, han influido en la radiación adyuvante de la cohorte IORT. Hasta un 6,5% de las pacientes propuestas para recibirla, han sido rechazadas por decisión de la propia paciente, comorbilidades presentadas o situación social.
Para aplicar la IORT es fundamental seguir unos criterios de selección5,6. En el estudio ELIOT, la recurrencia en pacientes de alto riesgo fue del 11,3% frente al 1,5% en aquellas de bajo riesgo6. Se han establecido criterios de selección de pacientes «adecuadas» o «de bajo riesgo» para tratamiento con APBI9,21, muy similares a los establecidos en nuestro centro.
Uno de los problemas de la IORT es no poder disponer del resultado AP definitivo en el momento de aplicar la terapia. Es por ello que algunas pacientes han sido tratadas con CLI, HER2 mutado o ILV. En todas las pacientes se empleó la biopsia con aguja gruesa, pero pueden existir discrepancias con el resultado definitivo22,23. En el estudio TARGIT-A5, el grupo «prepathology» (terapia en el mismo acto quirúrgico) presentó una recurrencia del 2,1% (1,1-4,2%), con un porcentaje de adyuvancia del 22%. Es una cifra ligeramente inferior al 26% de esta serie, en la que encontramos la afectación axilar como principal causa de radiación adyuvante. La ecografía axilar en EBC tiene una baja sensibilidad para poder detectar metástasis ganglionares de forma preoperatoria24. En estos casos el tratamiento puede complementarse con WBRT, actuando la IORT como una sobreimpresión del lecho.
En esta serie, el seguimiento de la cohorte IORT (24,4 ± 8 meses) impide extraer conclusiones definitivas sobre los resultados oncológicos, aunque supera el tiempo medio de aparición de recurrencias de otros estudios (19,4 meses)25 y no ha demostrado diferencias estadísticamente significativas en cuanto a recurrencia local, metástasis o mortalidad frente a la cohorte WBRT. Dado que se ha empleado una cohorte retrospectiva, el seguimiento ha resultado superior en la cohorte control frente a la cohorte IORT.
El dispositivo empleado en nuestro centro es Xoft®Axxent®. Emplea rayos X de baja energía, como Intrabeam®, pero presenta distintas diferencias técnicas y hasta el momento, no se han publicado los resultados del RCT26. Se han descrito tasas de recurrencia de 3,4% con una mediana de seguimiento de 50 (rango 12-81) meses19. Los tiempos medios de irradiación del dispositivo Xoft®Axxent® (11,8 ± 8 min en esta serie) son inferiores a los de Intrabeam (20-45 min)5.
En cuanto a las intervenciones, el número de cirugías oncoplásticas en este estudio resultó superior en el grupo IORT. Probablemente se deba a una mayor experiencia quirúrgica adquirida y a los beneficios de la combinación de ambas técnicas, que han potenciado su uso. La pérdida de las referencias del lecho tumoral tras la cirugía oncoplástica puede representar un auténtico reto a la hora de administrar radioterapia (RT) externa. Sin embargo, la IORT evita estos problemas. En cuanto al manejo axilar, las ALND (axillary lymph node dissection) durante la intervención inicial resultaron superiores en la cohorte WBRT. Ello es debido a la aplicación de criterios ACOSOG Z001111 a partir del año 2016. Sin embargo, los tiempos quirúrgicos resultaron superiores en la cohorte IORT, muy probablemente debido a las necesidades de tiempo de terapia y de coordinación multidisciplinar.
En esta serie no hallamos diferencias en las reintervenciones, incluyendo aquellas por complicación. Algunos estudios remarcan menores tasas de radiodermitis RTOG 3-4 en el grupo IORT frente a WBRT5. El análisis de la radiodermitis en este estudio confirmó mayor toxicidad precoz de cualquier grado en pacientes tratadas con WBRT. Únicamente se presentaron cuatro casos de radiodermitis tardía G1 en la cohorte IORT.
El presente estudio tiene limitaciones. Se trata de un análisis observacional en el que se han hallado diferencias en edad, riesgo ASA o ILV. Sin embargo, estas diferencias en edad y riesgo ASA pueden ser el reflejo de la menor tasa de WBRT en pacientes de edad avanzada y comorbilidades.
Puede entenderse que existe variabilidad en los tratamientos adyuvantes. El objetivo del estudio es comparar los tratamientos radioterápicos, por lo que deben existir diferencias entre ambos grupos. Sin embargo, en cuanto al resto de tratamientos adyuvantes (HT y QT), los datos resultaron equiparables. El seguimiento de la cohorte IORT es limitado, además de que el número de eventos ocurridos (oncológicos y mortalidad) es bajo, lo que impide extraer conclusiones definitivas sobre estos resultados.
A modo de conclusión, la IORT como monoterapia en pacientes seleccionadas con EBC representa una opción alternativa a WBRT. Presenta grandes ventajas gracias a su administración en una única dosis, por lo que puede ser especialmente útil en pacientes de edad avanzada o con comorbilidades.
Es una técnica segura en cuanto a complicaciones, presentando de hecho menor radiodermitis grave precoz que el tratamiento convencional.
FinanciaciónEl presente trabajo ha sido financiado por la Fundación «Mutual Médica» (Premio accésit a la investigación 2018). Sin embargo, la entidad no ha participado en el diseño o redacción del estudio.
Autorización y confidencialidad de los datosEl presente estudio ha sido evaluado y aprobado por el Comité ético de investigación de Aragón (CEICA). Se han seguido los protocolos establecidos para el acceso, recogida y publicación de los datos de las historias clínicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos al Proceso asistencial de la Mama del HU Miguel Servet (Zaragoza) su trabajo y colaboración en la redacción del presente manuscrito, recalcando la labor de la Dra. Cecilia Escuin (S. de Oncología Radioterápica) en el seguimiento y recogida de datos.