Introducción
Cuando hablamos de cáncer colorrectal es inevitable recurrir a los datos de incidencia para recordar el enorme problema sociosanitario que plantea1; en estos momentos es la segunda causa de muerte por cáncer en España donde se diagnostican 25.000 nuevos casos al año y fallecen en ese mismo período por esta enfermedad 12.500 personas2. Si extrapolamos las cifras de incidencia (50 nuevos casos anuales por 100.000 habitantes) a nuestra práctica clínica diaria, un hospital con una población de referencia de 300.000 habitantes atenderá entre 100 y 150 casos de cáncer colorrectal al año. Recurriendo de nuevo a los datos conocidos, en el momento del diagnóstico, sólo el 80% será potencialmente curable; de éstos, el 40% desarrollará recidivas locales o a distancia; menos del 25% de estas recidivas serán resecables, y la probabilidad de resección curativa es directamente proporcional al tiempo de detección de ésta3. En cualquier caso, y de manera global, sólo la mitad de los pacientes con carcinomas de colon y recto vivirá más de 5 años y la recidiva es la causa de la mayoría de las defunciones tras cirugía con intención curativa4.
La frialdad objetiva de las cifras nos lleva a una sencilla deducción: no debemos escatimar esfuerzos ni recursos en intentar disminuir la frecuencia de recidivas locales, porque aunque esta disminución sea pequeña, porcentualmente hablando, debido a la incidencia de la enfermedad los pacientes beneficiados pueden ser muchos.
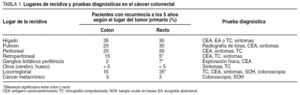
Las cifras y los lugares de recidivas tradicionalmente referidos quedan recogidos en la tabla 1. Durante los últimos años, se han conseguido significativos avances, fundamentalmente en el cáncer de recto. Así, de comunicarse y aceptarse como normales cifras de recidiva local entre el 20 y el 35%5-7, en la actualidad, y tras la generalización de la escisión total del mesorrecto (ETM)8,9 y el apoyo de la radioquimioterapia neoadyuvante, se logra mantener cifras en torno al 5%10, objetivo mínimo de todo el que trate a estos pacientes.
Definición y causas de la recidiva
Estrictamente hablando, una recidiva es la aparición de células tumorales originarias del cáncer primitivo en cualquier parte del organismo, tras haber realizado cirugía o cualquier modalidad de tratamiento con intención curativa. En este sentido, la recidiva o recurrencia se puede entender realmente como una recrudescencia de la enfermedad primaria.
En el cáncer colorrectal las recidivas locales, es decir, aquellas que se producen en la anastomosis, en el campo operatorio peritumoral, el territorio linfático mesentérico, los trayectos de los drenajes o la herida quirúrgica11, sin ser patrimonio exclusivo del cáncer de recto sí son mucho más frecuentes, sobre todo en el recto medio y bajo, pues hay datos suficientes de que el recto alto o tercio proximal presenta la misma frecuencia de recidivas locales que el resto del colon12.
La pregunta que subyace en todo este contexto continúa siendo: ¿cómo es posible la aparición de recidivas tras cirugía curativa? Si nos atenemos a la definición, la recidiva sólo puede ocurrir cuando tras completar el tratamiento radical adecuado se han dejado células viables en el paciente.
Lo más razonable es pensar que el problema está en la presencia de enfermedad residual microscópica13, si bien no se ha descartado que en ocasiones la recidiva dependa de la exfoliación celular durante el acto quirúrgico. Así, los exudados de colágeno y fibrina expuestos durante la disección y apertura de los tejidos, junto con la liberación de factores tisulares de crecimiento como respuesta al traumatismo, convierten el campo operatorio en un buen caldo de cultivo para la fijación y el desarrollo de las células neoplásicas14,15.
Ante la imposibilidad de identificar, con los medios actuales, las células liberadas o las micrometástasis se ha hecho especial hincapié en identificar a aquellos pacientes con riesgo para desarrollar una recidiva. Aunque se han asociado muchos, básicamente y siendo eminentemente prácticos, los factores de mayor interés y significación ligados a la recidiva locorregional dependerán de las características particulares del tumor en cuanto a estadificación (penetración en la pared y los ganglios linfáticos afectados), tamaño y grado de diferenciación11,16,17. En este sentido, la frecuencia de recidivas es directamente proporcional al estadio de la lesión, más frecuente en estadios más avanzados y para los tumores pobremente diferenciados18,19. Actualmente, en gran medida, las decisiones en cuanto a tratamiento más adecuado y seguimiento se basan en la adecuada clasificación de los pacientes20.
Mecanismo de prevención de la recidiva
El tratamiento de la recidiva comienza en el mismo momento en que se establece el diagnóstico de cáncer. Nunca se repetirá lo suficiente: el tratamiento del paciente con cáncer colorrectal es multidisciplinario y es deseable que los especialistas que tratan a este tipo de enfermos tengan especial dedicación para obtener los mejores resultados.
Apuntábamos previamente que el riesgo de recidiva se asocia a factores relacionados con el tumor. En el cáncer de recto, la radioterapia preoperatoria pretende disminuir el porcentaje de recidivas modificando las características anatomoclínicas negativas del tumor21; de hecho, por sí sola la radioterapia se ha demostrado beneficiosa al disminuir significativamente la tasa de recurrencia local22. Sin embargo, es conocida la toxicidad tanto aguda como a largo plazo de la radioterapia pelviana23, lo que hizo que muchos autores se plantearan su beneficio real, sobre todo cuando la técnica quirúrgica de ETM per se ya lograba disminuir significativamente las recidivas. Basados en estudios prospectivos y aleatorizados, hoy sabemos que los beneficios de una técnica quirúrgica meticulosa y los de la radioterapia son aditivos24,25 y han puesto en evidencia en qué pacientes es, hoy por hoy, asumible el riesgo-beneficio de este planteamiento terapéutico (invasión linfática y/o compromiso del margen circunferencial).
Tras la adecuada selección de los pacientes y el tratamiento neoadyuvante si es preciso, el pronóstico del paciente depende ahora de la maestría del cirujano, responsable del reconocimiento in situ de la lesión, así como de la técnica quirúrgica, que debe intentar resecar la tumoración y cualquier resto tumoral, con el mínimo traumatismo y exfoliación celular, y siguiendo las reglas oncológicas mínimas actualmente aceptadas (tabla 2). En el colon, los planos y las delimitaciones anatomoquirúrgicas son claros; en el recto se debe luchar por conseguir un adecuado margen circunferencial, con una disección limpia en el plano avascular del mesorrecto con los tejidos parietales de pared pelviana, sacro, vejiga, próstata o vagina. Uno de los motivos para la introducción de la ETM fue el hallazgo con relativa frecuencia de depósitos discontinuos tumorales en el tejido linfograso que rodea el recto26; hoy se sabe que estos depósitos se limitan principalmente a la proximidad tumoral, por lo que la ETM no se recomienda en todos los tumores de recto, y es suficiente la adecuada disección atraumática radial hasta unos 4-5 cm distales al borde inferior de la lesión27.
Con todo lo anterior, en nuestra opinión, el factor cirujano no debería incluirse entre los factores de riesgo para el desarrollo de recidiva locorregional. No podemos alterar las peculiaridades intrínsecas de la tumoración ni su respuesta al tratamiento neoadyuvante, pero sí podemos conseguir una adecuada preparación técnica que, por otro lado, es en estos momentos una exigencia social. Las bases de datos adecuadas y las auditorías deben ser una herramienta rutinaria en el quehacer diario, y por lo que respecta al cáncer colorrectal que hemos operado con intención curativa, estas auditorías propias nos deben indicar que el porcentaje de recidivas está por debajo del 5% de los pacientes que hemos intervenido.
Seguimiento y diagnóstico
¿Es necesario el seguimiento de estos enfermos? No hemos encontrado un desencuentro mayor que la cuestión del seguimiento y el control en el tema que nos ocupa. No sólo en las herramientas, el tiempo y la duración del período de seguimiento, sino también en la utilidad misma de estos programas de control que algunos autores cuestionan28,29.
En la práctica sabemos con certeza que, por muy "curativos" que hayamos sido con nuestro tratamiento, todo paciente con cáncer colorrectal puede desarrollar recurrencia, ya sea locorregional, a distancia o ambas. Sabemos que se presentarán en el 80% de las ocasiones antes de los primeros 2 años de postoperatorio y en la práctica totalidad antes de los 4 años. Sabemos que si existe alguna posibilidad de curación, ésta dependerá de que podamos realizar una adecuada resección en bloque con márgenes libres, y conocemos que esto se logra generalmente cuando la recidiva se ha detectado en fase asintomática30,31. Más aún, se sabe también que la incidencia de un segundo cáncer colorrectal ocurre con una frecuencia acumulativa constante del 3% cada 6 años32,33. La conclusión parece clara, se debe seguir a los pacientes con la intención de detectar la recidiva asintomática o una tumoración metacrónica. Ésta es, al menos, la conclusión aconsejada tras una reciente revisión34 que analiza la mejor evidencia disponible en estos momentos.
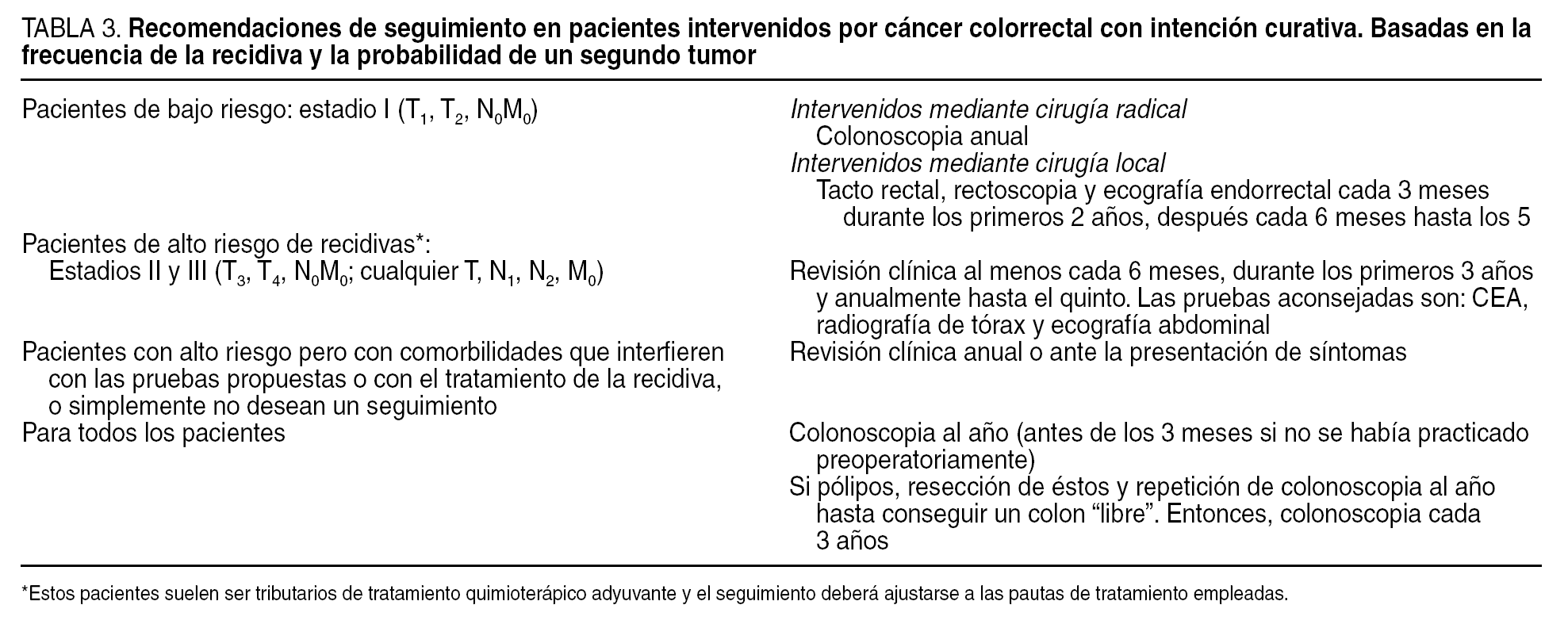
Ahora bien, ¿debemos seguir a todos los pacientes?, ¿cuáles son las pruebas que han demostrado el valor coste-beneficio? Insistimos en recordarlo: son muchos los enfermos que se acumulan año tras año, y los métodos diagnósticos son cada vez más caros y no siempre disponibles. Es obligatoria la eficiencia, que pasa por la individualización. En este sentido, nos parece interesante la guía de actuación del grupo de trabajo en cáncer gastrointestinal de Ontario (Canadá), que se actualiza con frecuencia basándose en la aparición de nueva evidencia científica35 y que deja claro que el beneficio del control más exhaustivo es para los pacientes en estadios II y III (tabla 3). Aunque con matices, en cuanto al grado de evidencia científica, las pruebas diagnósticas recomendadas son el antígeno carcinoembrionario (CEA), la radiografía de tórax y la ecografía abdominal34,35.
Tratamiento de las recidivas en el cáncer colorrectal
Una vez diagnosticada (o sospechada) la recidiva locorregional, la cirugía ofrece las mayores posibilidades de curación, pero a veces son necesarias otras técnicas en un intento, muchas veces desesperado, de lograrla. Es un grave error dar a estos pacientes por perdidos de antemano y tomar una postura nihilista, que arrastra sistemáticamente a la paliación. Es cierto que hay pocas razones para el optimismo, pero la individualización pormenorizada de los pacientes y la máxima objetividad de cada caso pueden lograr el éxito propuesto, bien en forma de supervivencia, o bien como mejoría de la calidad de vida36.
La confirmación de recidiva pelviana es, en muchos casos, difícil ya que los medios diagnósticos habituales tienen dificultades para diferenciarla de los cambios originados por la cirugía o la radioterapia previas. La mayoría de los pacientes sometidos a amputación abdominoperineal desarrollan una masa fibrótica presacra y la radiación causa una reacción inflamatoria de los tejidos pelvianos que provoca un engrosamiento de los tejidos perirrectales. Cualquiera de estos cambios se ven en la tomografía computarizada (TC) o en la resonancia magnética (RM), pero son indistinguibles de la recidiva local; en estos casos la tomografía por emisión de positrones (PET) es de gran ayuda37-39. Además de las ya citadas, se aconseja la radiografía de tórax para el rastreo de enfermedad pulmonar y la TC ósea ante el dolor osteoarticular.
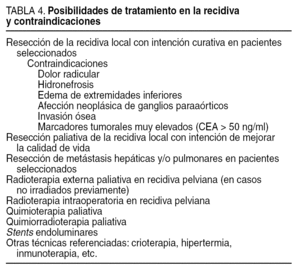
Por otro lado, es absolutamente imprescindible una adecuada valoración preoperatoria para definir las condiciones físicas y la tolerancia del paciente a la intervención, así como las posibilidades de curación. La recurrencia local aislada del cáncer colorrectal se sitúa, en el momento del diagnóstico, entre el 20 y el 30% de los casos40, pero incluso con metástasis hepáticas o pulmonares puestas en evidencia se puede intentar la cirugía curativa cuando en consulta multidisciplinaria se decide que éstas cumplen criterios de resecabilidad36. Según algunos autores, la tasa de supervivencia llega hasta el 20%41,42. Puede parecer, no obstante, que el intento de curación justifica cualquier agresión quirúrgica, pero se tiene que ser muy consciente del enorme precio que se paga, con tasas de mortalidad del 15% y de morbilidad cercanas al 100%43-45. En este sentido, todas las decisiones y consideraciones se deben hacer de acuerdo con las condiciones generales del paciente. Las posibilidades técnicas con las que contamos se exponen en la tabla 4, donde se incluyen las contraindicaciones.
El paciente con recurrencia local debe llegar al quirófano más que nunca con una planificación rigurosamente calculada y con todos los especialistas potencialmente necesarios (urólogos, vasculares, ginecólogos, torácicos, etc.) conscientes de la situación del paciente. Dicho lo anterior, se debe estar preparado para cualquier cambio en la estrategia ante los hallazgos tras la exploración intraoperatoria, y se debe buscar la escisión en bloque con disecciones en planos alejados de la infiltración neoplásica, pero a veces resulta difícil, si no imposible, la diferenciación entre tejido neoplásico e inflamatorio43.
La recidiva aislada perianastomótica ofrecerá las mayores posibilidades de resección con márgenes libres, incluso permitiendo una nueva anastomosis, si bien en el recto la amputación abdominoperineal es la norma. Las recidivas en la pared abdominal son raras y se asocian generalmente a enfermedad diseminada. Este tipo de recidivas tomó un nuevo auge con la llegada del abordaje laparoscópico al tratamiento del cáncer de colon y recto, y así, a principio de los años noventa, aparecieron alarmantes series con porcentajes elevados de recidivas en las zonas de inserción de los trocares. En la actualidad, la mayoría de los autores están de acuerdo en que, si bien existen y hay que tener presente una serie de cuidados en la manipulación de la pieza, las recidivas en la pared abdominal son anecdóticas44,47; ahora bien, si ocurren, por lo general son catastróficas para el paciente, que es difícilmente recuperable48.
Las recidivas pelvianas del cáncer de recto pueden alcanzar en su desarrollo las paredes laterales de la pelvis, el sacro o el promontorio y los órganos pelvianos adyacentes. Si los órganos afectados son la vejiga urinaria, la próstata o los órganos femeninos, la exanteración pelviana puede ser suficiente. En casos más avanzados puede ser necesaria la resección en bloque, incluyendo el sacro con abordajes abdominosacros.
La radioquimioterapia se puede utilizar en casos en que no se haya usado previamente, con la idea de reducir la masa y posibilitar o facilitar la resección. En estos momentos la quimioterapia se basa en su primera línea de fármacos en el 5-fluorouracilo, con respuestas cercanas al 20%, asociado o no a leucovorín. En la segunda línea de fármacos se encuentra en estos momentos el irinotecán (CPT-11). El oxaliplatino se está empleando junto al leucovorín fundamentalmente en los pacientes refractarios al 5- fluorouracilo36.
Por desgracia, la mayoría de los pacientes con recidivas tras cirugía curativa por cáncer colorrectal se diagnostica en fases incurables de su enfermedad, y todo el empeño se debe poner en mejorar la calidad de vida del paciente. La paliación va fundamentalmente dirigida a solucionar la obstrucción y las secreciones o hemorragia, para lo cual se han descrito una enorme cantidad de técnicas (tabla 4), entre las cuales cabe destacar como novedad el stent endoluminal, que hemos encontrado en ciertas ocasiones de gran ayuda. El dolor es la asignatura pendiente del tratamiento paliativo; para ello se emplean los analgésicos opioides, como primera línea, en asociación con corticoides o antiinflamatorios no corticoideos, e incluso benzodiacepinas. El dolor neuropático, que aparece en los casos de invasión de las raíces sacras, es tratado con amitriptilina, carbamazepina o mexiletina.
Cirugía en casos de urgencia
Muchas de las recurrencias locales se diagnostican o sospechan en los servicios de urgencias. La obstrucción es una causa frecuente por la que estos pacientes acuden al hospital. Lo habitual es que el paciente, en estas circunstancias, pueda ser tratado de manera conservadora, como urgencia diferida, y evaluado por un equipo quirúrgico con experiencia. La TC y la RM, cuando es posible, son de incalculable valor para la toma de decisiones, así como el consejo y la evaluación multidisciplinaria, si lo que se quiere es ofrecer las mejores oportunidades para el paciente; en estas circunstancias, las posibilidades de éxito se sitúan casi al mismo nivel que en los pacientes no diagnosticados de urgencia49. Si el caso no admite demora, las medidas deben ser mínimas, intentar solucionar la urgencia con la menor agresividad posible y una evaluación completa de la cavidad abdominal, dejando un meticuloso informe en el protocolo.
Recurrencia tras cirugía local del cáncer de recto
Hemos querido reservar un apartado especial para los pacientes sometidos a cirugía local por cáncer de recto con intención curativa, pues creemos que existen, en su control y seguimiento, significativas diferencias con los pacientes intervenidos de manera radical. No es éste el lugar para discutir las indicaciones o la oportunidad de este tratamiento, basta decir que está mayoritariamente aceptado en casos seleccionados de tumores T1 y que existen grupos, entre los que nos incluimos, que lo utilizan sirviéndose de la radioterapia como tratamiento adyuvante en los pacientes con lesiones T2 de bajo riesgo; en cualquier caso, su uso se limita a pacientes en estadio I de la UICC.
Estos enfermos son evaluados mediante rectoscopia, ecografía endorrectal y/o RM, y son tratados con escisión de pared total, lo que implica dejar detrás el tejido linfograso, que puede estar afectado de micrometástasis o satelizaciones (imposibles de identificar con las pruebas diagnósticas empleadas de forma sistemática), o incluso existir invasión ganglionar no detectada. La misión de la radioquimioterapia es la de esterilizar las micrometástasis y la posible afección de los ganglios linfáticos.
Así, las teóricas recurrencias de estos pacientes pueden ser endoluminares (próximas a la resección), o bien debidas al crecimiento neoplásico de alguna satelización, micrometástasis o ganglio afectado. Según nuestra experiencia sobre 55 pacientes tratados por cáncer en estadio I y cirugía local, la recidiva se situó en el 5%, todas fueron endoluminares y todas se detectaron en fase asintomática; no hubo ninguna ganglionar aislada. Todos los pacientes pudieron ser tratados mediante cirugía radical, bien con resección anterior o con amputación abdominoperineal, y la supervivencia tras un seguimiento medio de 4 años es del 96%50. Similares resultados obtienen los equipos que trabajan con radioterapia preoperatoria51. Existen otros autores que encuentran más dificultades para el rescate tras la cirugía local, pero de nuevo se saca a la luz la controversia de la técnica quirúrgica y la recogida de datos.
Estos autores reflejan, por lo general, los resultados de series retrospectivas, donde se han aplicado diferentes técnicas quirúrgicas y no existe certeza de comprobación de la pieza quirúrgica (debe ser en toda su extensión de espesor completo y con, al menos, 1 cm de margen libre). Surge de nuevo la cuestión que ya apuntábamos al principio al hablar de los malos resultados en cáncer de recto cuando no se emplea escisión de mesorrecto ni radioterapia preoperatoria. Ya ha quedado suficientemente claro qué hay que hacer en el cáncer de recto y la cirugía radical; si se pretende utilizar cirugía local con intención curativa se deben, además de realizar una adecuada selección de los pacientes, cumplir unas reglas técnicas mínimas, utilizar el equipo adecuado y llevar a cabo el control y el seguimiento reflejados en la tabla 3.